果蔬与肠道菌群互作及其健康功效研究进展
2022-05-25刘苗苗毕冉冉孙玉敬
刘苗苗,毕冉冉,孙玉敬
(浙江工业大学食品科学与工程学院 杭州 310014)
近年来,大量的流行病学研究发现增加水果蔬菜的摄入能够促进人类健康,减少慢性非传染性疾病的发生率。果蔬摄入量低的人群有19%发生结肠癌,31%发生心脏病,11%发生中风的概率[1-2]。《中国居民膳食指南》推荐我国成年人每天应摄入蔬菜300~500 g,最好深色蔬菜约占一半,新鲜水果200~350 g[3-4]。果蔬中含有的植物化学成分是其发挥其健康功能的物质基础[5-6]。过去很长一段时间果蔬植物化学素的抗氧化功能被认为是发挥健康作用的主要机制之一。近年来,随着肠道菌群研究的深入,发现果蔬营养健康作用也可通过其与肠道菌群的相互作用实现。对肠道菌群的研究为果蔬功能研究拓展了新思路。
果蔬中绝大部分植物化学成分如多酚[7-8]、多糖[9]等在胃和小肠中不能消化,从而进入大肠,只有在肠道菌群的作用下进行代谢,才能被吸收并产生生理功能。这些物质通过调整肠道菌群结构,保护黏膜屏障,增加短链脂肪酸(SCFAs)的产量等方式产生益生作用。肠道菌群的代谢产物SCFAs 能够进一步发挥益生功效[10],如丁酸可促进结肠运动,减少炎症,抑制肿瘤细胞的发展,丁酸和丙酸诱导T 调节细胞的分化,协助控制肠道炎症。SCFAs 还作为肠道微生物群的信号化学物质,通过与脂肪组织、肝脏和大脑等远端器官的接触,参与调节能量代谢和食欲[11]。
肠道菌群可大致分为有益菌、中性菌和有害菌,在人体中发挥许多重要功能。人体胃肠道为肠道菌群提供寄居环境,肠道菌群则为人体提供多种生理功能[12],其功能包括黏膜屏障功能——保护宿主免受病原体的侵害,免疫防御功能——调节免疫系统及免疫相关的健康问题,代谢与营养功能、能量调节功能——消化和吸收营养物质,产生必要的营养物质,调节衰老和内分泌状态[12-13]。肠道环境容易受到饮食、环境、年龄等多种因素[14]影响,而饮食最容易影响肠道环境,并与微生物群落不断相互作用[15]。
目前,国内外许多学者研究果蔬单一提取物对肠道菌群的影响,然而人体对果蔬的利用通常是以全果形式进行的。近年来,研究人员开始关注全果蔬对肠道菌群的影响,相关研究尚处于起步阶段。本文综述果蔬提取物和全果蔬与肠道菌群的相互作用研究进展。
1 果蔬对肠道菌群及其代谢的影响
厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是肠道中4 个主要的门,约占肠道菌群细菌组成的90%,其中厚壁菌门和拟杆菌门是最丰富的2 个门。果蔬主要通过调节肠道菌群的组成和/或代谢活动来影响人体健康。
人体中主要的肠道益生菌有:双歧杆菌属(Bifidobacterium)、乳酸杆菌属(Lactobacillus)、普雷沃特拉菌(Prevotella)、拟杆菌属、阿克曼氏菌(Akkermansia)。双歧杆菌属和乳酸杆菌属是生物体肠道内重要的益生菌[16-17],不仅可以分解代谢肠道内的益生元,产生有利于肠道微生态的代谢产物,还能在一定程度上抑制有害菌的繁殖,改善肠道内环境,因此可以维持免疫平衡,增强肠道屏障功能。普雷沃特拉菌和拟杆菌属是健康人体肠道菌群中的主要菌种[18],可利用复杂碳水化合物产生乙酸和丙酸,为人体提供营养并维持肠道的正常生理功能。阿克曼氏菌是黏液降解菌,可以特异性利用肠道中的黏蛋白[19],改善肠道屏障功能,以及降脂、降血糖等功能[20],故被认为是潜在益生菌。
1.1 全果蔬对肠道菌群的影响
全果蔬可以改变肠道微生物的种类、数量、丰富度和多样性,主要通过以下3 条途径来改变肠道菌群的结构。
第1 条途径是果蔬全果通过直接抑制有害菌的生长而影响菌群。研究发现佛手柑全果粉对革兰氏阴性菌中大肠杆菌ATCC 25922(Escherichia coli ATCC 25922) 和鼠伤寒杆菌ATCC 14028(Salmonella enterica ser.Typhimurium ATCC 14028) 及革兰氏阳性菌中金黄色葡萄球菌ATCC 25923(Staphylococcus aureus ATCC 25923)和粪肠球菌ATCC 29212(Enterococcus faecalis ATCC 29212)均有抑制作用[21]。中华猕猴桃果肉(ACF)和中华猕猴桃带皮果肉(ACFP)显著减少有害菌肠球菌属(Enterococcus)、葡萄球菌(Staphylococcus)和大肠杆菌/志贺氏菌(Escherichia/Shigella)的数量[22]。黄秋葵粉(OFP)[23]可抑制变形菌门、放线菌门的增加,降低幽门螺杆菌(Helicobacter)和Coprobacter 的数量及副拟杆菌科(Parabacteroides)丰度。
第2 条途径是果蔬全果通过富集有益菌群调节肠道菌群,增加对肠道有益的拟杆菌属菌群的丰度及数量,使得厚壁菌门/拟杆菌门比值显著降低而产生有益作用,或富集乳酸杆菌属、双歧杆菌属等益生菌含量。ACF 和ACFP 明显降低大鼠模型肠道中厚壁菌门的丰度,增加拟杆菌门的丰度,使得厚壁菌门/拟杆菌门比值显著降低[22]。OFP[23]可通过增加拟杆菌属丰度来降低厚壁菌门/拟杆菌门比值。ACF 和ACFP[22]显著增加有益菌乳酸杆菌属和巴恩斯氏菌(Barnesiella)的数量。带皮猕猴桃果肉比猕猴桃果肉对微生物多样性的影响更为显著,并具有更强的促进健康作用。丝瓜全果冻干粉[24]对双歧杆菌属、乳酸杆菌属、普雷沃特拉菌属和拟杆菌属的数量具有显著促进作用。OFP 可增加巴斯德氏菌(Pasteurella)、乳酸杆菌属和双歧杆菌属的菌群数量,增加肠道卟啉单胞菌科(Porphyromonadaceae)的丰度,从而富集有益菌,对高脂饮食(HDF)诱导的肥胖小鼠肠道微生物菌群失调有显著改善作用[23]。
第3 条途径是果蔬全果通过产生代谢产物间接影响肠道菌群,目前研究比较多的代谢产物是SCFAs。SCFAs 可以调节肠道环境的pH 值,也可作为结肠细胞和一些菌属的能量来源,从而对肠道健康及肠道菌群产生有益作用。枳实(FAI)经结肠发酵可以提高结肠中SCFAs 的含量,尤其是乙酸、丙酸和丁酸的含量,间接改善肠道菌群平衡[25]。丝瓜全果冻干粉[24]促进双歧杆菌属、乳酸杆菌属、普雷沃特拉菌属和拟杆菌属数量增加,普雷沃特拉菌属和拟杆菌属直接代谢丝瓜膳食纤维产生乙酸和丙酸。OFP[23]显著促进结肠SCFAs(乙酸、丙酸和丁酸)的产生,尤其是选择性增加丁酸产生菌的比例来促进丁酸的产生。
1.2 果蔬汁对肠道菌群的影响
摄入果蔬汁对肠道微生物群的组成、结构和代谢活性有正向调节作用。果蔬汁对肠道菌群的影响除了上述类似全果的3 条作用途径外,还可以通过果汁中的有机酸进行能量竞争,透过细菌外膜提高胞内渗透压,抑制生物大分子合成,诱导宿主产生抗菌肽等多个方面发挥抑菌作用,它可以有效降低人体肠道的pH 值,抑制沙门氏菌、大肠埃希氏菌等常见致病菌的生长,从而改善机体的健康状况[26]。
研究发现,富含多酚的果蔬汁与乳酸杆菌属、双歧杆菌属和肠球菌属多样性的增加有关[27-28],结肠中乳酸杆菌属和双歧杆菌属数量的增加有利于肠道健康,包括调节免疫系统和短链脂肪酸的产生。这些菌群还可以产生细菌素,表现出抗菌能力,使致病菌种群得以减少。梭状芽胞杆菌属(Clostridium) 数量的升高并不一定会对健康产生负面影响,该属的一些菌种与SCFAs 的产生有关,对健康有益[29],而其它菌种由于其代谢活性和致病性质,参与了胃肠道疾病的炎症过程[30-31]。蔓越莓汁增加了双歧杆菌的相对丰度,并减少假单胞菌属(Pseudomonas)的丰度,从而改善由于幽门螺旋杆菌引起的肠道菌群紊乱[32]。100%西沙诺尼纯果汁[33]可抑制肠炎沙门氏菌、大肠埃希氏菌O157、福氏志贺氏菌(Shigella flexneri)、金黄色葡萄球菌和铜绿假单胞菌(Pseudomonas aeruginosa)等常见致病菌,而对有益菌未产生影响。饮用野生蓝莓复原汁(250 mL 水中含有25 g 野生蓝莓粉)[34]使双歧杆菌和嗜酸乳杆菌 (Lactobacillus acidophilus)显著增加。鲜榨橙汁(FOJ)能够增加乳酸杆菌属、肠球菌属、双歧杆菌属和梭状芽胞杆菌属的数量,减少肠杆菌属(Enterobacteria)的数量,使总菌群丰度值降低;巴氏杀菌橙汁(POJ)能够增加乳酸杆菌属和双歧杆菌属,减少肠杆菌属。橙汁处理后,细菌总丰度降低,然而不一定对肠道微生物群有负面影响[30]。
果蔬汁经益生菌发酵呈现出果蔬汁-益生菌-发酵产物复合体,该复合物也会对肠道菌群结构进行调节。植物乳杆菌发酵苹果汁可增加肠道内拟杆菌门、放线菌门的数量,降低厚壁菌门的数量,增加乳杆菌属的比例,降低肠球菌属的比例,因此改善抗生素引起的肠道微生物群的紊乱[35]。将嗜酸乳酸杆菌LA5 胶囊化于龙眼巴氏杀菌汁[36],形成嗜酸乳杆菌-龙眼汁复合体,使嗜酸乳杆菌LA5 产生良好的结肠定殖效果,能促进结肠乳酸杆菌属和双歧杆菌属的生长,对大肠杆菌和梭状芽胞杆菌属 (包括厌氧菌总数)的生长有抑制作用,从而改变肠道微生物群落。
此外,临床试验[37]发现,20 名健康成年人在3 d 内只饮用果汁和蔬菜汁(6 瓶/d 的混合蔬菜、根、柑橘、柠檬、辣椒和香草杏仁的果汁),随后进行14 d 的日常饮食,以探究3 d 果蔬汁是否改变了20 名健康参与者的肠道菌群,结果表明3 d 果蔬汁干预使肠道菌群发生显著变化,其中厚壁菌门和变形菌门的比例显著降低,拟杆菌门的相对比例显著增加,然而在14 d日常饮食后又恢复到初始水平。
1.3 果蔬提取物对肠道菌群的影响
1.3.1 果蔬提取物——多酚 多酚(Polyphenol)是一大类广泛存在于自然界,具有大量酚羟基结构单元的植物次生代谢产物[37]。多酚主要分为两大类:一类是包括水杨酸、咖啡酸、槲皮素等在内的小分子酚酸类物质及黄酮类物质,另一类是单宁类的大分子物质。而膳食多酚包括酚酸类(Phenolic acids)、类黄酮类(Flavonoids)、1,2-二苯乙烯(Stilbenes)和木脂素类(Lignans)四大类,膳食多酚不能被小肠吸收,直接到达结肠作为肠道菌群的发酵底物,其代谢物也可通过与肠上皮细胞的相互作用,进一步影响肠道菌群的结构和数量。
多酚的研究通常集中在多酚提取物,通过有机试剂提取果蔬不同部分中的多酚物质,这类提取物大多是膳食多酚混合物。多酚提取物对菌群的作用比较显著,对肠道微环境稳态、宿主肠道健康很重要,如表1所示。多酚提取物引起的厚壁菌门及拟杆菌门变化使厚壁菌门/拟杆菌门比值降低,对降低肥胖有利。阿克曼氏菌、乳酸杆菌等对SCFAs 合成有正向调节作用,同时阿克曼氏菌与体重的降低有关。

表1 多酚提取物对肠道菌群的影响Table 1 Effects of polyphenol extract on intestinal microflora
关于多酚单体对肠道菌群影响的研究,以酚酸、黄酮类单体为主,主要集中在多酚单体对模型动物结肠菌群的影响,多酚单体对体外单菌株的作用,多酚单体为主要原料的酸奶饮品对肠道菌群的影响。它们基本都对肠道病原菌有一定抑制作用,在建立的小鼠、肉鸡等动物模型中,肠道菌群出现不同程度的紊乱,而多酚单体可以使其肠道菌群的结构趋于正常,因此对紊乱的肠道菌群有正向调节作用。具体菌群变化见表2。
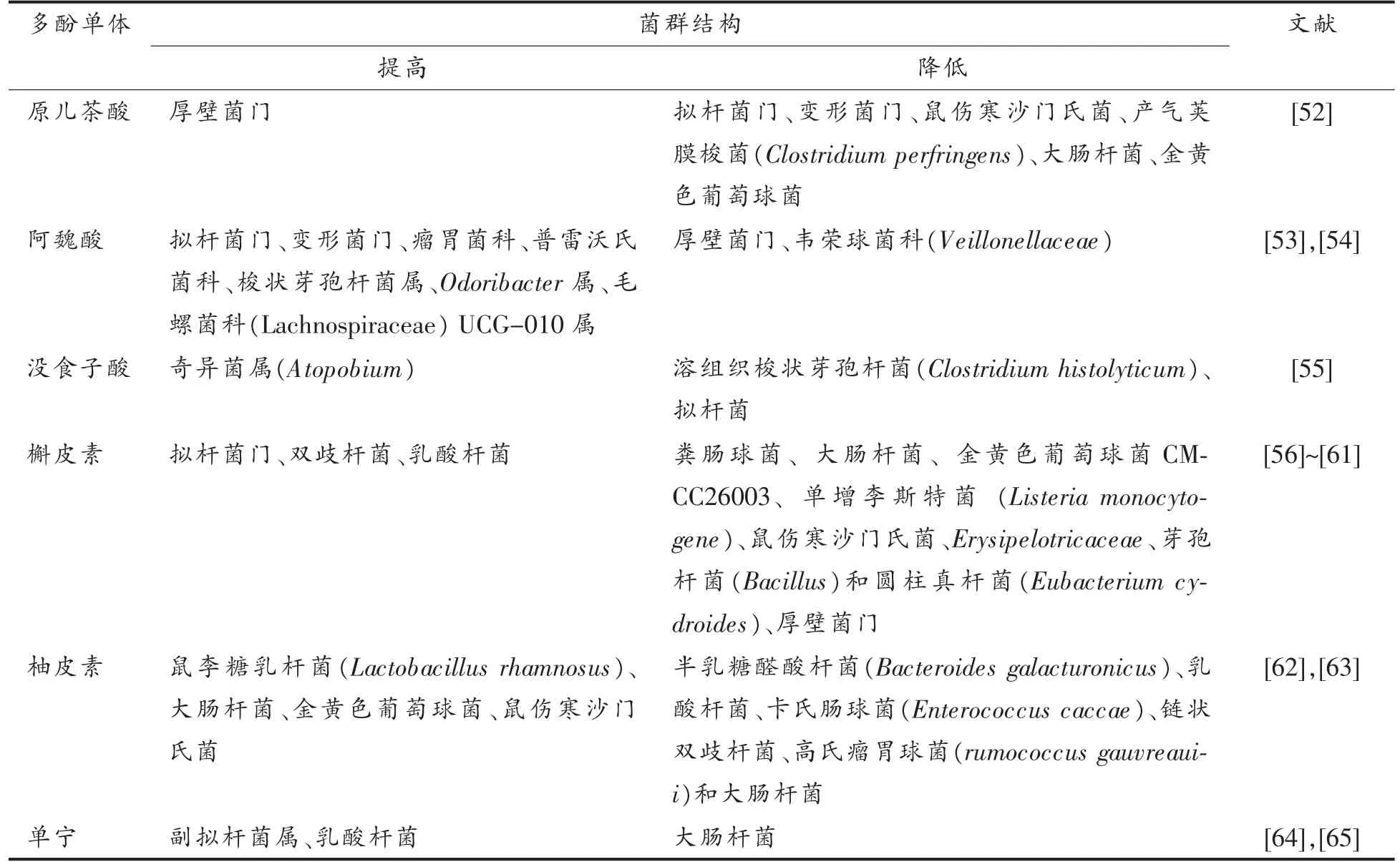
表2 多酚单体成分对肠道菌群的影响Table 2 Effects of polyphenol monomer composition on intestinal flora
1,2 -二苯乙烯类物质和木脂素类研究较少,白藜芦醇是增加了DSS 模型小鼠肠道乳酸杆菌和双歧杆菌,减少了肠杆菌的增加[48],也可改善HFD诱导的肠道菌群失调,具体表现为降低厚壁菌门/拟杆菌门比例,显著抑制粪肠球菌的生长,促进乳酸杆菌和双歧杆菌的生长[49]。芝麻素[50]可以重塑肠道微生物群,使厚壁菌门和放线菌门的相对丰度显著增加,变形菌门和拟杆菌门的相对丰度显著降低,显著增加大鼠粪便中益生菌乳酸杆菌属和双歧杆菌属的数量。另一项体外动物粪便厌氧培养实验表明[51],芝麻素可增加嗜酸乳杆菌的丰度,抑制大肠杆菌的生长。高通量测序分析表明,芝麻素处理增加了益生菌如乳酸杆菌属和Flavonifractor 的丰度,并降低了有害细菌,如拟杆菌、肠球菌、梭状芽孢杆菌xlva 和副拟杆菌的丰度。
1.3.2 果蔬提取物——多糖 植物多糖是由许多相同或不同的单糖以α-或β-糖苷键构成的化合物,包括淀粉、纤维素、果胶和多聚糖等重要的生物大分子,是生物体维持生命活动的主要能源物质[66]。多糖在胃肠消化中很难分解,大多都可完整进入结肠,可以作为肠道微生态系统的调节剂,对肠道菌群组成进行调节[67]。与肠道菌群相关的多糖范围非常广泛,大多集中在果蔬和食用菌。
多糖对肠道微生物的调节主要有两种方式,一是在门水平上针对厚壁菌门和拟杆菌门进行调节。HDF 促进厚壁菌门生长,减少拟杆菌门数量,引起厚壁菌门/拟杆菌门比例异常变化,大多数多糖可以恢复HDF 引起的厚壁菌门/拟杆菌门比值异常。多糖对肠道菌群调节的另一条途径就是促进有益菌的生长,减少有害菌数量,促进有益菌生长,从而促进肠道健康。
水果多糖是最常见报道的内容,对肠道菌群影响范围较广。Wang 等[68]对刺梨多糖(RTFP-3)模拟胃肠消化及发酵发现,RTFP-3 在门水平上降低厚壁菌门/拟杆菌门比值。RTFP-3 提高了有益菌的相对丰度,特别是双歧杆菌科、乳酸杆菌科、拟杆菌科和链球菌科(Streptococcaceae),降低有害菌的相对丰度,如毛螺菌科、韦荣氏球菌科、紫单胞菌科 (Porphyromonadaceae)、红蝽菌科(Coriobacteriaceae)和氨基酸球菌科(Acidaminococcacea)。冬枣小分子糖[69]发酵后对致病肠道细菌大肠杆菌/志贺氏菌等有害细菌有抑制作用。火龙果低聚糖(DFO)[70-71]增加了栖湖菌属(Limnohabitans)、布劳特氏菌属(Blautia)、副拟杆菌属、乳酸杆菌属、双歧杆菌属和拟杆菌属等有益菌的数量。木瓜果肉中的膳食纤维(DFs)[72]经发酵增加了梭菌科(Clostridiaceae)、粪芽孢菌属(Coprobacillus)、Bulleidia 和史雷克氏菌属 (Slackia) 的微生物数量。无花果多糖(FCPS)[73]提高了拟杆菌门S24-7菌科、拟杆菌属和粪球菌属等有益微生物的丰度,抑制了与炎症相关微生物大肠杆菌属和梭菌属的丰度。柑橘果胶[74-75]发酵可促进双歧杆菌属、拟杆菌属和普拉梭菌(Faecalobacterium prausnitzii)等有益菌的生长,且果胶可以特异性调节肠道中的微生物群落。
块茎类蔬菜因其淀粉及多糖含量高,也会在一定程度上影响肠道菌群组成及其代谢。生马铃薯淀粉[76]可以增加小鼠盲肠中阿克曼氏菌、理研菌科(Rikenellaceae)和Utterella,经盲肠代谢后丙酸含量明显升高。山药中的水溶性多糖CYP-1[77]降低另枝菌属(Alistipes)、螺杆菌属(Helicobacter)和一种未知肠道细菌的丰度。萝卜绿多糖(PRG)[78]增加了厚壁菌门的丰度,降低了拟杆菌门和疣微菌门的丰度。芦荟多糖(APs)[79]使厚壁菌门和疣微菌门的丰度降低,拟杆菌门和变形菌门的丰度增加。普雷沃氏菌属、链型杆菌属(Catenibacterium)、毛螺菌科、粪球菌属和瘤胃球菌属等与多糖和SCFAs 代谢相关的微生物丰度增加,大肠杆菌-志贺氏菌属和韦荣氏球菌属等有害微生物减少。低分子量朝鲜蓟果胶[80]可以促进拟杆菌属、普雷沃氏菌属、肠球菌属和梭菌属的生长。
食用菌多糖也可以显著改善肠道菌群,灰喇叭菌多糖(CCPs)[81]体外发酵可以降低厚壁菌门/拟杆菌门比值,显著调节拟杆菌属等有益菌群的组成和丰度。平菇(Pleurotus sajor-caju)[82]促进粪杆菌属、双歧杆菌属、罗氏菌属、布劳特氏菌属等产SCFAs 菌的生长,降低致病性大肠杆菌-志贺氏菌属的相对丰度。金针菇多糖(FVP)[83]可使厚壁菌门增加,拟杆菌门减少,因此显著改变微生物群的结构和组成。
1.3.3 果蔬提取物——类胡萝卜素 类胡萝卜素主要有两大类,胡萝卜素和叶黄素。胡萝卜素,如α-胡萝卜素和β-胡萝卜素。叶黄素,如玉米黄质,叶黄素和虾青素[84]。在正常饮食情况下,人体小肠吸收的类胡萝卜素只有5%~50%[85],由于其生物利用度差,大部分类胡萝卜素完整进入结肠,并由肠道菌群发酵并进行代谢[86]。同时类胡萝卜素可以促进微生物群落的丰度和物种丰富度,导致微生物群落的改变[87]。
虾青素(AST)和岩藻黄质这两种叶黄素类类胡萝卜素与肠道菌群作用的研究较多,AST 和岩藻黄质显著影响盲肠菌群的丰富度和多样性。AST[88]使盲肠炎模型小鼠厚壁菌门、乳酸杆菌科的相对丰度显著降低,变形菌门和毛螺菌科的相对丰度显著升高。Wu 等[84]探究了野生型C57BL/6 J(WT)和β-胡萝卜素加氧酶2(BCO2)敲除(KO)小鼠的虾青素积累及其对肠道菌群的影响,发现虾青素显著提高了蓝细菌(Cyanobacteria)丰度,降低了厚壁菌门和螺旋体门(Spirochaetes)丰度。添加虾青素显著提高KO 雄性小鼠体内阿克曼氏菌的丰度,增加了厚壁菌门/拟杆菌门比值。AST 降低了虎河豚肠道菌群的丰富度[89],AST 在适宜范围内增加,柔壁菌门 (Tenericutes) 和支原菌(Mycoplasma)的相对丰度梯度增加,而变形菌门和弓形杆菌属(Arcobacter)的相对丰度逐渐下降。AST过量,柔壁菌门和支原菌相对丰度降低,变形菌门和弓形杆菌属相对丰度升高。Liu 等[90]发现,岩藻黄质对革兰氏阳性菌肠球菌、金黄色葡萄球菌、粪链球菌(S.faecalis)和枯草芽孢杆菌(B.subtilis)均有较强的抑制作用,对革兰氏阴性菌绿脓杆菌(P.aeruginosa)的抑制作用较弱。岩藻黄质对肠道菌群的厚壁菌门/拟杆菌门比值有正向影响[91],同时抑制疣微菌门的生长,恢复HFD 引起的ε-变形菌纲 (Epsilon-proteobacteria)、帕拉普氏菌科(Paraprevotellaceae)丰度降低。岩藻黄质[92]显著抑制拟杆菌属、阿克曼氏菌、理研菌科和毛螺菌科,增加了拟杆菌门S24-7 菌科、副拟杆菌、理研菌属、Bilophil、幽门螺杆菌、Mucispirillum 和嗅杆菌(Odoribacter)等属的丰度。
水务改革发展持续推进。全年完成水务投资90亿元,比2012年增长10%。积极争取中央资金,大力增加市财政资金,足额计提土地出让收益、筹集水利建设基金、落实地方政府债券用于水务工程建设;水务投资集团融资33亿元,比2012年增长50%。滨海水业股份有限公司成功上市,为水务发展注入了新活力。覆盖全市的基层水利服务体系建设圆满完成,形成乡镇水利站、农民用水户协会、村级管水员三级管理格局。
胡萝卜素中,番茄红素(LYC)可以重塑右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠肠道菌群其肠道菌群[93],使厚壁菌门、放线菌门和TM7 相对丰度增加,变形菌门和脱铁杆菌门(Deferribacteres)相对丰度降低。LYC 使SCFAs 对应的肠道菌群中梭状芽胞杆菌属和毛螺菌科的相对丰度显著增加,同时,增加乳杆菌属、双歧杆菌属等几种益生菌的相对丰度。β-胡萝卜素使厚壁菌门和放线菌门的相对丰度增加,拟杆菌门和变形菌门的相对丰度降低,同时显著增加了与炎症细胞因子水平负相关的长栖粪杆菌的丰度[94]。杜佳等[95]研究了体外模拟消化后的孢子粉中类胡萝卜素对人体肠道菌群的影响,发现消化后的类胡萝卜素发酵使人体肠道中的有益菌增加,放线菌门菌群减少。而未经消化孢子粉类胡萝卜素使变形菌门显著增加,可能会导致人体肠道环境紊乱。
1.3.4 果蔬提取物——其它 果蔬其它提取物的研究较少,而它们对肠道菌群也具有特定的调节作用。柠檬苦素广泛存在于柑橘类水果中,具有多种有益健康的作用。柠檬苦素[96]沿肠粘膜富集由肠道菌群代谢,发酵后明显增加了结肠微生物区系的丰富度,22 个属的相对丰度也发生了明显的变化。柠檬苦素使拟杆菌门相对于厚壁菌门的比例发生了变化,使小鼠粪便中常见的梭菌目和丹毒丝菌科(Erysipelaceae)丰度显著降低,拟杆菌增加[97]。细菌毒素和金黄色葡萄球菌感染标志物被柠檬苦素显著抑制。
菠菜中的叶绿素[98]可以影响肠道菌群组成及其代谢产物含量的变化,体外发酵降低了儿童肠道菌群的多样性,添加叶绿素促进柯林斯氏菌属和双歧杆菌属相对丰度降低,乳杆菌属的相对丰度升高。脱镁叶绿素在体外结肠发酵过程中调节肠道微生物的组成,脱镁叶绿素微生物发酵使SCFAs 以及乙酸、丙酸和丁酸的含量均有所增加[99]。
2 肠道菌群对果蔬功能性成分的分解代谢
2.1 多糖
膳食中大部分多糖不能被胃肠道直接吸收,因为人类可编码的多糖降解酶仅限于淀粉、乳糖和蔗糖[100]。人肠道中寄居的微生物可以编码各种碳水化合物酶,这些酶能够对低聚糖、多糖和糖复合物进行分解代谢[101]。如双歧杆菌专门从事各种不可消化的植物聚合物、糖蛋白和糖复合物的分解代谢[102]。虽然其蛋白水解酶和脂解酶含量较少,但有许多酶可以水解低聚糖,包括一些不太常见的连接酶,如半纤维素、阿拉伯半乳聚糖、阿拉伯木聚糖、树胶、菊粉、半乳甘露聚糖和支链淀粉。
同时多糖在结肠内被微生物群发酵,产生各种微生物代谢物,其中SCFAs 研究最多(主要有乙酸、丙酸和丁酸)[73],它们是连接营养、肠道微生物、生理和病理的主要介质,在维持人类健康中起着重要作用。SCFAs 为上皮细胞提供能量来源,维持肠道屏障,在酸性条件下抑制致病微生物增殖[103];SCFAs 被宿主吸收并进入不同的生物合成途径[104];SCFAs[10]可以防止大肠癌的发展,减少炎症,抑制肿瘤细胞的发展;SCFAs 还作为肠道微生物群的信号化学物质,通过与脂肪组织、肝脏和大脑等远端器官的接触,参与调节能量代谢和食欲[11]。具体为:丁酸是结肠上皮细胞的直接能量来源,促进了细胞的增殖和分化,提高了肠道屏障的机械强度[105];丁酸和丙酸诱导T 调节细胞的分化,协助控制肠道炎症,也能够促进结肠中乳酸杆菌属和拟杆菌属的生长,并且在循环系统中有各种有益的代谢效应,如改善生热和能量消耗,这有助于减轻体重和代谢综合征。
拟杆菌淀粉利用系统(Sus)中,低聚糖上包含细胞表面结合和降解淀粉所需的蛋白质,在低聚糖穿过外膜进一步解聚到细胞质周的葡萄糖之前,具有不同独特结构特征的外膜蛋白SusD、E、F 和α-淀粉酶SusG,它们与细胞表面的淀粉相互作用产生麦芽低聚糖,麦芽低聚糖再经过SusA、SusB 进一步降解为葡萄糖,葡萄糖转运到细胞质中为机体提供能量[106]。厚壁菌门主要利用多种转运蛋白导入小分子糖用于细胞内运转,常见的转运蛋白有:ABC 转运蛋白,磷酸烯醇丙酮酸,碳水化合物PTS 转运蛋白,MTS 转运蛋白[107]。
龙须菜多糖恢复了HDF 诱导的肥胖小鼠肠道菌群失调,因此提高了SCFAs 的含量,SCFAs 能够抑制与脂肪增加呈正相关基因如过氧化物酶体增殖物激活受体(PPARγ)的表达,促进与脂肪增加呈负相关基因G 蛋白偶联受体(GPR)的表达,降低了脂质的积累[108]。芦荟多糖[79]提高微生物群降解糖类、果糖和甘露糖的代谢能力,促进了果糖和甘露糖的代谢,同时上调了含有甘露糖-6-磷酸异构酶在内的9 种酶的基因表达。水苏糖可作为人体肠道微生态环境的调节剂,腹泻患者服用水苏糖后,水苏糖进入人体内能被双歧杆菌上的编码蛋白酶降解[109]。刺梨多糖、未成熟和成熟木瓜果肉中的膳食纤维、果胶和无花果多糖[68,72-75]由于果胶的直接发酵和细菌间的交互作用,总SCFAs 和单体SCFAs(包括乙酸、丙酸、丁酸等)都有所增加,并且被肠道菌群以不同的方式利用,同时发酵产物的pH 值也有所下降。
丝瓜膳食纤维[24]可能促进普雷沃菌属和拟杆菌属直接代谢产生乙酸和丙酸,大量乙酸存在的环境促使丁酸CoA 转化为丁酸。黄秋葵粉[23]显著促进结肠 SCFAs(乙酸、丙酸和丁酸)的产生,尤其是选择性增加丁酸产生菌的比例来促进丁酸的产生。食用菌多糖能被肠道菌群分解并利用,或促进产SCFAs 菌的生长,使粪便培养物pH 值显著降低,发酵后总SCFAs 及单体乙酸、丙酸和正丁酸的浓度显著增加[81-82]。
2.2 多酚
去糖基化、甲氧基化、羟基化和C 环断裂是多酚在肠道内的主要代谢途径[25]。肠道细菌可将黄酮苷去糖基转化为苷元,如新圣草苷(Neoeriocitrin)、圣草次苷转化为圣草素,新橙皮苷、橙皮苷转化为橙皮素,柚皮苷、芸香柚皮苷转化为柚皮素,野漆树苷、异野漆树苷转化为芹菜素,木犀草苷转化为木犀草素,香叶木苷转化为香叶木素。人体肠道菌群可将柚皮素苷元、圣草素苷元和木犀草素苷元C-3′、4′处的-OH 甲基化,生成橙皮素、金圣草黄素和木犀草素。木犀草素、香叶木素、芹菜素被氢化为圣草酚、橙皮素、柚皮素。
芒果皮[113]结肠发酵后得到的多酚类化合物主要有羟基苯丙酸、羟基苯乙酸和羟基苯甲酸衍生物以及邻苯三酚。这些代谢产物可能来源于黄酮类化合物(黄烷醇和黄酮醇)、没食子酸酯和没食子酸的生物转化作用。胡萝卜膳食纤维[47]中结合多酚的释放后出现26 种多酚类物质及其分解代谢产物,释放的多酚具有较强的自由基清除能力和抑制α-葡萄糖苷酶活性。
酚类物质经肠道菌群发酵也会产生SCFAs,其变化趋势与多糖代谢产生的SCFAs 趋势类似。微生物代谢评价发现新鲜橙汁和巴氏杀菌橙汁都增加了SCFAs 产量,使丁酸、乙酸和丙酸浓度增加,同时降低了铵产量[30-31]。陈皮提取物(多甲氧基黄酮PMFs)、嘉宝果、桑葚粉多酚发酵后SCFAs含量显著增加,尤其是乙酸和丙酸[24,80,112],且其增加与微生物种群的动态变化是一致的。
3 果蔬与肠道菌群交互作用对人体健康的影响
肠道氧化损伤是导致肠道环境失衡的重要因素,维持肠道微生物平衡对宿主健康至关重要[114],而微生物失衡与代谢紊乱和/或疾病状态相关,因此对潜在致病菌株的选择性抑制很重要。此外,肠道中存在丰富的有益细菌,如双歧杆菌和乳酸菌,可能提供保护,以防止肠道病原体的入侵。有益细菌能够与肠道病原体竞争营养物质,强有力地粘附在肠道粘膜上,从而防止病原体粘附。果蔬引起肠道菌群及其代谢变化,从而对健康产生不同影响,如图1所示。
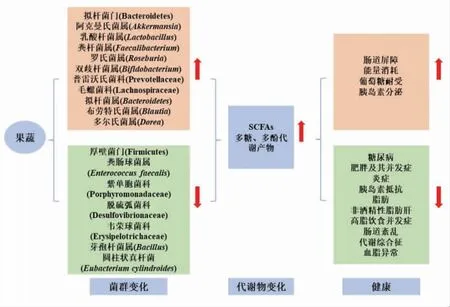
图1 果蔬引起的肠道菌群变化及其对健康的影响[27,115]Fig.1 Changes of intestinal microflora induced by fruits or vegetables and their effects on health[27,115]
3.1 肥胖
肥胖是全球范围内非常流行的一种疾病,肥胖通常与饮食结构、环境自身条件等因素有关。饮食是一个重要的诱因,饮食引起的有益菌大量减少和各种致病菌的增加,将导致细菌和毒素易位,炎症、脂肪代谢紊乱和肥胖;而且系统性或局部炎症可以作为肥胖、胰岛素抵抗和肝脂肪病的一个引发因素。显然,肠道微生物、炎症和肥胖之间存在密切联系。
肠道微生物群的组成与体重状况相关,在肥胖者体内肠道菌群多样性降低,厚壁菌门和阿克曼氏菌增加,拟杆菌门减少[116],引起厚壁菌门/拟杆菌门比例失衡。厚壁菌门/拟杆菌门被认为是典型的肥胖相关指标,肥胖的发生伴随着厚壁菌门/拟杆菌门的增加[117]。S24-7 和阿克曼氏菌丰度的变化被认为是与抗肥胖生物活性相关的主要肠道微生物[118],S24-7 是拟杆菌科未经培养的新分支,是碳水化合物的发酵剂,与肝脏代谢和免疫功能密切相关[119],阿克曼氏菌通过改善代谢与肥胖呈负相关[120]。宿主和肠道细菌之间存在相互作用,体重减轻的小鼠体内,属水平上阿克曼氏菌和Allobaculum 丰度增加,并且与体循环的瘦素浓度呈负相关[121]。一些对肥胖发育具有预防作用的植物化学物质可以选择性地促进这两种结肠细菌的生长[122-123]。
大量摄入类胡萝卜素有助于抑制厚壁菌门的丰度,岩藻黄质通过诱导UCP1 的表达来刺激脂肪分解,从而有效减轻体重;它还可以通过调节血浆瘦素水平来减轻肥胖[124-125]。同时可以显著抑制与肥胖和炎症相关细菌的生长,促进有益菌和一些产丁酸菌的生长来减轻肥胖[126]。白藜芦醇(RSV)[127]的抗肥胖作用显著减少了与宿主代谢疾病相关的通路,并增加了参与小分子代谢物生成的通路。RSV 的代谢产物4-羟苯基乙酸(4-HPA)和3-羟苯基丙酸(3-HPP)有助于改善脂质代谢进而改善HFD 诱导的肥胖和代谢综合征。4-羟基-3-甲氧基肉桂酸(HMCA)[128]的肠道代谢物3-(4-羟基-3-甲氧基苯基)丙酸(HMPA)通过增加拟杆菌门数量,减少厚壁菌门数量,调节肠道微生物与宿主代谢平衡从而减少肥胖发生。蓝莓全果粉和蓝莓[129]可以通过调节肠道微生物群,来降低饮食诱导的体重增加和改善胰岛素敏感性。裙带菜硫酸多糖(UPSP)可以降低HFD 诱导的小鼠的体重增加、脂肪堆积和代谢紊乱,还可以维持肠道屏障的完整性,降低代谢性内毒素血症[130]。
3.2 糖尿病
Ⅱ型糖尿病是一种慢性代谢性疾病,其病理生理机制主要集中在氧化应激、胰岛素抵抗和代谢紊乱[131]。肠道菌群通过短链脂肪酸代谢、胆汁酸代谢、支链氨基酸代谢、脂多糖分泌等途径在Ⅱ型糖尿病的发生发展中发挥重要作用。而大多数代谢与肠道菌群稳态及其代谢产物有关。
动物模型中,Ⅱ型糖尿病大鼠肠道中拟杆菌门和另枝菌属菌群数量均下调,厚壁菌门(Firmicutes)和布劳特氏菌属(Blautia)菌群数量上调,厚壁菌门/拟杆菌门明显升高[132]。也有报道Ⅱ型糖尿病大鼠肠道中厚壁菌门数量减少,拟杆菌门丰度增加,即厚壁菌门/拟杆菌门降低[133],这可能与菌群的个体作用方式有关。脱铁杆菌门与铁代谢有关,铁代谢异常可导致Ⅱ型糖尿病的发生[134-135]。糖尿病小鼠的肠道有益菌属乳酸杆菌属、普雷沃氏菌科、颤螺旋菌属的丰度显著降低,条件致病菌螺杆菌属、克雷伯氏菌属(Klebsiella)、梭菌属、肠球菌过度富集,部分产SCFAs 的菌群丰度降低[136]。乳酸杆菌属参与调控宿主糖代谢,且其功能可能与双歧杆菌属协同作用有关[137]。
富含膳食多酚的饮食能够降低Ⅱ型糖尿病的发病率。膳食多酚改变肠道菌群,促进有益细菌的生长,膳食多酚的微生物代谢产物显示出更好的抗糖尿病活性[138]。结合酚显著降低小鼠原生Ⅱ型糖尿病空腹血糖水平,激活骨骼肌IRS1/AKT/GLUT4 胰岛素信号通路,通过调节肠道菌群的失调,丰富产丁酸菌毛螺菌科和瘤胃球菌科,改变肠道微生物群,从而降低血糖水平[139]。豌豆超微粉碎膳食纤维可以被肠道内菌群发酵,调节肠道内pH值,从而调节肠道菌群丰度及多样性,改善糖尿病导致的肠道菌群紊乱[136]。半乳甘露聚糖可以恢复糖尿病小鼠肠道菌群组成,主要为降低厚壁菌门和梭菌门,增加拟杆菌门的相对丰度[140]。橄榄苦苷在门水平上,增加疣微菌门和脱铁杆菌门的相对丰度,降低拟杆菌门的相对丰度。在属水平上,增加阿克曼氏菌属的相对丰度,降低了普雷沃氏菌属、嗅杆菌属、瘤胃球菌属和副拟杆菌的相对丰度,从而改善晚期Ⅱ型糖尿病[141]。
3.3 肿瘤
炎症微环境在肿瘤的发生、发展及肿瘤治疗的敏感性中起重要作用,慢性感染、炎症和癌症之间有很强的相关性[142-143]。结直肠癌会导致肠道菌群多样性和丰富度降低,拟杆菌门丰度增加,厚壁菌门丰度降低。乳酸杆菌和双歧杆菌的相对丰度显著降低,颤螺旋菌属、脱硫弧菌属(Desulfovibrio)、另枝菌属、拉克氏梭状芽孢杆菌属(Lachnoclostridium)和副沙门氏菌(Parasutterella)的相对丰度增加[144]。肠道菌群与肠道屏障稳态可以有效增强宿主防御机制,避免受共生细菌、病原体和外来抗原的侵害,减轻、减少炎症反应[145]。肠道微环境失衡可以通过部分炎性因子循环增量的增加,使肠道产生的炎症影响到远离肠道部位疾病的发展[146]。结直肠癌与年龄和生活习惯密切相关,饮食风险因素包括红肉、加工肉类以及酒精,另一个风险因素是炎症性肠病。致癌细菌、肠道微生物的代谢产物和慢性炎症反应已被确定为促进癌症发生和发展的因素之一。
灵芝多糖 (GLP) 可能通过激活结肠细胞GPR43,响应肠道菌群组成的变化和SCFAs 产量的增加,引发抗炎和抗肿瘤作用,通过抑制TLR4/MyD88/NF-κB 信号通路抑制炎症反应和肿瘤发生[144]。枣多糖(JP)[147]能改善结肠炎引起的肠道功能障碍,从而避免结肠癌的发生。胡萝卜素亚麻酸酯(DLA)、胡萝卜素亚油酸酯(DL)和胡萝卜素棕榈酸酯(DP)[148]通过调节肠道微生物的稳态,产生SCFAs,进而干扰肿瘤相关蛋白的表达,从而抑制MCF-7 裸鼠的肿瘤生长。可延缓肿瘤生长,降低体内肿瘤标志物癌胚抗原 (CEA)、癌抗原125(CA125)和癌抗原153(CA153)水平。银杏叶提取物(GLE)[149]显著降低了变形菌门和脱铁杆菌门的种群数量,拟杆菌门和TM7 种群数量显著增加,GLE 调控肠道药物转运蛋白表达可能是调控肠道药物转运蛋白表达的途径。
3.4 炎性肠病
炎症性肠病(IBD)拥有慢性肠道炎症和肠道微生物菌群失调属性,是一种发生在回肠、直肠和结肠的反复、难治性和不受控制的炎症反应的特发性疾病,主要包括克罗恩病和溃疡性结肠炎(UC)[150]。肠道微生物是UC 的重要触发因素,UC患者会出现肠道微生物紊乱现象,主要表现为厚壁菌门和拟杆菌门相对丰度降低,变形菌门特别是γ-变形菌门相对丰度增加[151-152],大肠杆菌/志贺氏菌和肠杆菌具有较高的相对丰度,这些革兰氏阴性菌能够分泌脂多糖(LPS),而脂多糖可激活toll 样受体4 (TLR4)并诱发炎症。长栖粪杆菌与炎症细胞因子水平呈负相关,是缓解UC 的潜在靶点,具有抗炎特性,可促进上皮细胞的增殖和修复,维持肠道黏膜屏障的完整性,还参与了克罗恩病患者肠上皮NF-κB 通路的抑制和减少炎症过程的蛋白生产[153]。萨特氏菌属(Sutterella)常见于胃肠道紊乱患者的肠道,与炎症呈正相关[154]。肠道微生物组紊乱会导致肠道上皮细胞功能障碍和肠道黏膜损伤,最终增加肠道屏障的通透性[155-156]。此外,肠道内的促炎物质会积累,直接进入黏膜固有层,引起全身炎症反应[93]。
发酵蓝莓渣(FBP)[157]中含有36 种多酚类化合物,同时FBP 能够促进小鼠的生长,减缓小鼠的肝脏和肠道氧化应激,因此降低肠道炎症反应,改善肠道形态和屏障功能。芒果多酚[158]显著改变粪便微生物组成,增加乳杆菌属丰度,从而增加了粪便丁酸产量,因此减少炎症的发生,多酚与传统药物相结合,是治疗炎症性肠病的一种很有前途的辅助化疗。
3.5 阿尔兹海默症
肠道微生物通过复杂的双向通讯系统——肠-脑轴与大脑相连,肠-脑轴通过神经-免疫-内分泌介质将外周肠道功能与情感和认知大脑中枢结合起来[159]。年龄的增长会改变肠道微生物的数量,这不仅会导致胃肠道紊乱,还会导致中枢神经系统紊乱。阿尔茨海默氏病(AD)[160]是一种复杂的进行性发展的神经系统疾病,主要症状包括β-淀粉样蛋白(A-β)斑块、神经纤维缠结、记忆认知障碍、神经炎症一系列神经退行性病变,导致认知缺陷和记忆障碍,是老年痴呆症中最常见的一种。肠道菌群紊乱导致肠道屏障及血脑屏障通透性增加,引起全身性以及中枢神经系统炎症,肠道菌群的代谢产物影响γ-氨基丁酸、5-羟色胺、β-N-甲氨基-L-丙氨酸的分泌,维生素B12的合成及N-甲基-D-天冬氨酸受体和脑源性神经营养因子的表达,肠道菌群紊乱,肠道微生态被破坏,病原菌过量生长均会导致AD 的发生[161]。
AD 和轻微认知障碍(MCI)患者[162]体内微生物β 多样性明显不同。AD 患者拟杆菌属、毛螺菌属和瘤胃梭菌属减少,普雷沃氏菌属增加。拟杆菌属、毛螺菌属和瘤胃梭菌属与较好的认知功能呈正相关,而普雷沃氏菌属则相反,MCI 患者中普雷沃氏菌属与认知功能仍呈负相关。短双歧杆菌干预[163]显著提高了小鼠肠道中Allobaculum、颤螺菌属和脱硫弧菌属的相对丰度,同时降低了小鼠肠道中Mucispirillum 的相对丰度。短链脂肪酸能够调节血脑屏障的通透性,通过肠-脑轴刺激神经递质的产生,继而发挥强大的抗炎作用。短双歧杆菌治疗可减轻小鼠认知功能障碍,延缓AD 进展的能力,这种能力可能是因为促进神经递质生产(BDNF)和调节肠道微生物所致[164]。
4 结论与展望
目前,关于果蔬与肠道菌群的相互作用研究,主要是关于其中的某一类提取物或者单体对肠道菌群影响的研究,而关于肠道菌群对提取物或单体的代谢作用的研究除了多糖、膳食纤维的研究比较深入外,大部分成分在肠道菌群下的代谢变化缺少相关研究报道。
全果蔬含有多种活性成分,包括多酚、多糖、类胡萝卜素等,是一个复杂的体系,这也给全果的研究特别是机制性的研究带来了难度。单一组分对肠道菌群的影响是通过一定方式实现的,而复合成分之间本身就会互相影响,复合成分对肠道菌群的作用更为复杂。目前,全果对肠道菌群的研究还处于起步阶段,具体组分间的促进、拮抗、抵消等作用还需要进一步探究才能确定,进而为维护肠道健康进行果蔬干预。
另外,关于肠道菌群研究的方法,现阶段的发酵实验多集中于动物模拟和体外模拟。动物模拟多集中在小鼠、大鼠模型,也有少量以仔猪、鱼、果蝇为实验模型,虽然以上都是体内实验,但是其与人体肠道生理环境具有较大差距,因此这些研究还需要进行临床验证才能确定有效性。体外实验以人肠微生物生态系统模拟器和厌氧培养箱模拟为主,虽然可以实现厌氧发酵,但是这种体外模拟与人体真实环境不同,而且体外较难模拟人体生理微环境,还需要进一步改进才能进行精密的体外模拟。另一个难点就是菌种获取,当前实验中多以人体粪便为菌种来源,菌群个体差异性严重,且不同人群肠型不同会引起菌群结构不同,因此获取标准化菌种较难。同时粪便菌群与肠道菌群也存在一定差异。
总之,果蔬全果研究还处于起步阶段,菌种标准化未建立,动物、体外模拟精确性还需进一步改善。以便为果蔬干预调节肠道进而改善人体健康提供指导。
