水产源大肠杆菌耐药可移动遗传元件II型整合子的结构特征及适应性代价
2022-05-25方结红
焦 雪,余 庭,方结红,唐 标,汪 雯,蒋 晗*
(1 中国计量大学生命科学学院 浙江省海洋食品品质及危害物控制技术重点实验室 杭州 310018 2 浙江省农业科学院农产品质量标准研究所 农产品质量安全危害因子与风险防控国家重点实验室 杭州 310021)
抗生素因可治疗细菌性疾病,并可在低剂量下促生长,故被广泛应用乃至滥用于水产养殖中,由此引发了严重的水产源微生物耐药性问题[1]。研究表明,耐药微生物不仅能在水产品体内、养殖环境和供应链等环节中残留,还可通过食物链等多种途径进一步传递到人体中,对人类健康造成严重危害[2]。
整合子因在水产源细菌耐药基因快速传播中发挥至关重要的作用而备受关注[3-4]。它是一种可以定位于质粒、转座子或染色体上的遗传元件,通常由5’保守末端、3’保守末端和两者之间嵌有耐药基因盒的可变区组成[5]。整合子既可通过位点特异性基因重组来捕获、整合或剪切基因盒,使耐药基因在细菌间水平转移,也可借助接合型质粒等可移动元件进行整体横向传播,从而增强细菌在抗生素等压力下的生存适应性[6]。然而,当外界抗生素压力解除时,整合子会成为细菌的额外负担,其适应环境的能力可能会小于野生型菌株,这一现象被称为适应性代价[7]。如果适应性代价很大,当无抗生素压力时,耐药细菌就无法和野生型菌株竞争,容易被淘汰。反之,如果适应性代价小,整合子既可以在无抗生素压力时得到保留,又可以使其宿主菌很快适应外界环境中的抗生素压力并介导耐药基因的水平传播[8-9]。较低的适应性代价是整合子介导耐药基因广泛传播与流行的重要生物学基础[10]。
依据氨基酸序列的不同,整合子可分为5 种类型,日常食用的水产品中已监测到携带I 型和II 型整合子的细菌,尤以大肠杆菌居多[11-12]。其中II 型整合子发现时间相对较晚,因其有别于I 型整合子的独特结构和仍未清晰的传播机制,近年来日益受到关注[13]。然而,II 型整合子在相关宿主菌中的适应性代价尚未阐明,严重制约了对其在水产品中传播机制的深入理解。鉴于此,本研究采集浙江省市售南美白对虾、牡蛎和大黄鱼样品,分离鉴定大肠杆菌,分析其II 型整合子携带情况和结构特征,比较携带II 型整合子的大肠杆菌在无抗环境和抗生素亚抑制浓度下适应性代价的差异,为进一步揭示II 型整合子介导的耐药基因在水产源耐药微生物中的传播机制奠定理论基础,同时为打造有效的食源性致病菌耐药防控链提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
材料:2019年3月至2021年3月,从浙江省杭州市各大型超市和农贸市场购买南美白对虾、牡蛎和大黄鱼样品各200 份。
试剂:伊红美蓝培养基、LB 琼脂培养基,青岛海博生物技术有限公司;抗生素药敏片,杭州微生物试剂有限公司;克隆菌株大肠杆菌(Escherichia coli,E.coli)DH5α 和质控菌株大肠杆菌(E.coli)ATCC25922,中国普通微生物菌种保藏管理中心;PlatinumTMTaq 高保真DNA 聚合酶,赛默飞世尔科技(中国)有限公司;Ex Taq DNA 聚合酶、琼脂糖、DNA marker、切胶回收试剂盒、细菌基因组DNA 试剂提取盒、质粒DNA 提取试剂盒等,宝生物工程(大连)有限公司;pEASY-T1 载体,北京全式金生物技术有限公司;所有引物均由上海生工生物工程有限公司合成。
仪器:BD AccuriC6 流式细胞仪,美国BD Biosciences 公司;Arktik PCR 仪,赛默飞世尔科技(中国) 有限公司;Allegra X-30R 高速冷冻离心机,美国Beckman 公司;电泳及凝胶成像系统,上海天能科技有限公司。
1.2 试验方法
1.2.1 样品前处理 每份样品用独立无菌均质袋封装后,置于4 ℃保温箱,2 h 内低温运输至实验室进行样品前处理。无菌条件下,将样品切碎,按1 g/mL 加入无菌生理盐水,均质2 min,取均质液50 μL,接种入5 mL LB 液体培养基中,200 r/min,37 ℃过夜培养。
1.2.2 大肠杆菌的分离与分子鉴定 将过夜培养的均质液划线接种于伊红美蓝培养基,37 ℃过夜培养,挑取平板上具黑色中心有绿色金属光泽的典型菌落进行PCR 分子鉴定(每份样品挑取1 株大肠杆菌作为代表)。靶标基因为大肠杆菌特异基因uidA (Genbank ID:S69414),PCR 引物序列见表1。取过夜培养的待测菌液1 μL,加入30 μL Tri-HCl 缓冲液,金属浴煮沸5 min,4 ℃冷却2 min,12 000×g 离心2 min,取上清液用作PCR 反应DNA 模板。PCR 反应体系为:0.25 μL Ex Taq,5 μL 10×Ex Taq buffer,4 μL dNTPs,2 μL 上游引物(10 μmol/L),2 μL 下游引物(10 μmol/L),1 μL DNA 模板,35.75 μL 灭菌去离子水;反应程序:94 ℃预变性4 min,98 ℃变性10 s,56 ℃退火30 s,72 ℃延伸30 s,循环35 次后72 ℃延伸10 min。PCR 产物进行1.2%琼脂糖凝胶电泳。
1.2.3 II 型整合子的分离鉴定及结构分析 通过PCR 方法检测II 型整合酶基因intI2,分析大肠杆菌分离株携带II 型整合子情况。PCR 引物序列见表1,反应体系同1.2.2 节,反应程序:94 ℃预变性1 min;98 ℃变性30 s,55 ℃梯度退火30 s,72 ℃延伸1 min,循环35 次后72 ℃延伸10 min。PCR 产物进行1.2%琼脂糖凝胶电泳鉴定。
进一步分析intI2 基因阳性的大肠杆菌分离株的II 型整合子完整结构。根据II 型整合子5'-CS 和3'-CS 序列设计PCR 扩增引物P1,P2,引物序列见表1。利用Platinum 高保真混合DNA 聚合酶对II 型整合子进行PCR 扩增,反应体系:45 μL Platinum PCR SuperMix,1 μL 引 物P1(10 μmol/L),1 μL 引物P2(10 μmol/L),2 μL DNA 模板,1 μL 灭菌去离子水;PCR 反应条件:94 ℃预变性2 min,94 ℃变性30 s,62 ℃退火30 s,68 ℃延伸4 min,32 个循环。PCR 产物进行1.2%琼脂糖凝胶电泳鉴定和切胶回收。利用GeneArt Seamless Cloning & Assembly 克隆试剂盒,将切胶回收的II 型整合子与pEASY-T1 克隆载体进行连接。连接 反应体系为:5 μL GeneArt 2×Enzyme Mix,2 μL 切胶回收产物,1 μL pEasy-T1 (Xho I/Bam HI),1 μL 灭菌去离子水;反应条件:室温放置20 min 后,冰上放置2~3 min。连接产物全部转化感受态细胞大肠杆菌DH5α,挑选阳性克隆送上海生工测序。测序结果通过NCBI BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行比对分析,获得II 型整合子结构。
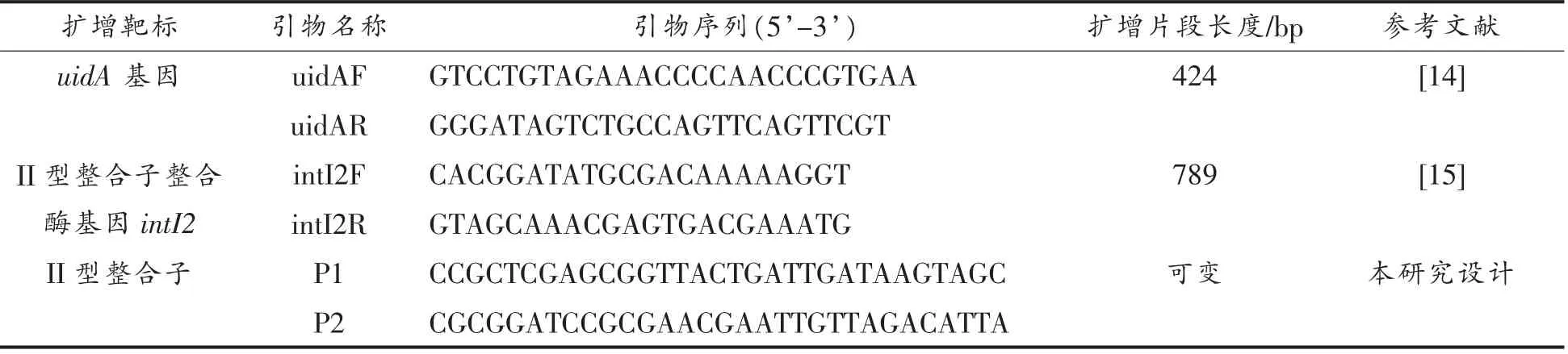
表1 引物信息表Table 1 Primer sequences information
1.2.4 II 型整合子阳性大肠杆菌的药敏分析 根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) 推荐的Kirby-Bauer 纸片扩散法测定28 株II 型整合子阳性大肠杆菌分离株对9 大类18 种抗生素的药敏性,质控菌株为大肠杆菌ATCC25922。按照CLSI(2019)推荐的标准判定分离株对该抗生素敏感(Susceptible,S)、中介(Intermediate,I)或耐药(Resistance,R)[16]。18 种抗生素的药敏片浓度及耐药折点如表2所示。对3 类或以上抗生素耐药的大肠杆菌记为多重耐药菌。

表2 抗生素种类、药敏片含量和耐药折点Table 2 The category,concentration and breakpoint of the antibiotics used for Kirby-Bauer susceptibility test
1.2.5 II 型整合子适应性代价研究用大肠杆菌基因工程菌构建 适应性代价研究用质粒pAKM 和大肠杆菌基因工程菌大肠杆菌MG1656 λatt∶∶gfp为本实验室前期构建。质粒pAKM 含p15a 低拷贝复制子、卡那霉素抗性基因和多克隆位点。菌株大肠杆菌MG1656 λatt∶∶gfp 在不引入适应性代价的λatt 位点插入组成型表达的gfp 基因,可稳定表达绿色荧光蛋白GFP。将质粒pAKM 转化至菌株大肠杆菌MG1656 λatt∶∶gfp,获得适应性代价研究对照菌株LC。将II 型整合子与质粒pAKM 连接,构建含典型II 型整合子基因盒的质粒pAKMintI2*-3GC 和含非典型II 型整合子基因盒的质粒pAKM-intI2*-4GC,将2 个质粒分别转化至菌株大肠杆菌MG1656 λatt∶∶gfp,获得试验菌株LA1和LA2。
1.2.6 大肠杆菌基因工程菌最小抑菌浓度测定参照CLSI 推荐的微量营养肉汤稀释法测定链霉素对照菌株LC 的最小抑菌浓度 (Minimal inhibitory concentration,MIC)[16]。
1.2.7 II 型整合子适应性代价分析 参照文献[17]的方法,利用竞争试验法分析II 型整合子的适应性代价。将试验菌株LA1、LA2 与对照菌株LC 在LB 液体培养基中过夜培养后,按1∶1(体积比)混合,每培养24 h 后以1∶100(体积比)接种至新鲜LB 液体培养基,连续转接4 次,共培养5 d。竞争试验混合液每转接前取100 μL 样品,通过BD AccuriC6 流式细胞仪测定混合液中含GFP 蛋白细胞数量和总细胞数量,从而获得试验菌株LA1 或LA2 相对于对照菌株LC 的相对频数F(Fnon-GFP/FGFP)。
以竞争试验中获得的相对频数自然对数lnF为因变量y,以时间(d)为自变量x,拟合线性回归方程y=kx+b。试验菌株相对于对照菌株的适应性代价选择系数S=k/ln(1/t),t——稀释倍数(1∶100)。
1.2.8 数据统计分析 试验做3 个重复。采用单因素方差分析(One-way ANOVA)和最小显著差异法(Least significant difference)比较不同数据组间的差异。采用SPSS(Version 20.0)软件对数据进行统计分析,P<0.05 认为差异具有统计学意义。利用GraphPad Prism 8 作图。
2 结果与分析
2.1 水产源大肠杆菌的分离鉴定
本研究采集了浙江省市售南美白对虾、牡蛎和大黄鱼样品各200 份,预处理并培养后挑取具黑色中心有绿色金属光泽的大肠杆菌疑似菌落(图1a),以大肠杆菌特异基因uidA 为靶标进行PCR 鉴定(图1b),共分离到278 株大肠杆菌,其中93 株来自南美白对虾样品,102 株来自牡蛎样品,83 株来自大黄鱼样品,大肠杆菌总分离率为46.3%。据文献报道,大肠杆菌因在水产品中宿主广泛、易通过水平基因转移获得耐药基因,常成为耐药基因的蓄积库和传播媒介,故大肠杆菌也被用作监测环境中耐药基因或元件的指示菌[18-19]。
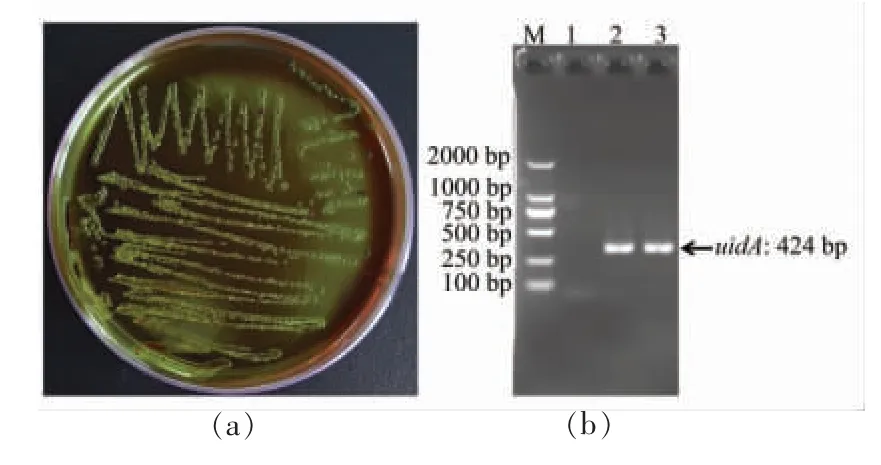
图1 大肠杆菌的选择性分离与PCR 分子鉴定Fig.1 Selective isolation and PCR molecular identification of Escherichia coli
2.2 II 型整合子的分离鉴定及结构分析
278 株水产源大肠杆菌中,有28 株(10.1%)II型整合酶基因intI2 阳性(图2a),其中27 个II 型整合子全长约3 200 bp (图2b),1 个II 型整合子全长约4 000 bp(图2c)。

图2 II 型整合子的分离鉴定Fig.2 Isolation and identification of class II integrons
对28 个II 型整合子全长扩增片段进行回收测序和BLAST 比对分析,并结合文献报道绘制出基本结构[5-6,20-21]。28 个II 型整合子的基本结构如图3所示:(1)II 型整合酶基因intI2,编码II 型整合酶;本研究分离到的28 个II 型整合子均含缺陷型整合酶,即intI2 在第178 位氨基酸后出现终止密码子TAA,致使其无法表达出完整的具有催化活性的整合酶蛋白,故标为intI2*。(2)attI 重组位点,可特异性组合attC 重组位点,用以整合和捕获基因盒。(3)Pc 启动子,负责可变区内基因盒转录表达;II 型整合子的Pc 启动子有Pc2A,Pc2B,Pc2C 和Pc2D,共4 个。(4)Pint2启动子负责整合酶转录表达,方向与Pc 的方向相反。(5)嵌有耐药基因盒的可变区:27 个片段的耐药基因盒阵列为dfrA1-sat2-aadA1,1 个片段的耐药基因盒阵列为dfrA1-catB2-sat2-aadA1(分别为介导细菌对甲氧苄氨嘧啶耐药的二氢叶酸还原酶基因dfrA1,介导细菌对链霉素耐药的链丝菌素转乙酰酶基因sat2,介导细菌对链霉素和大观霉素耐药的氨基糖苷类腺苷转移酶基因aadA1 和介导细菌对氯霉素耐药的乙酰基转移酶基因catB2)。(6)3’CS 保守序列。
研究表明,流行最广的典型II 型整合子包含缺陷型整合酶基因intI2* 与耐药基因盒阵列dfrA1-sat2-aadA1(图3A),该类II 型整合子虽有attI 和attC 重组位点,但因为整合酶的缺陷,导致其理论上仅能表达耐药基因,不具备捕获和剪切的功能[22],因此,耐药基因盒的阵列也相对固定。近年来,越来越多的新型II 型整合子基因盒阵列被发现,如本研究获得的dfrA1-catB2-sat2-aadA1也曾在变形杆菌属 (Proteus)、嗜水气单胞菌属(Aeromonas)、葡萄球菌属(Staphylococcus)、柠檬酸杆菌属(Citrobacter)和希瓦氏菌属(Shewanella)等菌中分离到的II 型整合子中发现过[23],说明II型整合子仍然具有剪切捕获耐药基因和在不同细菌间传播的功能,只是不依赖或不完全依赖II 型整合酶的作用[23]。此外,II 型整合子在自然界中没有I 型整合子流行广泛和耐药基因盒多样,然而仍具备重要的传播耐药基因的能力,其整合酶的特殊结构可能是为了维持功能进化与适应性代价间的平衡[13]。
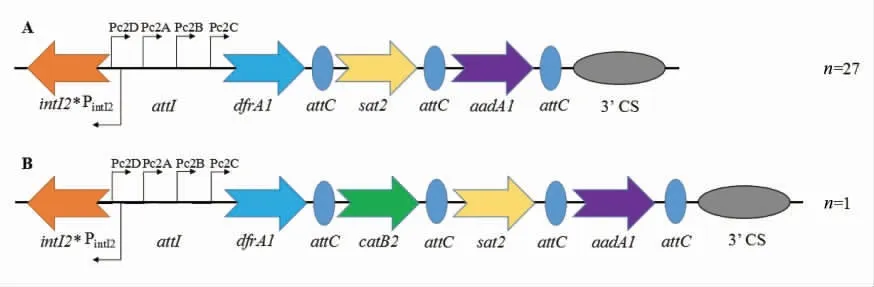
图3 II 型整合子结构图Fig.3 Structure chart of class II integrons
2.3 II 型整合子阳性大肠杆菌的药敏分析
对28 株II 型整合子阳性大肠杆菌分离株进行耐药分析,发现均为多重耐药菌,且共有17 种耐药表型组合,耐药模式多样化(表3)。其中所有菌株都对甲氧苄氨嘧啶、链霉素和大观霉素耐药,可能与II 型整合子耐药基因盒发挥相关作用有关。

表3 28 株II 型整合子阳性大肠杆菌分离株的耐药谱Table 3 Drug resistance spectra of 28 class II integron positive Escherichia coli isolates
2.4 适应性代价分析
根据选择系数S 值可判断试验菌株的适应性代价,若S>0,说明菌株适应性良好;若S<0,则菌株有适应性代价,且绝对值越大适应性代价越大[17]。如图4所示,在无抗LB 培养条件下,试验菌株LA1 和LA2 相对于对照菌株LC 的选择系数S依次为-0.068±0.006 和-0.117±0.009,均小于0,表明携带II 型整合子的大肠杆菌在不含抗生素的环境下存在适应性代价。此外,试验菌株LA2 比LA1 多1 个catB2 耐药基因盒,生长速率又下降了4.9%,说明基因盒的数量和种类在一定程度上也影响整合子阳性菌株的适应性代价。据文献报道,I 型整合子阳性的大肠杆菌工程菌选择系数S在-0.013±0.002 至-0.04±0.003 之间,即大肠杆菌的生长速率下降在1.3%~4%之间,显著低于II型整合子(P<0.05),这可能也是环境中I 型整合子比II 型整合子数量多且基因盒类型丰富的主要原因之一。
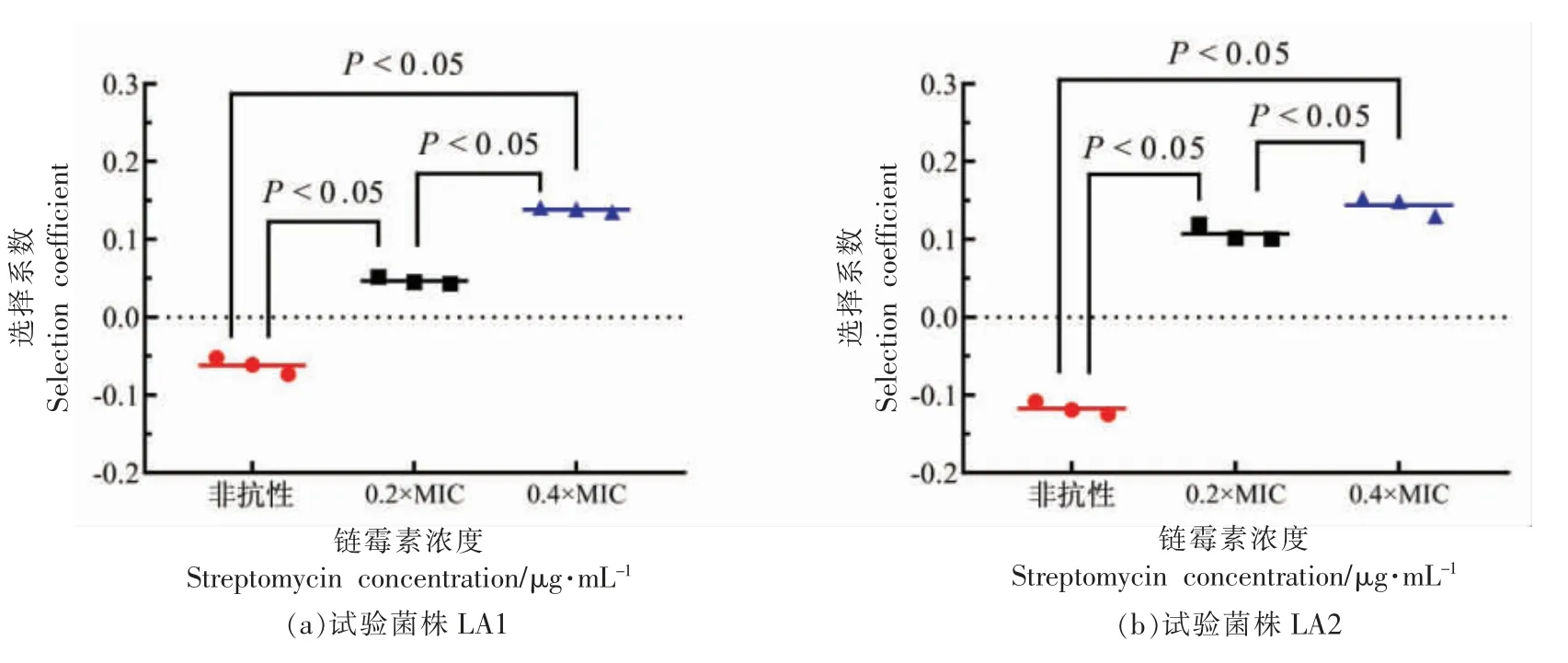
图4 II 型整合子阳性大肠杆菌基因工程菌在无抗和抗生素亚抑制浓度下的适应性代价选择系数SFig.4 Fitness cost selection coefficient S of class II integron positive Escherichia coli genetically engineered bacteria in the absence of antibiotics and at subinhibitory concentrations of antibiotics
在亚抑制浓度试验中,因本次分离到的II 型整合子基因盒以及试验菌株LA1 和LA2 均含链霉素耐药基因,而对照菌株LC 不含链霉素耐药基因,故选择链霉素作为亚抑制浓度下竞争试验的代表抗生素。链霉素对对照菌株LC 的MIC 值为8 μg/mL,以40%MIC(3.2 μg/mL 链霉素)和20%MIC(1.6 μg/mL 链霉素)作为亚抑制浓度值。如图4所示,在抗生素亚抑制浓度 (40%MIC 和20%MIC)下,2 类II 型整合子的选择系数S 均大于0,适应性良好。在20%MIC 时,试验菌株LA1 的S值为0.047 ± 0.005,LA2 的S 值为0.107 ± 0.010;在40%MIC 时,试验菌株LA1 的S 值为0.138 ±0.003,LA2 的S 值为0.144±0.012。40%MIC 下的菌株适应性显著好于20%MIC 下的适应性,且亚抑制浓度下菌株适应性显著好于无抗条件下的菌株适应性(P<0.05)。因此,环境中低浓度抗生素有利于II 型整合子在宿主菌中的维持和富集,从而促进其有效应对外界抗生素压力以及在细菌间传播扩散。
3 结论
采集浙江省市售南美白对虾、牡蛎和大黄鱼样品各200 份,分离到大肠杆菌278 株,其中28株携带II 型整合子且均为多重耐药菌株,耐药模式多样。对II 型整合子进行结构分析可得,整合酶均为缺陷型,其中27 个含典型耐药基因盒dfrA1-sat2-aadA1,1 个含非典型基因盒 dfrA1-catB2-sat2-aadA1。此外,携带II 型整合子的大肠杆菌工程菌在抗生素亚抑制浓度下选择系数S 均大于0,适应性良好,然而在无抗环境下均有明显的适应性代价。综上,II 型整合子在水产源大肠杆菌中已有一定比例,且低浓度抗生素有利于其维持和富集,从而促进其有效应对外界抗生素压力以及在细菌间的传播扩散。
