ISL1通过影响滋养细胞迁移、侵袭参与子痫前期的发生*
2022-05-25郭玉萍刘婷婷庞慧源范翠芳
余 樱 邓 娜 雷 帝 郭玉萍 刘婷婷 庞慧源 范翠芳 ,#
子痫前期(Pre-Eclampsia,PE)是妊娠20周后以新发高血压和蛋白尿为主要特征的多脏器损害疾病。PE是造成孕产妇死亡的第二大原因,也是造成胎儿宫内及新生儿出生后预后不良的重要原因[1, 2]。PE是一种胎盘源性疾病,目前公认的发病机制是“两阶段”学说,第一个阶段为胎盘阶段,是由于母体螺旋动脉绒毛外滋养细胞(Extravillous Trophoblast,EVT)侵入不足,引起胎盘灌注减少,导致胎盘功能异常;第二个阶段是胎盘功能异常释放多种胎盘活性因子及抗血管生成因子进入母体血液循环,使母体出现炎症反应过度激活和血管内皮受损,最终导致血压升高[3]。而胎盘的发育涉及绒毛外滋养细胞对子宫内膜基质的侵润、母-胎血液循环的建立、滋养层细胞内分泌功能的维持等一系列时空事件,其中绒毛外滋养细胞侵袭不足是子宫螺旋动脉重铸不良引起PE发生的关键事件[4]。因此,EVT的侵袭行为及其调控机制是PE研究的重点。胰岛素增强子结合蛋白(Islet-1,ISL1)属于LIM同源框蛋白家族, 是一种多效性转录因子,在正常组织中, ISL1参与心肌及尿道上皮的分化[5]、胰岛细胞增殖[6]、运动神经元发育[7],许多研究表明ISL1的异常表达可能与肿瘤的发生及预后相关[8, 9]。引起PE的发病滋养细胞有与肿瘤细胞类似的生物学行为,如迁移、侵袭,故ISL1在子痫前期发病机制第一阶段中的作用具有重要意义[10, 11]。本课题组先前的研究[12]发现PE胎盘mRNA表达谱与正常胎盘显著不同,且ISL1基因可能参与PE的发生。本研究通过探索ISL1对滋养细胞侵袭及迁移能力的影响,探讨PE的发病机制。
1 资料与方法
1.1 主要材料与试剂
ISL1过表达质粒及siRNA购自苏州吉玛基因,质粒序列如下:过表达质粒:pCDH-CMV-MCS-COpGFP-T2A-Puro-ISL1,空载质粒:pCDH-CMV-MCS-COpGFP-T2A-Puro对照(NCBI注册码:NM-002202),siRNA有3条,序列如下:gen OFFTM st-h-ISL-1-001:GCA TCA TGA TGA AGC AAC T,gen OFFTM st-h-ISL-1-002:GCT CCA AGG TGT ATC ACA T,OFFTM st-h-ISL-1-003:CCA GCC ACC TTG GAA AGT A;LipofectamineTM3000转染试剂购自美国Invitrogen公司;ISL1抗体(ab109517)购自Abcam,β-tublin(10094-1-AP)、 GF(19003-1-AP)、CK7抗体(17513-1-AP)购自Proteintech,MMP2(WL01579a)抗体购自Wanleibio,抗兔二抗(GB23303)购自Servicebio;1640培养基、胎牛血清购自美国Gibco公司;逆转录PrimeScript RT试剂盒及SYBR Green试剂盒购自日本Takara Bio,Inc.;Transwell 24孔板购自康宁公司。
1.2 组织、细胞来源
从妊娠6至8周接受择期手术终止妊娠的妇女中获得早孕胎盘绒毛样本6例(早孕组),从足月分娩的妇女获得孕晚期胎盘样本[PE 3例(PE组)和正常孕妇3例(NP组),两组一般资料见表1]。胎盘收集及处理方法如下:剖宫产后按照无菌原则留取胎盘。从脐带根部取下0.5×0.5×1cm的胎盘组织,在冰0.9%盐水中清洗,立即冷冻并保存在-80℃,以便后续研究。另外在胎盘的母体表面和胎儿表面切下3-5块组织,大小约1×1×0.3cm,并用4%多聚甲醛固定,石蜡包埋后常规切片(5μm)。本研究得到武汉大学人民医院伦理委员会批准。所有捐赠胎盘的妇女均签署知情同意书。 PE诊断符合美国妇产科学院(ACGO)要求,排除:多胎妊娠,妊娠糖尿病,HELLP综合征(Hemolysis,Elevated Liver Enzymes, and Low Platelet Count Syndrome,溶血、肝酶升高及血小板减少综合征),胎儿畸形和其它慢性疾病。
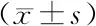
表1 NP组和PE组妇女临床资料比较
HTR8细胞购自美国典型培养物保藏中心(ATCC序列号:CRL-3271)。
1.3 组织实验
1.3.1 蛋白质印迹(Western Blot,WB)检测胎盘ISL1蛋白表达水平:胎盘组织经预冷PBS清洗三遍后,加入蛋白裂解液,使用匀浆器冰上充分研磨,加入预冷的蛋白裂解液,冰上裂解30min提取总蛋白,使用BCA法检测蛋白浓度。提取的蛋白进行定量,取30μg进行SDS聚丙烯酰胺凝胶电泳,浓缩胶配置浓度为5%,分离胶配置为10%。后用湿转法将蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭1h后,TBST洗膜三遍,每遍10min,将膜放入1∶1 000稀释的相应一抗中,4℃摇床过夜。次日将膜取出,TBST洗三遍,二抗1∶3 000稀释后室温孵育1h,TBST洗三遍,通过ECL化学发光液在凝胶成像系统进行显色并拍照记录,以β-Tubulin为内参蛋白,利用ImageJ软件分析条带,以目的蛋白条带与内参蛋白条带灰度值的比值表示该蛋白的相对表达量。
1.3.2 RT-PCR检测胎盘ISL1 mRNA水平:用Trizol提取胎盘总RNA。然后进行去基因组DNA操作:4μl 4×gDNA wiper mix,1μg模板RNA,用DEPC水将体系补足到16μl,普通PCR仪42℃ 2min;向反应体系中加入4μl 5×HiScript II qRT SuperMix II,普通PCR仪50℃ 15min,85℃ 5 sec,将RNA反转录为cDNA。配制RT-PCR体系:10μl 2×ChamQ SYBR qPCR Master Mix,0.4μl正向引物,0.4μl反向引物,2μl模板cDNA,最后加入DEPC水将体系体积补充至20μl。使用CFX管理器系统进行定量RT-PCR。ISL1引物序列如下:正向5'-GTT ACC AGC CAC CTT GGA AA-3';反向5'-GGA CTG GCT ACC ATG CTG TT-3'。以β-actin作为内参基因,使用2-ΔCt法计算目的基因相对表达水平。
1.3.3 免疫组织化学染色检测ISL1蛋白表达:将胎盘组织切片脱蜡并在二甲苯和乙醇梯度中再水化,加入柠檬酸盐缓冲液,于92-98℃的微波炉中煮沸15min。将切片依次与3%H2O2的甲醇溶液孵育10min,并在正常山羊血清中封闭20min。将切片与一抗在4℃下孵育过夜,然后与过氧化物酶偶联的二抗共同孵育。染色后用立式荧光显微镜拍照。棕色为ISL1蛋白表达阳性,蓝紫色为细胞核。
1.3.4 免疫荧光染色检测ISL1蛋白:参照免疫组织化学的过程,对早孕流产组织石蜡切片进行脱蜡、梯度酒精复水等预处理后,用0.2%Triton X-100渗透切片,然后将含有0.5% BSA的PBS在室温下封闭1h。将组织切片与一抗于4℃下孵育,该一抗包括抗ISL1抗体和抗CK7抗体。用PBS洗涤后,将切片与FITC、CY3二抗以及DAPI一起室温孵育1-2h。染色后用立式荧光显微镜拍照,若标本自发荧光,对照和特异性对照呈无荧光或弱荧光,阳性对照和待检标本呈强荧光,判断为特异性染色阳性。
1.4 细胞实验
1.4.1 细胞培养和分组:将HTR8细胞在1640培养基(含有10%胎牛血清和1%双抗)中于37℃、5%CO2条件下培养。根据制造商操作规程,在HTR8细胞中使用LipofectamineTM3000瞬时转染 ISL1-SiRNA、对照SiRNA、ISL1过表达及空载质粒,孵育48h进行后续实验。分组如下:转染SiRNA ISL1为ISL1-Si组(转染序列gen OFFTM st-h-ISL-1-001为ISL1-Si-1组、转染序列gen OFFTM st-h-ISL-1-002为ISL1-Si-2组、转染序列gen OFFTM st-h-ISL-1-003为ISL1-Si-3组),转染对照siRNA为Si-control组;ISL1过表达质粒为ISL1-OE组,空载质粒为VE组。
1.4.2 伤口愈合测定:将各组细胞接种至6孔板,细胞密度为达90% 后,用10μl移液管吸头划痕。将伤口刮擦记为0h,在12h、24h、48h时于相同位置拍摄。使用ImageJ软件分析结果。
1.4.3 基质胶测定细胞侵袭和跨孔迁移能力:采用Transwell小室检测细胞侵袭和迁移能力,在含基质胶的Transwell插入物中进行侵袭能力检测,插入物孔径为8μm的聚碳酸酯滤膜。细胞迁移能力检测时,插入物未涂基质胶。将细胞(4×105个/ml)加入200μl无血清培养基中,向下部室中加入600μl完全培养基。孵育24h后,用4%多聚甲醛固定,3%结晶紫染色,记录每个插入物在5个随机视野中的迁移细胞。侵袭细胞数则孵育48h后进行上述操作。
1.4.4 WB检测HTR8中ISL1蛋白表达水平:细胞转染72h后弃去培养基后无菌预冷PBS洗三遍,余步骤同组织实验。
1.4.5 PT-RCR检测HTR8中相关基因mRNA水平:操作步骤同组织实验,引物序列如表2。

表2 各基因引物序列
1.5 统计学处理
2 结 果
2.1 ISL1在胎盘中的表达
2.1.1 PE组和NP组胎盘组织中ISL1蛋白和mRNA水平比较:PE组胎盘中ISL1的蛋白和mRNA表达均显著低于NP组(P<0.01)。见图1和表3。
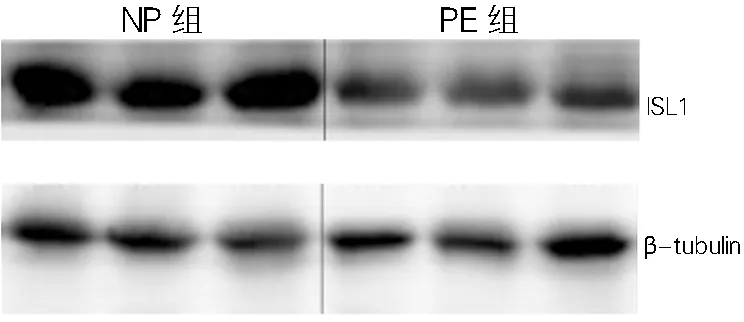
图1 妊娠晚期胎盘组织中ISL1蛋白的表达(WB)
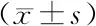
表3 PE组和NP组胎盘组织中ISL1蛋白和mRNA表达水平比较
2.1.2 ISL1在胎盘组织中的定位:ISL1在接近母体蜕膜侧的一类巨核细胞中表达强阳性,并且在细胞核和细胞质中均表达,主要在细胞核中表达,根据解剖位置推测该细胞可能是蜕膜化的子宫内膜基质细胞或EVT。见图2。
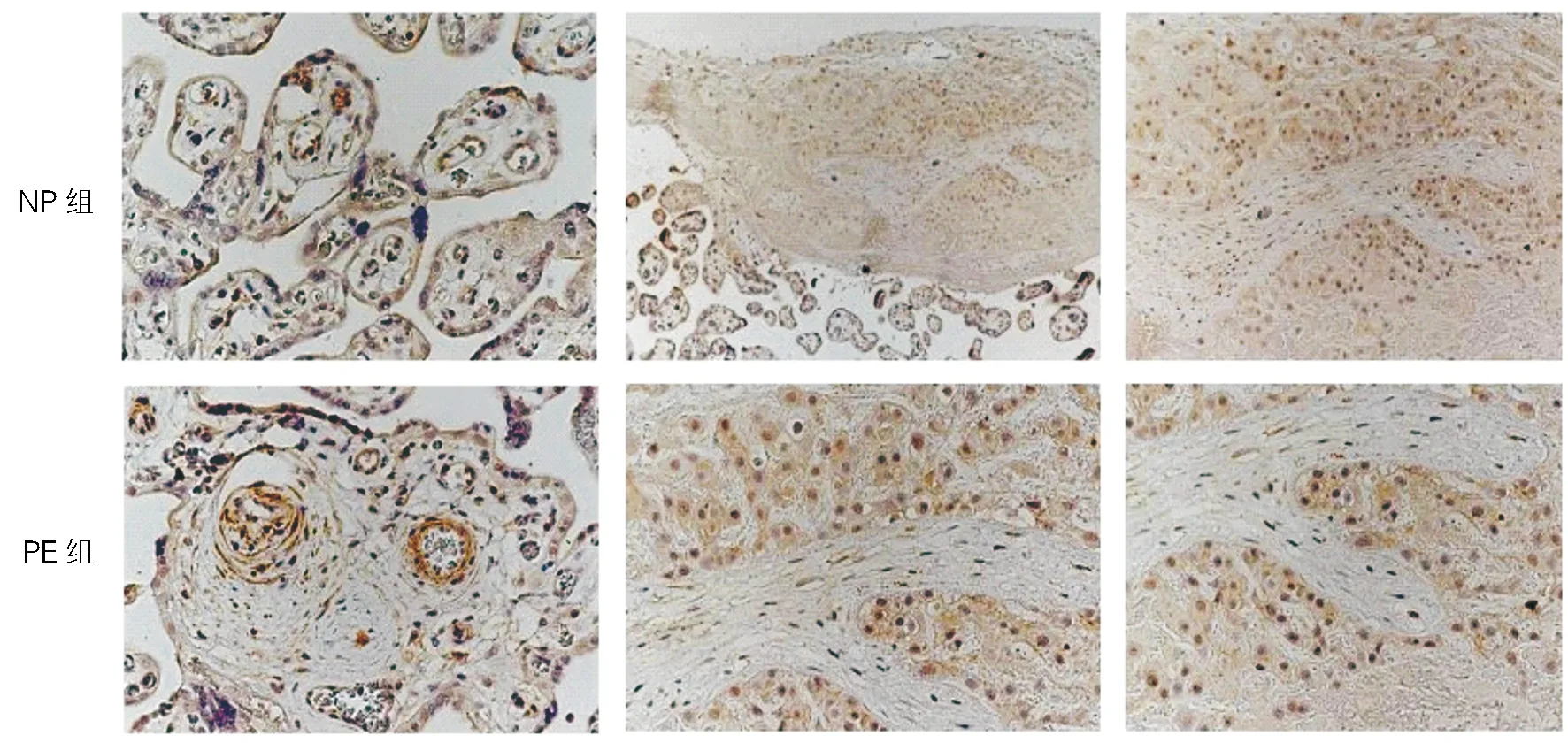
注:从左到右依次显示 ISL1 在漂浮绒毛、锚定绒毛和蜕膜组织中的表达,棕色为阳性信号,蓝紫色为细胞核
2.1.3 ISL1在早孕组织中的定位:滋养细胞标志物为细胞角蛋白(Cytokeratin,CK)、间充质细胞标志物为波形蛋白(Vimentin),免疫荧光染色结果显示,ISL1主要在滋养细胞(图3A)和血管内皮细胞的核中表达。图3B。
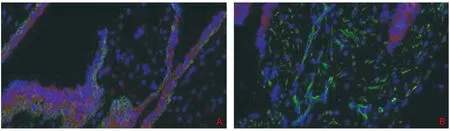
注:A,滋养细胞,红色为ISL1,绿色为CK;B,血管内皮细胞,红色为ISL1,绿色为Vimentin
2.1.4 巨核细胞类型鉴定:绒毛膜外滋养细胞标志物为人白细胞抗原-G(Human Leucocyte Antigen-G,HLA-G),具有强ISL1表达的细胞是CK(+)Vimentin(-)HLA-G(+),为EVT。见图4。
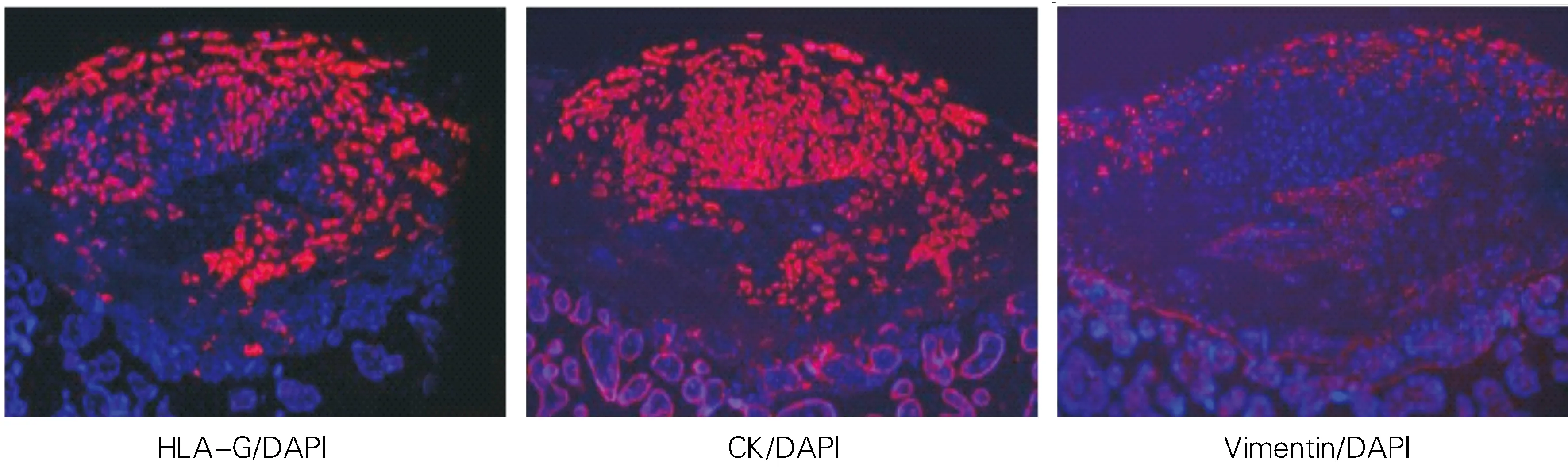
图4 ISL1在早孕流产组织中HLA-G、CK和Vimentin的表达(免疫荧光染色,×100)
2.2 HTR8细胞ISL1表达与以及各组侵袭和迁移能力
WB和RT-PCR证实,与Si-control组比较,ISL1-Si-1、-2、-3组ISL1 mRNA和蛋白表达水平均降低(P<0.01),且ISL1-Si-1组的敲除效率最高(84.70%,图5),因此后续选择ISL1-Si-1组进行功能实验。RT-PCR及WB结果显示,与VE组比较,ISL1-OE组ISL1 mRNA和蛋白的表达均增加(图6)。如表3所示,与Si-control组相比,ISL1-Si-1组伤口愈合实验迁移距离(t=6.61、14.20、22.24)、迁移细胞数(t=42.79)、侵袭细胞数(t=36.58)均较高(P<0.01)。与空载组(VE)相比,过表达组伤口愈合实验迁移距离(t=-21.04、—23.22,—37.58)、迁移细胞数(t=-48.04)、侵袭细胞数(t=-93.72)均较低(P<0.01)。
表3 ISL1改变对伤口愈合实验迁移距离和迁移、侵袭细胞数的影响
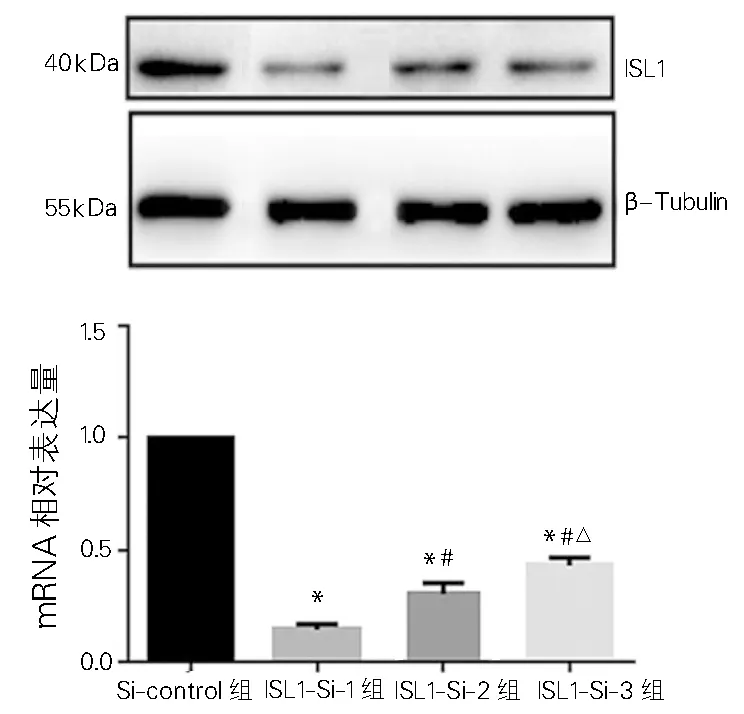
注:与Si-control组比较 ,*P<0.01; 与ISL1-Si-1组比较,#P<0.05;与ISL1-Si-2组比较,△P<0.05
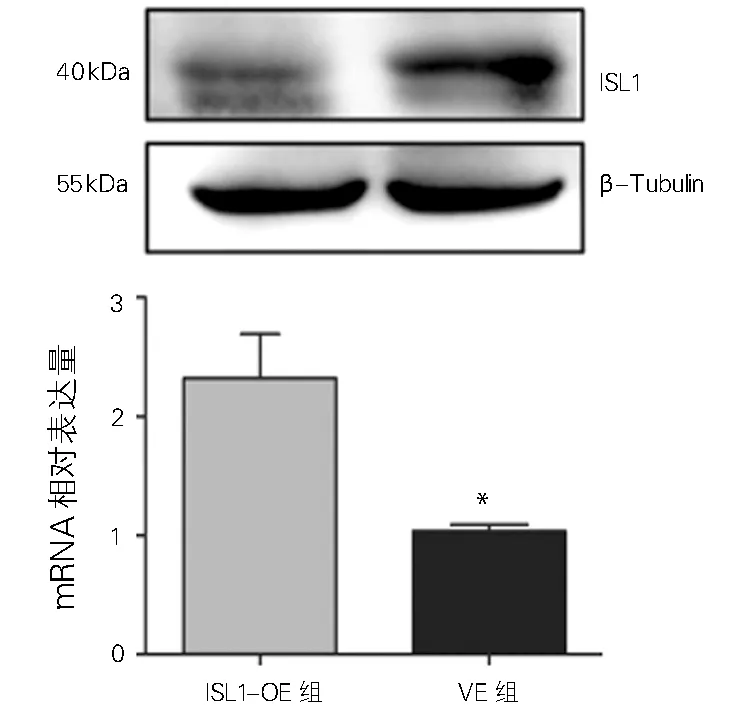
注:与ISL1-OE组比较,*P<0.05
2.3 ISL1基因对下游靶基因表达的影响
通过CHIP-Seq数据库分析发现锌E-box蛋白1(ZEB1),转化生长因子-β(TGFβ),Wnt5a和GATA3(GATA Binding Protein 3)可能是ISL1的靶基因。如表3所示,与Si-control组比较ISL1-Si-1组和ISL1-Si-2组ZEB1和TGF-β的mRNA表达明显降低,而Wnt5a和GATA3的表达无明显改变。
表4 ISL1的下游基因的mRNA水平
3 讨 论
本文结果表明,在PE患者的胎盘EVT中, ISL1的表达是明显低于正常人,表明ISL1可能在PE的发展中起重要作用。故本实验选用HTR8/SVneo细胞系来探索ISL1在PE中的具体机制,ISL1表达下降后,HTR8/SVneo细胞的迁移及侵袭功能增强,而过表达后则减弱。目前被广泛接受的PE病理机制表明,EVT分化的缺陷以及EVT的侵袭不足可能会促进PE发展[17, 18],这预示着ISL1在PE胎盘中的表达应该增加,但在本实验中却与PE患者妊娠晚期胎盘的结果相反。这可能是由于不同细胞对同一基因的应答反应存在差异,在一种组织中能促进增殖的基因在另外一种组织中几乎没有任何作用,甚至抑制增殖[19]。但也有研究[20]表示ISL1的表达受时空限制,故ISL虽然在晚期胎盘中表达下调,但在早期可能是高表达的,但由于伦理局限,不能获取到早期胎盘,故该猜测无从验证。
ISL1如何调节迁移、侵袭的机制尚不清楚。通过CHIP-Seq分析发现了ISL1的两个潜在的靶基因ZEB1和TGFβ,而ZEB1和TGF-β是细胞上皮间质转化过程中的重要调节剂[21-25]。EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,这一过程会下调上皮细胞表达的粘附分子,使它们更易于迁移和侵袭[24]。滋养层细胞分为细胞滋养层细胞(Cytotrophoblast,CTB)、合体滋养层细胞(Syncytiotrophoblast cells,STB),CTB可分化STB覆盖胎盘绒毛,直接参与胎盘的母胎界面形成,CTB也可分化为EVT, EVT锚定绒毛侵入蜕膜,将胎盘附着在子宫壁上成为血管内绒毛外滋养细胞(Endovascular Extravillous Trophoblast,eEVT),eEVT替换掉血管壁本身的部分内皮细胞使螺旋动脉的直径增加5-10倍,形成“高流低阻”的重铸血管,这一过程对胎盘的形成来说至关重要[26]。当CTB分化为EVT时,会发生一些分子变化,如金属蛋白酶的分泌增加,它会破坏细胞外基质,并使EVT迁移通过子宫内膜[27],E-钙粘蛋白等上皮标记物,波形蛋白和纤连蛋白等间质标记物以及基质金属蛋白酶MMP2和MMP9也发生了变化,这个变化的过程即为EMT[28, 29]。CTB发生EMT转化为EVT这一过程异常可能会导致PE的发生。结合本实验的结果,我们推测ISL1可能通过靶向ZEB1、TGF-β来影响滋养细胞的EMT而参与PE的进展。
但是,本次研究也有其局限性。本文仅研究了ISL1在分娩后PE患者胎盘中的表达。但是,PE的根本原因是妊娠早期的胎盘形成过程障碍,直到妊娠中期和晚期才出现临床表现。对于这项研究,收集早期胎盘显然更合适。但是,由于伦理规范的限制和PE的低发生率,我们无法获得这些样本进行研究。后期可能通过动物模型来验证ISL1是否呈现一个妊娠早期高表达而后期低表达这样一个动态变化过程。
总之,本研究表明,ISL1在迁移和侵袭的生物学功能中起着重要作用。ISL1可能通过靶向ZEB1或TGF-β来影响滋养层细胞的上皮间质转化,并参与子痫前期的发展。
◀
