三角梅苞叶色彩参数和色素含量分析及蓝色转基因受体的筛选
2022-05-24钟晓缘
钟晓缘,刘 姗,孙 蓉,张 颖
(攀枝花学院 生物与化学工程学院[农学院],四川攀枝花 617000)
三角梅(Bougainvilleaspectabilis)是中央种子目(Centrospermae)紫茉莉科(Nyctaginaceae)叶子花属(Bougainvillea)的一类常绿藤状灌木[1],其可花叶俱赏,具花朵花色丰富、花期长、适应性广、生命力强等特点,是一种深受市民喜爱且广泛应用的观赏花木。作为景观植物,花色改良是其重要的育种目标,目前三角梅观赏品种约有100多个[2-3],有红色系、橙色系、粉紫色系及白色系等[4],但缺乏稀有的蓝色花系。然而迄今为止,基于传统育种方法未培育出蓝色三角梅新品系,报道显示利用基因工程技术向非蓝色花植物中引入目标基因可实现蓝色花色的培育,而筛选合适的蓝色基因转化受体是蓝色三角梅育种的前提条件。飞燕草素苷是蓝色花色形成的主要色素,三角梅的传统花色中缺少蓝色是因为甜菜色素合成路径和黄酮成分合成路径有相互制约关系,由于缺乏F3′5′H基因不能有效生成二氢杨梅素(DHM),因而不能合成蓝色的飞燕草素苷。利用饲喂实验筛选可高效催化含DHM的品种已在菊花、仙客来等植物中证明其可行性[5-7]。本研究选取常见的红色、白色、黄色和紫色4大花色6个品种三角梅进行花色分析,对其苞片进行DHM离体饲喂培养实验,观察苞片的颜色变化,分析不同品种利用DHM的能力及对甜菜色素合成的干扰影响能力,初步筛选适合转化蓝色基因的三角梅受体品种。
1 材料和方法
1.1 植物材料
选择生长状态相似的不同色系6个品种三角梅样品枝条扦插种植于攀枝花学院苗圃,选择生长良好的植株作为供试材料(图1)。其中,在各品种三角梅花盛开期,‘新加坡大白’苞片为白色,‘宝老橙’和‘花叶大红’苞片为红色,‘中国丽人’和‘安格斯’苞片为紫色,‘黄蝶’苞片为黄色。根据三角梅苞片发育过程将其分为3个时期,S1幼嫩期(苞片根部为绿色或苞片处于转色期);S2盛开期(苞片颜色成熟,三角梅花开始或全部盛开)和S3衰败期(三角梅花部分或全部萎焉)。苞片色彩分析供试样本为同一株不同时期的苞片;体外饲喂供试样本为同一株S1期苞片。

S1.幼嫩期;S2.盛开期;S3.衰败期;下同图1 供试三角梅品种表观特征S1. Budding stage; S2. Blooming stage; S3. End flowering stage. The same as belowFig.1 The apparent characteristics of the tested Bougainvillea ssp. varieties
1.2 仪器与试剂
主要仪器包括:取色器(NCS Color Muse, Color Muse SE, NCS-92),电子天平(HZT,USA. HZUHUAZHI, HZT-FA220S),紫外可见分光光度计(INESA L5S,上海仪电分析仪器有限公司制造),高压蒸汽灭菌锅(BXM-100M,上海博迅实业有限公司医疗设备厂),超声波清洗仪(BQ-4, 无锡市美极超声设备有限公司),超净工作台(SW-CJ-1D,上海尚道仪器制造有限公司制造),光照培养箱(MGC-350B0-2,上海一恒科学仪器有限公司制造)。主要试剂包括:二氢杨梅素(DHM),MS培养基,蔗糖,琼脂粉,无水乙醇,亚硝酸钠,硝酸铝,氢氧化钠,丙酮,芦丁标准品。所用试剂均为分析纯,供试用水为超纯水。
1.3 花色测定
在避免日光直射、光线良好的室内,以苞片下端靠近叶柄处的上表皮细胞中央部位为取色点,用取色器对各品种三角梅不同花期苞片取色,色彩定量分析,记录色彩亮度L*、红绿色相值a*、黄蓝色相值b*、色彩饱和度C*,以及根据a*和b*计算色相角H*[H*=arctan(b*/a*)]。测定位置均为苞片下端靠近叶柄处的上表皮细胞中央部位,同一苞片测定3次,取其平均值为测定结果。各品种各花期三角梅苞片色彩数据采集不低于100组。
1.4 体外诱导培养
参照Brugliera等菊花DHM体外饲喂实验[5-7]的方法并做适量改进,采用固体培养基添加DHM进行饲喂。固体培养基:1/4 MS+蔗糖10 g/L+琼脂粉6 g/L,pH 6.5;DHM试验组在此基础上添加2 mg/mL DHM。采取幼嫩期(S1)的三角梅叶子花,将苞片分别插入DHM试验培养基、空白对照培养基,使苞片完全浸泡在培养基中。25 ℃、光照培养36 h。各品种每个处理苞片处理量2 g,重复3次。培养结束后,清水冲洗苞片表面培养基,滤纸吸干表面水分,记录颜色变化。
1.5 苞片水提液色素成分分析
1.5.1 总黄酮的提取及含量测定将苞片剪成1 mm以下的细丝,称取三角梅苞片细丝2 g,以25 mL 60%乙醇超声波提取40 min,浸泡24 h后离心取上清液,得到色素水提液,于4 ℃冰箱保存,备用。利用亚硝酸钠-硝酸铝-氢氧化钠显色法,以芦丁为标准品绘制总黄酮含量测定标准曲线。精密量取2 mL水提供试液于容量瓶,60%乙醇溶液定容至25 mL,为稀释液。吸取2 mL稀释液加入1 mL 5% NaNO2溶液,1 mL 10% Al(NO3)3溶液,立即混匀,静置5 min,加入5 mL 4% NaOH溶液,以60%乙醇溶液定容至25 mL,混匀。静置5 min,利用紫外可见光谱仪在510 nm处测定吸光值,同时以试剂空白作参比。平行测定3次,并按照下式计算含量。
黄酮含量(mg·g-1) =(C×V1×V2)/(M×V3×1 000)×100%
式中,C为标准曲线计算的仪器检测浓度(mg/mL),V1为提取液定容量(mL),V2为测定时定容量(mL),V3为吸取测定量(mL),M为称取样品的量(g)。
1.5.2 甜菜色素的提取及总量测定精密称取三角梅各供试材料各2 g,加入液氮将其研磨为粉末,迅速加蒸馏水 50 mL 进行振荡,然后置于超声波清洗器中提取 20 min,置于 4 ℃、12 000×g 的条件下进行离心 20 min,收集上清液。精密量取2 mL上清液于容量瓶,60% 乙醇溶液定容至25 mL,为稀释液。取2 mL稀释液定容至25 mL,紫外可见分光光度计538 nm处测稀释液甜菜红吸光值,465 nm处测甜菜黄吸光值[8],同时以试剂空白作参比。平行测定3次,并按照Stintzing的公式计算含量。
1.5.3 叶绿素、类胡萝卜素提取及含量的测定取0.5 g左右的三角梅苞片细丝,以10 mL丙酮和无水乙醇(V∶V=1∶1)混合提取液超声波提取40 min,避光浸提至苞片颜色消失,离心取上清液为供试液,在波长663、645和470 nm下测定吸光度值[9],同时以试剂空白作参比。平行测定3次。叶绿素a、叶绿素b、类胡萝卜素以及叶绿素总量按Lictenthaler[10]的公式计算。
1.6 数据统计分析
使用软件SPSS Statistics 26进行相关性分析;Excel进行数据整理及绘图,Origin 2019进行多元线性回归分析;DPS数据处理系统进行灰色关联分析。
灰色关联分析以供试的6个三角梅品种做为一个灰色系统,其中每一个品种作为系统中的一个灰色单元,以各指标最佳值构建“参考品种”的苞片参数,对三角梅苞片参数指标进行标准化处理及无量纲化处理,计算各品种差序列Δi=|x0(k)-xi(k)|,求得最大极差值M=maximaxkΔi(k)与最小极差值m=miniminkΔi(k),然后计算各指标关联系数ζi(k)=(m+ρM)/(Δi+ρM),对无量纲化后各指标参数赋权,最后计算加权关联度[11]。公式中,i=1,2,3…,n(待评价品种数);k=1,2,3…,n(待评价指标数);Δi=|x0(k)-xi(k)|为第i个品种第k个指标无量纲化处理值与最优指标值的绝对差值。为分辨系数,取值范围为[0,1],本实验中取0.5,γi为第i个品种的灰色关联度,w(k)第k个指标的权重。
2 结果和分析
2.1 三角梅各品种苞片不同发育时期色素含量、色彩参数及相关性分析
2.1.1 苞片色素含量三角梅苞片色素含量在品种间和不同发育时期之间多存在显著性差异。其中,苞片中总黄酮含量以‘安格斯’最低,而以‘新加坡大白’和‘花叶大红’相对较高,且品种间均存在显著性差异;随苞片发育进程(S1→S2→S3),各品种苞片中总黄酮含量均呈较为一致的逐渐下降趋势,但在发育时期间均无显著差异(图2,A)。苞片甜菜色素(甜菜红素和甜菜黄素)含量在各品种间有显著差异,并以品种‘花叶大红’最高,且显著高于同期其余品种,而苞叶甜菜红素含量以品种‘新加坡大白’最低,并低于同期大多数品种,苞叶甜菜黄素含量以‘新加坡大白’和‘安格斯’最低,并与其余品种差异显著;苞片甜菜色素随苞片发育总体呈上升趋势,但仅‘新加坡大白’‘宝老橙’和‘中国丽人’苞叶甜菜红素含量在生育时期间有显著差异。各品种苞片叶绿素含量(叶绿素a和b)从S1期到S2期大多显著下降,随后均保持相对稳定,即S1期明显高于其余时期,且在各时期均以品种‘花叶大红’含量最高。苞叶类胡萝卜素含量在各品种三角梅苞片中均处于较低水平,但在品种间和生育期间存在显著差异,各品种以‘新加坡大白’、‘花叶大红’和‘安格斯’相对较高;随着生育期推进,‘花叶大红’和‘中国丽人’含量有降低趋势,并在S1时期有最高值,而其余品种则有上升的趋势,多在S3时期有最高值。
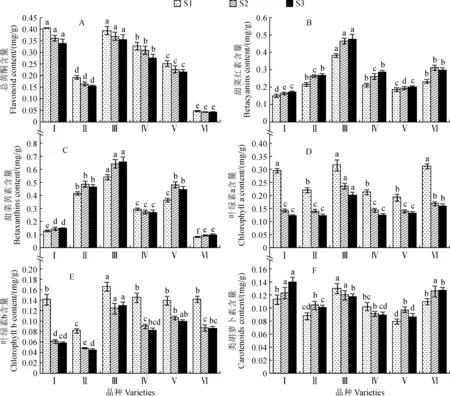
Ⅰ.新加坡大白;Ⅱ.宝老橙;Ⅲ.花叶大红;Ⅳ.中国丽人;Ⅴ.黄蝶;Ⅵ.安格斯;同一发育阶段内不同小写字母表示三角梅品种间苞片色素含量在0.05水平存在显著性差异(P<0.05);下同图2 各品种三角梅苞片不同发育期色素含量Ⅰ. Singapore White; Ⅱ. Baolaocheng; Ⅲ. Brilliant Variegata; Ⅳ. China Beauty; Ⅴ. Firecracker Yellow; Ⅵ. Elizabeth Angus;Different lowercase letters indicate significant differences in pigment content of Bougainvillea spp. bracts among different varieties at the same developmental stage at 0.05 level (P<0.05). The same as belowFig.2 The pigment content of Bougainvillea spp. bracts in different developmental stages
2.1.2 苞片色素含量比例不同三角梅品种间苞片中各色素含量占比也有明显差异(图3)。其中,甜菜色素作为三角梅苞片中的主要色素,其在不同品种三角梅苞片中含量占比差距较大,且甜菜红素与甜菜黄素也有所差异。在苞片幼嫩期(S1),叶绿素和甜菜色素是苞片中的主导色素(占比>50%),而在盛开期(S2)和衰败期(S3),总黄酮和甜菜色素是苞片中的主导色素。可以看出,随三角梅苞片发育,其中色素含量占比的变化表现出一定规律性, 即在3个发育时期,苞片中甜菜色素含量(甜菜红素+甜菜黄素)都是较高,随着发育时期总体呈上升趋势;随着苞片不断发育,其中的总黄酮、叶绿素含量都出现下降趋势,且叶绿素(叶绿素a、叶绿素b)含量下降明显;苞片胡萝卜素含量在发育中变化较小,增降幅度均波动不大。

图3 不同品种和发育期三角梅苞片各色素含量占比差异Fig.3 The difference in the percentage of pigment content of Bougainvillea ssp. bracts in different cultivars and developmental stages
2.1.3 色彩参数随三角梅苞片发育进程,各品种苞片色彩参数的变化表现出一定的规律性及差异性(表1)。其中,苞片亮度(L*值)大致呈增大趋势,即随苞片发育,苞片亮度增大,并以白色品种三角梅‘新加坡大白’苞片色彩亮度最大;各品种苞片的红绿色相值(a*值)在幼嫩期向盛开期发育阶段(S1→S2)均呈增大趋势,在盛开期向衰败期发育阶段(S2→S3)除‘新加坡大白’与‘黄蝶’两品种a*值呈下降趋势,其余4品种均呈上升趋势;各品种苞片黄蓝色相值(b*值)随发育的进程(S1→S3)整体呈下降趋势,除‘新加坡大白’ b*值的下降主要体现在幼嫩期向盛开期发育阶段(S1→S2)外,其余品种b*值的下降主要体现在盛开期向衰败期发育阶段(S2→S3);随苞片发育进程,各品种苞片色彩饱和度(C*值)除‘新加坡大白’外也整体呈上升趋势。
2.1.4 苞片色素含量与色彩参数相关性为探究三角梅苞片色素含量与苞片色彩间的关系,将三角梅苞片中色素含量与色彩参数进行相关性分析。由表2可知,苞片叶绿素(叶绿素a、b、总叶绿素)和类胡萝卜素的含量与其色彩参数无显著相关性;苞片甜菜色素(甜菜红素、甜菜黄素、总甜菜色素)含量及总黄酮含量与其色彩参数有显著的相关性。其中,甜菜红素、甜菜黄素及总甜菜色素含量与苞片a*值呈显著正相关(P<0.05),即随着甜菜色苷含量的升高,苞片a*值增大(红色增加或绿色减退);甜菜红素及总甜菜色素含量与苞片L*值呈显著负相关,即随着甜菜红素、总甜菜色素含量的升高,苞片L*值减小(苞片色彩变暗);甜菜红素含量与苞片b*值呈显著负相关,即随着甜菜红素含量的升高,苞片b*值减小(黄色减退或蓝色增加);总黄酮含量与苞片L*值及b*值呈显著正相关,与苞片a*值呈极显著负相关(P<0.01),即随着总黄酮含量增加,苞片L*值增大(苞片色彩变亮)及b*值增大(黄色增加或蓝色减退);同时,三角梅苞片中甜菜黄素含量与色相值H*呈显著正相关。

表1 三角梅各品种不同生育期苞片色彩参数

表2 三角梅苞片色彩参数与色素含量相关系数
为进一步了解三角梅苞片与其色素含量间的关系,对三角梅苞片色彩参数与其苞片中色素含量存在着相关性的因子间进行回归分析,即以L*、a*、b*为因变量(y),甜菜红素、甜菜黄素、总甜菜色苷、总黄酮含量为自变量(分别以x1、x2、x3、x4表示),进行多元线性回归方程拟合,得如下拟合方程:
L*:y=64.001-747.345x1-1.079x3+812.974x4(R2=0.551);
a*:y=12.124+90.656x1+13.45x2+19.255x3-21.809x4(R2=0.767);
b*:y=25.377-84.439x1+24.347x4(R2=0.535)
根据回归方程自变量系数可知,三角梅苞片色素含量对其色彩参数值(L*、a*、b*)的影响中,甜菜红素含量的影响值均大于总黄酮含量的影响值。综上,三角梅苞片色彩主要由甜菜色素和黄酮类色素两类色素所决定,并以甜菜红素的影响最大。因此后续主要讨论甜菜色素及总黄酮对三角梅苞片色彩的影响。
2.2 DHM离体诱导培养对三角梅苞片色素成分含量和色彩参数的影响
2.2.1 色素成分含量及占比图4,A、B显示,经二氢杨梅素(DHM)体外诱导培养的6个品种三角梅苞片中,总黄酮含量在4个品种三角梅(‘新加坡大白’、‘宝老橙’、‘中国丽人’、‘黄蝶’)苞片中明显升高,并以‘新加坡大白’苞片中总黄酮含量上升幅度最大(+65.77%);各品种苞片总甜菜色素含量均下降,其中的‘新加坡大白’苞片中甜菜色素含量下降幅度最大(甜菜红素:-62.80%,甜菜黄素:-59.75),‘黄蝶’、‘安格斯’苞片中甜菜黄素含量变化与其他4个品种相反,有小幅度上升(‘黄蝶’甜菜黄素:+9.72%,‘安格斯’甜菜黄素:+15.30%)。
同时,如图4,C、D所示,经DHM体外诱导培养的6个品种三角梅苞片中,除红色品种‘花叶大红’及紫色品种‘安格斯’例外,其余4个品种的三角梅苞片中总黄酮含量占比均呈上升趋势,甜菜色素含量占比均呈下降趋势。其中,白色花色品种‘新加坡大白’苞片中色素含量占比变化幅度最大,并且表现为总黄酮含量占比显著上升(+26.91%),甜菜色素占比下降(甜菜红素含量占比-15.24%,甜菜黄素含量占比-11.67%);红色花色品种‘花叶大红’苞片中各色素含量占比变化幅度最小。

DHM.DHM饲喂培养实验组;CG.对照组;下同图4 三角梅苞片DHM体外诱导培养后色素含量及其占比的变化DHM. DHM feeding experimental group; CG. Control group. The same as belowFig.4 The changes of pigment contents and its percentage in Bougainvillea ssp. bracts after DHM induction and culture in vitro
2.2.2 苞片表观色彩6个品种三角梅苞片在含飞燕草素苷前体物DHM的培养基光照培养36 h后,3个品种的三角梅苞片出现了较为明显的颜色变化(图5)。其中,‘中国丽人’苞片颜色加深,苞片底部到尖端的颜色过渡减弱,苞片呈色较为一致;‘宝老橙’苞片橙色变浅,色彩变暗;‘新加坡大白’苞片叶脉变明显,同时苞片颜色发生较为明显变化,苞片呈白色。各品种苞片色彩的变化与其苞片中甜菜色素含量及色素含量的占比变化结果基本一致。可见,经过DHM体外离体饲喂培养的苞片颜色和色素含量及占比发生了较明显变化,由此可推测此类供试品种苞片组织细胞能自动摄取,并使摄入的DHM进入自身色素代谢途径,对原有的自身色素代谢途径下游产物产生一定干扰。

图5 三角梅苞片DHM体外诱导培养后表观色彩变化Fig.5 The apparent color changes of Bougainvillea ssp. bracts after DHM induction and culture in vitro
2.3 三角梅品种苞叶色素成分含量的灰色关联度分析
三角梅苞片总黄酮含量和甜菜色素含量与其苞片色彩参数间有着较强相关性,同时总黄酮含量及占比变化大的品种对应苞片色彩变化有较明显变化,说明高含量的总黄酮及权重有益于三角梅花色的改变,而甜菜色素是三角梅苞片中的主要色素。因此,高含量及占比的总黄酮、低含量及占比的甜菜色素是三角梅新型花色选育研究中选择目标品种时重要的考虑因素。
由于本实验各指标参数单位一致,因此采取均值化对各指标进行无量纲化处理。由供试品种各指标参数的最佳值作为灰色关联分析参考品种指标参数。参考三角梅品种的各项指标参数为:总黄酮含量0.421 9 mg/g,甜菜红素含量0.161 2 mg/g,甜菜黄素含量0.098 3 mg/g,总甜菜色素含量0.322 6 mg/g;由于甜菜红素含量、甜菜黄素含量与蓝色花色呈负相关作用,因此对无量纲化甜菜红素含量、甜菜黄素含量指标参数时取逆序列值;根据本实验所测色素含量与苞片间相关性分析结果对无量纲化后各指标参数赋权:总黄酮含量为0.4,甜菜红素含量为0.5,甜菜黄素含量为0.05,总甜菜色素含量为0.05。
应用灰色系统的关联度分析计算供试品种与参考品种的关联度(表3),发现‘新加坡大白’关联度最高(0.744 4),所以可选定‘新加坡大白’作为蓝色转基因三角梅候受体品种。

表3 三角梅品种苞叶色素成分含量灰色关联度分析
3 讨 论
本研究对三角梅苞片色彩参数间进行相关性分析发现苞片色彩明亮度(L*)值与色红绿色相(a*)值呈负相关,这与余秋岫等[12]在对紫花含笑花被呈色过程中色素含量变化研究结果一致,即随着红度的降低,花瓣的亮度逐渐升高。三角梅苞片的红绿色相(a*)值对三角梅苞片的呈色有着举足轻重的作用,因此,在对三角梅花色的改良及新型花色的培育研究中,红绿色相(a*)值的控制与改变是今后研究者们的重要研究切入点。
本研究通过对三角梅苞片中色素含量与苞片色彩参数进行相关性分析发现,总黄酮含量与苞片a*值呈显著正相关,这与前人对叶片色彩与色素含量的相关性研究结果一致,即黄酮类色素含量与红绿色相值a*呈显著或极显著正相关[13-15]。同时,本研究发现三角梅苞片甜菜红素含量与苞片L*值及b*值呈极显著负相关,与a*值呈显著正相关,即甜菜红素含量对三角梅苞片呈色有着决定性的影响。Aida等研究证明,提高黄酮、黄酮醇含量能使蝴蝶兰转化植株花色变蓝[16]。黄酮类物质的黄酮和黄酮醇是重要的助色素,当黄酮与花色苷组成复合物时,可产生增色效应,使花色苷的可见光吸收光谱发生红移现象,使花色的蓝色效果增强[17]。因此,高黄酮含量的植物品种也是理想蓝色转基因受体的一个重要选择对象。在本研究供试4大花色6个品种三角梅品种中白色三角梅‘新加坡大白’最适宜作为蓝色花色转基因受体。三角梅苞片中的甜菜色素是决定其花色的主要色素,白色品种中甜菜色素含量权重低,有利于其他色素的展色,并且不会对其他色素原有色彩产生干扰,可使转化植株形成的蓝色效果更加明显。
三角梅苞片颜色隶属的甜菜色素和属于类黄酮的花青素在自然界排斥分布,不能积累蓝色素,目前解决这一问题的方法一是为植物转入F3′5′H基因,一是进行DHM饲喂。在不能确定能否有效发挥作用的品种中盲目转入新基因很难取得明显结果,因此饲喂实验变为首选。近年研究发现三角梅属植物苞片中存在大量黄酮类物质(檞皮素、山奈酚、异鼠李素等)[18],同时在三角梅属植物中已成功检测出花青素合成途径末端的3个基因(DFR,LDOX,3-GT),特别是DFR是催化F3′5′H生成DHM的关键基因,使得培育三角梅蓝花色品种有了科学依据。自然界中大多数蓝色花的花色苷都是由飞燕草素苷组成,而DHM是飞燕草素合成必要的前体物质。该合成路径是转化外源蓝色基因受体花色呈现蓝色的前提。
在本研究中只是讨论了三角梅产生蓝色花的可能性,找到了最适宜作为转基因受体的花色——白色。我们推测其余颜色中较高的甜菜色素含量对花青素的合成有一定影响。前人认为两者的合成前体存在渊源,均与苯丙氨酸相关,有一定的竞争关系[19]。Harborne等报道当植物体中单独存在飞燕草素糖苷时,多数情况下花显现紫红色,只有需要类黄酮作为助色素才会表现出蓝色[20],因此今后仍需进一步对相关基因功能进行验证,检测助色素含量,以及研究如何抑制甜菜色素合成途径让代谢流进入花青素合成途径,才能最终达到蓝色三角梅培育的目的。本研究是首次在甜菜色素合成途径的观赏植物中进行饲喂实验,为三角梅新花色的培育提供了新方向,为利用基因工程技术合成蓝色三角梅提供了数据支撑。
