荒漠半灌木白滨藜种子的萌发特性及其生态意义
2016-01-28蔡丹红严成魏岩
蔡丹红,严成,魏岩*
(1.新疆农业大学草业与环境科学学院,新疆草地资源与生态重点实验室,新疆 乌鲁木齐830052;
2.中国科学院新疆生态与地理研究所,新疆 乌鲁木齐830011)
荒漠半灌木白滨藜种子的萌发特性及其生态意义
蔡丹红1,严成2,魏岩1*
(1.新疆农业大学草业与环境科学学院,新疆草地资源与生态重点实验室,新疆 乌鲁木齐830052;
2.中国科学院新疆生态与地理研究所,新疆 乌鲁木齐830011)
摘要:白滨藜是具有抗旱、抗盐碱和耐贫瘠能力的半灌木,为新疆地区的良等牧草。通过研究温度、贮藏时间、苞片及盐分对白滨藜种子萌发的影响,结果表明:白滨藜种子萌发的最适温度为20/30℃和25/35℃。室温干藏2~8个月显著提高种子的萌发速率,干藏10个月后,种子萌发速率与萌发率显著降低。苞片延缓种子吸胀,对种子的最终萌发率有显著影响;去除苞片可以明显促进种子的萌发。浓度低于0.8 mol/L的NaCl溶液对种子萌发的影响不大;但从0.8 mol/L起萌发率随着浓度增高而降低,直至为零;将在0.05~4.00 mol/L盐溶液中处理的种子转移至蒸馏水后,仍有一定的萌发恢复率,表明NaCl处理后的部分种子有保持活力的能力,部分种子丧失活力。对白滨藜种子萌发特性的研究,为揭示其萌发行为进化和生态适应机制提供科学依据,也为新疆荒漠盐碱地区饲用半灌木引种改良,良种繁育提供基础资料。
关键词:白滨藜; 温周期; NaCl胁迫; 苞片; 种子萌发
Seed germination characteristics of the desert subshrubAtriplexcanaand its ecological significance
CAI Dan-Hong1, YAN Cheng2, WEI Yan1*
1.XinjiangKeyLaboratoryofGrasslandResourcesandEcology,CollegeofGrasslandandEnvironmentalScience,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangEcologyandGeographyResearchInstitute,ChineseAcademyofSciences,Urumqi830011,China
Abstract:Atriplex cana is a xerophytic subshrub with drought resistance, salinity resistance and low fertility tolerance. It is a useful forage plant in Xinjiang. Experiments were conducted to determine the effects of temperature, seed bract removal, and NaCl on seed germination. Seeds were able to germinate in a range of temperatures from 5/15℃ to 25/35℃. The higher the temperature, the faster the germination occurred. The optimum temperature regime for seed germination was 20/30℃ and 25/35℃. Under a 25℃ dark/35℃ light regime, the final germination percentage reached a maximum value after 6-8 days of hydration, while under 5/15℃ and 10/20℃ temperature regimes final germination percentage was achieved after 25-34 days. There was a significant increase in seed germination rate after 2-8 months seed storage, while germination percentage of seeds decreased when exposed to natural atmospheric conditions for 10 months. Bracts formed a mechanical barrier to water uptake, and has a significant influence on the final seed germination rate. Removal of bracts promoted seed germination. Germination was not affected by NaCl at concentrations below 0.8 mol/L, but was decreased by NaCl at higher concentrations. Seeds incubated in NaCl at concentrations of 0.05-4.00 mol/L recovered after being transferred to distilled water. After NaCl treatment some seeds retained their vigor, while others lost vigor. Research into seed germination characteristics may reveal a scientific basis for this ecological adaptation trait. Such research may also provide basic data for improvement salinity tolerant forage subshrub production in the Xinjiang desert.
Key words:Atriplex cana; temperature; NaCl stress; bracts; germination
随着世界人口的增长和人们生活水平的提高,土地和淡水资源越来越匮乏,开发利用盐碱地已成为当今世界研究的热门领域之一。新疆是我国盐渍土分布最广、面积最大的省区[1]。盐生植物群落是盐渍生境中唯一能够生长的植物群落类型,对区域生态建设和经济发展有着重要贡献。种类众多的盐生植物必将成为区域未来经济发展的宝贵的潜在资源。
在盐碱土上引种和驯化具有经济价值的盐生植物和耐盐植物, 可以增加盐土荒漠的植被盖度,在盐碱土或因次生盐渍化而弃耕的土地上选择饲用盐生植物建立人工草场,开辟草料地,在一定程度上能够增加草料生产,缓解天然草场的放牧压力, 发展干旱荒漠区的畜牧业。
白滨藜(Atriplexcana)为藜科(Chenopodiaceae)滨藜属(Atriplex)半灌木,具有很强的抗干旱、抗盐碱和耐贫瘠能力;在我国新疆北部,额尔齐斯河、乌伦古河两岸分布较集中;外高加索(东部)、中亚、哈萨克斯坦、西西伯利亚、蒙古及欧洲也有分布[2]。在新疆山地白滨藜常以单优势种或以优势种组成不同的草地型[3]。白滨藜以其适口性评价好[4],营养价值和生产性能高,被列为良等牧草[5],并可作为荒漠类草地的补播草种。对白滨藜的研究主要集中在形态[2],营养器官的结构[6],饲用价值[5-7]等方面,对其种子的萌发行为还未见报道。
种子萌发是植物生命周期的关键阶段,是种群更新的重要途径[8]。本文从温度、盐分、苞片附着物及种子贮藏时间等角度对白滨藜种子萌发特性进行研究,以揭示种子萌发特性及其生态适应对策,为新疆荒漠盐碱地区饲用半灌木引种改良,驯化培养、良种繁育提供基础资料,也为保护、恢复与重建受损生态系统提供理论依据。
1材料与方法
1.1 研究材料与研究地点
成熟白滨藜种子于2013年10月采集于新疆准噶尔盆地南缘的低山砾质荒漠(43°45′44″-43°47′25″ N,87°33′16″-87°34′56″ E)。该区春秋季较湿润,夏季干旱,热量充足,冬季漫长而寒冷,属中温带荒漠区。年降水量为266.9 mm,蒸发量为2731 mm;年均温7.5℃,极端最高温为37.7℃,极端最低温度为-19.1℃[9]。
1.2 种子形态
白滨藜的种子为胞果,果皮薄,内有1粒种子,胚螺旋状,文中将果实称为种子。随机选取大小不同的白滨藜植株20株,于2013年8-10月,观察种子和宿存苞片的形态,种子的形状、颜色。用万分之一天平称量25粒种子质量(g),4 个重复,计算单粒种子的质量。在显微镜下测量种子的长与宽(mm)。
1.3 种子的萌发特性
种子收集后,在通风条件下晾干,室温下保存备用。种子的萌发试验以每组25粒,4个重复。种子的萌发以胚根突破种皮为标志。在种子萌发过程中,每24 h观测1次,记录不同变温下种子萌发数并把已萌发的幼苗移走。
1)种子在不同变温下的萌发。新成熟的种子置于直径为90 mm垫有2层滤纸的培养皿中,加入5 mL蒸馏水,分别在5/15℃、10/20℃、15/25℃、20/30℃、25/35℃ (暗/光=12 h/12 h)变温下进行种子萌发实验,持续观察直到连续5 d无新种子萌发时视为萌发结束。
2)储藏时间对种子萌发的影响。每隔2个月,进行萌发实验。根据(1)的实验结果,在20/30℃的温度和光照(暗/光=12 h/12 h)条件下,将种子置于直径为90 mm垫有2层滤纸的培养皿中,加入5 mL蒸馏水培养。
3)苞片对种子萌发的影响。将种子设3个处理:①带苞片的种子;②苞片+种子(将苞片与种子剥离,一起放入培养皿中);③去除苞片的种子(裸种子)。在20/30℃的温度和光照(暗/光=12 h/12 h)条件下进行萌发。每天观测不同处理组种子的萌发数目及每个处理萌发率都达到50%的时间(TG50)。
种子吸胀的方法:种子处理为去除苞片的种子和带苞片的种子。在20/30℃的温度和光照(暗/光=12 h/12 h)条件下进行萌发。每半小时称量各处理下的裸种子1次(每次20粒,重复3次),5 h后每小时称重1次直到吸胀稳定,并观测记录每个处理初始萌发时间。
4)种子在不同浓度NaCl溶液中的萌发。NaCl溶液的浓度分别为0(CK),0.05,0.1,0.2,0.4,0.6,0.8,1.0,1.2,1.6,2.0及4.0 mol/L。在20/30℃的温度和光照(暗/光=12 h/12 h)条件下,将种子置于直径为90 mm垫有2层滤纸的培养皿中。每个处理加入5 mL不同浓度盐溶液,对照中加入5 mL蒸馏水,为防止溶液蒸发,用封口膜封口。实验过程中每天观测1次,并记录每个处理萌发率都达到50%时的时间(TG50)。无种子萌发后(19 d)将未萌发的种子转移到蒸馏水中继续培养,观测不同盐处理下种子萌发恢复情况,并计算萌发恢复率。萌发恢复率=(A-B)/(C-B)100%,其中,A是全部时间的萌发种子数,B是盐溶液中的萌发种子数,C是实验用的该处理的全部种子数,并记录4个重复萌发恢复率都达到50%的时间(TG50)。
1.4 数据统计与分析
实验结果均以平均值±标准误(SE)表示。使用SPSS 17.0统计软件,在95%水平上通过单因子方差(One-Way ANOVA)分析,对数据进行显著性检验。Duncan post-hoc test用于检验处理间多重比较的差异显著性(P<0.05)。用Sigma plot 12.5制图。
2结果与分析
2.1 种子形态
白滨藜的果实为胞果,果实外有2枚苞片包被,苞片表面有银白色密粉,苞片卵圆形,长(7.04±0.51) mm,宽(5.73±0.28) mm。种子圆形,暗红褐色,直径(3.62±0.16) mm,单粒重(3.89±0.21) mg。
2.2 不同变温下的种子萌发
白滨藜种子在不同温周期下进行培养,种子的最终萌发率都较高(95%以上)(图1),而萌发速率则随着变温周期的升高而增快。种子萌发的适宜温周期为20/30℃和25/35℃,萌发率达100%,6~8 d萌发完。温度越低,种子的萌发速度越慢,低温周期(5/15℃和10/20℃)的萌发时间大于25 d,种子呈持续性萌发。
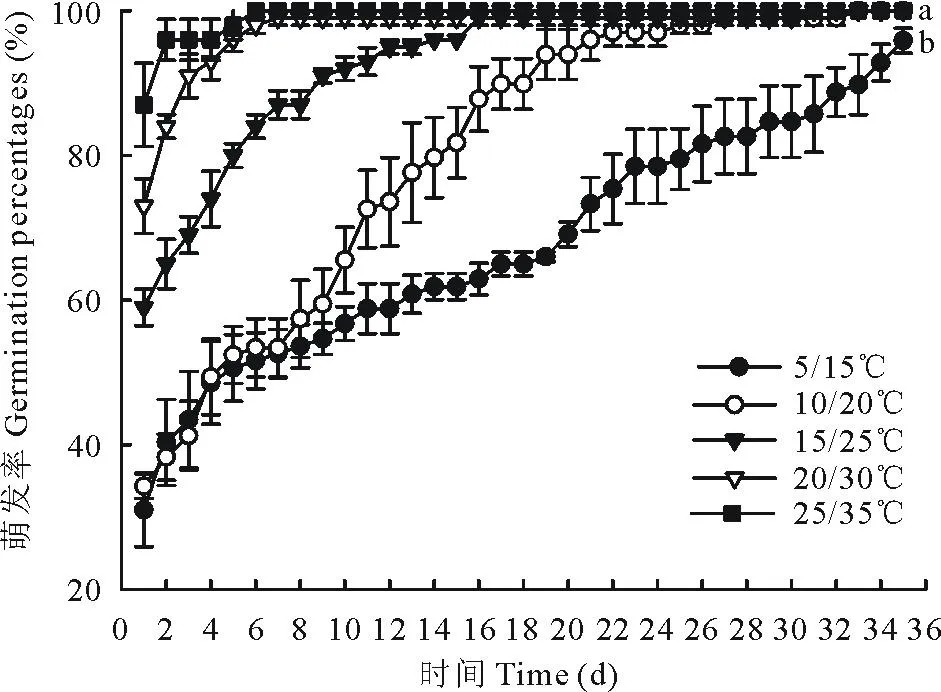
图1 白滨藜种子在不同变温下的累积萌发率Fig.1 Cumulative germination percentages of A. cana seeds at different temperature
2.3 不同储藏时间下的种子萌发
对不同贮藏时间下的白滨藜种子进行培养,萌发率如图2所示。和新成熟种子(0月)相比,干藏2~8个月显著提高种子的萌发速率,第1天的萌发率均达到90%以上;干藏10个月后,种子萌发速率与萌发率显著降低。

图2 白滨藜种子在不同贮藏时间下的累积萌发率Fig.2 Cumulative germination percentages of A. cana seeds at different storage time
2.4 苞片对种子萌发的影响
不同处理下的种子萌发率如图3所示。带苞片种子的最终萌发率低(<65%)。去除苞片能显著地促进种子的萌发,并且有较高的萌发率(>95%);苞片与种子剥离,一起放入培养皿中萌发11 d后,种子的萌发率和去除苞片的种子萌发率无显著差异。
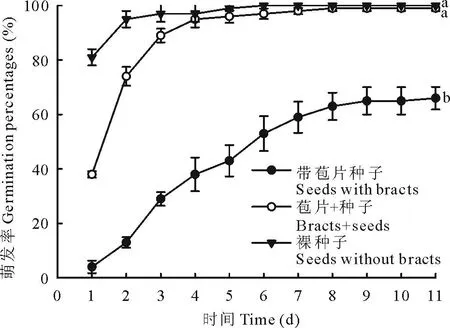
图3 白滨藜种子在不同处理下的累积萌发率Fig.3 Cumulative germination percentages of A. cana seeds at different treatments
种子吸涨实验表明(图4),苞片延缓种子的吸胀,去除苞片种子的吸胀重量在23 h已达到稳定,带苞片种子在70 h达到稳定。当去除苞片的种子吸水2 h时开始萌发,此时种子重量是吸水前的1.76倍;而具有苞片的种子吸水23 h 时重量才达到吸水前的1.76倍,此时种子开始萌发。

图4 苞片对白滨藜种子吸水与萌发的影响 Fig.4 Influence of the presence or absence of bracts on imbibition and germination of A. cana seeds 字母“G”代表开始萌发的时间。Letter “G” represents the time of beginning germination.
2.5 不同浓度NaCl溶液中的种子萌发
2.5.1盐胁迫下的白滨藜种子的萌发培养19 d后,白滨藜种子在不同NaCl溶液中的萌发率如图5所示。低浓度的NaCl溶液(≤0.1 mol/L)促进白滨藜种子的萌发;≤0.8 mol/L的盐溶液对种子的累积萌发无显著影响;NaCl溶液≥1.0 mol/L时,随着盐浓度的增加,种子的累积萌发率呈下降趋势,直至为零。
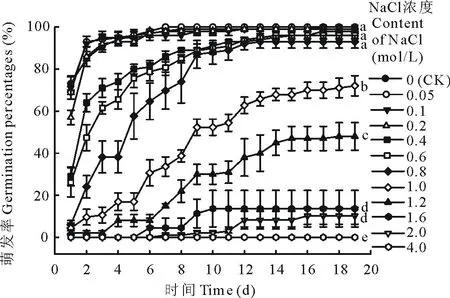
图5 白滨藜种子在不同浓度NaCl溶液下的累积萌发率Fig.5 Cumulative germination percentages of A. cana seeds at different saline solution
白滨藜种子在不同NaCl溶液中的TG50如图6所示。盐浓度在≤1.0 mol/L中的累积萌发率能达到50%。TG50随着盐浓度的增加而延长。
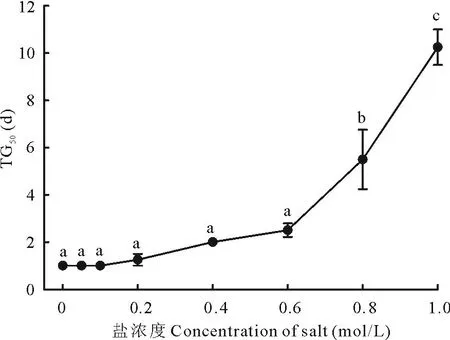
图6 白滨藜种子在不同浓度 NaCl溶液下的TG50Fig.6 Effects of concentration of NaCl solution on TG50 of A. cana seeds
2.5.2复水后的白滨藜种子的恢复萌发在萌发19 d后,将未萌发的白滨藜种子放到蒸馏水中继续萌发。恢复萌发率如表1所示,在高浓度盐溶液中,种子的恢复萌发率保持在较高水平;大于0.8 mol/L的盐溶液的恢复萌发都大于25%;1.6 mol/L盐溶液的恢复萌发达到46.9%。
复水6 d后,8个盐溶液处理(0~1.0 mol/L)种子的最终萌发率达到80%以上;和对照相比,在大于1.0 mol/L的高浓度NaCl溶液中的最终萌发率则较对照低,且差异显著。盐溶液浓度与白滨藜种子的最终萌发率呈负相关性。种子萌发的初始时间和TG50都随着盐浓度的提高而显著延长。
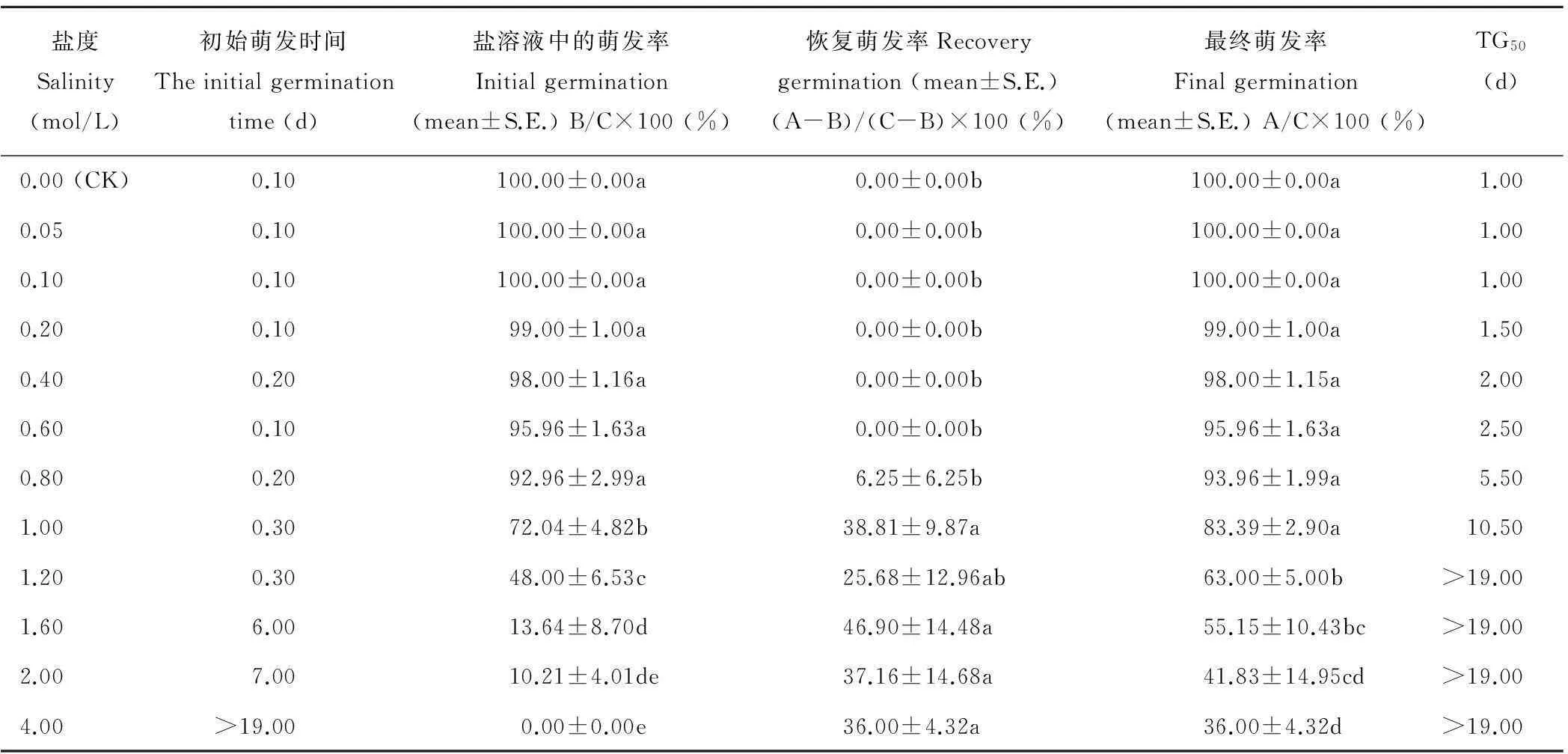
表1 白滨藜种子在不同浓度的NaCl溶液中的萌发率、复水后的恢复萌发率和最终萌发率
注: A表示全部时间的萌发种子数,B表示盐溶液中的萌发种子数,C表示实验用的该处理的全部种子数。同列中不同字母(a、b、c)表示不同处理间差异显著(Duncan post-hoc 多重比较,P<0.05)。
Notes: A is all the time on the number of germination of seeds; B is the number of germination of seeds in a salt solution; C is experiment with the number of all the seed of the processing. Different letters (a, b, c) in each column indicate significant differences between all concentrations of NaCl (Duncan post-hoc test,P<0.05).
3讨论与结论
对于荒漠中的植物来说,生存机制的特殊结合是非常普遍的[10]。而特殊的萌发机制对环境的适应是荒漠植物能够存活和发展的关键。白滨藜长期生活在盐碱荒漠环境中,形成了与环境相适应的萌发对策。
温度是植物种子萌发的重要因子,适宜温度是种子快速萌发的先决条件[10-11]。实验表明,白滨藜种子萌发的适宜温度为20/30℃和25/35℃,萌发速率最快;随着温度降低,种子的萌发速度也随之减缓;低温周期(5/15℃和10/20℃)的种子萌发时间相对比较长,成持续性萌发。Khan等[12]曾报道Salicorniarubra种子的最佳萌发温度为20/30℃和25/35℃,在25/35℃温周期中萌发率最大(98%),而5/15℃的低温周期的种子萌发率不到50%,低温周期在一定程度上延迟或抑制种子萌发。此类报道还在Salicorniapacificavar.utahensis[13],Allenrolfeaoccidentalis[14]、Triglochinmaritima[15]一些荒漠物种中出现。
种子质量的优劣影响着植物繁衍后代,而贮藏时间则在一定程度上影响种子质量。室内干藏对种子有一定促进作用,种子存在后熟现象[16]。实验表明,白滨藜种子的萌发速率在种子贮藏2个月后有所提高,而在干藏时间达10个月后种子萌发率和萌发速率开始下降,说明种子采集后存在生理后熟现象[16]。在自然生境中,白滨藜种子在10月份成熟,到第2年的春季(3-4月)种子经过生理后熟,萌发速率快,为幼苗的补充和更新提供保证。
散布结构对植物的进化过程具有重要的影响。散布体产量对保证植物有足够的机会得到散布,避开不良环境,在适宜条件下形成新的植株,进而对种群的稳定和发展起到重要作用,这些散布结构同时也影响种子的萌发特性[10]。吸水膨胀是种子萌发过程的重要环节;荒漠环境中,水也是种子萌发的制约因子[17]。种子内含水量达到一定程度才会萌发[18-19]。实验表明苞片对种子的萌发具有机械抑制作用,延缓了种子的吸水速度从而延缓了种子萌发时间,不带苞片的种子在2 h开始萌发,重量增加到原来的176%;带苞片的种子在23 h才开始萌发。苞片延长种子的吸胀时间,延缓种子的萌发速度。在自然条件下,种子的苞片使它更好地适应恶劣的沙漠气候变化,苞片对种子萌发的机械障碍,使种子萌发具有不整齐性,减少了突如其来的气候变化对幼苗的伤害。有关散布结构对种子吸胀萌发的影响在藜科其他植物中也有报道,Salsolaaffinis的果翅对种子萌发主要起机械障碍作用,从而延缓种子的萌发时间,不带翅的种子在吸水3 h后开始萌发,吸水后重量增加到原来的167%;带翅的种子在吸水24 h后,吸水后重量增加到原来的318%时才开始萌发[20];Atriplexprostrata的苞片限制其种子在秋天萌发,而在春天由于苞片脱落种子可以正常萌发[21];Atriplexmicrantha的苞片对褐色种子萌发没有抑制作用[22]。
盐分是盐碱荒漠环境中种子萌发的重要影响因子之一[23-24]。盐分对种子萌发有明显的抑制作用,且随盐度的增加而增加[25-29]。种子萌发的TG50及初始时间随着盐浓度的增加而显著延长[20]。实验表明,白滨藜种子在≤0.8 mol/L的盐溶液对种子的萌发率无显著影响,种子的萌发率保持在较高水平(90%),同科植物木地肤(Kochiaprostrata)种子在≤1.0 mol/L 的盐溶液中种子的萌发率在70%以上[27],梭梭(Haloxylonammodendron)种子在0.4 mol/L 的盐溶液中种子的萌发率已小于50%[29],因此白滨藜和木地肤均为高耐盐类种子[26-27]。NaCl溶液≥1.0 mol/L时,白滨藜种子的萌发率随着盐分浓度的增加而减少,4.0 mol/L的NaCl溶液完全抑制种子萌发。
盐生植物种子长时间在高盐条件下有保持活力的能力,当盐分降低后能够恢复萌发[30-31]。低浓度的NaCl溶液对白滨藜种子的萌发影响不大而高浓度则较强抑制萌发;高浓度盐溶液(>1.0 mol/L NaCl)培养的种子转移至蒸馏水后,种子的萌发恢复率都较低(<40%),但在高达4.0 mol/L NaCl溶液中培养的种子转移至蒸馏水后,种子仍有36%的萌发恢复率,高浓度NaCl溶液可能造成部分种子的永久性失活。
从白滨藜的萌发特性看,白滨藜种子在20/30℃和25/35℃温周期中快速萌发;而苞片延缓种子吸胀,在一定程度上抑制白滨藜种子萌发,使种子萌发具有不整齐性,减少了突如其来的气候变化对幼苗的伤害;同时,白滨藜种子对盐分具有较高的忍耐力,在高盐条件下有保持活力的能力,当盐分降低后能够恢复萌发,保证幼苗的更新,使白滨藜在盐渍荒漠环境成功繁衍。
References:
[1]Fan Z L, Ma Y J, Ma Y J. Salinized soils and their improvement and utilization in West China.Arid Zone Research, 2001, 18(3): 1-6.
[2]Mao Z M. Flora Xinjiangensis,Tomus2(1)[M]. Urumqi: Xinjiang Science & Technology & Hygiene Publishing House, 1994: 18-27.
[3]Xu P. Grassland Resources and its Utilization in Xinjiang[M]. Urumqi: Xinjiang Science & Technology & Hygiene Publishing House, 1993.
[4]Xi J B, Zhang S F, Tian C Y. Halophytes in Xinjiang[M]. Beijing: Science Press, 2006: 1-56.
[5]Nizhmiding K, Mahsut G. Initially investigate and experiment on biological characteristic and feeding value ofAtriplexcana. Modern Agricultural Science and Technology, 2009, 9: 236-237.
[6]Zhou G L, Dilxat, An Z X,etal. Study on the micromorphology of leaf epidermis and the comparative anatomy of leaf ofAtriplexin Xinjiang. Arid Zone Research, 1995, 12(3): 34-37.
[7]Department of Animal Husbandry of Xinjiang Uygur Autonomous Region. Main Forage Plants in Xinjiang, Tomus 2[M]. Urumqi: Xinjiang Science & Technology & Hygiene Publishing House, 1994.
[8]Khan M A, Ungar I A. Influence of salinity and temperature on the germination ofHaloxylonrecurvumBunge ex. Boiss. Annals of Botany, 1996, 78: 547-551.
[9]Ye W Y, Yin L K, Qian Y,etal. Study on the vegetation type of Yamalike Mountain and plant diversity characteristic. Environmental Protection of Xinjiang, 2005, 27(2): 1-4.
[10]Gutterman Y. Seed Germination of Desert Plants[C]. Berlin: Springer-Verlag, 1993.
[11]Zhang J N, Liu K. Mechanisms for plants detecting the optimum time and place to germinate. Acta Prataculturae Sinica, 2014, 23(1): 328-338.
[12]Khan M A, Gul B, Weber D J. Germination responses ofSalicorniarubrato temperature and salinity. Journal of Arid Environments, 2000, 45: 207-214.
[13]Khan M A, Weber D J. Factors influencing seed germination inSalicorniapacificavar.utahensis. American Journal of Botany, 1986, 73: 1163-1167.
[14]Gul B, Weber D J. Effect of salinity, light and thermoperiod on the seed germination ofAllenrolfeaoccidentalis. Canadian Journal of Botany, 1999, 77: 1-7.
[15]Khan M A, Ungar I A. Seed germination and recovery ofTriglochinmaritimafrom salt stress under different thermoperiods. Great Basin Naturalist, 1999, 59: 144-150.
[16]Baskin J M, Baskin C C. A classification system for seed dormancy. Seed Science Researeh, 2004, 14: 1-16.
[17]Zhu X W, Huang Z Y, Zhang S M,etal. The responses of seed germination, seedling emergence and seedling growth inAgropyroncristatumtosand water content in Otindag Sandland, China. Acta Ecologica Sinica, 2005, 25(2): 364-370.
[18]Zheng G H, Shi Z L,Zhao T F. Application of Seed Physiology[M]. Beijing: China Agriculture Press, 1990.
[19]Baskin C C, Baskin J M. Seeds, Ecology, Biogeography and Evolution of Dormancy and Germination[M]. San Diego: Academic Press, 2001.
[20]Wei Y, Dong M, Huang Z,etal. Factors influencing seed germination ofSalsolaaffinis(Chenopodiaceae), a dominant annual halophyte inhabiting the deserts of Xinjiang, China. Flora, 2008, 203: 134-140.
[21]Ungar I A, Khan.M A. Effect of bracteoles on seed germination and dispersal of two species ofAtriplex. Annals of Botany, 2001, 87: 233-239.
[22]Liu P W, Wei Y. Seed dimorphism and germination behavior ofAtriplexmicrantha, an annual inhabiting Junggar desert. Acta Ecologica Sinica, 2007, 27(10): 4233-4239.
[23]Guma I R, Padron-Mederos M A, Santos-Guerra A,etal. Effect of temperature and salinity on germination ofSalsolavermiculataL (Chenopodiaceae) from Canary Islands. Journal of Arid Environment, 2010, 74: 708-711.
[24]Lu Y M, Su C Q, Li H F. Effects of different salts stress on seed germination and seedling growth ofTrifoliumrepens. Acta Prataculturae Sinica, 2013, 22(4): 123-129.
[25]Khan M A, Rizvi Y. Effect of salinity, temperature, and growth regulators on the germination and early seedling growth ofAtriplexgriffithiivar.stocksii. Canadian Journal of Botany, 1994, 72: 475-479.
[26]Khan M A. Comparative influence of salinity and temperature on the germination of subtropical perennial halophytes. In: Hamdy A, Lieth H, Todorovis M,etal. Halophyte Uses in Different Climates I. Ecological and Physiological Studies[M]. Leiden: Backhuys Publishers, 1999: 77-1188.
[27]Guo H C, Tahan W, Gao R,etal. Effect of salinity and temperature on the seed germination ofKochiaprostrate. Journal of Arid Land Resources and Environment, 2014, 28(9): 106-110.
[28]Keiffer C H, Ungar I A. The effect of extened exposure to hypersaline conditions on the germination of five inland halophyte species. American Journal of Botany, 1997, 84: 104-111.
[29]Huang Z Y, Zhang X S, Zheng G H,etal. Influence of light, temperature, salinity and storage on seed germination ofHaloxylonammodendron. Journal of Arid Environment, 2003, 55: 453-464.
[30]Khan M A, Gul B, Weber D J. Seed germination in the great basin halophyteSalsolaiberica. Canadian Journal of Botany, 2002, 80: 650-655.
[31]Woodell S R J. Salinity and seed germination patterns in coastal plants. Vegetatio, 1985, 61: 223-229.
参考文献:
[1]樊自立, 马英杰, 马映军. 中国西部地区的盐渍土及其改良利用. 干旱区研究, 2001, 18(3): 1-6.
[2]毛祖美. 新疆植物志第二卷第一分册[M]. 乌鲁木齐: 新疆科技卫生出版社, 1994: 18-27.
[3]许鹏. 新疆草地资源及其利用[M]. 乌鲁木齐: 新疆科技卫生出版社, 1993.
[4]郗金标, 张锁福, 田长彦. 新疆盐生植物[M]. 北京: 科学出版社, 2006:1-56.
[5]库尔班·尼扎米丁, 古丽加克热·买合苏提. 白滨藜生物学特性及饲用价值的初步调查与试验研究. 现代农业科技, 2009, 9: 236-237.
[6]周桂玲, 迪利夏提, 安争夕, 等. 新疆滨藜属植物叶表皮微形态学及叶的比较解剖学研究. 干旱区研究, 1995, 12(3): 34-37.
[7]新疆维吾尔自治区畜牧厅. 新疆主要饲用植物志(第二册 )[M]. 乌鲁木齐:新疆科技卫生出版社, 1994.
[9]叶卫英, 尹林克, 钱翌, 等. 雅玛里克山植被类型及物种多样性的特征. 新疆环境保护, 2005, 27(2): 1-4.
[11]张佳宁, 刘坤. 植物调节萌发时间和萌发地点的机制. 草业学报, 2014, 23(1): 328-338.
[17]朱选伟, 黄振英, 张淑敏, 等. 浑善达克沙地冰草种子萌发出苗和幼苗生长对土壤水分的反应. 生态学报, 2005, 25(2): 364-370.
[18]郑光华, 史忠礼, 赵同芳. 应用种子生理学[M]. 北京: 中国农业出版社,1990.
[22]刘鹏伟, 魏岩. 准噶尔荒漠异苞滨藜(Atriplexmicrantha)的种子二型性及其萌发行为. 生态学报, 2007, 27(10): 4233-4239.
[24]卢艳敏, 苏长青, 李会芬. 不同盐胁迫对白三叶种子萌发及幼苗生长的影响. 草业学报, 2013, 22(4): 123-129.
[27]郭红超, 吾买尔夏提·塔汉, 高蕊, 等. 温度、盐分对木地肤Kochiaprostrata种子萌发的影响. 干旱区资源与环境, 2014, 28(9): 106-110.
http://cyxb.lzu.edu.cn
蔡丹红, 严成, 魏岩. 荒漠半灌木白滨藜种子的萌发特性及其生态意义. 草业学报, 2015, 24(10): 131-138.
CAI Dan-Hong, YAN Cheng, WEI Yan. Seed germination characteristics of the desert subshrubAtriplexcanaand its ecological significance. Acta Prataculturae Sinica, 2015, 24(10): 131-138.
通讯作者*Corresponding author. E-mail:weiyan1966@163.com
作者简介:蔡丹红(1987-),女,浙江温岭人,在读硕士。E-mail:906212640@qq.com
基金项目:国家自然科学基金项目(31360091;31560113)资助。
收稿日期:2014-11-13;改回日期:2015-02-11
DOI:10.11686/cyxb2014463
