‘潘那利’番茄碱性螺旋环螺旋转录因子基因的克隆与表达分析
2022-05-24胡佳蕙王柏柯余庆辉
胡佳蕙,王柏柯,李 宁,余庆辉,王 娟*
(1 新疆农业科学院 园艺作物研究所,乌鲁木齐 830091;2 新疆农业大学 园艺学院,乌鲁木齐 830052)
碱性螺旋环螺旋(basic/Helix-Loop-Helix, bHLH)转录因子结构域高度保守,由碱性区及螺旋环螺旋2个部分组成[1],即N端的碱性区域和紧随其后的碱性螺旋环螺旋区域。这2个区域的功能分别是DNA结合和促进蛋白-蛋白相互作用[2-3]。bHLH编码蛋白能识别靶基因的核心DNA序列元件,并与其相互作用[4-5]。近期研究显示,植物bHLH转录因子家族与植物各阶段的生长发育密切相关,参与多种转录调控途径及应对各种环境胁迫[6]。1989年,首次在玉米中发现调控R基因的bHLH转录因子[7],随后发现其广泛存在于植物界,如在模式植物拟南芥和水稻中分别鉴定出167个和177个bHLH转录因子[8-9]。
研究表明,bHLH能够通过ABA信号转导途径参与植物多种非生物胁迫反应。在拟南芥中,AtbHLH92[10]、AtbHLH17[11]和AtbHLH122[12]通过ABA依赖途径响应干旱、盐、氧化或低温胁迫。葡萄VvbHLH1通过ABA信号通路赋予转基因拟南芥更好的耐盐性和抗旱性[13]。最近,有研究发现,在拟南芥中异源表达MfbHLH38能够调节细胞的渗透平衡,提高保水能力,增强胁迫诱导的氧化清除系统,显著提高了拟南芥对盐和干旱的耐受性,并可能参与了ABA依赖的胁迫响应途径[14]。
在大肠杆菌(Escherichiacoli)中异源表达植物非生物胁迫响应基因,已成为初步探索基因功能的有效方法。Narayan等[15]在E.coli中异源表达鱼腥藻(Anabaenasp.)的PCC 7120all3940(一个Dps家族基因),能有效提高受体E.coli的非生物胁迫耐受性;在E.coli中异源表达异子蓬(Suaedaaralocaspica)SaPEPC1(磷酸烯醇式丙酮酸羧化酶基因),能够促进重组细菌在非生物胁迫下的生长[16];而在E.coli中过表达番茄SlWRKY6,则降低了重组菌的胁迫耐受性[17]。此外,在抗旱转基因小麦安全性风险评价过程中,发现转基因抗旱小麦中的表达蛋白与E.coli表达的His-WK融合蛋白具有相似的功能[18]。
野生番茄‘潘那利’(SolanumpennelliiCorrell)多分布于干旱的河床与岩石斜坡。经过自然界长期筛选,对干旱环境产生了较强的耐受力,其已进化出许多抗旱、耐盐等优秀突变体品种(系),积累了丰富的耐旱基因资源[19]。基于其优良的抗旱能力,本研究从野生‘潘那利’番茄中分离得到一个bHLH转录因子基因SpbHLH89,通过生物信息学、亚细胞定位等分析其编码蛋白质的结构;同时在E.coli中异源表达SpbHLH89,检测重组菌对干旱胁迫的耐受性,初步研究该基因的耐旱功能,为番茄抗逆育种提供优良的候选基因。
1 材料和方法
1.1 植物材料栽培和处理
本实验所用植物材料‘潘那利’番茄(S.pennellii)种子由番茄遗传资源中心TGRC(Tomato Genetics Resource Center)引进。选取饱满成熟种子播种于营养土和蛭石(体积比为2∶1)的育苗钵中,在温度25 ℃、光照16 h/黑暗8 h、相对湿度10%~20%、光照强度100 μmol·m-2·s-1条件下培养5~6周,取幼嫩叶片液氮速冻,于-80 ℃保存备用。
用于农杆菌瞬时转化实验的本氏烟草(NicotianabenthamianaKarel Domin),栽培条件同上,于烟草生长5~6周时选取完全展开的叶片进行注射。
1.2 方 法
1.2.1 番茄总RNA提取及SpbHLH89基因克隆利用植物总RNA提取试剂盒DP441(天根,北京)提取番茄叶片总RNA,利用5×All-In-One RT MasterMix(AccuRT Genomic DNA Removal Kit,Abm,苏州)合成cDNA,-80 ℃贮存备用。利用SpbHLH89(Sol Genomics登录号Sopen04g001150)基因序列设计引物(表1),以cDNA为模板,分别利用引物pSuper1300-SpbHLH89-GFP-F/R和pET30a-SpbHLH89-F/R扩增目的片段连接至pMD19-T克隆载体(TaKaRa,大连)上,利用限制性内切酶XhoⅠ,或XbaⅠ和KpnⅠ双酶切重组质粒pMD19-SpbHLH89,回收纯化目的片段连接至原核表达载体pET30a或植物双元表达载体pSuper1300-GFP上。PCR鉴定阳性重组菌落,重组质粒双酶切鉴定测序。序列比对正确的质粒分别转化E.coliBL21(DE3)和农杆菌GV3101感受态细胞。
1.2.2 生物信息学分析及亚细胞定位通过在线工具ProtParam分析SpbHLH89的基本理化性质;利用SMART(http://smart.embl.de)分析蛋白质结构域。通过在线软件NCBI和GenBank数据库检索与SpbHLH89高度相似的13个不同物种的序列,利用DNAMAN8.0对其进行多序列比较,分析bHLH转录因子家族的保守结构;同时利用MEGA X软件构建系统进化树,利用Neighbor-joining分析方法分析进化亲缘关系。
亚细胞定位分析时,将该基因开放阅读框的cDNA 3′端与编码绿色荧光蛋白基因的开放阅读框的5′端融合。重组表达载体质粒利用电转化法,转化至农杆菌GV3101。将重组农杆菌GV3101∷pSuper1300-SpbHLH89-GFP活化后,1 200 r/min离心弃上清,弃掉废液,用烟草转化液重悬菌液调至OD600为0.8;将重组农杆菌、番茄丛矮病毒P19蛋白(促进异源蛋白的表达)和类钙调磷酸酶亚基B蛋白CBL(Calcineurin B-like protein)的农杆菌按体积比=3∶2∶3混合,室温静置2 h;注射叶片,并标记注射范围。注射后保持烟草植株生长条件湿润。3 d后,激光共聚焦显微镜(Zeiss LSM 800,Carl Zeiss,德国)进行观察,通过ZEN Imaging Software(Version 2.3)捕捉荧光信号并获取图像。
1.2.3SpbHLH89基因表达分析1)组织特异性表达。取开花期‘潘那利’番茄植株的茎、叶、花,液氮研磨提取植物RNA并反转录生成cDNA。2)干旱响胁迫下表达。生长5~6周的‘潘那利’番茄植株进行模拟干旱胁迫(0、200、300、500、600 mmol/L甘露醇)处理5 h,并选择300 mmol/L甘露醇处理植株,分别在胁迫处理前及处理后1、3、6、9 h采取植株叶片,用液氮速冻后与-80 ℃贮存备用。然后提取其叶片RNA并反转录成cDNA。以Actin基因作为内参,用QuantiNova SYBR Green PCR Kit(Qiagen, 德国)和LightCycler96(Roche, 美国)进行qRT-PCR,引物序列见表1。
1.2.4SpbHLH89基因原核表达活化携带有重组原核表达载体pET-30a-SpbHLH89的E.coliBL21(DE3)菌株,利用0.5 mmol/L IPTG诱导表达3 h。制备蛋白样品进行SDS-PAGE电泳,检测特异表达目标蛋白。将未染色SDS-PAGE胶上的蛋白样品利用半干转膜仪转移至PVDF膜后,用2%脱脂奶粉将鼠抗His-标签的单克隆抗体稀释2 000倍。第二抗体羊抗鼠IgG稀释10 000倍,进行Western
bloting检测。显色用全式金EasySee®Western Blot Kit(DW101-01)避光孵育30 s后于LAS 4000超灵敏化学发光成像仪(Fujifilm,日本)拍照。
1.2.5 重组菌的胁迫耐受性测定以E.coliBL21(DE3)∷pET-30a为对照菌株,测定重组菌E.coliBL21(DE3)∷pET-30a-SpbHLH89的干旱胁迫耐受性。将IPTG诱导表达3 h后的重组菌和对照菌菌液利用液体LB培养基调节OD600至1.0,按1% (V/V)接种在分别含有0、200、400、600、800 mmol/L甘露醇和含有0、200、300、400、500 mmol/L NaCl的LB液体培养基中,于37 ℃,220 r/min摇床培养12 h后测定菌液OD600,记录并分析重组菌的干旱胁迫耐受性。将诱导的菌液接种至400 mmol/L NaCl和600 mmol/L甘露醇的LB液体培养基中,每隔2 h取1次样,测菌液OD600,绘制生长曲线。
1.2.6 统计分析对本体表达分析qRT-PCR数据及重组菌胁迫耐受性测定数据均采用软件Graphad Prism 8.0(GraphPad Software,San Diego,USA)分析,并进行单因素方差分析(One-way ANOVA);通过多重比较进行差异显著性分析。
表1 本研究所用引物
2 结果与分析
2.1 番茄SpbHLH89基因的克隆
SpbHLH89基因(Sol Genomics登录号Sopen04g001150)的开放阅读框长度为684 bp,编码227个氨基酸。以‘潘那利’番茄叶片cDNA为模板扩增SpbHLH89基因的开放阅读框序列,将其构建于重组质粒pET30a-SpbHLH89,pSuper1300-SpbHLH89-GFP并进行双酶切验证及测序(图1),将重组载体质粒分别转化E.coliBL21(DE3)及农杆菌GV3101,通过PCR鉴定重组菌中目标片段阳性。

M.DL2000;A.SpbHLH89基因PCR扩增及重组质粒的双酶切:1.SpbHLH89;2.重组质粒;3.Kpn Ⅰ和Xho Ⅰ酶切;B.重组菌菌落PCR:+.阳性对照;1-2.pET30a-SpbHLH89;3-5.pSuper1300-SpbHLH89-GFP图1 SpbHLH89基因的cDNA扩增及重组质粒的双酶切鉴定M. DL2000; A. PCR of SpbHLH89 gene and double digestion of recombinant plasmid: 1. SpbHLH89; 2. Cloning vector recombinant plasmid; 3. Kpn Ⅰ and Xho Ⅰ digested recombinant plasmid; B. PCR of recombinant. +. Positive control; 1-2. pET30a-SpbHLH89; 3-5. pSuper1300-SpbHLH89-GFPFig.1 PCR amplification of SpbHLH89 and double digestion of recombinant plasmids
2.2 生物信息学分析
通过NCBI网站BlastP对SpbHLH89氨基酸序列进行同源比对,保守结构域分析显示,该序列具有bHLH的典型结构域,SpbHLH89氨基酸序列与芝麻(Sesamumindicum)、菠菜(Spinaciaoleracea)、豇豆(Vignaunguiculata)等物种的bHLH转录因子相似性较高(图2)。系统进化树结果显示,番茄SpbHLH89与烟草NtbHLLH094相似性最高(图3)。

Sp.‘潘那利’番茄;Si.芝麻;So.菠菜;Vr.绿豆;Vu.豇豆;Cc.黄灯笼辣椒;Oe.橄榄树;Ap.相思子;It.三裂叶薯;Cq.藜麦;Nt.拟绒毛烟草;Sl.番茄;Ce. 咖啡;Ca.辣椒;图3同图2 SpbHLH89与其他物种的bHLH序列比对Sp. Solanum pennellii; Si. Sesamum indicum; So. Spinacia oleracea; Vr. Vigna radiata; Vu. Vigna unguiculata;Cc. Capsicum chinense; Oe. Olea europaea; Ap. Abrus precatorius; It. Ipomoea triloba; Cq. Chenopodium quinoa;Nt. Nicotiana tomentosiformis; Sl. Solanum lycopersicum; Ce. Coffea eugenioides; Ca. Capsicum annuum; The same as Fig.3Fig.2 Analysis of conserved domains of SpbHLH89 and its highly homologous proteins
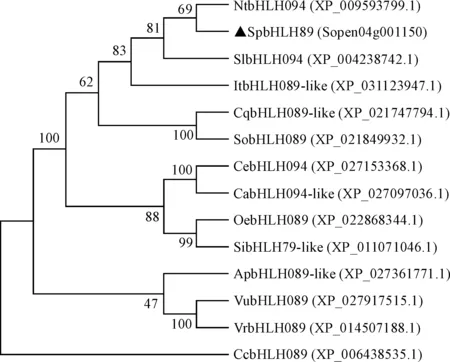
图3 SpbHLH89与其他物种bHLH转录因子进化树分析Fig.3 Phylogenetic analysis of SpbHLH89 and bHLH transcription factors in different species
2.3 SpbHLH89基因表达分析
qRT-PCR分析SpbHLH89在‘潘那利’番茄中的表达,结果表明,SpbHLH89在番茄不同组织中均有表达(图4,A)。不同浓度甘露醇(0、200、300、500、600 mmol/L)处理下,SpbHLH89的表达随干旱胁迫增强而升高,在500 mmol/L时,表达量达到最高值,且显著高于处理前及其他处理组(图4,B)。在500 mmol/L甘露醇处理下,随着胁迫时间的增加其相对表达量逐渐增高,在处理6 h时达到最高值(图4,C)。
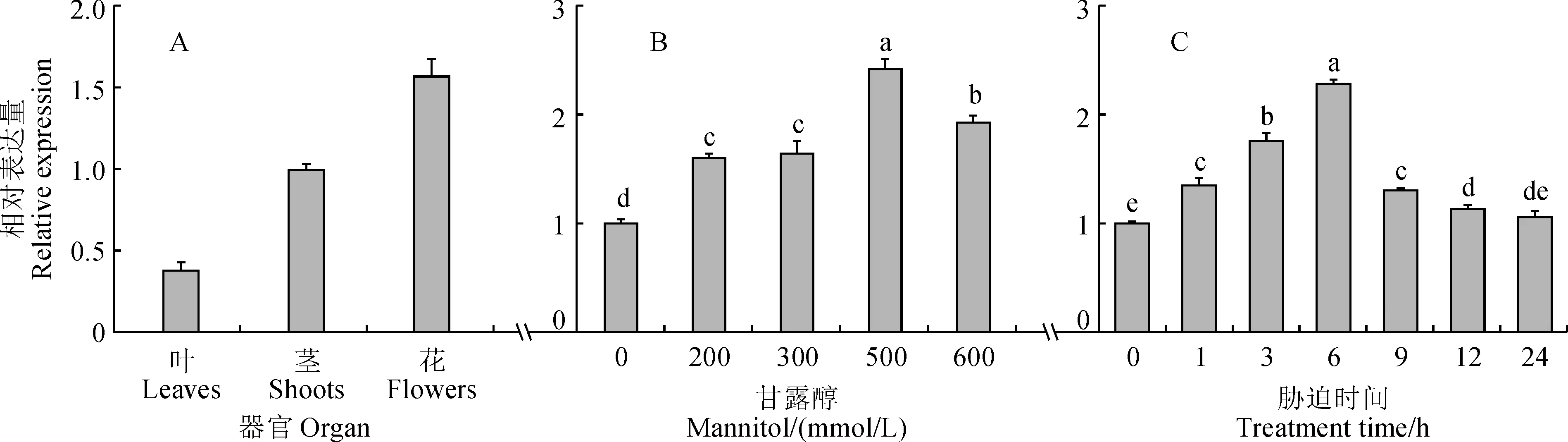
A.不同器官中的表达;B.不同浓度甘露醇胁迫下的表达;C.500 mmol/L甘露醇处理不同时间的表达;不同小写字母表示不同处理之间差异显著(P<0.05)图4 ‘潘那利’番茄SpbHLH89表达模式分析A.Expression in different organs; B.Expression under different concentrations of mannitol stress; C.Expression under the mannitol of 500 mmol/L at different time points. Different normal letters indicate significant differences (P<0.05)Fig.4 Expression patterns of SpbHLH89 in S. pennellii
2.4 SpbHLH89的亚细胞定位分析
bHLH作为转录因子调控基因表达,通常定位于细胞核并在其中发挥调节功能[9],SpbHLH89中预测的NLS(图2)表示它可能在细胞核中发挥作用。为了证实这一推测,利用融合绿色荧光蛋白的SpbHLH89蛋白转化本氏烟草叶片,利用激光共聚焦显微镜观察发现,SpbHLH89-GFP转化细胞的细胞核内特异性出现强烈的绿色荧光,表示转录因子SpbHLH89蛋白主要在植物细胞核中表达,这与预测相符(图5)。
2.5 SpbHLH89蛋白免疫印迹分析
SDS-PAGE结果显示,pET30a-SpbHLH89表达的特异蛋白条带在35 kD 与25 kD 之间(图6,A)。Western bloting分析显示,诱导表达的携带His-标签重组蛋白能与单克隆抗体发生特异反应,在约31 kD 处产生单一免疫条带,表明SpbHLH89-His重组蛋白正确表达(图6,B)。
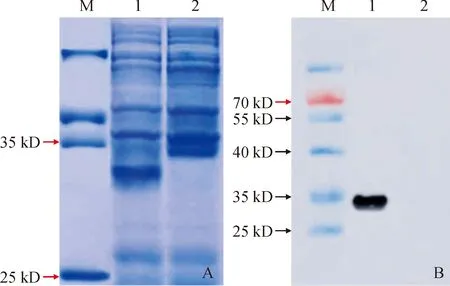
A.SDS-PAGE:M.蛋白质分子量标准;1.IPTG诱导的pET-30a-SpbHLH89;2.未诱导的重组菌;B.Western bloting:M.预染蛋白质分子量标准;1.重组菌的IPTG诱导;2.重组菌未诱导图6 SpbHLH89重组蛋白的SDS-PAGE及Western bloting分析A. SDS-PAGE: M. Standard molecular weight of protein;1. IPTG induced pET-30a-SpbHLH89; 2. pET-30a-SpbHLH89 was not induced; B. Western blotting: M. Molecular weight standards for prestained proteins; 1. IPTG induced pET-30a-SpbHLH89; 2. pET-30a-SpbHLH89 was not inducedFig.6 Analysis of recombinant SpbHLH89 protein by SDS-PAGE and Western blotting
2.6 重组菌的干旱胁迫耐受性
为进一步探究SpbHLH89在响应非生物胁迫中的生物学功能,分析了在E.coliBL21(DE3)中异源表达SpbHLH89对大肠杆菌耐旱性的影响,比较不同浓度盐或甘露醇胁迫下重组菌E.coliBL21(DE3)∷pET30a-SpbHLH89与对照菌株E.coliBL21(DE3)∷pET30a的生长情况。结果(图7,A、B)显示,随着盐或甘露醇浓度增加,盐、干旱胁迫逐渐严重,菌株生长速度逐渐降低,但重组菌在胁迫下比对照菌株生长状况更好。
重组菌与对照菌株在液体LB培养基中培养时(图7,C),发现重组菌与对照菌株在12 h内的生长情况基本一致。进一步进行600 mmol/L甘露醇模拟干旱胁迫及400 mmol/L NaCl处理(图7,D、E),发现对照菌株的生长受到严重抑制,而表达SpbHLH89重组蛋白的菌株相较于对照菌株生长状态显著提高。说明SpbHLH89的表达增强了受体大肠杆菌对盐、干旱胁迫的耐受性。
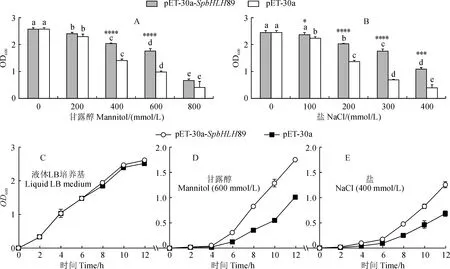
不同小写字母表示同一处理不同浓度间差异显著(P<0.05),*、***和 ****分别表示同一浓度处理重组菌与对照菌之间在0.05、0.001和0.0001水平差异显著性(P<0.05, P<0.001和P<0.0001)图7 重组菌胁迫耐受性Different normal letters indicate significant differences (P<0.05). *, *** and **** represent significant difference(P<0.05, P<0.001 and P<0.0001) between the recombinant and control bacteria strains at the same concentrationFig.7 Stress tolerance of recombinant bacteria
3 讨 论
bHLH转录因子是植物第二大转录因子家族,其主要在细胞核中发挥调节作用[20]。多项研究表明该转录因子能积极响应多种逆境胁迫[21],低温、高盐、干旱等非生物胁迫条件可诱导bHLH转录因子表达[22-23]。在拟南芥中,AtbHLH122受干旱胁迫表达量增加[14]。在水稻中,bHLH转录因子OsbHLH148和OsbHLH006通过参与茉莉酸信号途径,调节相关基因的表达,进而提高植株干旱耐受性[24]。在梨中,通过对PbrbHLH基因家族的鉴定及表达模式分析,结果表明PbrbHLH能积极响应干旱和冷胁迫[25]。在杨树中,PebHLH35经干旱和盐胁迫其表达水平提高[26]。在苹果中MdbHLH106L的表达水平和启动子活性在盐胁迫下呈现显著增强[27]。本研究结果显示,潘那利番茄SpbHLH89主要定位于细胞核,该转录因子受干旱胁迫诱导,其表达量随胁迫程度加剧而明显增高。
为进一步验证SpbHLH89的耐旱功能,本研究借助原核表达途径,将潘那利番茄SpbHLH89在E.coli中异源表达。据研究报道在E.coli中异源表达非生物胁迫相关基因可初步验证其胁迫耐受性,例如大豆抗旱负调控基因GmGols,其降低了重组菌的活力,表现出对干旱胁迫更加敏感[29];番茄SlWRKY16的抗逆分析研究中,也显示表达融合蛋白WRKY的重组大肠杆菌,降低了自身盐、旱胁迫耐受性[30]。本研究结果显示,在E.coli异源表达SpbHLH89可显著提高重组菌对盐、旱胁迫的耐受性,此结果与Wang等[28]结果一致,初步实现对SpbHLH89的耐旱功能验证,然其在植物中抗逆功能有待进一步研究。
