珙桐苞片发育过程中内源激素的变化特征
2017-12-10曹福祥刘志明吴习安张雄锋
胥 雯 ,曹福祥 ,李 萌 ,刘志明 ,吴 毅 ,吴习安 ,张雄锋
(1.中南林业科技大学,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南长沙 410004;3.东新墨西哥大学,新墨西哥州 波塔利斯 88130;4.桃江县林业局,湖南 桃江 413400)
珙桐苞片发育过程中内源激素的变化特征
胥 雯1,2,曹福祥1,2,李 萌1,2,刘志明3,吴 毅1,吴习安4,张雄锋4
(1.中南林业科技大学,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南长沙 410004;3.东新墨西哥大学,新墨西哥州 波塔利斯 88130;4.桃江县林业局,湖南 桃江 413400)
珙桐苞片是重要的生殖器官和观赏部位。将珙桐各个生长期的苞片依据颜色和苞片横径比划分为4各阶段,利用高效液相色谱(HPLC)技术测定各个阶段苞片及叶片各阶段中的脱落酸(ABA)、赤霉素(GA3)、细胞分裂素(ZT)、3-吲哚乙酸(IAA)4种植物内的主要内源激素含量,分析其比值的动态变化,将叶片各阶段激素动态变化做对比。本实验旨在阐明和揭示内源激素在珙桐苞片发育过程中的的作用,有助于对珙桐苞片生长发育过程的了解,还可以进一步对开展珙桐苞片的生长,激素相关基因调控表达研究奠定基础。关键词:珙桐;苞片;叶绿素;内源激素
珙桐Davidia involucrata是蓝果树科Nyssaceae珙桐属Davidia落叶乔木,国家Ⅰ级保护植物[1],最具代表性的特征是其圆形的头状花序和成对的白色苞片[2]。在每年4~5月的盛花期,成年珙桐树整株同时出现上千朵花序,白色的大小苞片垂下,将头状花序围绕其中,犹如一群鸽子栖息在树上,栩栩如生,特别壮丽,被誉为“北温带最独特和最漂亮的木本植物”[3]。珙桐传粉主要依靠蜜蜂来进行,珙桐没有完整的花的结构,缺少花萼及花冠,苞片就承担起了吸引昆虫传粉的作用,苞片生长期颜色的变化主要功能也就是吸引昆虫。独特的大小双苞片结构能保护花序中花粉,使其不会遇水失活[4]。观察发现,珙桐苞片在形成初期呈绿色,苞片与叶片同在混合芽中,芽鳞未完全脱落,与普通叶片形态差别很小,色差很小。随后珙桐苞片颜色逐渐与叶片在色彩上出现差异,颜色变浅,苞片进入快速生长期。到苞片发育晚期,苞片上的绿色已经基本退去,略微带浅黄色,苞片生长速度稍微放缓。当苞片已经到达成熟期,苞片颜色变为纯白色,到达苞片的最大尺寸,生长停止。在部分混合芽中同时萌发的苞片和叶片,两者在发育早期都存在被毛的现象,在生长过程中逐渐褪去,证明两者具有更高的同源性[5]。
苞片是花序内不能促进植物生长的变态叶状物。广义上,任何和花序有关的叶片均称为苞片[6]。由于这种定义不能明确区分苞片、叶片与鳞片,因此目前有较明确的定义来区分:叶子生长在花茎基部,常用来保护芽体。叶芽和花蕾的包裹叶片中,一般的苞片是比较大的叶片,鳞片是比较小的叶片,两者的区别不一定明显。通常冬芽会被几层鳞片覆盖着,花芽外面也有覆盖着与叶芽不同特征的某种形态的苞片[7-8]。虽然苞片在植物界广泛存在,但是珙桐苞片的形态是其中比较大的,方便观察和采集。相较于其它苞片的生长周期并不算很长,约23 d左右,但是珙桐苞片在短时间内的的快速生长变化使其成为研究苞片发育机制的理想材料。
1 研究方法
1.1 实验材料
以湖南省八大公山天平山站为长期观测基地,在4—5月采集珙桐的叶芽、混合芽、各生长阶段的苞片、叶片枝条;7—9月采集珙桐的叶片等样本。将新鲜样品采集后迅速置于液氮速冻后,-70 ℃条件保存。按照珙桐苞片的生长阶段颜色变化过程将苞片分为幼苞>黄绿色苞片>浅黄色苞片>白色苞片.
1.2 叶绿素含量的测定
取新珙桐不同发育时期的苞片0.5 g,擦干,去中脉,剪碎放入研钵;加入95%乙醇3 mL和少许石英砂和碳酸钙,充分研磨,再加10 mL乙醇(95%),静置10 min;把残渣滤掉, 研钵和残渣用丙酮反复冲洗至无色;定容至50 mL。将叶绿素提取液注入到光径为1 cm的比色杯,以95%乙醇注入另一同样的比色杯内作为空白对照,在波长665、649和470 nm下测定吸光度。叶绿素a、b的浓度及其叶绿素总浓度和类胡萝卜素的浓度按照下列公式分别计算出[9]。
计算公式:95%乙醇提取液中色素浓度的计算
Ca(叶绿素 a)=13.95A665– 6.8A649。
Cb(叶绿素 b)=24.96A649– 7.32A665。
CT(叶绿素)=Ca+Cb=18.16A649+ 6.63A665。
Cx.c(类胡萝卜素)=(1000A470–2.05Ca-114.8Cb)/248。
叶绿体色素含量=[色素浓度× 提取液体积×稀释倍数]/样品鲜质量(或干质量、面积)。
1.3 激素的提取方法
称取样品3 g用液氮研磨成粉于离心管中,加入40 mL 80%的预冷甲醇,加入少量抗氧化剂(铜试剂),摇匀4 ℃避光浸提12 h。将浸提的样品3 000 r/min 4℃ 离心20 min,收集上清液。残渣再次用20 mL 80%的预冷甲醇浸提12 h,3 500 r/min 4℃ 离心15 min,合并上清液。上清液38℃下旋转减压蒸发,除去甲醇。在浓缩液加入适量PVPP,等体积的三氯甲烷萃取2次,每次需要混匀静置1 h,离心3 000 r/min离心5 min,丢弃下层溶液,上层溶液合并并且调节pH值至2.8~3.0。再用等体积的乙酸乙酯萃取2次,合并酯相在35℃的烘箱干燥。残留物用3 mL甲醇∶0.8%冰醋酸=45∶55溶解,溶解后用1 000 r/min 4 ℃离心10 min,取上清。最后过0.45 μm的微孔滤膜后进行HPLC分析[10]。
1.4 激素的测定方法
1.4.1 仪器与药品
Agilent1260型高效液相色谱仪,Agilent1260高压输液泵,Agilent1260系列紫外监测器,Wondasil C18液相色谱柱(250 mm×4.6 mm/5 μm),超纯水制备器等激素标准品(GA3、ZT、ABA和IAA)都是Sigma中国代理产品;流动相的甲醇和乙酸都是色谱纯级,其余药品试剂为分析纯级,实验用水为超纯水。
1.4.2 色谱条件的选择
色谱条件:以甲醇∶0.8%乙酸水溶液=45%∶55%为流动相, C18液相色谱柱(250 mm×4.6 mm/5 μm);柱温 25 ℃;检测波长为254 nm,0.8 mL/min横流洗脱。
1.4.3 计算方法
内源激素含量 =(V·C·S)/(A·W);V为样品体积,C为标样浓度,S为样品峰面积,A为标样峰面积,W为植物样品鲜重(g)[11]。
2 结果与分析
2.1 苞片中叶绿素含量的确定及苞片不同发育时期的分类
国外对珙桐苞片发育过程粗略的分成3个部分:珙桐苞片在形成初期呈浅绿色,与普通叶片形态相似。进入发育Ⅱ,苞片颜色逐渐由浅绿色变为纯白色。至花期末,苞片由白色转变为黄色,最终萎蔫脱落[12]。本研究通过三年实际观测,和对苞片叶绿素的测定将苞片生长发育阶段分成4个时期:
图1(a): 苞片Ⅰ期珙桐苞片在形成初期呈绿色,苞片与叶片同在混合芽中,芽鳞未完全脱落,与普通叶片形态差别很小,色差很小。
图1(c)苞片Ⅱ期的珙桐苞片颜色逐渐与叶片在色彩上出现差异,颜色变浅,苞片成快速生长期。
图1(b)苞片Ⅲ期得苞片已经转为绿色已经基本退去,略微带浅黄色,苞片生长速度稍微放缓。
图1(d)苞片Ⅳ期的苞片已经到达成熟期,纯白色,到达苞片的最大尺寸。生长停止,苞片保持几天之后就会自然掉落。

图1 苞片的各个生长时期变化Fig.1 Bracts each growth period of change

表1 苞片生长发育各阶段区分Table 1 Bracts growth in different stages
由珙桐苞片表面的色差和苞片大小为依据将苞片的生长发育划分为Ⅳ个时期。
通过对珙桐叶片的对照以及珙桐苞片各个生长阶段的叶绿素含量进行测量,发现苞片在任何时期的叶绿素含量都要少于叶片的叶绿素含量,唯独在苞片Ⅰ期时的叶绿素含量和苞片最为相近。随着苞片的生长,苞片内叶绿素含量也随之变化。这与我们观测到的情况一致。
2.2 珙桐苞片及叶片内源激素的HPLC测定及分析
使用高效液相色谱仪(HPLC)对珙桐苞片和叶片不同发育时期的主要内源激素含量进行测定,首先使用Sigma 公司的激素标准样品做出标准曲线进行参考对照。首先分别对各标准激素样品分别进行检测,得出各标准品的单一峰和保留时间,最后综合浓度激素标准品做混合样,得出混合样品的出峰时间和保留时间为样品的检测提供参考依据。

图2 珙桐叶片和不同时期苞片叶绿素含量的变化Fig.2 Davidia leaves and bracts chlorophyll content in different periods of change
图3 主要内源激素标准品色谱图像Fig.3 The main standard chromatogram endogenous hormone
准确秤取各标准品各1 mg,用调整好的流动溶解样品,配成母液,取一定量的母液稀释成1/2、1/4、1/16、1/32稀释,制备有浓度梯度的标准溶液,并在已经明确的色谱条件下进样,得出数据后计算各内源激素的的线性回归方程,制作图表显示为图4,从图4可以看出这几种植物内源激素的标准品浓度和出峰面积的相关系数R2分别为0.999 9、0.999 9、0.993 8、0.991 8,证明其相关性良好。
2.3 珙桐苞片及叶片IAA,ABA,GA3和ZT4种主要内源激素含量的变化
本研究对珙桐苞片和叶片内的主要内源激素IAA,ABA,GA3和ZT采取了高效液相色谱法进行检测,检测整个珙桐苞片和叶片的生长过程中激素的动态变化情况,具体结果如下:
(1)IAA:珙桐叶片发育过程中IAA激素变化不明显,在5~8 μg/g之间,早期叶片中含量略高(幼叶>成叶>中叶);在珙桐苞片发育过程中IAA含量变化明显(Ⅳ>Ⅲ>Ⅱ>Ⅰ),在苞片刚萌发的Ⅰ期无法检测出IAA激素含量。在苞片Ⅳ期中IAA的含量达到了80 μg/g,说明在苞片生长发育的过程中,苞片内源激素IAA的合成速率较高。
(2)ABA: ABA激素含量在叶片中是稳定增长的(成叶>中叶>幼叶),成叶含量最高,达到4.2 μg/g,是幼叶0.3 μg/g的14倍;在同一个混合芽萌发的苞片中,ABA含量随着苞片生长发育而稳定增长,在苞片Ⅲ期达到最大值(Ⅲ>Ⅱ>Ⅳ>Ⅰ),在Ⅳ期降低了近50倍。

图4 激素标准曲线Fig.4 Calibration curves of the standards of Hormone
(3)GA3:在珙桐叶片的整个生长发育过程中:刚萌发幼叶中GA3含量为3.2 μg/g,叶片中期含量最高,达20.3 μg/g,是成熟叶片1.8 μg/g的11.3倍。表明珙桐叶片的GA3初始含量高于叶片成熟后的含量(中叶>幼叶>成叶)。在苞片的整个生长过程中,GA3含量在Ⅲ期达到最大值201.1 μg/g,该激素含量是叶片GA3含量最大值的10倍。GA3在苞片的其他时期含量相对较低,Ⅰ、Ⅱ期分别为 0.13 μg/g,0.25 μg/g(Ⅲ>Ⅳ>Ⅱ>Ⅰ)。(4)ZT:与其它3种激素进行比较,发现ZT是整体含量最高的一种内源激素,在珙桐叶片的发育过程中含量都比较稳定(幼叶>成叶>中叶)最低值为11.6 μg/g,在苞片中的ZT含量是稳定增加的,在Ⅳ期达到最大值122.7 μg/g(Ⅳ>Ⅲ>Ⅱ>Ⅰ)。
ZT:在珙桐苞片和叶片中相比较于其他3种激素,细胞分裂素ZT是整体含量最高的一种内源激素,在整个珙桐叶片的发育过程中的含量都相对比较稳定(幼叶>成叶>中叶)最低也有11.6 μg/g,而在苞片中的ZT含量是稳步增加的,在Ⅳ期达到最大值122.7 μg/g(Ⅳ>Ⅲ>Ⅱ>Ⅰ)。
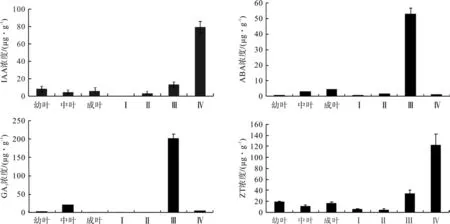
图5 珙桐苞片和叶片不同生长时期的内源激素含量的变化Fig.5 The changes of endogenous hormone content of different growth period in Davidia leaves and bracts
2.4 珙桐苞片不同生长期内源激素的比值
本研究依据不同苞片中的IAA,ABA,GA3和ZT4种主要内源激素的高效液相色谱测定数据,参考数据的变化情况,计算ABA/GA3、ABA/ZT和ABA/IAA比值,得出相应的激素比值动态变化图,用以展示珙桐苞片的生长发育状态。

图6 珙桐苞片不同生长期内源激素的比值Fig.6 The ratio of dovetree bracts different growthhormones
由图6可以看出来ABA/GA3的比值变化程度相对较大,在苞片Ⅰ期比值比较大,在Ⅱ期达到最大值,但是在Ⅲ期突然降低,后面2个时期成放缓的趋势;内源激素ABA/ZT的比值变化呈相对平缓,在Ⅰ期到Ⅲ期逐渐增加,到第Ⅲ期开始逐渐下降;ABA/IAA的比值变化最为剧烈,在第Ⅰ期开始呈平缓上升趋势,第Ⅲ期到达最大值,比值到达最大,但是到达第Ⅳ期又猛然下降。
3 结论与讨论
珙桐有叶芽和混合芽2种芽,在珙桐的混合芽中苞片与叶片的萌发时间基本一致,但是苞片的生长期大约为23 d,而叶片的生长期约为200 d。苞片20多天生长量要超过叶片约200 d的生长量,可见苞片具有很高的生长速度。通过对珙桐苞片颜色的变化情况,珙桐苞片生长过程中的数据分析,将珙桐苞片的生长发育阶段分为4个时期,并通过对苞片叶绿素的测量,对该分段进行验证,验证结果和观察结果一致。珙桐苞片和叶片都是由珙桐混合芽萌发,在形成初期呈绿色,珙桐苞片与叶片形态差别很小,色差很小,都被毛。随后珙桐苞片颜色与叶片颜色出现差异,苞片颜色变浅绿色,苞片进入快速生长期。到苞片Ⅲ期时,苞片的绿色已经基本消失,略微带浅黄色,苞片生长速度放缓。到达成熟期时,苞片变成纯白色,苞片达到最大生长量。生长停止,苞片保持几天之后就会自然掉落。
脱落酸(ABA)是一种较强的生长抑制剂,可抑制整株植物或离体器官的生长[13],推测苞片第Ⅲ期中合成的大量ABA可能对苞片的细胞生长起到了抑制作用,使苞片生长速度减慢。脱落酸(ABA)是主要在叶绿体内生产的一类激素,该激素主要通过类胡萝卜素途径合成[14],苞片中的ABA可能是通过苞片Ⅰ、Ⅱ期内的叶绿体合成,也有可能是从叶片中转运到苞片中,具体过程还需要对苞片中的ABA合成途径进行研究。ABA能调控植物生长发育和响应非生物胁迫,如种子萌发、营养生长、胚胎成熟、叶片衰老[15]、低温胁迫、盐胁迫、渗透胁迫[16-17];在珙桐苞片中,ABA在Ⅰ、Ⅱ 期含量与叶片基本持平,到Ⅲ期突然增高,可能是因为在Ⅲ期的珙桐苞片已经基本成熟,ABA含量的增加是苞片对热、光辐射等非生物胁迫的响应,苞片中ABA对非生物胁迫的响应是否如此,还需要进一步的验证。GA3的变化趋势与苞片中的ABA增长趋势是一致的。
生长素(IAA)浓度较低时可促进植物生长,但是在浓度较高时则抑制植物生长[18];在珙桐叶片中的IAA较低,生长过程中IAA浓度基本稳定;在苞片中的IAA含量持续增长,从Ⅰ期的未检测出一直增长到Ⅳ期的80.13 μg/g,是叶片IAA含量的的10倍。目前对于GA3调节IAA含量变化的机制主要有3种观点:(1)GA3促进IAA的合成;(2)GA3抑制IAA氧化酶的活性,提高IAA含量;(3)使结合型IAA变成自由型IAA[19]。根据本实验的结果,推测GA3的增加使IAA的含量一直增加,珙桐苞片从Ⅰ期到Ⅲ期这个阶段,IAA是促进苞片快速生长及细胞伸长,但是到第Ⅳ阶段的高含量IAA对苞片的生长起到了抑制作用。玉米素(ZT)是细胞分裂素的一种,在苞片中的主要作用是促进细胞分裂和分化[20],所以在苞片中ZT与IAA的动态变化趋势是一致的。
ABA/GA3的比值在苞片Ⅱ期最大,有研究表明,恰当的ABA/GA3比值更适合诱导成熟[21]。ABA/ZT的比值变化相对平缓,但是在苞片的Ⅲ期,比值也是达到了最大值,但是相对值还是比较低。ABA/IAA的比值都比较低,只是在Ⅲ期出现了较大的波动。
综合上述苞片内源激素的变化情况分析:珙桐苞片远超叶片近10倍的生长速度正是由于其内部激素含量巨大的含量及变化造成的,珙桐苞片快速的生长状态和巨大的形态变化使珙桐苞片不能仅仅依据传统的幼、中和晚期这种方式来区分苞片的生长阶段。本实验依据珙桐苞片叶绿素含量的变化以及外观形态的变化将珙桐苞片划分为4个阶段,同时依据这4个生长阶段来测定其内部主要内源激素含量的变化过程和激素动态比值,有助于对珙桐苞片生长发育机理的认识,为珙桐苞片的研究奠定了基础。但是这只是单纯从生化的角度来分析珙桐苞片生长发育的情况,仍然还需要在生理及分子调控水平进行研究才能够揭示珙桐苞片快速生长的机理。
[1]傅立国,金鉴明.中国植物红皮书——稀有濒危植物[M].北京:科学出版社,1992:44-75.
[2]吴俊长,李 萌,曹福祥,等.珙桐种子快速繁殖技术的研究[J].中南林业科技大学学报,2016,36(2):66-70,95.
[3]罗桂环.西方对“中国园林之母”的认识[J].自然科学史研究,2000,19(1):72-88.
[4]Sun JF, Ging YB, Renner SS,et al. Multifunctional bracts in the Dove treeDavidia involucrate(Nyssaceae:Cornales):rain protection and pollinator attraction[J]. American Naturalist,2008,171: 119-124.
[5]Vekemans D, Viaene T, Caris P,et al.Transference of function shapes organ identity in the dove tree in florescence[J]. New Phytologist,2012,193(1):216-228.
[6]Harris JG , Harris MW. Plant identi fi cation and terminology: an illustrated glossary[M]. London: Spring Lake Publishing, 2001.
[7]Irish VF, Sussex IM. Function of the apetala-1 gene during Arabidopsis floral development[J]. Plant Cell, 1990, 2: 741-753.
[8]Bowman JL, Alvarez J, Weigel D,et al.Control of flower development in Arabidopsis thaliana by APETALA1 and interacting genes[J]. Development, 1993, 119: 721-743.
[9]曾建敏,姚 恒,李天福,等.烤烟叶片叶绿素含量的测定及其与SPAD值的关系[J].分子植物育种,2009,7(1):56-62.
[10]李 超.具有重要生物活性的倍半萜内酯类天然产物的全合成研究[D].天津:天津大学,2013.
[11]雷泞菲,彭书明,牛 蓓,等.珍稀濒危植物珙桐种子休眠萌发过程中内源激素的变化[J].广西植物,2009,29(1):66-69,131.
[12]Jha B, Agarwal PK, Reddy PS,et al.Identification of saltinduced genes from Salicornia brachiata,an extreme halophyte through expressed sequence tags analysis Genes [J]. Genet Syst.,2009, 84(2): 111-120.
[13]鲁旭东,吴 顺.脱落酸对植物生长发育的调控作用[J].孝感学院学报,2004(3):10-14.
[14]郭文雅,赵京献,郭伟珍.脱落酸(ABA)生物学作用研究进展[J].中国农学通报,2014, 30(21):205-210.
[15]李培旺,陈景震,张良波,等.蓖麻叶片内源激素变化对主花序开花结实的影响[J].经济林研究,2016,34(4):113-116.
[16]Seo M, KoshibaT. Complex regulation of ABA biosynthesis in Plants[J]. Trends PlantSei, 2002, 7(l): 41-48.
[17]Narnbara E. Marion-Poll A. Abseisic acid biosynthesis and eatabolism[J]. Annu. Rev. Plant Biol., 2005, 56: 165-185.
[18]倪迪安,许智宏.生长素的生物合成、代谢、受体和极性运输[J].植物生理学通讯,2001,37(4):346-352
[19]李保珠,赵 翔,安国勇.赤霉素的研究进展[J].中国农学通报,2011,27(1):1-5.
[20]彭邵锋,陆 佳,陈永忠,等.高温胁迫下21个山茶种质的生理生化响应[J].经济林研究, 2016, 34(3): 121-125.
[21]Aurelio Gomez-Cadenasl, Rodolfo Zentellaa, Mary Kay walkersimmonsb,et al.Gibberellin/ Abseisie acid aniagonism in barley aleurone cells: Site of action of the Protein kinase PKABA 1 in relation to Gibberellin sigaling molecules[J]. Plant Cell, 2001,13: 667-679.
Research on the changes of endogenous hormones in the development of Davidia involucrata bracts
XU Wen1,2, CAO Fuxiang1,2, LI Meng1,2, LIU Zhiming3, WU Yi1, WU Xi’an4, ZHANG Xiongfeng4
(1. Central South University of Forestry & Technology, Changsha 410004, Hunan, China; 2. Hunan Environmental Plant Resources Utilization of Engineering and Technology Research Center, Changsha 410004, Hunan, China; 3. Eastern New Mexico University,Portales 88130, New Mexico, USA; 4. Taojiang County Forestry Bureau, Taojiang 413400, Hunan, China)
Davidia involucratais bract important part of reproductive organs and ornamental. In this study, the bracts ofDavidia involucratawere divided into four stages according to the color and bract width ratio, and the GA3(gibberellin) in each stage of bracts and leaves were determined by high performance liquid chromatography (HPLC), ZT (cytokinin), ABA (abscisic acid) and IAA(3-indoleacetic acid), and the dynamic changes of the ratio of the hormones were analyzed. The The aim of this study is to elucidate and reveal the role of endogenous hormones in the development of the bracts ofDavidia involucrata, which is helpful to understand the growth and development process of the bracts ofDavidia involucrata, and to further study the growth and shedding genes of the bracts ofDavidia involucrataRegulate expression research to lay the foundation for research.
Davidia involucrata; bract; Chlorophyll; endogenous hormones
S759.95
A
1673-923X(2017)11-0103-07
10.14067/j.cnki.1673-923x.2017.11.017
2017-04-02
国家林业公益性行业科研专项(201104016);湖南省百人计划项目(112-0991);中南林业科技大学博士科研基金项目(0490016);中南林业科技大学青年基金项目(QJ201512)
胥 雯,硕士研究生
曹福祥,教授,博士;E-mail:csfucao@163.com
胥 雯,曹福祥,李 萌,等.珙桐苞片发育过程中内源激素的变化特征[J].中南林业科技大学学报,2017,37(11):103-109.
[本文编校:吴 毅]
