续随子ElSAD2基因的克隆与功能分析
2022-05-24王鑫雨葛丽萍盛晓倩牛听风李润植
王鑫雨,葛丽萍*,盛晓倩,牛听风,包 鹏,李润植
(1 山西农业大学 林学院,山西太谷 030801;2 山西农业大学 分子农业与生物能源研究所,山西太谷 030801)
续随子(EuphorbialathyrisL.)为大戟科大戟属,1~2年生草本植物,全株无毛,高可达1 m。根柱状,茎直立,顶部二歧分枝,灰绿色;叶交互对生,线状披针形,全缘,无叶柄;花序单生近钟状,雄花多数,雌花1枚。蒴果三棱状球形,种子柱状至卵球状。花期4~7月,果期6~9月,在中国多个省区有分布或栽培[1]。20世纪80年代,美国加利福尼亚大学M.Calvin教授通过对油脂植物续随子进行能源利用潜力的评价研究发现,续随子的种子油中含有30%~40%类似于石油的碳氢化合物,这些油脂化合物可作为石油代用品,是一种很有开发前途的新型能源油料植物。危文亮等在2007年研究表明,续随子种子含油率为43.3%,脂肪酸成分以C16、C18为主,其中油酸(C18∶1Δ9)含量高达83%,亚麻酸为2.5%,不饱和度适中[2]。研究认为,如果充分利用可耕土地,种植能源植物,并对其他农副产物的生物质进行加工,全球的植物能源开发潜力可达到435 EJ/年,远远超过初级能源的需求量[3]。
植物油脂是植物体内的储能物质,在人类生产生活方面起着重要作用,尤其还可以用于生物燃料的产生[4]。植物油脂是由1个甘油分子和3个不同类型的脂肪酸分子相结合而成的高级脂类化合物。质体中的Δ9-硬脂酰-ACP脱氢酶 (stearoyl-acyl carrier protein Δ9desaturase,SAD)催化单不饱和油酸的合成,是控制植物细胞饱和脂肪酸与不饱和脂肪酸比例的关键酶。以硬脂酰-ACP(C18∶0-ACP)为底物,在第9~10碳原子之间脱氢形成一个双键,催化生成油酰-ACP(C18∶1Δ9-ACP),在硫酯酶的作用下解离,转运至内质网进行三酰甘油的组装或再延长去饱和等过程,生成多不饱和脂肪酸[5-7]。多项研究表明SAD基因决定植物细胞中的不饱和脂肪酸含量。烟草中过表达黄羽扇豆(Lupinusluteus)的SAD基因,导致叶片油酸的含量增加[8]。在莱茵衣藻(Chlamydomonasreinhardtii)中,降低SAD的表达量,引起硬脂酸含量增加[9]。在甘蓝型油菜(Brassicanapus)种子中过表达乌桕(Sapiumsebiferum)SAD基因,也引起油酸(C18∶1)、亚油酸(C18∶2)和亚麻酸(C18∶3)含量的变化[10]。在拟南芥[7](Arabidopsisthaliana)、蓖麻[11](Ricinuscommunis)和大豆[12](Glycinemax)等植物中也分离得到了SAD基因,并验证了异源表达SAD基因可以提高宿主组织油脂含量。然而,有关续随子SAD基因的研究尚未见报道。
本课题组前期已研究了续随子种子油脂合成通路中ElDGAT1[13]、ElDGAT2[14]、ElFAD2[15]和ElPDAT1[16]基因。本研究基于续随子种子转录组数据分析发现一条高表达的功能注释为SAD的转录本,以续随子为材料,应用生物信息工具分析续随子SAD2蛋白的理化性质、高级结构和系统发育特征,PCR技术获得该续随子ElSAD2基因的cDNA序列,并分析该基因在不同器官中的表达谱,构建植物表达载体和酵母表达载体,通过异源表达ElSAD2基因分析烟叶及酵母细胞中的油脂含量变化,鉴定续随子ElSAD2基因的功能。研究可为解析续随子油脂合成的分子机理提供科学参考,可进一步应用于油料植物油脂产量和品质改良。
1 材料和方法
1.1 材 料
本研究所用续随子种植于山西农业大学林业站苗圃。取材为续随子根、茎、叶、花以及3个不同发育时期(花后15、30 和45 d)的种子。所有材料采集后立即置于-80 ℃超低温冰箱保存。本氏烟草(Nicotianabenthamiana)种植于基质土中,设置光照培养箱生长条件为:温度26 ℃,相对湿度60%,光照/黑暗16 h/8 h[17]。酿酒酵母(Saccharomycescerevisiae)突变菌株BY4389缺陷型酵母(MATaolelΔ∷LEU2ura3-52his4)、DH5α大肠杆菌、pMD18-T克隆载体、GV3101根癌农杆菌均保存于山西农业大学分子农业与生物能源研究所。
1.2 方 法
1.2.1 续随子RNA提取、cDNA第一链的合成以续随子根、茎、叶、花的混样及3个不同发育时期(花后15、30和45 d)的种子转录组数据为基础,选用模式植物拟南芥SAD(AtSADs)基因家族编码的蛋白序列作为检索序列,对续随子种子转录组数据库进行BLAST比对,并参考转录组数据功能注释,分析得到续随子Δ9-硬脂酰-ACP脱氢酶转录本,命名为ElSAD2。使用Trizol法提取续随子根、茎、叶、花以及3个不同发育时期(花后15、30 和45 d)种子的总RNA。利用5×All-In-One RT MasterMix 反转录试剂盒合成cDNA,cDNA保存于-20 ℃冰箱备用。
1.2.2 续随子各器官ElSAD2基因表达特性检测及基因克隆以续随子各器官cDNA为模板,使用NCBI中的 Primer-BLAST 对ElSAD2 基因编码序列设计特异性引物(表1),以续随子ElActin作为内参基因,使用2×RealStar Green Fast Mix(GenStar公司)试剂盒进行qRT-PCR反应。反应体系为:cDNA 模板0.5 μL, 2×RealStar Green Fast Mixture 5 μL,正向引物0.25 μL,反向引物0.25 μL,ddH2O 4 μL。引物退火温度均为60 ℃,反应程序为两步法:95 ℃、10 min,95 ℃、15 s,60 ℃、1 min,40个循环,溶解曲线拍照。

表1 引物信息
以表达量最高的cDNA为模板,使用目的基因特异引物及2×GPV8 HF Polymerase Master高保真酶扩增目的基因的ORF,目的片段经凝胶回收和纯化后连入pMD18-T载体并转入大肠杆菌中,选取阳性菌株,并测序验证。
1.2.3 续随子ElSAD2蛋白的理化性质分析以拟南芥AtSADs家族蛋白为序列源,对续随子转录组数据进行BLAST比对,获得续随子ElSAD2基因候选氨基酸序列。将检索到的氨基酸序列提交到CDD数据库进行验证分析,分析鉴定ElSAD2蛋白序列的保守结构域。用在线软件 ProtParam 预测续随子ElSAD2蛋白的分子量、理论等电点、不稳定性等理化性质。通过在线工具TMHMM Server v.2.0 (http://www.cbs.dtu.dk/ services/TMHMM/)预测续随子ElSAD2的跨膜结构区域;通过Plant-mPLoc(www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi)在线软件对续随子ElSAD2蛋白的亚细胞定位进行预测。
1.2.4 续随子ElSAD2蛋白二级结构和三级结构分析利用SOPMA网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat. pl?page=npsa_sopma.html)预测ElSAD2的二级结构。用在线网站SWISS-MODEL对ElSAD2进行三级结构预测分析并建模。
1.2.5 续随子ElSAD2蛋白的多序列比对和系统进化分析从NCBI中调取其他植物的SAD蛋白序列,用软件DNAMAN对续随子、拟南芥、蓖麻、烟草、茶树和芝麻的SAD蛋白的氨基酸序列进行多序列比对。运用MEGA7.0软件对续随子和其他物种SAD蛋白的氨基酸序列采用邻接法(NJ)构建无根系统发育树,自举检验值设置为1 000个循环[18]。
1.2.6 续随子ElSAD2基因表达载体的构建根据已经克隆获得的续随子ElSAD2基因序列信息,使用Primer Primer5.0软件设计带有KpnI和XbaI酶切位点的引物。以上述重组质粒pMD18-T- ElSAD2为模板,进行PCR扩增,获得带有酶切位点(KpnI和XbaI)的ElSAD2目的片段,回收纯化,同时对酵母表达载体pYES2.0进行KpnⅠ和XbaⅠ 双酶切,用T4-DNA连接酶将ElSAD2基因连接到pYES2.0载体上,形成重组酵母表达载体pYES2.0-ElSAD2,将其转至大肠杆菌DH5α中,继续培养,提取质粒pYES2.0-ElSAD2,进行双酶切验证,将阳性菌液加入等体积的50%甘油,保存于-80 ℃冰箱备用。
用以上的重组质粒pMD18-T-ElSAD2为模板,进行PCR扩增,获得带有酶切位点(KpnⅠ和XbaⅠ)的ElSAD2目的片段,回收纯化,同时对植物表达载体pCAMBIA1303用KpnⅠ和XbaⅠ进行双酶切反应,酶切产物经回收纯化后,用T4-DNA连接酶连接,得到重组表达载体 (pCAMBIA1303-ElSAD2)。再将其转入大肠杆菌DH5α,继续培养,经PCR和双酶切试验鉴定阳性克隆,将阳性菌液加入等体积的50%甘油,混匀后保存于-80 ℃冰箱备用。
1.2.7 续随子ElSAD2基因的烟草叶片瞬时表达和突变体酵母功能互补检测将构建成功的植物表达载体pCAMBIA1303-ElSAD2及空载体pCAMBIA1303通过冻融法转入根癌农杆菌中,配制烟草侵染液,使用注射器侵染本氏烟草的叶片[19-20]。取侵染3 d后的叶片,提取RNA,并检测目的基因是否有效表达。取侵染6 d后的叶片冷冻干燥,保存备用。
将上述构建成功的酵母表达载体pYES2.0-ElSAD2和空载体pYES2.0转化到BY4389缺陷型酵母中,挑取转化后的2种BY4389缺陷型酵母[转基因的BY4389缺陷型酵母和转空载的BY4389缺陷型酵母(EV)]单菌落和未转化的BY4389缺陷型酵母[以下称为野生型(WT)]单菌落分别接种于尿嘧啶缺陷的合成完全培养基SC-URA上,待长出菌落,进行菌液PCR检测。将检测结果为阳性的转基因酵母置于诱导培养基,诱导表达,收集菌体。
1.2.8 脂肪酸甲酯和总油脂的提取与测定采用内标法对上述酵母和烟草叶片提取脂肪酸甲酯。称取50 mg样品研磨至粉末(设置3次生物学重复),加入50 μL的Tir17:0 作为内标 (浓度为10 mg/mL)。加入1.5 mL的2.5%的浓硫酸-甲醇混合液,80 ℃水浴2 h进行甲酯化,冷却后,加入2 mL 0.9%KCl和1 mL正己烷,离心,取上清液至新的玻璃试管中,氮吹仪吹干,沉淀用50 μL的乙酸乙酯混匀溶解,转移到GC小瓶中,-20 ℃保存备用。
采用氯仿-甲醇法分别提取酵母和烟草叶片的总油脂。分别称取上述冷冻干燥的酵母和烟草叶片50 mg粉末置于离心管中(设置3次生物学重复),加入7.5 mL的氯仿∶甲醇(1∶2),混匀后于37 ℃抽提24 h,收集上层有机相。将收集的上层有机相混匀,加5 mL氯仿和9 mL 1%氯化钠溶液,使氯仿∶甲醇∶水体积比为2∶2∶1.8,充分混匀后8 000 r/min离心10 min,收集下层有机相转移至已称重的玻璃管m0(g)中,待氮吹仪吹干后再次称重,称取总重量m1(g)。总脂肪酸含量=(提取后总重m1-提取前管重m0)/0.05。
2 结果与分析
2.1 续随子ElSAD2基因的表达分析
提取续随子根、茎、叶、花以及3个不同发育时期(花后15、30和45 d)种子的RNA,经核酸浓度仪检测,RNA的浓度和纯度合适,并通过凝胶成像仪观察RNA条带(图1),使用反转录试剂盒合成cDNA。为鉴定续随子ElSAD2基因是否行使功能,通过qRT-PCR分析续随子ElSAD2基因在不同器官及种子不同发育时期的表达特性。实时荧光定量qRT-PCR(图2)结果显示:在花后30 d,ElSAD2基因的表达量最高,其次是花后45 d。
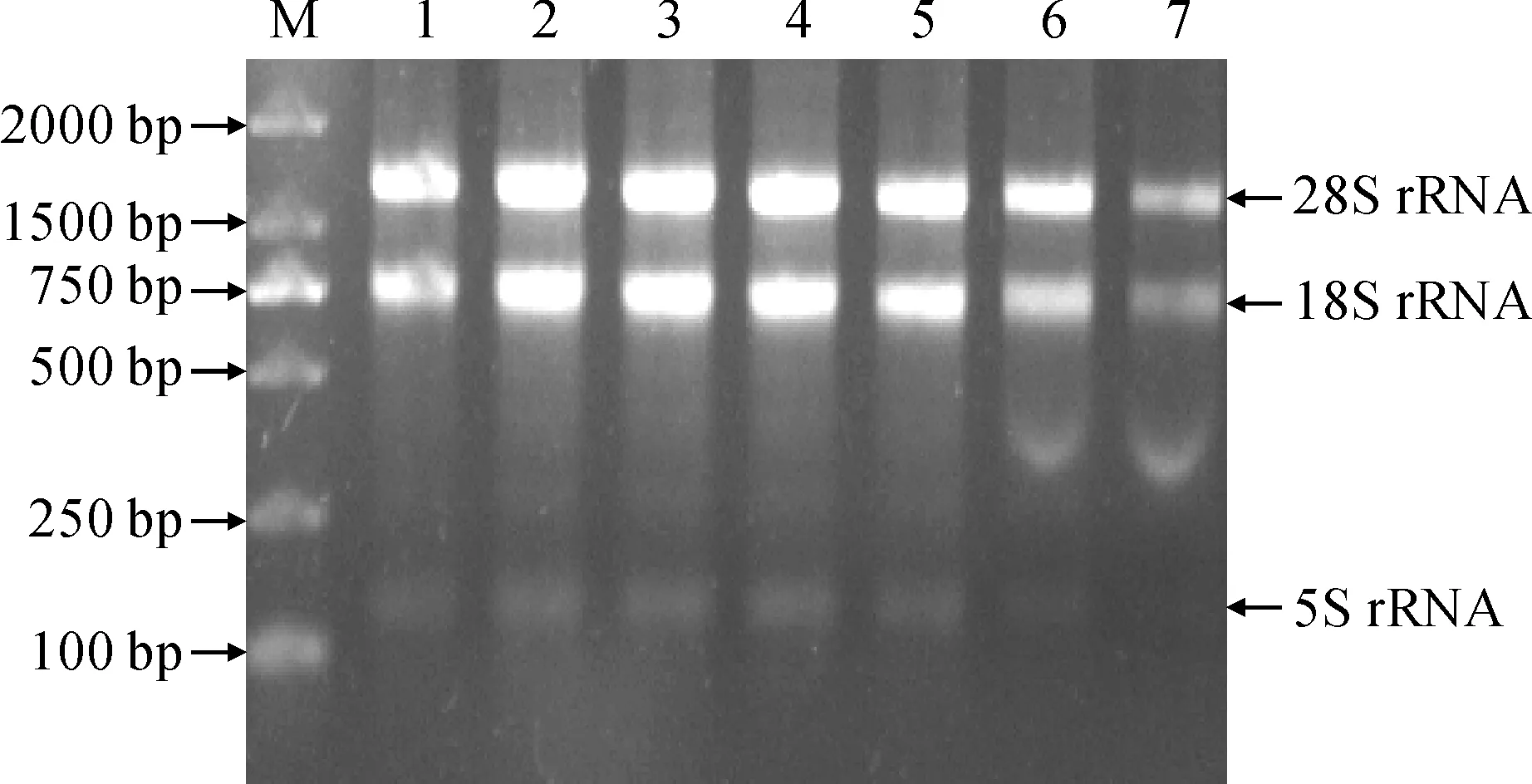
M. DL2000;1. 根;2. 茎;3. 叶;4. 花;5. 花后15 d种子;6. 花后30 d种子;7. 花后45 d种子图1 续随子各器官RNA琼脂糖凝胶电泳M. DL2000; 1. Root; 2. Steam; 3. Leaf; 4. Flower;5. Seeds of 15 days after flowering; 6. Seeds of 30 days after flowering; 7. Seeds of 45 days after floweringFig.1 The agarose gel electrophoresis of RNA from Euphorbia lathyris organs
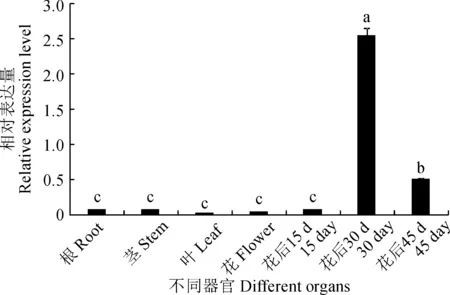
不同小写字母表示差异显著(P<0.05),下同图2 ElSAD2基因在不同器官及种子不同发育时期的相对表达量Different normal letters on the bar represent significant difference (P<0.05), the same as belowFig.2 Relative expression of ElSAD2 in different organs and seed developing stages
2.2 续随子ElSAD2蛋白理化性质及高级结构分析
通过NCBI-ORF Finder在线软件对续随子ElSAD2基因的开放阅读框(ORF)及编码氨基酸序列进行识别、比对,结果显示:ElSAD2基因cDNA全长为1 665 bp,开放阅读框(ORF)长度为1 194 bp,共编码397个氨基酸残基。ElSAD2相对分子量为45.21kD,理论等电点为6.29,为亲水性蛋白。ElSAD2蛋白无信号肽和跨膜结构,亚细胞定位预测定位于叶绿体,推测该蛋白可能在叶绿体中发挥作用。
ElSAD蛋白二级结构预测(图3)结果显示,ElSAD2蛋白二级结构由α-螺旋、β-折叠、无规则卷曲和延伸连组成,所占比例分别为54.91%、5.54%、31.99%和7.56%。其中α-螺旋和无规则卷曲所占比例较大,β-折叠所占比例最小。
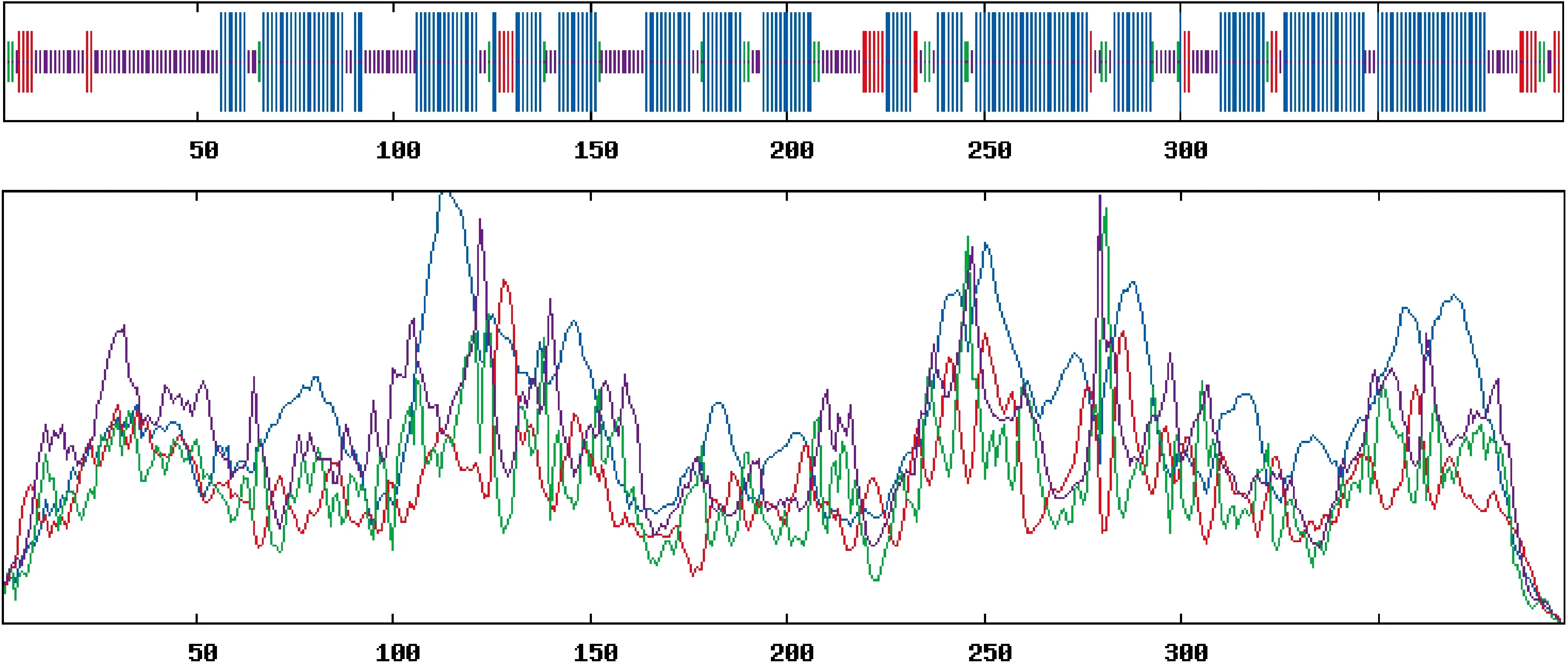
蓝色.α-螺旋;红色.延伸连;绿色.β-折叠;紫色.无规则卷曲;横坐标表示氨基酸数图3 ElSAD2蛋白的二级结构预测Blue. Alpha helix; Red. Extended strand; Green. Beta turn; Purple. Random coil;The horizontal axis represents the number of amino acidsFig.3 The second structure prediction of ElSAD2
利用SWISS-MODEL软件以蓖麻硬脂酰酰基载体蛋白去饱和酶T199D突变株(PDB数据库编号:2j2f.1)为模板对续随子ElSAD2蛋白进行同源建模。如图4所示,预测到ElSAD2蛋白活性形式为二聚体,在SAD保守区,4个α-螺旋束包围的2个二价铁离子,Fe离子的配基即是四螺旋束的氨基酸侧链,两个单体的二价铁离子位于SAD二聚体底物结合凹槽的内部,共同组成了脱氢酶催化活性中心。
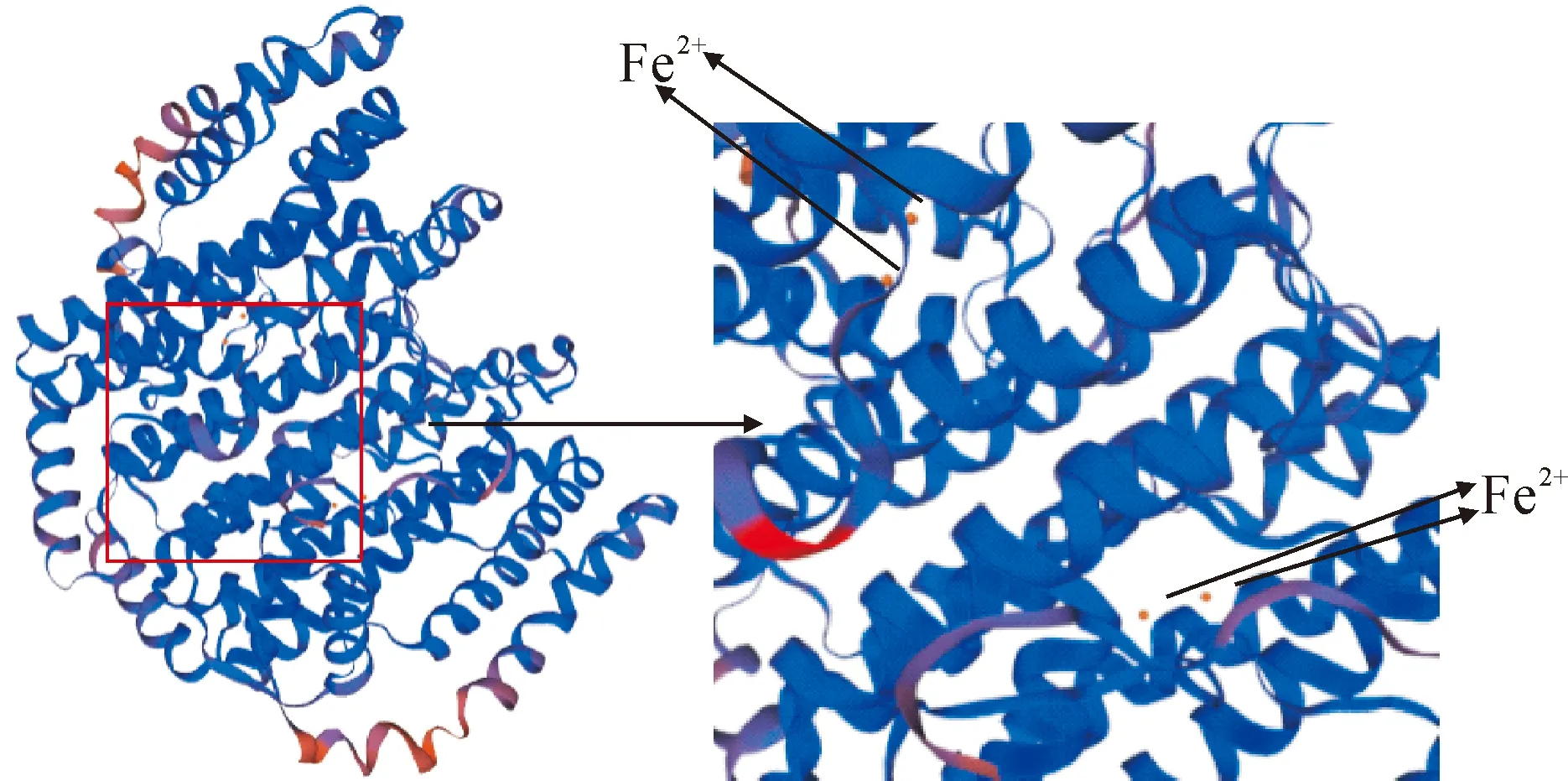
图4 ElSAD2蛋白三级结构预测Fig.4 The tertiary structure prediction of ElSAD2 protein
2.3 续随子ElSAD2蛋白保守域及系统进化分析
通过对续随子、拟南芥、蓖麻、烟草、茶树和芝麻这6种植物的氨基酸序列比对,结果表明,续随子ElSAD2的关键氨基酸残基与蓖麻RcSAD1和拟南芥AtSSI2完全相同, 氨基酸序列相似度高。续随子ElSAD2中有两个典型SAD特征的保守的组氨酸富集区,即EENRHG和DEKRHE(图5),其中天冬氨酸(D)和组氨酸(H)为ElSAD2催化活性中心的二价铁离子提供了必须结合位点,保证脱氢酶具有一定的催化活性。

AtSSI2. 拟南芥 (At2g43710); RcSAD1. 蓖麻(XP_002531889.1); NtSAD1. 烟草(XP_016449714.1); CsSAD. 茶树 (XP_028086173.1);SiSAD. 芝麻 (NP_001291335.1); 绿色框代表2个保守的富含组氨酸的基序EENRHG和DEKRHE,红色框标记决定功能性的氨基酸图5 不同物种SAD氨基酸序列比对分析AtSSI2. Arabidopsis thaliana (At2g43710); RcSAD1. Ricinus communis (XP_002531889.1); NtSAD1. Nicotiana tabacum (XP_016449714.1); CsSAD. Camellia sinensis(XP_028086173.1); SiSAD. Sesamum indicum (NP_001291335.1);The green boxes represent two conserved histidine-rich motifs EENRHG and DEKRHE, the red box marks the amino acids that determine the functionalityFig.5 Sequence alignment of SAD proteins from different plant species
运用MEGA 7.0软件对续随子ElSAD2蛋白和其他植物SAD蛋白进行多序列系统进化分析,结果如图(图6),ElSAD2与蓖麻RcSAD1、茶树CsSAD等亲缘关系较近,聚为一支。
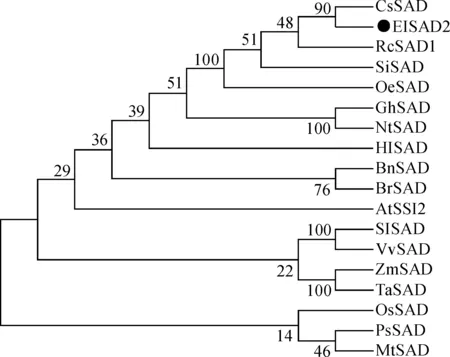
OeSAD.油橄榄(XP_022874955.1);GhSAD.陆地棉(XP_016699036.1);HlSAD.湖泊红球藻(ABP57425.1); BnSAD.油菜(AAT65205.1);BrSAD.白菜(XP_009133630.1);SlSAD.番茄(XP_004234817.1);VvSAD.葡萄(XP_003635378.1);ZmSAD.玉米(NP_001151340.2);TaSAD.翼叶山牵牛(AAA82160.1);OsSAD.水稻(CAE03992.1);PsSAD.北美云杉(ABK24594.1);MtSAD.结核杆菌(NP_335274)图6 ElSAD2与其他物种SAD蛋白的系统发育分析OeSAD. Olea europaea (XP_022874955.1); GhSAD. Gossypium hirsutum (XP_016699036.1); HlSAD. Haematococcus lacustris (ABP57425.1); BnSAD. Brassica napus (AAT65205.1);BrSAD. Brassica rapa (XP_009133630.1); SlSAD. Solanum lycopersicum (XP_004234817.1); VvSAD. Vitis vinifera (XP_003635378.1); ZmSAD. Zea mays (NP_001151340.2);TaSAD. Thunbergia alata (AAA82160.1); OsSAD. Oryza sativa (CAE03992.1); PsSAD. Picea sitchensis (ABK24594.1);MtSAD. Mycobacterium tuberculosis (NP_335274)Fig.6 Phylogenetic tree of ElSAD2 and other SAD proteins
2.4 续随子ElSAD2基因克隆和表达载体构建
为解析ElSAD2编码的酶蛋白是否具有SAD酶活性以及在续随子油脂生物合成中的功能,我们克隆了ElSAD2基因,并分别构建了植物表达载体和酵母表达载体。以开花后30 d种子的cDNA为模板,通过高保真PCR扩增出ElSAD2基因片段,经过回收纯化和测序验证,成功克隆出ElSAD2。
用KpnⅠ和XbaⅠ酶分别双酶切ElSAD2基因和酵母表达载体pYES2.0,使用T4连接酶将二者进行连接,通过双酶切验证得到重组酵母表达载体pYES2.0-ElSAD2(图7,A)。用类似的方法,构建植物表达载体pCAMBIA1303-ElSAD2(图7,B)。
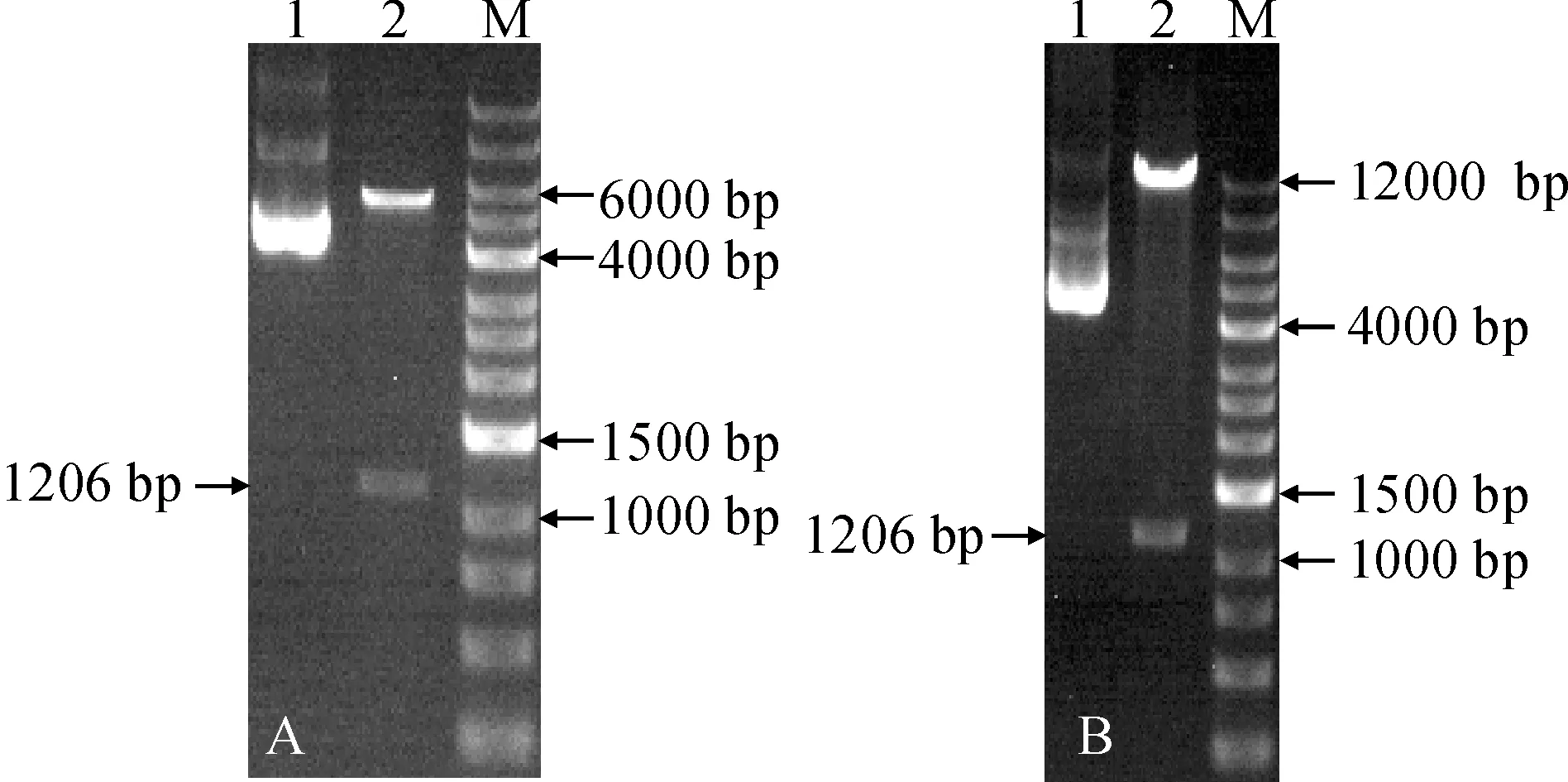
A. 重组酵母表达载体双酶切验证:1. pYES2.0;2. 双酶切pYES2.0-ElSAD2;M. 12 000 bp marker;B. 重组植物表达载体双酶切验证:1. pCAMBIA1303;2. 双酶切pCAMBIA1303-ElSAD2;M. 12 000 bp marker图7 双酶切验证A. Double restriction enzyme digestion verification of recombinant yeast expression vectors: 1. pYES2.0; 2. Double digested electrophoresis pYES2.0-ElSAD2; M. 12 000 bp marker;B. Double restriction enzyme digestion verification of recombinant plant expression vectors: 1. pCAMBIA1303; 2. Double digested electrophoresis pCAMBIA1303-ElSAD2; M. 12 000 bp markerFig.7 Double restriction enzyme digestion verification
2.5 过表达ElSAD2促进烟叶总油脂含量升高及脂肪酸成分的变化
利用农杆菌介导本氏烟草瞬时表达ElSAD2基因,取根癌农杆菌瞬时侵染3 d后的烟草叶片提取总RNA,反转录成cDNA,以该cDNA为模板进行RT-PCR检测ElSAD2基因是否有表达,结果显示,转pCAMBIA1303-ElSAD2基因烟草叶片能扩增出约1 194 bp大小的目的条带,而转pCAMBIA1303空载的烟草叶片无目的条带。这表明瞬时转化后的烟草叶片中目的基因ElSAD2能够正常转录形成mRNA有效表达。
选择野生型(WT)、转pCAMBIA1303空载体(EV)以及转pCAMBIA1303-ElSAD2的烟草叶片进行总油脂含量和脂肪酸组分测定。总油脂含量结果显示(图8),与野生型和转空载相比,转pCAMBIA1303-ElSAD2基因烟草叶片的总油脂含量提高了2.46%。脂肪酸组分分析显示(图9),与野生型和转空载相比,转pCAMBIA1303-ElSAD2基因烟草叶片的不饱和油酸(C18∶1Δ9)和亚油酸(C18∶2)分别增加了2.1%和2.4%,而棕榈酸(16∶0)、硬脂酸(C18∶0)、亚麻酸(C18:3)和花生酸(C20∶0)的含量均下降,其中硬脂酸(C18∶0)下降了约2.7%。总之,ElSAD2增加了烟草叶片中总油脂含量,并且饱和脂肪酸含量下降,不饱和油酸显著增加。结果表明,ElSAD2在烟叶组织中发挥SAD蛋白功能,催化18∶0-ACP生成18∶1Δ9-ACP,且促进总油脂的积累。
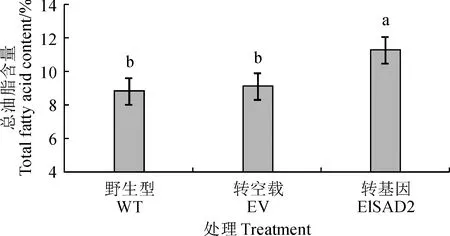
图8 过表达ElSAD2基因的烟叶总油脂含量Fig.8 Total oil contents in tobacco leaves overexpressing ElSAD2

图9 过表达ElSAD2基因的烟叶脂肪酸成分变化Fig.9 Changes of fatty acid profiles in tobacco leaves overexpressing ElSAD2
2.6 缺陷型酵母异源表达ElSAD2促进酵母总油脂含量升高和脂肪酸成分变化
将重组酵母表达载体pYES2.0-ElSAD2和空载体pYES2.0转入BY4389缺陷型酵母中,同时通过尿嘧啶缺失的固体培养基来筛选转化株,得到平板上的阳性克隆菌落,进行菌液PCR检测。结果显示:转重组质粒pYES2.0-ElSAD2的BY4389缺陷型酵母中得到长度为1 194 bp的目的条带,这与目的基因的ElSAD2的开放阅读框(ORF)大小相符,转基因BY4389缺陷型酵母在不含油酸的培养基中正常生长扩繁,未转化的BY4389缺陷型酵母(WT)和转空载的BY4389缺陷型酵母(EV)则无法正常生长,表明目的基因已成功转入BY4389缺陷型酵母中,并能够合成不饱和脂肪酸满足自身生长需求。
将阳性菌株涂布于以半乳糖为碳源的SC-URA诱导培养基上,倒置于28 ℃培养箱,培养2~4 d出现菌斑,扩繁收集酵母,冷冻干燥研磨获得酵母菌粉,选择野生型(WT)、转pYES2.0空载体(EV)以及转pYES2.0-ElSAD2的BY4389缺陷型酵母进行总油脂含量和脂肪酸组分测定。总油脂含量测定结果显示(图10):与野生型和转空载相比,转pYES2.0-ElSAD2的BY4389缺陷型酵母中总脂肪酸含量增加了约4.0%。脂肪酸组分测定结果显示(图11):与野生型和转空载相比,转pYES2.0-ElSAD2的BY4389缺陷型酵母中棕榈酸(16∶0)和硬脂酸(C18∶0)分别下降了约2.6%和4.8%,单不饱和脂肪酸油酸(C18∶1)增加了约6.6%,棕榈油酸(C16∶1)含量有少量(约1.6%)增加。表明ElSAD2可以使BY4389缺陷型酵母不饱和脂肪酸含量升高,且主要以硬脂酰-ACP(18∶0-ACP)为底物,催化脱氢成为油酰-ACP(18∶1-ACP)。
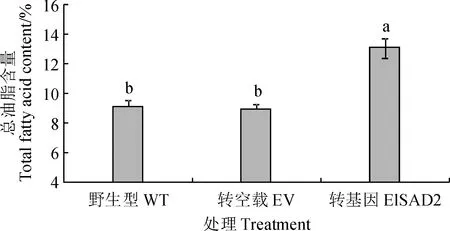
图10 过表达ElSAD2基因的BY4389缺陷型酵母总油脂含量Fig.10 Total oil contents in SAD-defective yeast BY4389 overexpressing ElSAD2
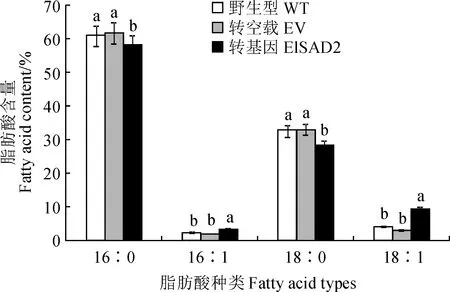
图11 过表达ElSAD2基因的BY4389缺陷型酵母脂肪酸成分变化Fig.11 Changes of fatty acid profiles in SAD-defective yeast BY4389 overexpressing ElSAD2
3 讨 论
新型能源植物续随子种子含油率为43.3%,油酸含量高(83%),且作为林下植物,具有“不与人争粮,不与粮争地”的优势,加速相关应用基础研究对于该能源植物的开发利用极为重要。Δ9-硬脂酰-ACP脱氢酶在不饱和脂肪酸合成中发挥重要作用。研究表明,蓖麻RcSAD1和拟南芥AtSSI2均对18∶0-ACP具有底物选择性,催化生成18∶1Δ9-ACP,形成油酸。因此,探究续随子Δ9-硬脂酰-ACP脱氢酶的催化活性,为解析油酸合成机制,并为后续通过转基因工程培育高油酸续随子具有重要指导意义。
在获得续随子种子转录组数据情况下,通过BLAST比对分析,鉴定得到续随子ElSAD2基因序列。ElSAD2基因cDNA全长为1 665 bp,开放阅读框长度为1 194 bp,共编码397个氨基酸残基。ElSAD2蛋白三级结构与蓖麻RcSAD1相似。Lindqvist等通过X射线晶体衍射方法分析的蓖麻RcSAD的晶体结构,是第一个鉴定了三级结构的SAD蛋白,该SAD为同型二聚体,4个α-螺旋与Fe2+共同形成SAD活性中心[21]。通过保守结构域分析发现,续随子ElSAD2中有两个典型SAD特征的保守组氨酸富集区,即EENRHG和DEKRHE。系统发育分析显示,续随子ElSAD2蛋白与同科植物蓖麻RcSAD蛋白相似度最高,具有较高的同源性,说明SAD在进化中是非常保守的,这进一步说明SAD是一种非常重要的脂肪酸去饱和酶。
表达模式分析发现,ElSAD2基因在不同器官中均有表达,尤其在开花后30 d种子中表达量最高。这与麻疯树JSAD基因表达谱一致,麻疯树JSAD基因在麻疯树的幼嫩根、茎、叶、花、果实以及成熟叶片中都有表达,在幼嫩的果实(正发育的果皮和种子)中表达最旺盛[22]。陆地棉GhSAD2基因在花后25 d的种子中表达量达到最高值[23]。紫苏PfSAD5在开花后30 d种子中表达较高[24]。推测SAD酶在种子发育过程中发挥主要作用,参与油脂的合成。
农杆菌介导的叶片瞬时转化广泛应用于植物外源基因的快速表达和功能鉴定。酿酒酵母由于其生长周期短,稳定性好等优势,常用于外源基因的表达来验证基因功能[25]。BY4389缺陷型酵母中OLE1基因发生缺失突变,酵母中失去脱氢酶活性,无法正常合成不饱和脂肪酸[26]。本研究构建了植物表达载体和酵母表达载体,通过异源表达ElSAD2基因分析烟叶及酵母细胞中的油脂含量变化,鉴定ElSAD2基因的功能。研究发现转基因烟叶中ElSAD2基因参与了油脂合成,使得不饱和油酸显著增加,转基因的BY4389缺陷型酵母中的油酸含量升高。烟草叶片瞬时表达和BY4389缺陷型酵母功能互补结果表明ElSAD2能高效催化硬脂酸生成油酸,促进细胞总油脂合成积累。
本研究鉴定得到续随子ElSAD2基因,确定该基因具有SAD酶的典型特征。对该基因的序列特征和表达模式进行了分析,并通过异源表达鉴定该基因的功能。本研究为深入解析能源植物续随子种子油脂合成和富集油酸的分子调控机制提供了科学参考,ElSAD2基因可作为靶基因应用于油料作物油脂产量及不饱和脂肪酸合成的基因工程。
