香蕉MaSNAT2基因的克隆与表达分析
2022-05-24刘嘉鹏伍俊为程春振黄玉吉
刘嘉鹏,武 欢,王 斌,伍俊为,程春振,2,黄玉吉*
(1 福建农林大学 园艺学院,福州 350002;2 山西农业大学 园艺学院,山西太谷 030801)
自褪黑素(N-乙酰基-5甲氧基色胺,N-acetyl-5-methoxytrytamine)被Lerner等[1]在牛松果体中发现以来,其在动物昼夜节律、睡眠、体温、季节繁殖及免疫系统等的调控作用被广泛揭示和关注[2-4]。1995年褪黑素于高等植物中被发现[5-6],从此开启植物褪黑素研究的热潮。植物褪黑素是一种生长调节剂,参与调控植物生长发育[7-8]和生物及非生物胁迫响应[9-11]。其合成途径以色氨酸为前体,通过TDC(tryptophan decarboxylase)、T5H(tryptamine 5-hydroxylase)或TPH(tryptophan hydroxylase)、SNAT(serotonin N-acetyltransferase)和ASMT(acetylserotonin-O-methyltransferase)或COMT(caffeic acid O-methyltransfer-ase)等酶催化的酶促反应合成[9]。其中,SNAT酶催化最后一步或倒数第二步反应[10-11],编码该酶的基因首次从水稻中被鉴定获得[12-13],之后陆续在多种植物中被鉴定研究[14-16]。
SNAT不仅催化褪黑素的合成[17-18],在植物逆境响应过程中也扮演着重要角色[9]。蓝藻SNAT在70 ℃仍具有较高催化活性[19];重组水稻SNAT在55 ℃的酶活性比30 ℃提高了16倍,并通过增加褪黑素含量提高了水稻的耐热性[13, 20];火炬松SNAT 酶在 55 ℃ 时表现出较高的催化活性[16]。除高温胁迫外,SNAT在响应其他生物胁迫及非生物胁迫中也发挥着重要作用。比如,抑制GhSNAT1基因的表达,降低了棉花对病原菌的抵抗力[21];异源过表达葡萄VvSNAT2基因的拟南芥褪黑素含量增加,白粉病抗性增强[15];异源过表达苹果MzSNAT5 的拟南芥褪黑素含量增加,耐旱性提高[11]。Byeon等[22]研究发现,抑制水稻内源SNAT的表达会导致褪黑素含量降低、生长发育滞后。
鉴于SNAT在植物生长发育和抗逆防御反应中的重要作用,本研究以‘巴西蕉’为材料对香蕉MaSNAT进行了克隆和生物信息学分析,研究了其在不同激素、外源褪黑素及低温处理下的表达模式,为揭示香蕉MaSNAT的功能奠定基础。
1 材料和方法
1.1 材 料
本研究所用‘巴西蕉’(Musaacuminatacv. ‘Brazil’,AAA group)由中国热带农业科学院海口试验站提供。将长势一致的‘巴西蕉’进行ABA、GA3、MeJA、褪黑素及低温处理。激素处理方法参考刘嘉鹏等[23]的方法:分别使用100 μmol·L-1ABA、100 μmol · L-1GA3和100 μmol·L-1MeJA溶液喷淋香蕉叶片至充分湿润,在处理0、4、8、12、24和48 h后收集样品。使用100 μmol·L-1褪黑素处理后将植株分为两组,分别放入28 ℃和4 ℃光照培养箱,于处理前及 处理12 h后观察植株表型并取样。以上所有处理均重复3次。使用RNAprep Pure Plant Kit(TIANGEN,China)试剂盒提取叶片RNA;使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen Biotech,China)逆转录试剂盒获得cDNA用于PCR扩增;使用HifairⅢ 1stStrand cDNA Synthesis逆转录试剂盒(TESEN,China)获得cDNA用于qRT-PCR。
1.2 方 法
1.2.1MaSNAT基因的鉴定及克隆从水稻基因组数据库(http://rice.plantbiology.msu.edu)下载获得水稻OsSNAT蛋白序列[24],参考刘范等[25]的方法鉴定香蕉MaSNAT。具体方法为:使用香蕉蛋白序列构建本地Blast数据库,以水稻SNAT蛋白序列进行本地Blast搜索,筛选条件为:E<1e-5,目标分值>50。通过Pfam数据库(http://pfam.xfam.org/)下载Acetyltransf_7 (Pfam13508) 的隐马氏模型[9],使用hmmer 3.0软件筛选出含有Acetyltransf_7结构域的香蕉蛋白,并使用SMART(http://smart.embl-heidelberg.de/)进行结构域验证。从香蕉基因组(https://banana-genome-hub.southgreen.fr)下载获得了2条基因MaSNATs的gDNA、CDS和蛋白序列,二者仅相差18 bp,因此使用DNAMAN软件,根据CDS序列设计出1对引物(F: ATGCCTTTCGGCGCTTCCA,R: CTAAT-ATCTTGGGTACCAG,目的片段长度分别为726 和744 bp)。参考刘嘉鹏等[26]的方法使用25 μL 体系进行PCR扩增,将PCR产物回收纯化后进行TA克隆,挑取9个阳性单菌落送至铂尚生物技术有限公司测序。
1.2.2 生物信息学分析参考刘嘉鹏等[23,26]的方法,对克隆获得MaSNATs基因进行生物信息学分析(表1),将MaSNATs蛋白序列进行Blastp(https://blast.ncbi.nlm.nih.gov/Blast)搜索,筛选相似度大于70%,覆盖度高于80%,E-value小于1e-5的同源蛋白用于蛋白序列比对及进化树构建。

表1 本研究所用生物信息学软件
1.2.3 实时荧光定量PCR利用DNAMAN软件根据MaSNAT2的CDS序列设计实时荧光定量PCR引物(F:GTGCTGGATTCATAATGGAC-TC,R:TCTGCTCAAATGTTCCGTC,224 bp),以CAC内参基因(CAC-F:CTCCTATGTTGCTCG-CTTATG,CAC-R:GGCTACTACTTCGGTTCT-TTC)进行qRT-PCR扩增。使用2-ΔΔCT法计算MaSNATs基因相对表达量[26]。使用SPSS软件对数据进行显著性分析后,使用GraphPad Prism 5软件作图[23]。
1.2.4 褪黑素含量测定参考Wei等[27]的方法使用江莱生物科技有限公司生产的植物褪黑素酶联免疫吸附试剂测定试剂盒测定CK、M、T和MT组香蕉叶片褪黑素含量。利用SPSS软件分析MaSNAT2基因相对表达水平与内源褪黑素含量的相关性。
2 结果与分析
2.1 MaSNATs基因的鉴定、克隆及基因结构
从香蕉基因组中鉴定获得2个SNAT蛋白,根据基因组ID分别命名为 MaSNAT1(Ma05_p32060.1)和MaSNAT2(Ma05_p32060.2)。MaSNAT1和MaSNAT2的CDS长度分为726和744 bp(图1),MaSNAT1仅比MaSNAT2缺少一段18 bp的序列(GTAGGTCTCCAGGCACAG)。使用RT-PCR仅克隆获得1条长度约740 bp的目的条带,测序结果显示该序列长度为741 bp(图2),比香蕉基因组的MaSNAT2少3 bp,相似度达98.92%,说明成功获得了‘巴西蕉’MaSNAT2,而MaSNAT1在‘巴西蕉’中不表达。基因结构分析结果显示MaSNAT2基因具有7个内含子和8个外显子(图3)。

MaSNAT2为巴西蕉SNAT基因,SNAT1与SNAT2为小果野蕉SNAT基因。黑框为SNAT1与SNAT2差异碱基图1 巴西蕉和小果野蕉SNAT基因CDS序列比对结果MaSNAT2 is Brazil banana SNAT gene, SNAT1 and SNAT2 are Musa acuminata subsp. malaccensis SNAT gene. The black box is the base difference between SNAT1 and SNAT2 geneFig.1 Sequence alignment results of the SNAT CDS sequences from ‘Brazil’ banana and Musa acuminata subsp. malaccensis
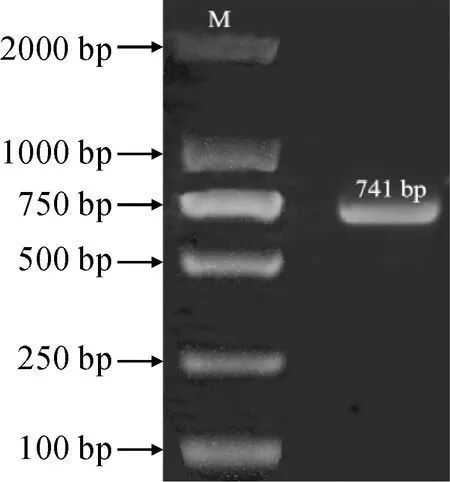
M.DL2000图2 MaSNAT2 cDNA扩增产物电泳检测结果Fig.2 Electrophoresis results of the amplified complementary sequence of MaSNAT2

红框为Acetyltransf_7结构域图3 MaSNAT2保守结构域The red box is the Acetyltransf_7 domainFig.3 Conserved domains in MaSNAT2
β折叠(28%)和无规则卷曲(13%)组成。MaSNAT2三级结构与水稻OsSNAT相似度为81.60%。
2.2 香蕉MaSNAT2生物信息学分析
ExPASy预测结果显示MaSNAT2编码一个分子式为C1254H1925N327O354S8,具有246 aa,相对分子量为27 502.54,等电点为6.20,脂肪系数和亲水性分别为88.37和-0.123的不稳定蛋白。MaSNAT2蛋白不具有跨膜结构,具有叶绿体转运信号肽;亚细胞定位预测发现该蛋白定位于叶绿体。二级结构分析结果显示MaSNAT2主要由α螺旋(37%)、结构域预测结果显示MaSNAT2的C端159~231 aa间存在乙酰转移酶催化结构域(Acetyltransf_7),182~195 aa间存在辅酶A结合位点(图3)。保守基序预测结果显示MaSNAT2具有15个保守基序,基序NATIWD、YQGQGLG、VEQLIR、GMARAT、DFYKNL、TLFADNK、VLLQRD和VLVDPS等8个基序是组成结构域Acetyltransf_7的保守序列。
基于水稻蛋白质数据库,使用STRING在线软件预测了MaSNAT2潜在互作蛋白。结果(图4)显示,香蕉MaSNAT2与水稻SNAT1高度同源,与ASMT1、TDC2和 SNAT2互作系数均高于0.990(分别为0.994、0.991和0.990),与酪氨酸/多巴脱羧酶以及芳香族-L-氨基酸脱羧酶也存在互作。

图4 以水稻蛋白质数据库为参考构建的MaSNAT2蛋白互作网络模型Fig.4 Protein-protein interaction network of MaSNAT2 based on Oryza sativa L. protein database
2.3 蛋白序列比对及进化树
蛋白序列比对结果(图5)显示:植物SNAT蛋白C端高度保守。MaSNAT2与小果野蕉SNAT相似度最高(99.19%),其次为野蕉(相似度为98.39%)。进化树分析结果(图6)也表明,MaSNAT2与小果野蕉(XP_009402202.1)亲缘关系最近,其次是野蕉(THU68065.1)。
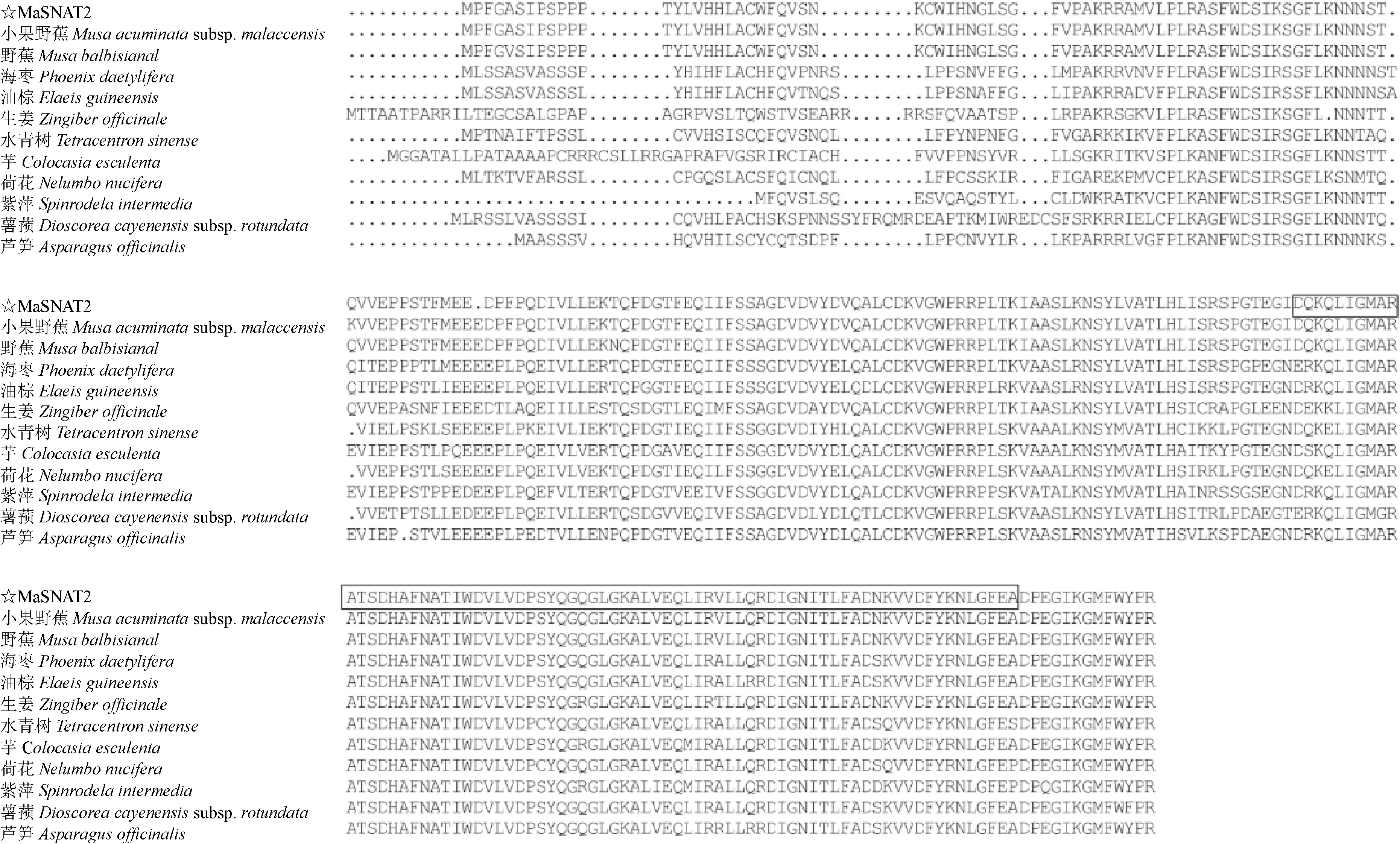
框内为Acetyltransf_7结构域图5 MaSNAT2与其他物种蛋白序列比对结果The box represents the Acetyltransf_7 domainFig.5 Protein sequence alignment between MaSNAT2 and other species
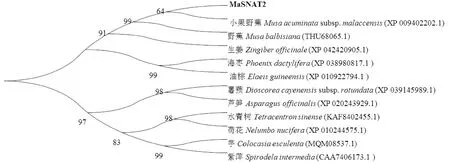
图6 不同植物SNAT蛋白系统进化树Fig.6 Phylogenetic tree of homologous SNAT proteins of different plant species
2.4 启动子顺式作用元件分析结果
启动子顺式作用元件分析结果显示,除核心元件外,MaSNAT2启动子上存在6个ABA、2个GA和 3个MeJA响应元件,此外还含有1个厌氧诱导元件、1个胚乳表达、1个分生组织表达和13个光响应元件(表2)。

表2 MaSNAT2基因启动子顺式作用元件
2.5 激素处理下MaSNAT2基因的表达
qRT-PCR结果显示(图7),在ABA处理下,MaSNAT2相对表达量随处理时间呈‘降-升’的趋势,在处理4、8、12、24和48 h时的表达量分别为对照的0.37、0.11、0.43、0.56和0.55倍;在GA3处理下,MaSNAT2相对表达量呈‘降-升-降-升’的趋势,在8 和48 h表达量显著上调,分别为对照的15.1和16.2倍;在MeJA处理下,MaSNAT2基因表达呈‘升-降-升-降’的趋势,在4 h时的表达量显著高于对照,为对照的5.2倍,其他时间点的表达量低于对照,但与对照差异不显著。

*表示与对照相比差异显著图7 激素处理下MaSNAT2的相对表达量* represents significant difference compared with CKFig.7 Relative expression level of MaSNAT2 gene under hormone treatments
2.6 外源褪黑素对MaSNAT2表达的影响
通过比较4组处理香蕉表型差异发现:M组与CK组相比无明显变化,T组香蕉叶缘软化、卷曲下垂,MT组也表现出叶片卷曲症状,但明显轻于T组(图8,A),说明褪黑素处理可以提高香蕉的抗寒性。通过分析4组香蕉叶片中MaSNAT2基因表达情况,发现褪黑素及低温复合处理时MaSNAT2表达量最高,为对照的2.66倍;其次是单独低温处理,为对照的2.03倍;单独褪黑素处理时MaSNAT2表达量也高于对照,但差异不显著(图8,B)。
与CK组相比,M组、T组及MT组褪黑素含量显著增加(P<0.05),分别为对照的1.10倍、1.16倍和1.32倍(图8,C)。通过分析4组样品中MaSNAT2的表达和褪黑素含量的相关性,发现MaSNAT2的表达水平与褪黑素含量呈极显著正相关(相关性系数为0.816,P<0.01)。
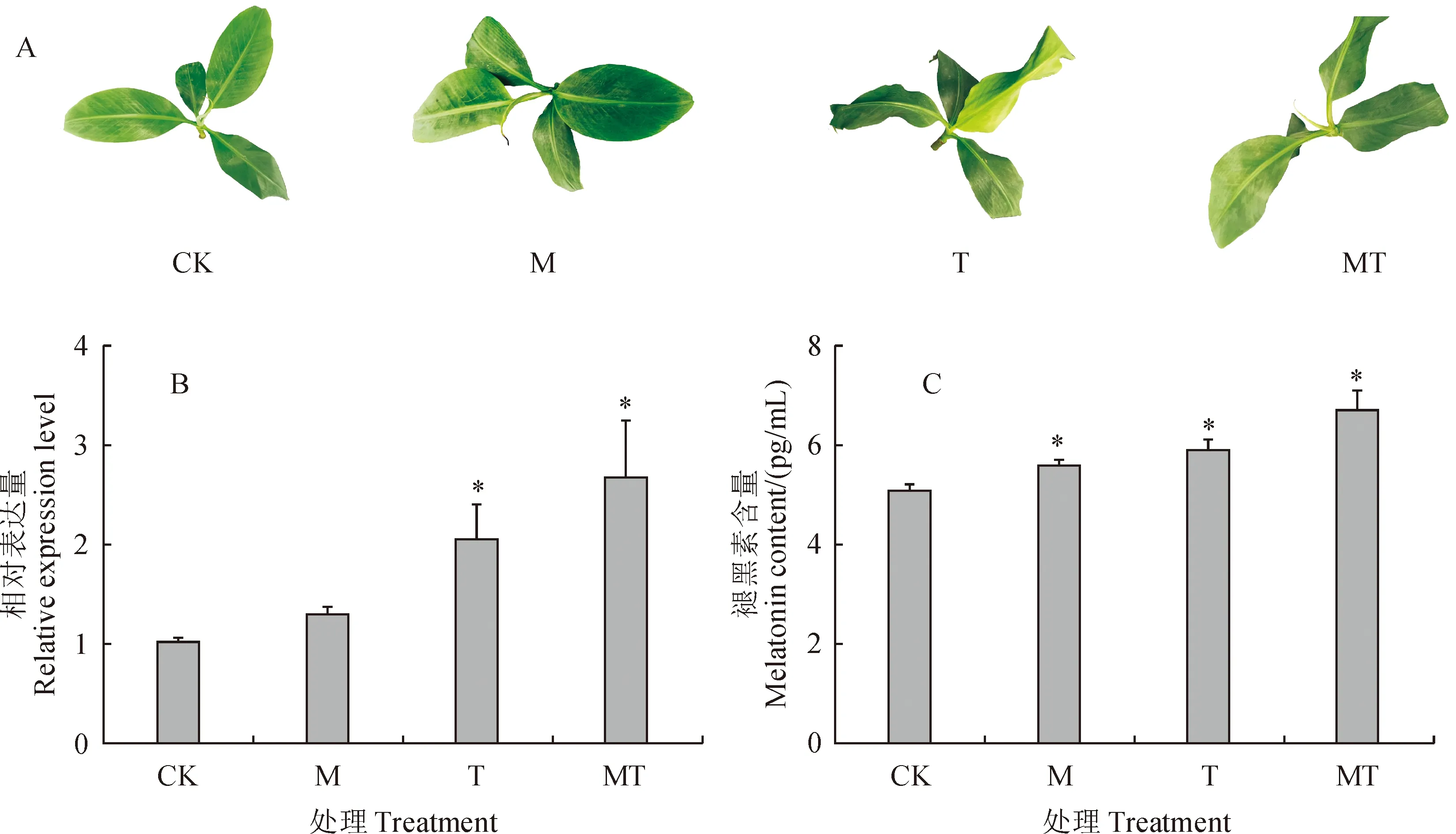
CK. 28 ℃对照;T. 低温;M. 褪黑素;MT. 褪黑素+低温;*表示与对照相比差异显著图8 不同处理对香蕉表型(A)、MaSNAT2表达(B)及内源褪黑素含量(C)的影响CK. 28 ℃ control group; M. Melatonin treatment group; T. Low temperature treatment group; MT. Melatonin and low temperature co-treatment group. *represents significant difference compared with CKFig.8 Different treatments on banana phenotypes (A), relative expression of MaSNAT2 gene (B) and endogenous melatonin content (C)
3 讨 论
SNAT属于GNAT超家族(也称GCN5相关家族),该家族成员对不同乙酰受体具有显著的特异性[28],在调节褪黑素合成与积累过程中发挥重要的作用[17, 29]。本研究发现MaSNAT2的C端高度保守,且存在乙酰转移酶催化结构域及辅酶A结合位点[30],说明C端高度保守对于SNAT功能的发挥意义重大[9]。
Zhang等[9]研究发现与水稻OsSNAT1基因同源性较高的烟草(Nicotianatabacum)的NtSNAT1和NtSNAT2基因、绒毛烟草(Nicotianatomentosiformis)NtoSNAT1与开花烟草(Nicotianasylvestris)NsSNAT1等基因均具有7个内含子和8个外显子。本研究发现MaSNAT2基因也具有7个内含子和8个外显子。火炬松PtSNAT定位于叶绿体[16];葡萄VvSNAT2具有叶绿体转运信号肽,定位于叶绿体[15];红藻PySNAT蛋白不具有叶绿体转运信号肽,定位于细胞质[31]。本研究发现,香蕉MaSNAT2具有叶绿体转运信号肽,亚细胞定位预测结果也显示其定位于叶绿体。因此推断SNAT蛋白亚细胞定位与叶绿体转运信号肽存在情况有关。
褪黑素合成与各种激素代谢间存在密切联系[32-33]。本研究通过分析MaSNAT2启动子顺式作用元件,发现其启动子上存在有ABA、GA3和MeJA响应相关元件,暗示MaSNAT2的表达可能受多种激素调控。研究表明干旱胁迫下褪黑素处理可以上调苹果2个ABA分解基因MdCYP707A1和MdCYP707A2的表达,减少ABA含量[32]。Zhang等[34]发现褪黑素降低高温胁迫下黑麦草ABA含量。本研究发现,香蕉MaSNAT2的表达受ABA显著抑制,暗示褪黑素和ABA之间存在一定拮抗关系。褪黑素可以提高黄瓜GA合成基因GA20ox和GA3ox的表达提高GA含量[35]。本研究发现,MaSNAT2基因表达受到GA3诱导,说明GA3可能对褪黑素的合成具有一定促进作用。此外,本研究还发现MeJA处理可以诱导MaSNAT2基因的表达,再次暗示褪黑素代谢与多种激素代谢存在‘cross-talk’。
大量研究表明,外源褪黑素处理可以提高植物的抗寒或耐寒能力[36-39]。烟草NtSNAT1基因在低温处理24 h表达量上调[9]。本研究发现,低温和外源褪黑素处理均能显著提高香蕉叶片内源褪黑素含量,且二者复合处理对内源褪黑素积累的促进效果最佳;而MaSNAT2的相对表达水平也表现为:CK< M< T
