火炬松体细胞胚胎发生体系的优化
2022-05-24杨春霞谷振军肖平江李火根
胡 珊,杨春霞,谷振军,杜 强,肖平江,李火根
(1. 江西省林业科学院,江西 南昌 330013;2. 南京林业大学南方现代林业协同创新中心,江苏 南京 210037;3. 安福县武功山林场,江西 吉安 343200)
火炬松(Pinus taedaL.)作为我国成功引种的国外松树种之一,因其生长快、用途广、适应性强等特性,成为我国南方地区的重要用材树种和生态树种。然而,火炬松育种和生长周期长,常规有性繁殖子代表型变异大,且种子园建设成本和维护成本高、更新慢,在短期内不能满足生产上对火炬松苗木的需求,限制了火炬松规模化推广应用。无性快繁不仅可在短期内保质保量地规模生产无性系苗木,而且还可缩短育种周期,加速育种进程。
植 物 体 细 胞 胚 胎 发 生 ( Somatic embryogenesis)具有繁殖系数高、遗传稳定性好、生产周期短、便于规模化生产等优点,是植物良种规模化繁殖的有效手段之一,在提高森林生产力、可持续性和林产品一致性方面发挥重要作用[1]。早在1987 年,美国学者[2]开始火炬松体胚发生技术研究,初步建立了悬浮培养体系并获得再生植株。随着Becwar 等[3]、Li 等[4]、Pullman[5]等学者对体胚发生技术研究的深入,体胚技术逐渐成熟,火炬松一些优良基因型的体胚诱导率和植株再生率显著提升,并成功用于商业化生产[6]。国内对火炬松体胚发生方面的研究相对较少,主要集中在20 世纪90 年代[7],虽然近年来也开展过一些研究,但效果不理想[8-9]。无论是国外还是国内,火炬松体胚发生技术研究中仍存在一些共性的、难以克服的技术问题,如某些优良基因型的胚性愈伤组织诱导率低、增殖稳定性差、体胚成熟分化同步性低及体胚萌发率低等[6],造成大多数火炬松优良基因型目前尚不能通过体胚发生途径进行规模化生产。
为此,本研究以江西省推广应用的火炬松良种[赣R-CS0(1)-PT-001-2020(5)]的未成熟种子为材料,对胚性愈伤组织诱导与增殖、体胚成熟与萌发、体胚苗移栽等相关技术进行了优化,以期提高火炬松胚性愈伤组织诱导率、体胚成熟分化及植株再生效率,为江西省火炬松良种体胚繁育奠定了基础,并为其规模化生产体胚苗提供技术支撑。
1 试验材料
未成熟球果采自江西省安福县武功山林场的第1 代火炬松无性系种子园中6 个长势好、结实量高、且子代速生特性明显的无性系(武林1、武林2、武林3、武林16、荣山52、湖南39)。自2019年7 月7 日开始采集,8 月19 日结束,每周采集1 次,共采集7 次,每株每次采集20~30 个未成熟球果,随机取3 个球果镜检,剩余的放置4 ℃冰箱保存备用。
2 方法
2.1 外植体消毒与接种
未成熟种子先用无菌水清洗1 遍,然后用75%(v/v)酒精消毒30 s,无菌水清洗3 遍,再用0.1%(w/v)升汞消毒7~8 min,无菌水清洗5 遍,最后用无菌滤纸将种子表面多余的水分吸干,备用。
消毒后的种子用无菌手术刀和镊子剥除种子的外种皮和内种皮,将其接种至提前配好的胚性愈伤组织诱导培养基中,每皿10 粒。
2.2 胚性愈伤组织诱导与增殖
设置不同基因型、基本培养基类型、不同采样时间、PGR 不同组合(NAA、6-BA 和KT)及浓度梯度等因素对火炬松胚性愈伤组织诱导影响的试验。
不同采样时期、不同基因型的诱导培养基采用DCR 培养基 + 1.0 mg·L−12,4-D + 0.5 mg·L−16-BA + 1.0 mg·L−1NAA + 5.0 mg·L−1ABA;不同基本培养基类型采用基本培养基 + 1.0 mg·L−12,4-D +0.5 mg·L−16-BA + 1.0 mg·L−1NAA + 5.0 mg·L−1ABA;PGR 组合则采用4 因素3 水平正交试验设计,在DCR 基本培养基上添加不同PGR 及其浓度的组合。以上培养基同时添加L-谷氨酰胺450 mg·L−1、肌醇500 mg·L−1、水解酪蛋白500 mg·L−1、2-吗啉乙磺酸250 mg·L−1、蔗糖30 g·L−1、卡拉胶7.5 g·L−1。每个处理设置3 个重复,(22±1)℃暗培养, 8 周后统计胚性愈伤组织诱导率。
选择生长状态良好的胚性愈伤组织,在增殖培养基中(MLP+2.0 mg·L−1NAA+0.5 mg·L−16-BA+0.5 mg·L−1KT+450 mg·L−1L-谷氨酰胺+500 mg·L−1肌醇+500 mg·L−1水解酪蛋白+30 g·L−1麦芽糖+7.5 g·L−1卡拉胶)进行继代,培养条件同诱导培养。
2.3 成熟分化培养
选择增殖能力强、具有典型的胚性胚柄细胞团结构细胞系#R52(荣山52 无性系的未成熟种子诱导的一个细胞系),在增殖培养基上增殖10 d 后,称取鲜质量1 g,转接至MLP 基本培养基,暗培养14 d 后再转移至成熟分化培养基中进行培养,成熟培养基设置ABA 浓度(6、8、10 mg·L−1)、PEG 8 000 浓度(120、140、160 g·L−1)、麦芽糖浓度(20、30、40 g·L−1)3 因素3 水平的正交设计试验,同时添加450 mg·L−1L-谷氨酰胺 、500 mg·L−1肌 醇、 500 mg·L−1水 解 酪 蛋 白、 250 mg·L−12-吗啉乙磺酸、30 g·L−1麦芽糖、7.5 g·L−1卡拉胶,8 周后统计成熟胚的数量。
2.4 萌发与移栽
将细胞系#R52 成熟的体细胞胚胎接种于萌发培养基G0 和G1(G0=WPM + 肌醇500 mg·L−1+L-谷氨酰胺450 mg·L−1+ 水解酪蛋白 500 mg·L−1+2-吗啉乙磺酸 250 mg·L−1+ 麦芽糖30.0 g·L−1+ 结冷胶10 g·L−1,G1=G0 + 3.5 g·L−1活性炭)中进行萌发,先暗培养7 d,然后置光照下培养。组织培养间的环境控制为:光照强度为50 μmol·m−2·s−2、光照16 h/黑暗8 h,温度(22±1)℃,湿度为60%~65%。将体胚生根且长出真叶判定为萌发,统计8 周内的萌发率。
体胚萌发后,将其放在瓶装的萌发培养基上继续培养4~6 周,室温下开口炼苗1 周后移栽,移栽基质按照泥炭土∶珍珠岩=3∶1 的比例配置,光照16 h 的光周期/黑暗8 h、光照强度为50 μmol·m−2·s−2,温度25 ℃,湿度前两周控制为85%,后续两周湿度控制75%。8 周后统计移栽成活率。
2.5 数据统计分析
使用Excel 进行数据的计算,采用SPSS 22.0软件对数据进行方差分析和多重比较。采用单因素的一般线性模型进行方差分析,模型为:
Y=u+F+e
式中:u为平均值,F为处理,e为误差。
对各处理的试验结果平均值进行Duncan 多重比较。
胚性愈伤组织诱导率=诱导出胚性愈伤组织的未成熟合子胚数/接种的未成熟合子胚数 × 100%。
萌发率=已萌发的体胚数量/萌发试验体胚起始数量 × 100%。
移栽成活率=成活的体胚苗数量/移栽的体胚苗总数量 × 100%。
3 结果与分析
3.1 火炬松胚性愈伤组织诱导
3.1.1 采集时期 将火炬松3 个无性系不同时期采集的未成熟种子(图1a)镜检后对应合子胚发育期,剥除内外种皮后(图1b)接种于诱导培养基中,胚性愈伤组织(图1c)诱导率区别很大,且均以7 月20 日采集的未成熟种子的胚性愈伤组织诱导率最高(表1)。由此可推断,火炬松最佳采样时期是7 月20 日,最佳的合子胚发育期处于裂生多胚期。

注:a. 火炬松球果及其种子;b. 去除种皮的未成熟合子胚;c. 诱导胚性愈伤组织;d. 继代一次的胚性愈伤组织;e. 体细胞胚胎的成熟分化培养;f. 成熟的体细胞胚胎;g. 萌发试验;h. 壮苗培养;i. 炼苗移栽。Notes: a. Cones and seeds of loblolly pine; b. Immature zygotic embryo with seed coat removed; c. Mature differentiation of embryogenic callus; d. Embryogenic callus subcultured once; e.Maturation culture of T somatic embryos; f. Mature somatic embryos;g. Germination test; h. Strong seedling culture; i. Seedling refining and transplanting.
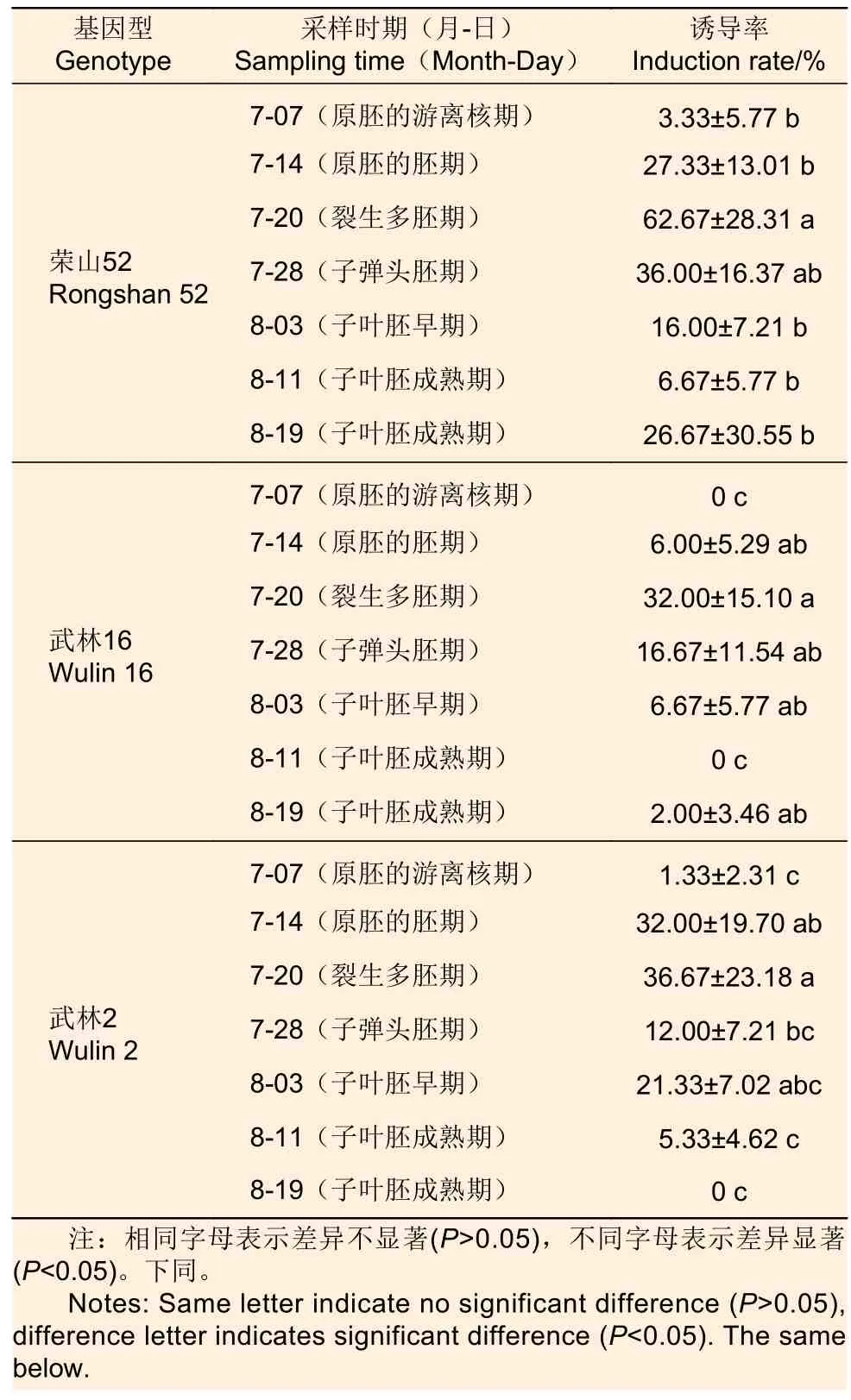
表1 不同基因型未成熟合子胚在不同采样时期的胚性愈伤组织诱导率Table 1 Effect of different genotypes of immature zygotic embryos on embryogenic callus induction rate at different sampling stages
3.1.2 基因型 将7 月20 日采集的6 个不同基因型火炬松未成熟种子接种于诱导培养基中进行胚性愈伤组织诱导,发现胚性愈伤组织诱导率差别明显(表2),其中,荣山52 号未成熟合子胚的胚性愈伤组织的诱导率最高,达63.33%;湖南39 号次之,愈伤组织诱导率达60.00%;武林1 号胚性愈伤组织的诱导率最低,仅为10%。
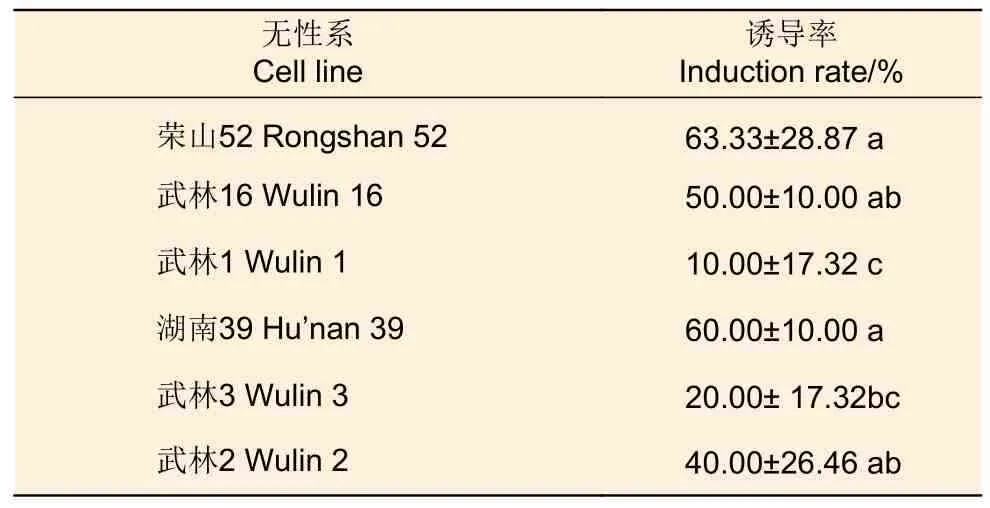
表2 不同基因型对胚性愈伤组织的影响Table 2 Effects of different genotype on embryonic callus introduction
3.1.3 基本培养基类型 以武林2 号未成熟合子胚(7 月20 日)为材料开展不同基本培养基上胚性愈伤组织诱导试验(表3),发现DCR 培养基上胚性愈伤组织的诱导率最高,达到40.00%,且与其他培养基间差异显著;其次WPM 和MLP 培养基,胚性愈伤组织诱导率分别为20.00%和13.33%;而MLV、WV5 和B5 培养基中诱导率较低。
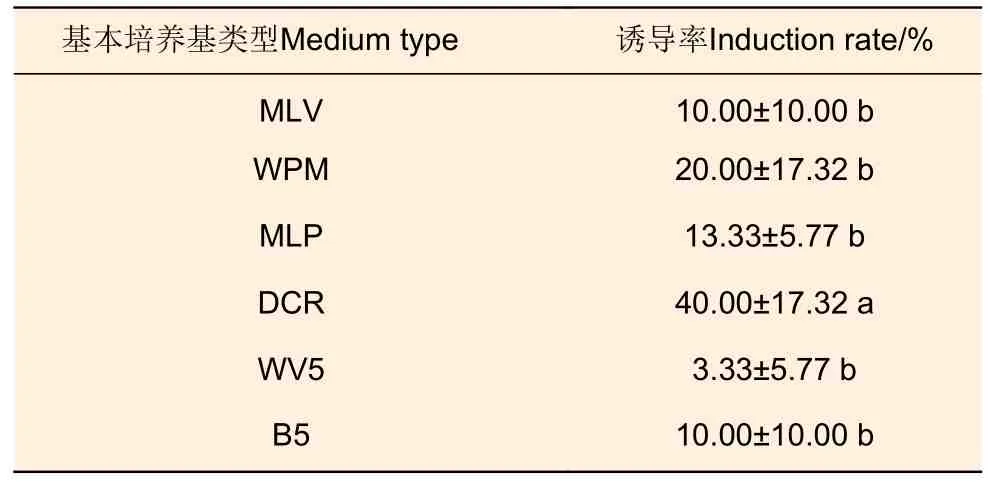
表3 不同基本培养基对胚性愈伤组织诱导的影响Table 3 Effects of different basic media on embryogenic callus induction
3.1.4 不同PGR 组合及其浓度 荣山52 的未成熟合子胚接种于不同浓度的6-BA、2,4-D、NAA和ABA 的正交设计处理的9 种培养基中,培养基配方为DCR + PGR 组合,结果(表4)发现:处理3的胚性愈伤组织诱导率最高,达50.00%;其次是处理7,胚性愈伤组织诱导率达18.33%;处理6 的胚性愈伤组织的诱导率最低。从正交设计的方差分析可得,6-BA 浓度、NAA 浓度以及ABA 浓度都对胚性愈伤组织的诱导率有显著影响。
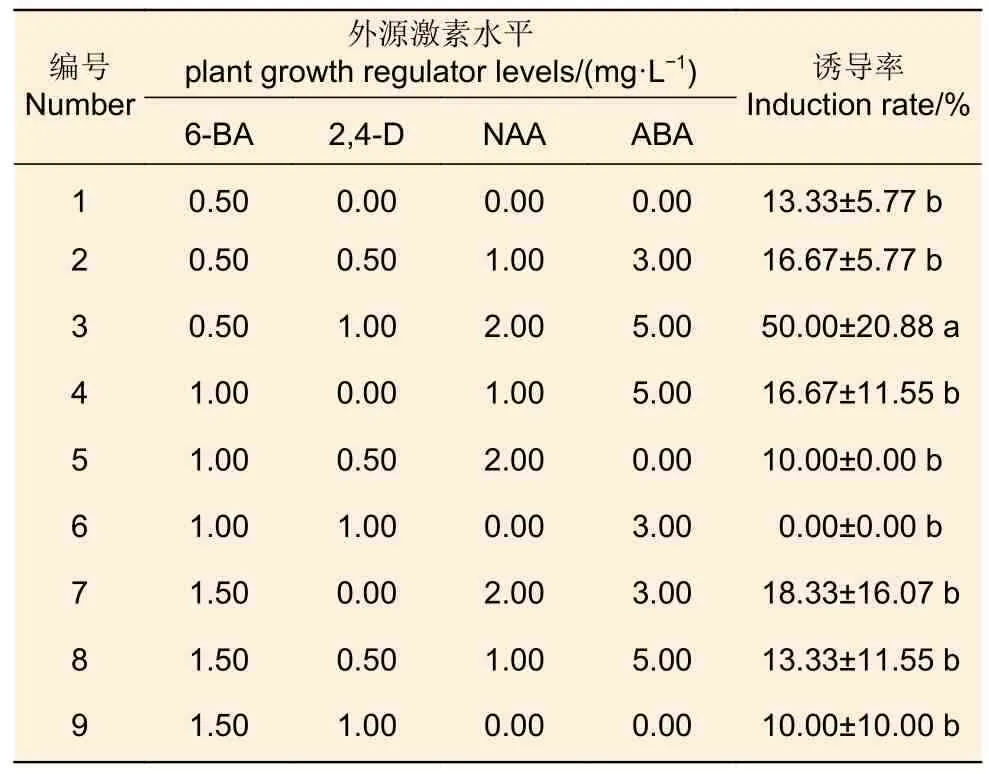
表4 不同PGR 组合及浓度对荣山52 胚性愈伤组织诱导率的影响Table 4 Effects of different PGR combinations and concentrations on embryogenic callus induction rate of Rongshan 52
3.2 体胚成熟分化培养
选择半透明、粘连状,且具有典型ESM 结构的#R52 胚性愈伤组织(图1d)进行成熟分化试验。#R52 胚性愈伤组织在成熟分化培养基培养1 周后,胚性愈伤组织表面即可观察到原胚,此后原胚不断生长分化,子叶开始形成,2 个月左右体细胞胚胎基本发育成熟(图1e、f)。体胚成熟分化培养的9 种处理中体胚诱导率差别明显(表5、图2),处理5 对#R52 胚性愈伤组织成熟诱导效果最好,平均可达411 个·g−1成熟胚,最高可达448 个·g−1成熟胚;其次是处理3,成熟胚数量平均达257 个·g−1,最高可达327 个·g−1。

注: a. 处理1 的体胚;b. 处理2 的体胚;c. 处理3 的体胚;d. 处理4 的体胚;e. 处理5 的体胚;f. 处理6 的体胚;g. 处理7 的体胚;h. 处理8 的体胚;i. 处理9 的体胚。Notes: a. the somatic embryos treated with 1; b. the somatic embryos treated with 2; c. the somatic embryos treated with 3; d. the somatic embryos treated with 4; e. the somatic embryos treated with 5; f. the somatic embryos treated with 6; g. the somatic embryos treated with 7; h. the somatic embryos treated with 8; i. the somatic embryos treated with 9.
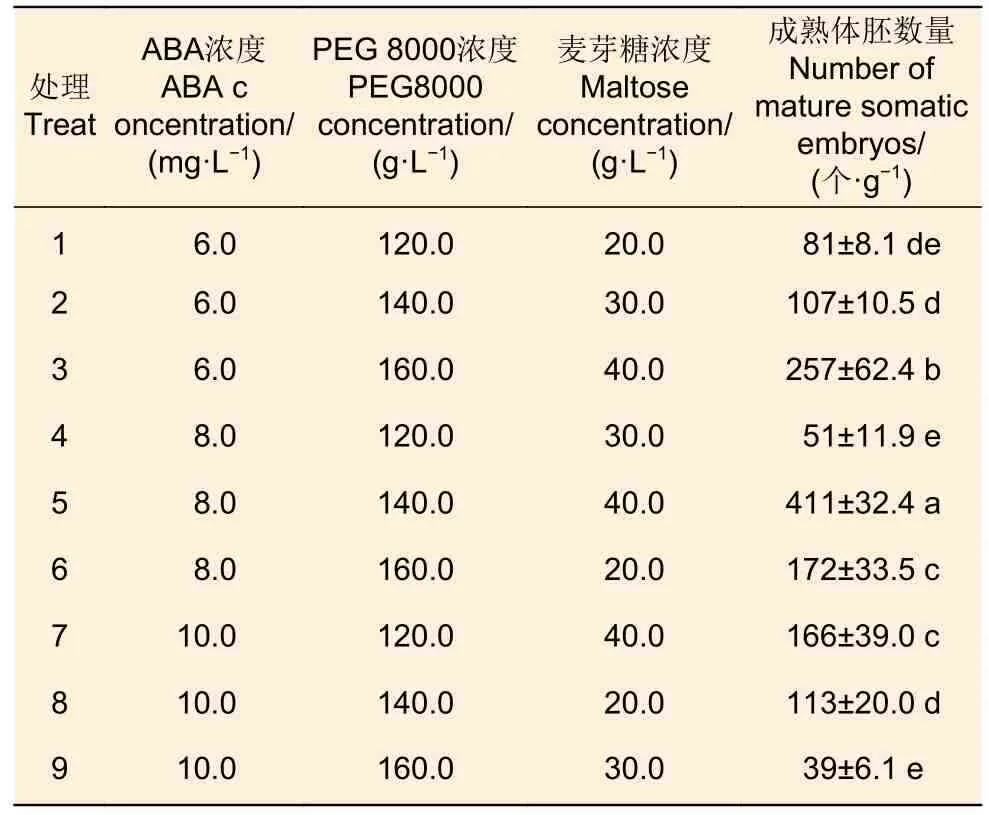
表5 培养基组合对#R52 体胚成熟分化培养的影响Table 5 Effect of medium combination on somatic embryo mature differentiation of #R52
对成熟分化培养的结果进行方差分析,可得ABA 浓度、PEG 8 000 浓度以及麦芽糖浓度均对成熟分化培养的影响很大,且3 个因素影响效果的主次为:麦芽糖>PEG 8 000>ABA。
3.3 萌发与炼苗移栽
将火炬松成熟胚(图1f)置于萌发培养基中萌发,#R52 细胞系在添加3.5 g·L−1活性炭的G1 培养基中体胚萌发率可达93.33%(表6),优于不添加活性炭的G0 培养基。体胚萌发(图1g)后,在瓶装基本培养基中继续培养(图1h)4~6 周后,选择生长旺盛、根系发达的的体胚苗移栽至基质中,做好控温控湿管理,移栽成活率可达86.30%(表6、图1i)。

表6 #R52 体胚的萌发与移栽Table 6 Germination and transplanting on somatic embryos of #R52
4 讨论
4.1 胚性愈伤组织诱导
基因型是影响体胚诱导的重要因素之一,已有研究表明,在体胚发生起始时存在很强的遗传累积效应和母体效应,故在取材时选择优良基因型对体胚成功诱导至关重要[10-11]。不同基因型之间胚性愈伤组织诱导率存在显著差异,Tang 等[12]和MacKay等[13]对火炬松不同家系在相同培养条件下进行胚性愈伤组织诱导,均得出相似的结论。Pullman等[5]对10 个开放授粉的火炬松无性系进行了体胚发生研究,胚性愈伤组织诱导率最高的无性系可达33%,部分无性系诱导困难,不能诱导出胚性愈伤组织。本研究中,火炬松6 个基因型在诱导胚性愈伤组织效率上也存在明显差异,其中,荣山52 和湖南39 两个无性系种子的诱导率均超过50%,荣山52 的无性系种子的诱导率高达63.33%,高于以往的报道[8-13]。在其他针叶树种的研究中,如马尾松(Pinus massonianaLamb.)[14]和云南松(Pinus yunnanensisFranch.)[15],不同基因型之间胚性愈伤组织诱导率也呈显著差异,说明基因型是影响胚性愈伤组织诱导率的关键因子。
研究发现,利用未成熟合子胚为材料更有利于胚性愈伤组织诱导[11,16-17],且大多研究表明,当合子胚发育处于裂生多胚期时其胚性愈伤组织诱导率显著高于其他发育阶段[18-19]。国内外对火炬松球果采样期发现,其最佳采样期在7 月中下旬,该时期合子胚发育阶段大多处于裂生多胚期[3,8],此时胚性愈伤组织诱导率最高。本研究结果与以往研究结果一致。
培养基成分是诱导体胚成功的关键因子之一,包括基本培养基、PGR 及碳源。基本培养基中某些成分(尤其是氮源和一些金属离子)的增加或减少能有效促进胚性愈伤组织诱导与生长[20],Pullman等[21]发现火炬松未成熟种子在改良的1/2 P6 基本培养基上胚性愈伤组织诱导率最高,随后,研究表明在基本培养基1/2 P6 基础上添加一定浓度的MES、生物素和叶酸,可以显著提高胚性愈伤组织的诱导率和生长速度[18]。本研究发现,DCR 培养基是诱导胚性愈伤组织的最佳基本培养基,DCR 培养基中NH4+的含量介于MLP 与MLV 培养基之间,NO3−的含量低于MLP 与MLV,DCR 培养基中NH4+:NO3−约为0.38,MLP 约为0.17,MLV 约为0.44,这说明适当降低氮含量以及调节NH4+与NO3−的比例是诱导胚性愈伤组织的关键因素。在增殖培养与成熟分化培养中,本研究发现,火炬松胚性愈伤组织适合在MLP 中培养,这可能同样和氮素的含量与比例有关。在Pullman 等[5]、Tang 等[12]的研究中也有相似的发现。PGR 是培养基中诱导体胚的决定性因素,火炬松胚性愈伤组织诱导中,使用最多的PGR 组合是2,4-D + 6-BA,2,4-D + 6-BA +KT,NAA + 6-BA + KT 等[8,22-23],且有研究表明向培养基中添加 ABA,火炬松胚性愈伤组织诱导作用增强[5,24]。Pullman 等[24]的研究中,在添加1.1 mg·L−12,4-D + 0.45 mg·L−16-BA + 0.43 mg·L−1KT的培养基中,火炬松诱导率最高可达30.1%。添加1 mg·L−1ABA 可以显著提高诱导率,32 个火炬松半同胞家系的平均诱导率可达17.90%[25]。本研究利用4 种PGR(2,4-D、6-BA、NAA 和ABA)组合显著提升了火炬松胚性愈伤组织诱导效率,诱导率最高可达50%,明显优于以往的研究结果。4 种PGR 中6-BA、NAA、ABA 对胚性愈伤组织诱导的影响是显著的,说明这3 种PGR 在火炬松胚性愈伤组织诱导中发挥着重要作用,而高浓度2,4-D 会导致胚性愈伤组织过甲基化,抑制体胚的成熟,所以在后续的培养中应及时调整,降低2,4-D 的浓度或用NAA 替代。因此,作者认为胚性愈伤组织的诱导率的提高更多的是多种PGR 的联合效应,尤其是6-BA、NAA、ABA,若要进一步提高胚性愈伤组织的诱导率,可在这3 种PGR 浓度的基础上深入开展试验,但3 种PGR 对胚性愈伤组织诱导的联合效应的机制尚不明确,还需要更加深入的研究。
4.2 体胚成熟分化培养
体胚成熟分化培养是体胚发生技术研究中的难点之一,也是限制体胚技术商业化生产应用的重要因素,在体胚诱导过程中,体细胞胚畸形或发育不完全严重影响后期体胚的萌发率[26]。众多研究表明,ABA、PEG 8 000 以及麦芽糖在针叶树种体胚成熟分化培养中发挥着重要作用[13,18,27-29]。
适当浓度的ABA 促进体细胞胚胎的成熟[30],针叶树种中ABA 浓度对体胚成熟分化培养的作用效果差异显著。马尾松[17]在成熟培养基中添加2 mg·L−1ABA,对细胞系体胚的成熟效果较好。20 mg·L−1是红皮云杉(Picea koraiensisNakai)细胞系体胚成熟的ABA 最佳浓度,能获得较高的成熟体胚数量[31],并且畸形率较低。在对火炬松体胚的研究中,众多学者也对ABA 在其体胚成熟的作用展开了研究。Kapik 等[32]对火炬松合子胚的发育过程的ABA 估算研究时,发现火炬松合子胚ABA 浓度的峰值出现在合子胚胚胎发育的早期和晚期。唐巍[33]在对火炬松悬浮细胞进行成熟培养过程中,添加5 mg·L−1ABA,能够观察到裂生多胚以及子叶原基的分化。Pullman 等[6]在火炬松的体胚成熟分化培养的研究中认为,ABA 浓度为9.0 mg·L−1时,获得的成熟体胚的数量较多;而本研究中,火炬松体胚成熟分化培养的最适ABA 浓度为8.0 mg·L−1,稍低于Pullman 的研究结果,说明火炬松不同基因型甚至不同细胞系之间体胚成熟分化培养所需ABA 浓度可能略有差异。
PEG 在培养基中作为渗透剂的作用可能与诱导水分胁迫、脱水耐受性和一些贮藏储备的积累有关,在针叶树种的体细胞胚胎发生研究中也常被用于促进体胚成熟[34-35]。在日本黑松(Pinus thunbergiiParl.)[34]体胚成熟培养的培养基中添加0~150 g·L−1PEG 8 000,3~4 周后可见子叶胚,培养8 周左右体胚基本成熟。李亦轩等[36]在对油松(Pinus tabuliformisCarr.)体胚的成熟培养中亦发现,成熟胚的数量随着PEG4000 浓度(25~100 g·L−1)的增加而增加。Pullman 等[6]的研究中,在成熟分化培养基中添加130 g·L−1PEG 8000,火炬松体胚的成熟度较好,可获得成熟胚150 个·g−1。本研究在添加140 g·L−1PEG 8000 的成熟分化培养基中,获得411 个·g−1成熟胚,成熟分化培养效率得到显著提升。PEG 对体细胞胚胎发生的作用,不仅体现在PEG 种类及浓度的差异上,更多的是PEG 和培养基的其他添加剂对体胚发生产生的组合效应,这也表明体胚成熟过程的生理生化反应及其调控机制是极其复杂的。
糖类物质是体胚发生过程中必不可少的添加剂之一,不仅给体细胞胚胎生存和发育提供营养,还能调控培养基的渗透势[37]。针叶树种体胚成熟培养中常用的糖类多为麦芽糖和蔗糖,糖的浓度也对体胚成熟培养有显著影响。Xia 等[17]发现,马尾松使用麦芽糖进行体胚成熟培养效果较好,且增加麦芽糖的浓度提高了产生体细胞胚胎的能力,但在高浓度(30.0~40.0 g·L−1)之间没有显著差异。Peng 等[38]则认为,蔗糖有利于红松(Pinus koraiensisSieb. et Zucc.)体胚成熟培养,并且蔗糖浓度对红松体胚的成熟有极显著影响,68.5 g·L−1蔗糖可获得成熟胚134 个·g−1。在火炬松中,麦芽糖比蔗糖更能促进火炬松体胚的成熟[6-8],吴丽君[39]在添加蔗糖的成熟培养基中未获得成熟胚,Pullman 等[6]通过添加60 g·L−1麦芽糖,能获得150 个·g−1成熟胚。本研究发现,用40.0 g·L−1麦芽糖效果最佳,且体胚成熟效率较以往研究有显著提升。
在对火炬松体胚的研究中发现,ABA、PEG 8000 以及麦芽糖的浓度均对其体胚成熟分化培养具有极显著影响,其中,麦芽糖浓度的影响最显著。ABA、PEG 和麦芽糖对火炬松体胚成熟分化的影响都不是独立产生作用,也不是简单的累加效应,而是三者联合时共同对火炬松体胚成熟分化产生的促进作用。
5 结论
通过对火炬松体细胞胚胎发生各培养环节进行优化研究,总结出一套技术较为成熟的火炬松体细胞胚胎发生技术体系。火炬松胚性愈伤组织诱导的最佳条件为:以处于裂生多胚期(约7 月20 日左右)的荣山52 无性系的合子胚为最佳起始材料,其胚性愈伤组织诱导率可达63.33%;诱导培养最适PGR 组合是0.5 mg·L−16-BA+ 1.0 mg·L−12,4-D+2.0 mg·L−1NAA+ 5.0 mg·L−1ABA;在成熟分化培养基MLP + 8.0 mg·L−1ABA + 140.0 g·L−1PEG 8000 +40.0 g·L−1麦芽糖 + 7.5 g·L−1卡拉胶中,可获得411个·g−1成熟胚;在添加活性炭的WPM 培养基上,体胚萌发率可达93.33%。
致谢:感谢美国艾博金林木种苗公司(ArborGen Inc.)和南京林业大学陈金慧教授在研究中给予的帮助和指导。
