多囊卵巢综合征合并阻塞性睡眠呼吸暂停临床特征与危险因素分析
2022-05-24宋岩何鑫胡克
宋岩 何鑫 胡克
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄期妇女最常见的内分泌代谢疾病,以月经稀少和高雄激素血症为常见表现。阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是机体在睡眠中因上气道塌陷或阻塞引起呼吸暂停和低通气的一种疾病,临床表现包括睡眠打鼾伴呼吸暂停及日间嗜睡等。多项研究表明,PCOS患者OSA的发病率高于普通女性[1],肥胖型PCOS患者OSA的发病率高于非肥胖型。此外有研究表明,肥胖、高雄激素血症、胰岛素抵抗及其他因素是PCOS女性高发睡眠呼吸障碍的原因[1]。为进一步探讨我国PCOS女性与OSA的相关性及危险因素等特征,我们开展了本研究。
资料与方法
一、研究对象
1 患者一般资料及分组:连续入组2018年11月至2021年7月在武汉大学人民医院妇科或生殖内分泌科、诊断为PCOS的患者共74例,平均年龄25.71±5.05岁。经患者知情同意后进行多导睡眠监测,根据睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)将患者分为单纯PCOS组(AHI<5次/h)和合并OSA组(AHI≥5次/h),后者又分为合并轻度(AHI 5~14.9次/h)和中重度OSA组(AHI≥15次/h)。此外,根据不同体质量指数(body mass index, BMI)将PCOS患者分为超重组(BMI≥24 kg/m2)和常重组(BMI<24 kg/m2)。
2 诊断标准
(1)PCOS:满足2003年荷兰鹿特丹PCOS诊断标准[2]3项中的2项,并排除其他疾病:1)稀发排卵或无排卵;2)临床或生化检查提示高雄激素血症;3)超声提示卵巢多囊性改变:至少一侧卵巢存在≥12个直径2~9mm的小卵泡,和(或)卵巢体积>10 cm3。
(2)OSA:参照中华医学会呼吸病学分会《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011 年修订版)》的诊断和严重程度分级标准[3]:临床有典型的夜间睡眠打鼾伴呼吸暂停、日间嗜睡[Epworth sleepiness scale (ESS) 评分≥9分]等症状,查体可见上气道任何部位的狭窄及阻塞。AHI≥5次/h者可诊断OSA;其中,5≤AHI<15次/h为轻度OSA,AHI≥15次/h为中重度OSA。
(3)超重:参照2002年中国肥胖问题工作组数据汇总分析协作组提出的中国成年人超重和肥胖程度的判断界值,将BMI≥24 kg/m2者定义为超重[4]。
二、研究流程
所有经B超检查考虑PCOS女性于月经周期第2~4d(周期紊乱者随机)采血测定性激素六项,包括卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌激素(estrogen,E2)、孕激素(progesterone,P)、睾酮(testosterone,T)和催乳素(prolactin,PRL)。根据武汉大学人民医院的检验标准,以睾酮(T)≥47.95 ng/dL为存在高雄激素血症,并计算T/E、LH / FSH比值。
符合PCOS诊断标准的患者在签署知情同意书后确定入组。患者入组后,首先接受综合问卷,包括记录人口学资料、病史,测量身高、体重、腰臀围,完善 ESS 嗜睡量表。于入组 3 日内由专业技术人员完成多导睡眠监测,并于睡眠监测的次日凌晨(禁食 10 h)采血测定触珠蛋白、抗 Müllerian 激素(anti-Müllerian hormone,AMH)、空腹血糖、胰岛素和低密度脂蛋白。按公式计算稳态模型胰岛素抵抗指数(HOMA-IR),即 HOMA-IR=[空腹血糖(mmol/L) × 空腹胰岛素(mIU/L)]/22.5。本研究方案得到武汉大学人民医院临床医学伦理委员会(批号:WDRY2021-K0191)的审核同意。
三、统计学方法
符合正态分布且方差齐的连续变量以均数及标准差表示,差异性比较采用两独立样本t检验;不符合正态分布的变量以中位数及四分位数间距表示,差异性检验采用非参数检验;率的比较采用卡方检验。二分类变量与分类变量及连续性变量之间的关系评估采用Logistic回归分析,以ROC曲线计算敏感度和特异度。所有资料以SPSS 23.0软件进行处理。
结 果
一、合并OSA的PCOS患者临床特征
1. OSA检出率:74例PCOS患者中,合并OSA者25例,占33.78%;其中8例合并中重度OSA,占10.81%。
2. 合并OSA的 PCOS 患者临床特征:单纯PCOS组与合并OSA的PCOS患者在年龄、腰围、BMI等指标比较差异无统计学意义(P>0.05);但合并OSA的患者使用性激素类药物比例更低、腰臀比更大,同时,合并中重度OSA患者的年龄、腰围、BMI等指标均高于单纯PCOS患者,差异有统计学意义(P<0.05)(见表1)。
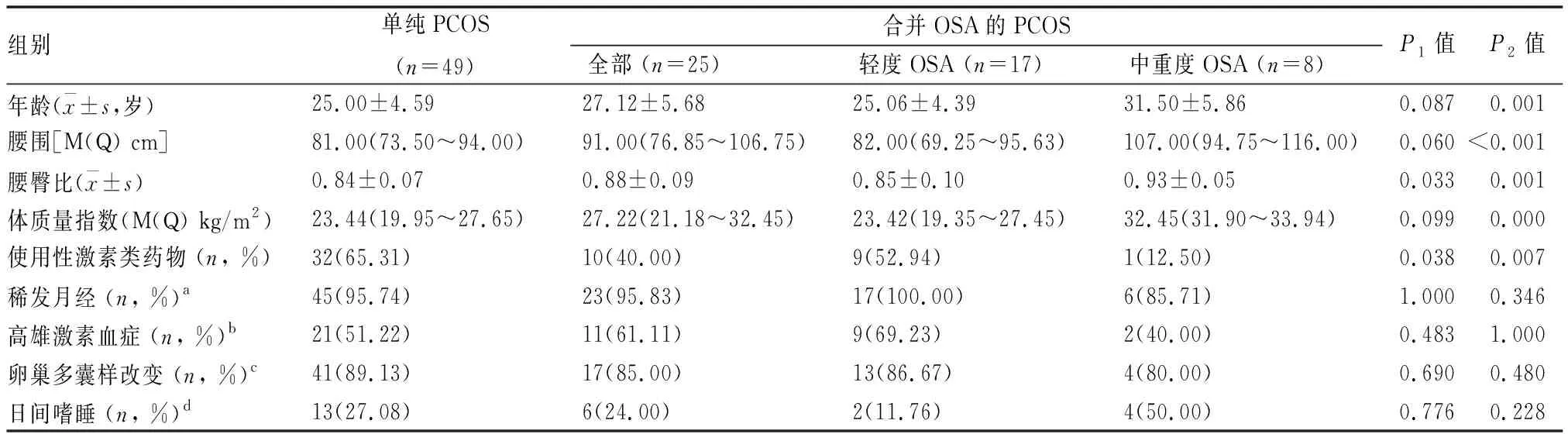
表1 单纯 PCOS患者与合并OSA 的PCOS患者临床特征比较
3. 合并OSA的PCOS患者性激素水平及代谢指标比较:单纯PCOS与合并OSA的PCOS患者卵泡刺激素、黄体生成素、孕激素、睾酮、催乳素、黄体生成素/卵泡刺激素水平比较差异均无统计学意义;但单纯PCOS组雌激素水平高于合并OSA组,包括合并中重度OSA的患者,差异具有统计学意义(P<0.05)。
单纯 PCOS 组与合并 OSA 组各代谢指标水平比较差异无显著性意义,但空腹血糖、低密度脂蛋白水平低于合并中重度 OSA 的 PCOS 患者,差异具有统计学意义(P<0.05)(见表 2)。
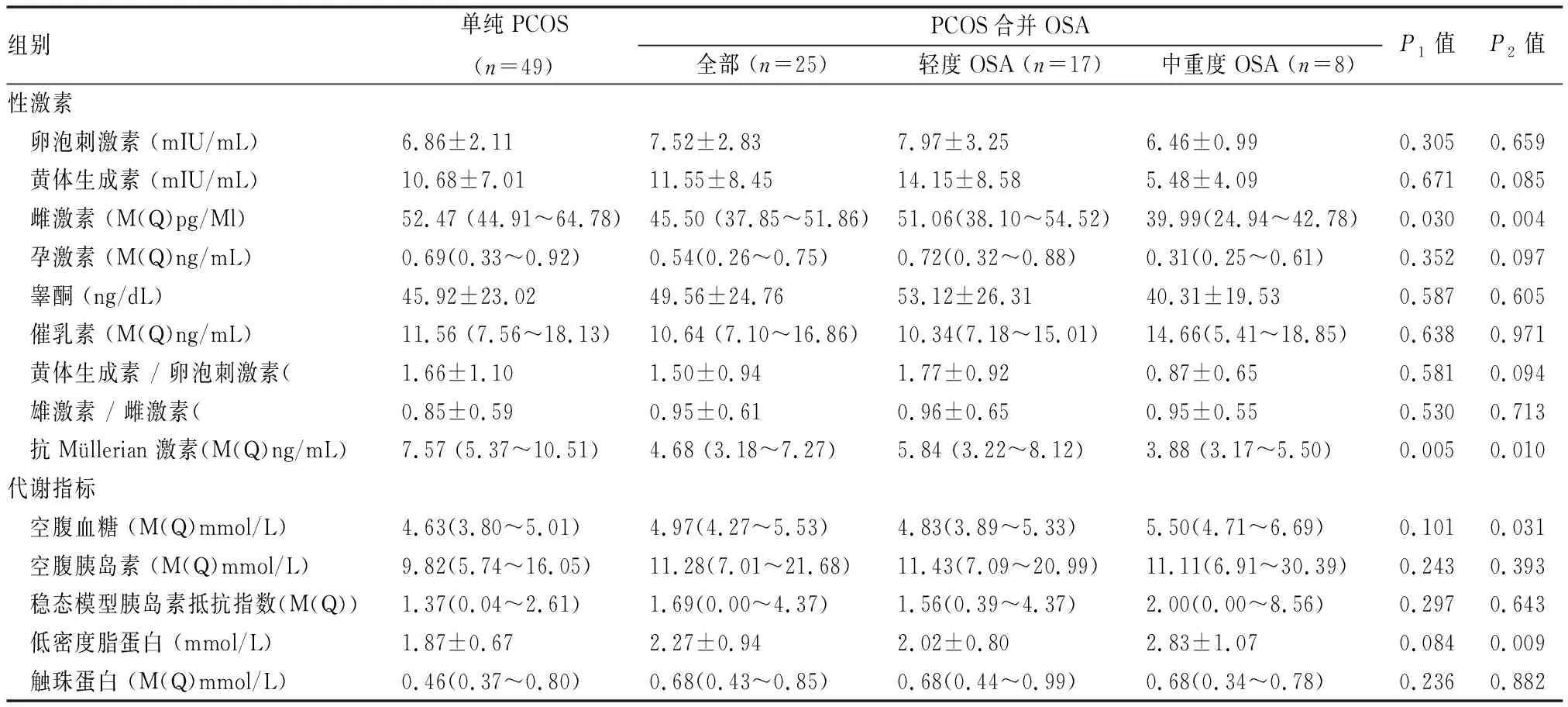
表2 单纯PCOS与合并OSA的PCOS患者性激素水平及代谢指标比较
二、超重PCOS患者合并OSA情况
1. OSA检出率:74例PCOS患者中,超重者共33例,其中合并OSA者15例;常重者41例,合并OSA者10例。2组OSA患病率分别为45.45%、24.39%,差异无显著性(χ2=3.626,P=0.057)。
2. 临床特征比较: 合并OSA的超重PCOS患者与未合并OSA者在年龄、腰臀比、使用性激素类药物等方面比较,差异均有显著性意义(P<0.05)。合并OSA超重PCOS患者的年龄、腰围、腰臀比均高于合并OSA的常重型PCOS患者,差异有统计学意义(见表3)。

表3 不同体质量指数PCOS患者合并OSA情况及临床特征
3. 不同体质量指数合并OSA的PCOS患者性激素及代谢指标水平比较
不同体质量指数合并与未合并OSA的PCOS患者性激素及代谢指标水平比较结果(见表4)。合并OSA超重PCOS组雌激素水平低于未合并OSA者,而空腹胰岛素水平高于合并OSA的常重型PCOS患者,差异有统计学意义。其余指标比较,差异均无显著性意义。
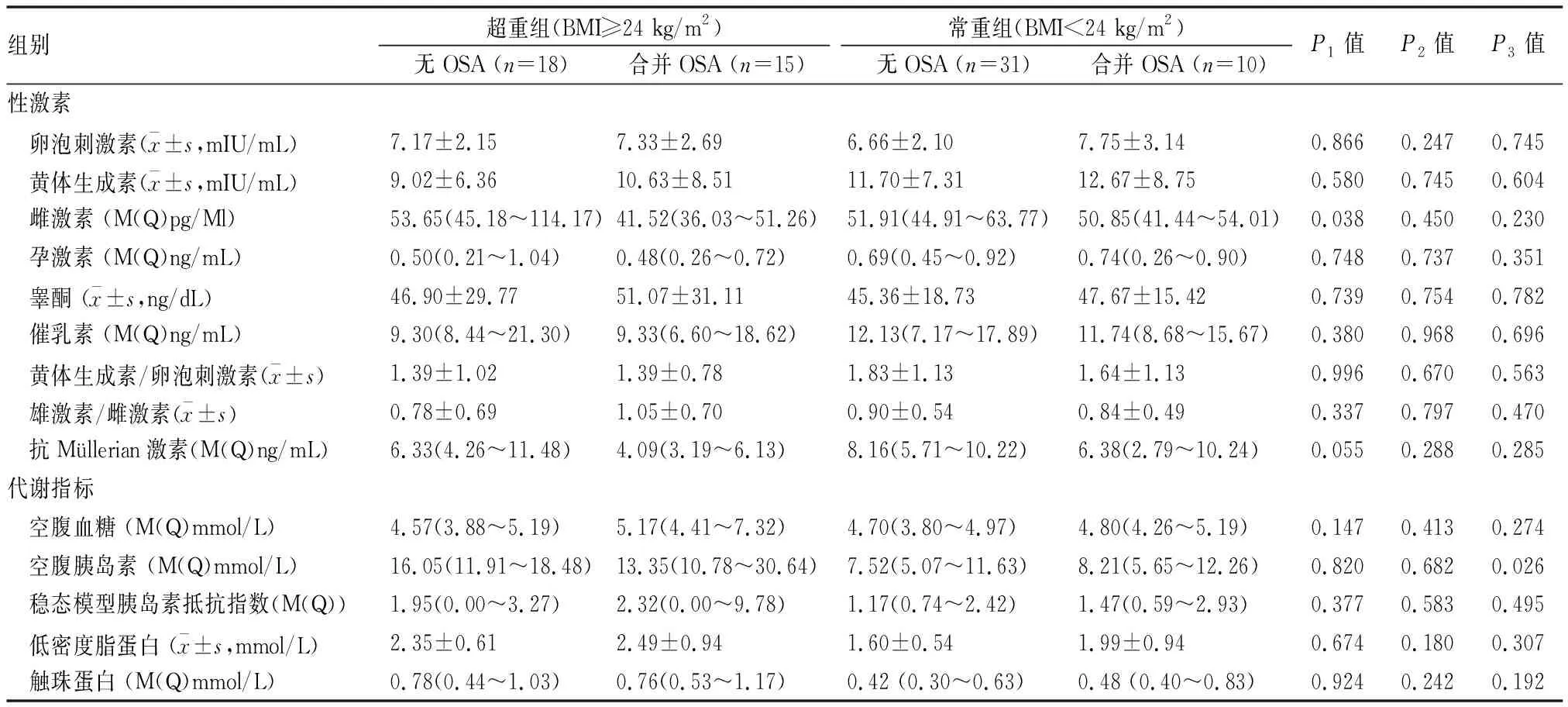
表4 合并与未合并OSA的PCOS患者性激素水平及代谢指标比较
三、合并 OSA 的PCOS患者触珠蛋白及抗Müllerian 激素水平变化
结果见(表2)和(表4)。各组触珠蛋白水平比较差异无显著性。抗Müllerian 激素水平比较方面,单纯PCOS患者[7.57 (5.37~10.51) ng/mL]高于合并OSA的PCOS患者[4.68 (3.18~7.27) ng/mL,P=0.005],也高于合并中重度OSA的PCOS患者[3.88(3.17~5.50)ng/mL,P=0.010];但常重PCOS患者不论是否合并OSA,抗Müllerian 激素水平比较均无差异性。
四、PCOS患者合并OSA的危险因素
根据(表1、2)结果,对上述P<0.05的各因素逐个进行单因素回归分析,发现应用性激素类药物及抗Müllerian激素水平高的PCOS患者合并OSA的风险较低,腰臀比大的PCOS患者合并OSA的风险较高。将上述因素进行多因素Logistic回归分析,结果显示,高水平抗Müllerian激素是PCOS患者患OSA的保护因素(OR=0.847,95%CI0.725~0.988,P=0.035),相应的预测模型为Logit(P)=-0.199×AMH+0.625(见表5)。作ROC曲线评价该预测模型的区分度,曲线下面积为0.703,对应的灵敏度为0.878,特异度为0.500。通过最大约登指数(0.378)得出抗Müllerian激素的界值为4.330 ng/mL(见图1)。根据此界值将抗Müllerian激素转化为二分类变量,进行Logistic回归分析,得出高于此数值患OSA的风险更低(OR=0.140,95%CI0.043~0.450,P=0.001)。
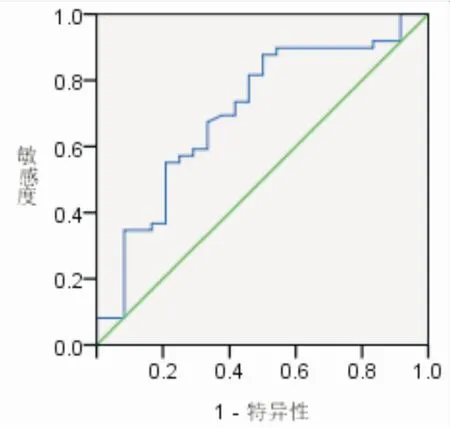
图1 多囊卵巢综合征合并阻塞性睡眠呼吸暂停危险因素预测模型的ROC曲线分析
根据(表3、4)结果,将超重组P<0.05的各因素逐个进行单因素回归分析,发现年龄、腰臀比、未应用性激素类药物是超重PCOS患者发生OSA的危险因素,但不是独立危险因素;上述因素均不是常重PCOS患者发生OSA的危险因素。结果(见表6)。
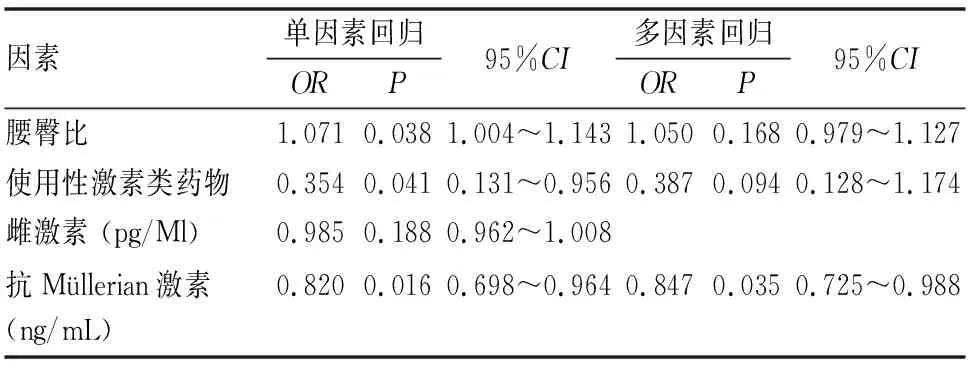
表5 PCOS患者合并OSA 的危险因素
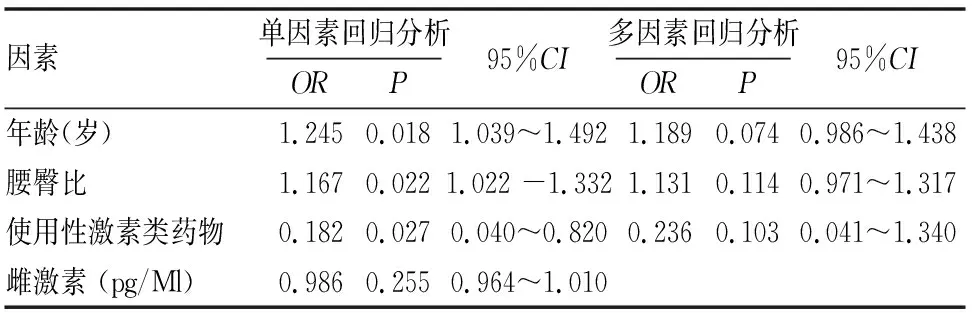
表6 超重组PCOS合并OSA的危险因素
讨 论
本研究探讨了PCOS女性与OSA之间的相关性及危险因素,分析了不同BMI的PCOS患者合并OSA的特点,以及抗Müllerian激素、触珠蛋白水平在PCOS合并OSA患者中的变化。结果发现,与文献报告的非PCOS女性OSA患病率相比[1],PCOS女性患OSA的风险更高,与未合并OSA的PCOS女性相比,合并OSA的PCOS患者腰臀比更高,性激素类药物使用率以及雌激素水平更低,且合并中重度OSA的PCOS患者腰臀比进一步增大、雌激素水平进一步降低,而空腹血糖、低密度脂蛋白水平更高,年龄更大,BMI、腰围更高。超重PCOS女性OSA的患病率为45.45%,高于常重者的24.39%。合并OSA患者(尤其中重度OSA)的PCOS女性的抗Müllerian激素水平明显降低,而各组间触珠蛋白的差异无显著性。
本研究发现,PCOS患者OSA患病率高于普通育龄期女性,这与其他研究结果相一致。一项包括肥胖PCOS女性以及年龄、BMI相匹配对照组肥胖女性的横断面研究结果显示,PCOS女性合并轻、中度OSA(AHI>10、>15次/h)分别为44.44%、5.5%,明显高于对照组[5]。Tasali等发现PCOS女性OSA患病率达56%,明显高于对照组的19%,在调整BMI后这种高风险仍存在;与对照组相比,存在OSA的PCOS女性代谢指标更差[6]。
研究表明,PCOS患者发生OSA的主要危险因素包括年龄、肥胖以及胰岛素抵抗。聚积在上气道周围的脂肪组织增加上气道可塌陷性,中心性肥胖可减少肺容积,对呼吸调控产生负性影响[7-8]。胰岛素抵抗常见于PCOS患者,并增加OSA的发生,尤其是肥胖PCOS女性[9]。存在OSA的PCOS女性可表现较严重胰岛素抵抗状态并增加发生OSA的风险,机制上可能与腹型肥胖有关[10]。在本研究中,合并中重度OSA的PCOS患者年龄、腰围、腰臀比、体质量指数、空腹血糖、低密度脂蛋白水平更高,提示年龄及肥胖,尤其向心性肥胖是合并OSA的危险因素。空腹血糖、低密度脂蛋白水平高也说明合并OSA的PCOS患者有更严重代谢紊乱。但本研究中合并OSA的PCOS患者与单纯PCOS患者相比,并无明显胰岛素抵抗,可能与样本量少有关。
本研究发现,合并OSA的PCOS女性雌激素水平较低,且使用性激素类药物的比例更低。受体内雌激素成分及代谢特点影响,PCOS女性体内的雌激素活性较低[11]。雌激素在控制上呼吸道肌肉活动中起着重要作用。颏舌肌是上气道中最重要的扩张肌,其功能异常易引起上气道塌陷而导致上呼吸道阻塞[12]。因此,PCOS患者低雌激素水平可促进OSA的发生和发展,反之,对PCOS患者使用性激素治疗可降低发生OSA的风险。
约80%PCOS患者的体质量指数值高于正常值,且表现出典型的临床特征,例如雄激素过多、多囊卵巢和胰岛素抵抗。但仍有一部分患者的体重指数正常或偏低,这种情况称为常重型或瘦型PCOS。研究表明,与瘦型PCOS相比,肥胖型PCOS患者有着更严重激素和代谢紊乱[13]。在本研究中,超重PCOS的OSA患病率为45.45%,常重者的患病率为24.39%,二者差异无统计学意义(可能与样本量少有关);然而,常重型患者多囊较少,合并OSA者更少。需要纳入更大样本PCOS患者以进一步分析,尤其是常重型或瘦型PCOS。
抗Müllerian激素是β-转化生长因子超家族的成员,由卵巢颗粒细胞产生,能较好反映卵巢储备功能,同时,由于检测不受月经周期影响,而被广泛应用于临床。2018年发布的PCOS中国诊疗指南首次将抗Müllerian激素升高作为诊断PCOS的实验室指标[14]。触珠蛋白是一种经典的炎症标志物,有认为触珠蛋白可能是PCOS的生物标志物[15]。PCOS较高触珠蛋白水平与炎症和氧化应激状态相关,并随胰岛素抵抗程度而增加[15],肥胖与触珠蛋白水平独立相关[16]。炎症、氧化应激和肥胖在PCOS和OSA的发生发展中均起重要作用,而高胰岛素血症、高雄激素血症和炎症状态在PCOS的病理生理过程中相互作用,形成恶性循环[17]。本研究发现,合并OSA(尤其是中重度OSA)PCOS患者的抗Müllerian激素值更低,且抗Müllerian激素水平高的PCOS患者合并OSA的风险更低,为指导临床应用,本研究构建了预测模型Logit(P)=-0.199×AMH+0.625,该预测模型的ROC曲线下面积为0.703,对应的灵敏度为0.878,特异度为0.500,通过最大约登指数(0.378)得出抗Müllerian激素的界值为4.330 ng/mL,高于此数据患OSA的风险更低(OR=0.140,95%CI0.043~0.450,P=0.001),具体机制待进一步研究。不同组别PCOS患者触珠蛋白水平差异无统计学意义,可能与样本量小有关。
总之,PCOS 患者OSA的患病率较高,大多存在性激素及代谢功能障碍,年龄、肥胖、低雌激素水平、低用药水平、低抗 Müllerian 激素水平是 PCOS 患者合并 OSA 的重要因素,且低水平抗 Müllerian 激素是PCOS患者患有OSA的独立危险因素。当然,需要开展更大样本的深入研究以进一步证实和分析。
