SPP1基因在肺腺癌中的表达及与预后的相关性研究
2022-05-24栾艳超梁超韩青松刘佳坤杨立伟李志峰
栾艳超 梁超 韩青松 刘佳坤 杨立伟 李志峰
肺腺癌作为肺癌最常见亚型,其发病率逐年上升,死亡率高[1],因肺癌早期无特有的临床表现,导致大多患者确诊时已出现局部及远处转移,无法手术治疗[2]。目前,随着生物治疗及免疫治疗的快速发展和广泛应用,打破了肺癌以微创外科手术、放、化疗为主的传统治疗方式,进而使得肺癌患者的生存期逐渐延长[3];而早期肺腺癌患者如及时手术治疗,可极大降低术后复发率及死亡率[4]。为此,我们亟需寻求可靠的用于早期诊断以及治疗的靶标分子。研究发现,在肝癌细胞、乳房癌、胃癌中均检测到SPP1异常高表达与临床分期及预后有关[5-6]。本研究将生物信息学与分子生物学相结合,探讨SPP1在肺腺癌中的表达及其与临床表现及预后的关系; 旨在临床上为LUAD诊治及预后提供新的参考。
资料与方法
一、标本来源
本研究选取138例肺腺癌患者癌组织和癌旁组织标本,所有患者均于2014年12月至2015年12月期间我院行肺腺癌手术切除。入组标准:男性54.3%(75/138)例,女性45.7%(63/138)例,年龄35岁至88岁之间,根据国际第八版肺癌TNM 分期标准,将患者分为Ⅰ+Ⅱ期83例,Ⅲ+Ⅳ期55例(T1/2期101例、T3/4期37例,N0 期68例,N1/2 期70例,M0 期133例、M1期5例),病理分级Ⅰ/Ⅱ 级82例、Ⅲ级56例,患者术前均未给予放、化疗及其他生物治疗,截止随访2019年12月,并已获我院伦理委员会批准(编号:2021071)。通过门诊复查、电话回访等方式随访,记录病情、病史询问、肿瘤标志物检验、胸部CT等检查,术后复发及死亡时间。
二、材料
基因扩增仪Eppendorf,荧光定量PCR仪:Mx3000p,RT Fiest Strand cDNA Synthesis Kit(Servicebio,G3330-100),2 X SYBR Green qPCR Master Mix(low Rox),Servicebio,G3321-01;引物购自上海生工生物。SP试剂盒(上海科欣生物); DAB试剂盒(河北博海生物);一抗:SPP1多克隆抗体(河北博海生物),浓度1 ∶200;生物素化通用二抗工作液;苏木素染料(上海恒远生物);辣根酶标记链酶卵白素工作液(苏州宇恒生物)等。
三、利用UALCAN数据库分析SPP1表达与临床关系
通过UALCAN数据库(http://ualcan.path.uab.edu/index.html)行 TCGA Gene Analysis,检索SPP1,选择肺腺癌,检出结果中运用泛癌表达分析(pan-cancer view)[7]。通过基于TCGA(The Cancer Genome Atlas)所搭建的数据可视化平台UALCAN,在UALCAN 数据库中进行TCGA 及CPTAC(Clinical Proteomic Tumor Analysis Consortium)数据集中检索SPP1,于数据库选项中选择肺腺癌。分别对年龄、性别、TNM 分期、淋巴结转移等临床特征分组及预后情况进行分析。
四、运用GEPIA、KM Plotter数据库研究SPP1表达与预后关系
利用GEPIA 数据库(Gene Expression Profiling Interactive Analysis)进行SPP1的表达与肺腺癌患者生存关系的分析。GEPIA数据库是用于分析来自TCGA (The Cancer Genome Atlas)和GTEx (Genotype-Tissue Expression)项目的RNA测序表达数据[8]。通过分析KM Plotter数据库中SPP1肺腺癌样本表达,使用Survival选项,绘制样本表达与生存时间关系的Kaplan-Meier曲线,包括总生存率(overall survival,OS)[9]。
五、RT-qPCR检测SPP1表达
通过TRIzol法提取细胞总RNA,分光光度计测定RNA浓度和纯度。按逆转录试剂盒说明书将RNA合成cDNA,采用PrimeScript RT Enzyme Mix I进行RT反应。反应条件:1个循环的95℃、5 min;40个循环的95℃、10s 和60℃、30s,以GAPDH为内参.通过2-ΔΔCt方法表达SPP1相对表达量。获得SPP1基因扩增和溶解曲线(图1)。
图1 SPP1基因扩增曲线图(左)和溶解曲线图(右)
六、Western blotting检测SPP1蛋白表达
加入蛋白裂解液分离总蛋白, BCA法定量蛋白;经变性后行SDS-PAGE电泳,250mA恒定电流,转膜90min;PVDF膜用5%脱脂奶粉封闭1h,一抗(稀释度为1 ∶1000),4℃孵育过夜;经TBST漂洗10min,重复3次;浸入二抗工作液(稀释度为1 ∶5000),37 ℃孵育1 h,再次TBST漂洗;滴入ECL化学发光试剂,行ECL检测并拍照; 采用Image J 分析条带灰度值。
七、免疫组织化学
石蜡切片、脱蜡、水化、抗原修复、渗透、封闭等操作后,给予一抗(SPPI抗体1 ∶200)过夜,给予生物素化通用二抗工作液;,加入辣根酶标记链酶卵白素工作液DAB染色,苏木素复染,脱水封片。镜下拍摄, Image-J软件分析,棕色、褐色、黄色颗粒为(+),无染色为(-),随机选取5个视野,计算平均吸光度。
八、统计分析
采用SPSS 23进行统计分析,以Graphpad Prism9.0作图,运用Image J分析免疫组织化学染色结果。采用Kaplan-Meier和Cox回归进行生存分析,采用t检验进行两组定量资料的比较,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
一、SPP1在肺腺癌组织中高表达
我们前期利用UALCAN数据库全面分析SPP1在人类常见恶性肿瘤中的表达,分析发现包括肺腺癌在内的多种恶性肿瘤组织中SPP1 mRNA表达明显高于癌旁组织,并且可能发挥致癌基因的作用(图2)。通过挖掘GEPIA数据库和TCGA数据库同样验证SPP1在肺腺癌组织中表达显著高于肺正常组织(图3,P<0.001)。
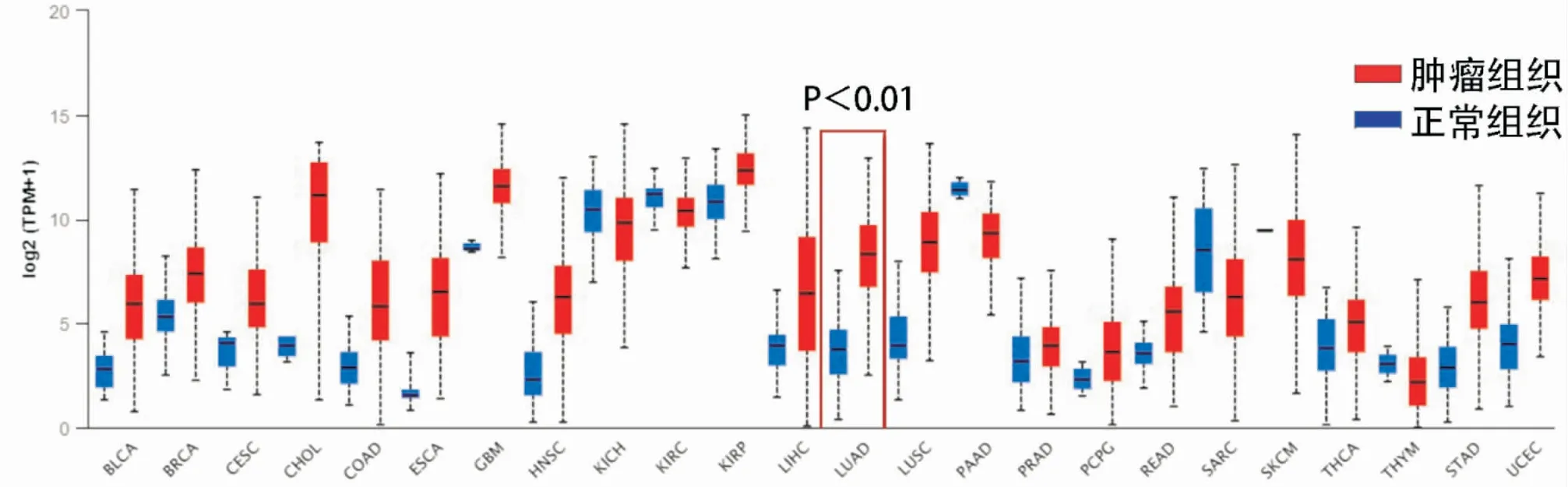
图2 不同肿瘤组织中SPP1的表达水平
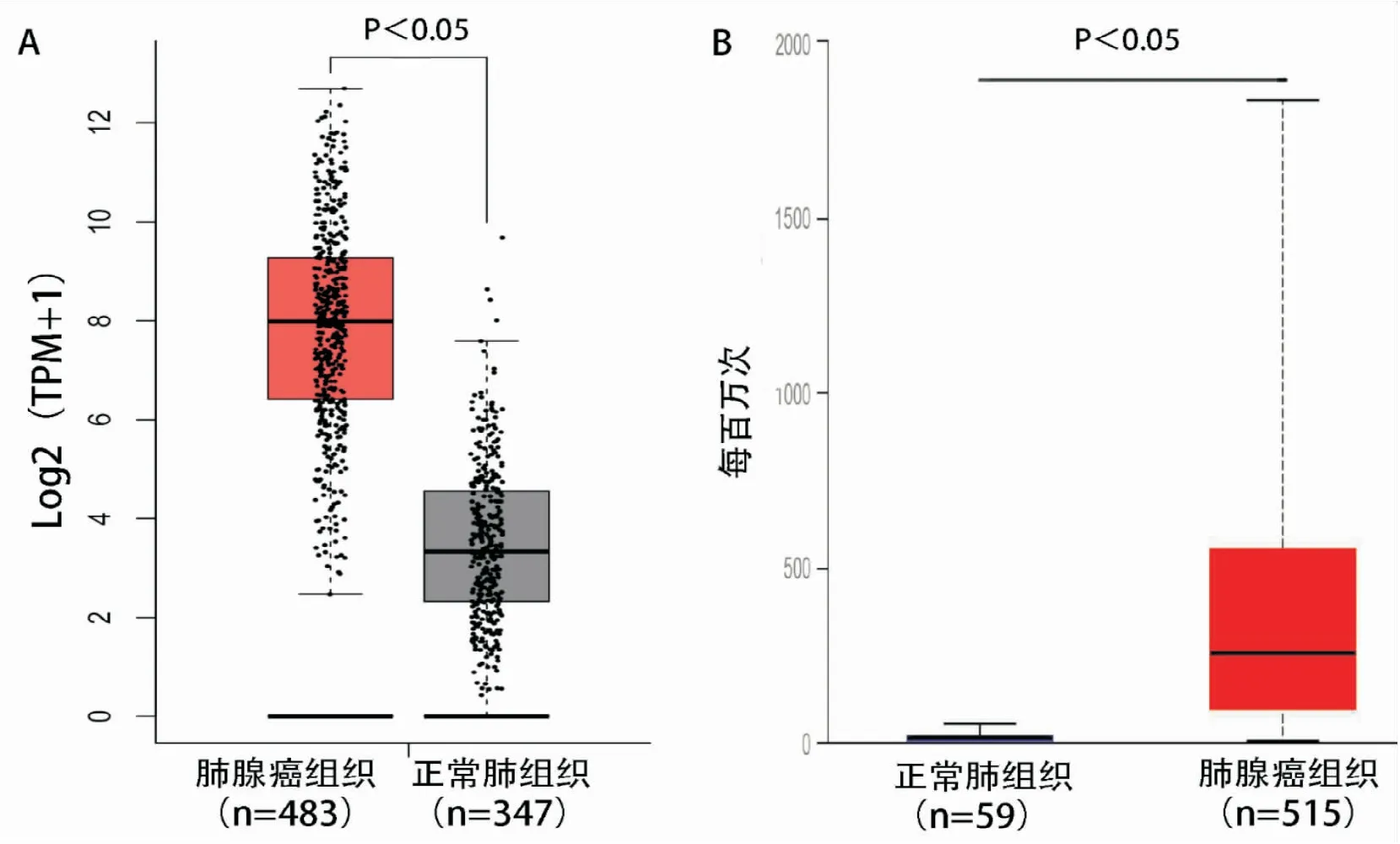
图3 SPP1在肺腺癌与正常组织表达差异 A: GEPIA; B: UALCAN
二、GEPIA数据库分析LUAD中SPP1 mRNA表达与预后关系
为了深入分析SPP1表达与LUAD患者预后关系,我们首先通过GEPIA数据库分析SPP1 mRNA表达与LUAD患者预后的关系,发现 SPP1 mRNA高表达与更差的OS(P=0.016,图4A)显著相关,初步提示SPP1 mRNA高表达与预后不良有关。鉴于GEPIA中LUAD患者病例数有限,我们利用Kaplan -Meier Plotter数据库对SPP1 mRNA表达与预后关系的进行了验证,同样发现SPP1 mRNA高表达的LUAD患者,其OS明显缩短(P=5.2e-06,图4B),进一步证实SPP1 mRNA高表达与不良预后密切相关。
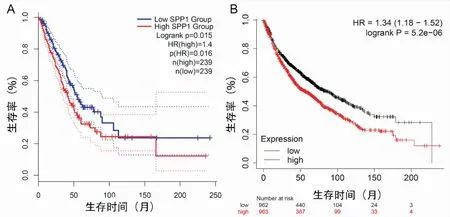
图4 GEPIA和K-M数据库检测SPP1的表达对患者生存率的影响 A: GEPIA; B: K-M
三、UALCAN数据库分析LUAD中SPP1表达与临床特征关系
接下来,利用UALCAN数据库分析了LUAD (515例)中SPP1的表达与临床特征的关系,发现SPP1 mRNA的表达与LUAD患者的N分期(P<0.001,图5D)显著相关,且随着N分期的增高SPP1的表达水平有着上升的趋势,与TNM分期、年龄、性别无显著相关性。利用CPTAC数据库进一步分析SPP1蛋白表达与临床特征的关系,结果显示,SPP1蛋白表达在肺腺癌中显著升高,且与LUAD患者的TNM分期(P<0.001,图6B)、N分期(P<0.001,图6D)显著相关,且随着TNM分期、N分期的增高 SPP1的表达水平有着上升的趋势,但与年龄、性别无显著相关性。
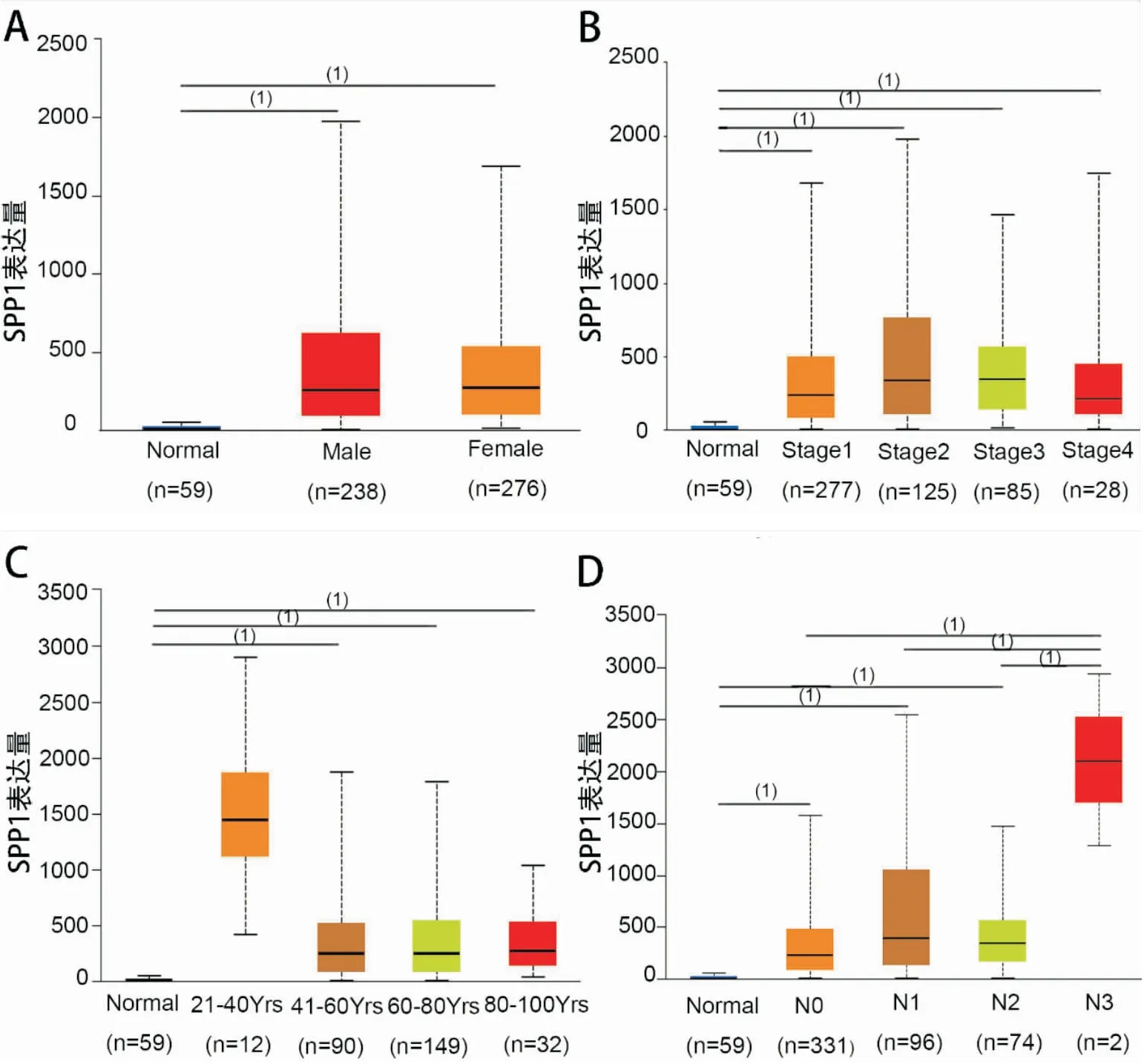
图5 UALCAN数据库中SPP1 mRNA 与临床特征关系 (1)P<0.001
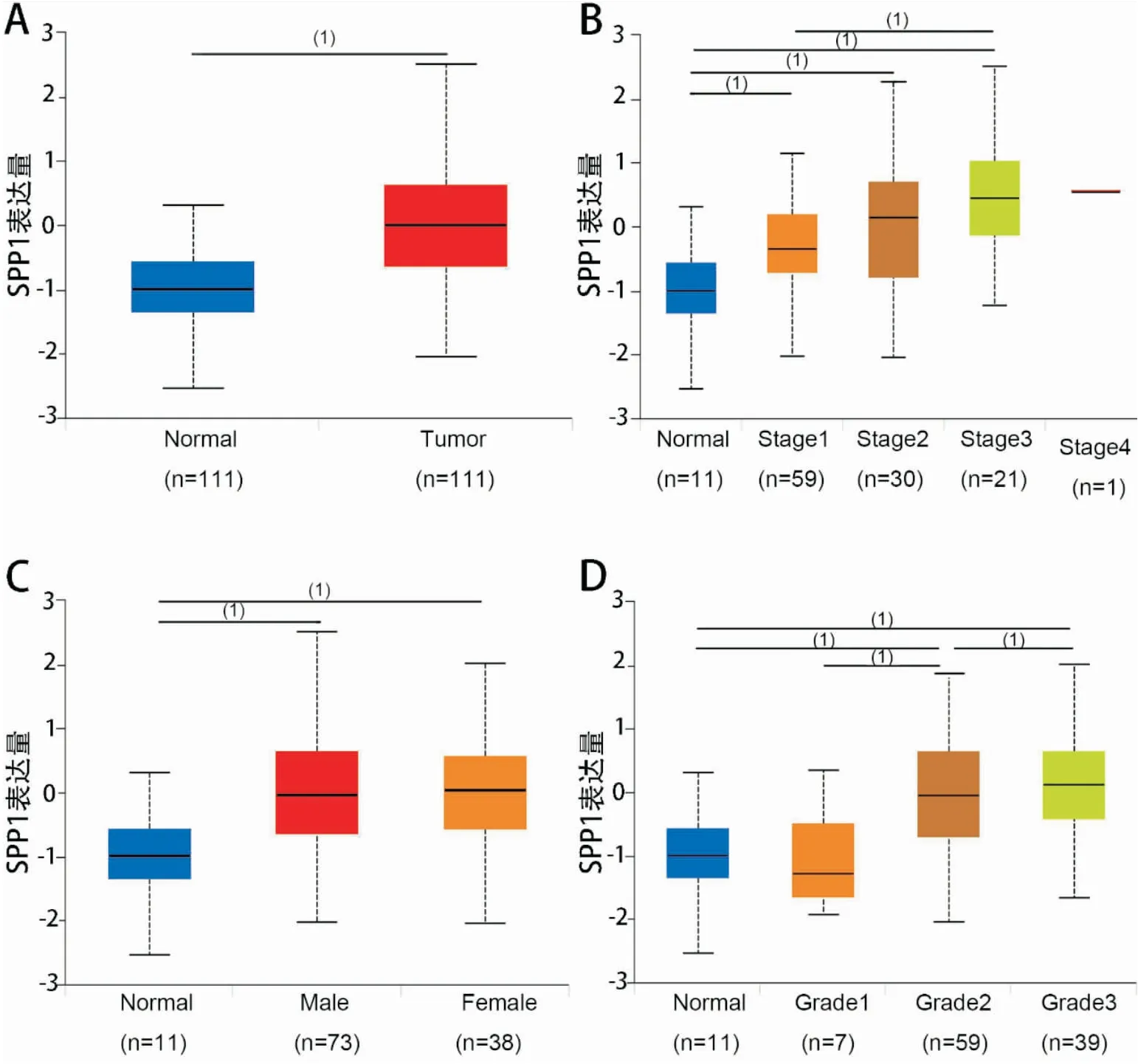
图6 CPTAC 数据库中SPP1 蛋白表达与临床特征关系 (1)P<0.001
四、肺腺癌组织中SPP1高表达
我们为了进一步验证肺腺癌组织中SPP1的表达情况,采用(RT-qPCR)检测肺腺癌组织和对应癌旁组织,结果显示,癌组织中SPP1 mRNA表达水平显著高于对应癌旁组织,(n=39,P<0.001,图7A)。然后采用western blot检测10例肺腺癌组织和对应癌旁组织,结果显示,肺腺癌组织中SPP1蛋白表达显著上调(P<0.0149,图7B、C)。运用免疫组化检测138例肺腺癌石蜡切片中SPP1蛋白表达情况,结果显示,SPP1蛋白在LUAD组织中表达显著上调(P<0.001,图8A),SPP1定位于胞浆或核,(图8C)。为了排除不同患者之间个体差异的影响,进一步分析69例配对肺腺癌组织与正常肺组织的免疫组化结果,同样显示肺腺癌组织中SPP1蛋白显著高表达(P<0.001,图8B)。
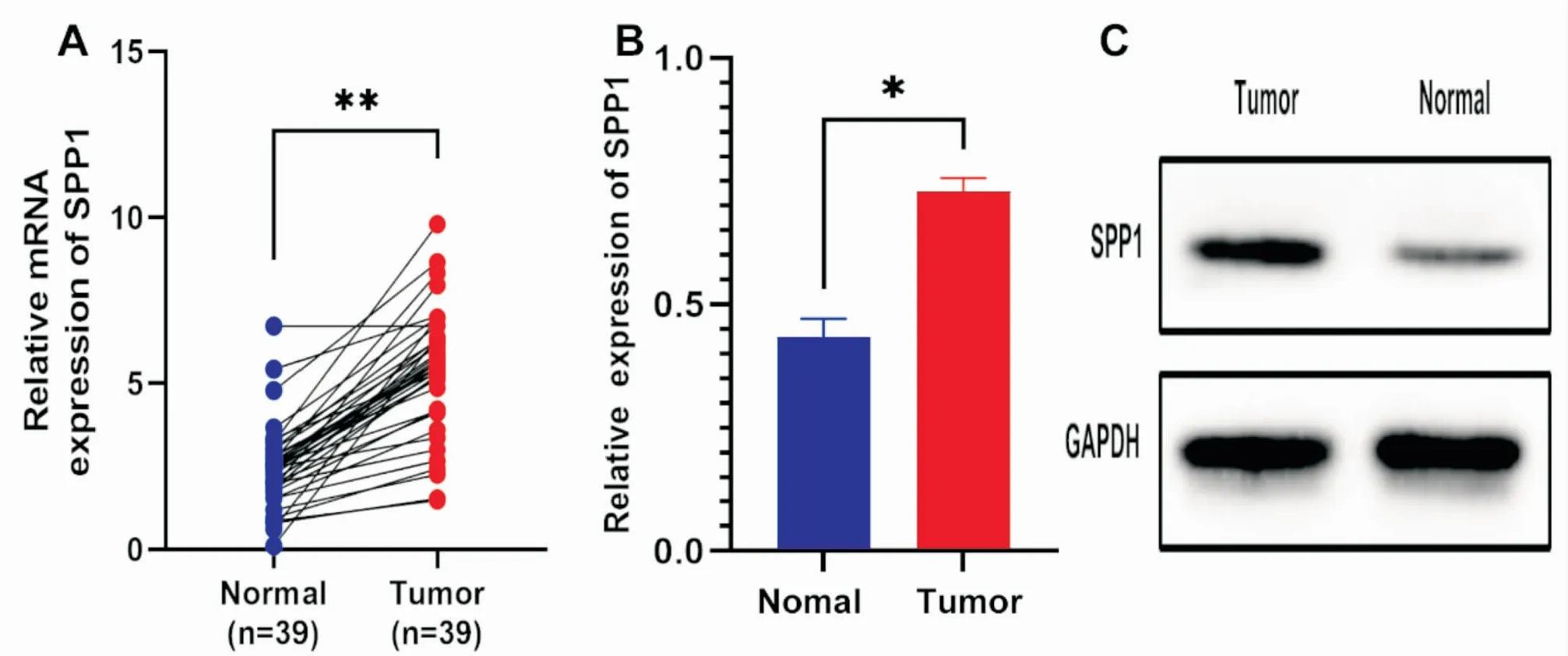
图7 肺腺癌和正常肺组织中SPP1表达
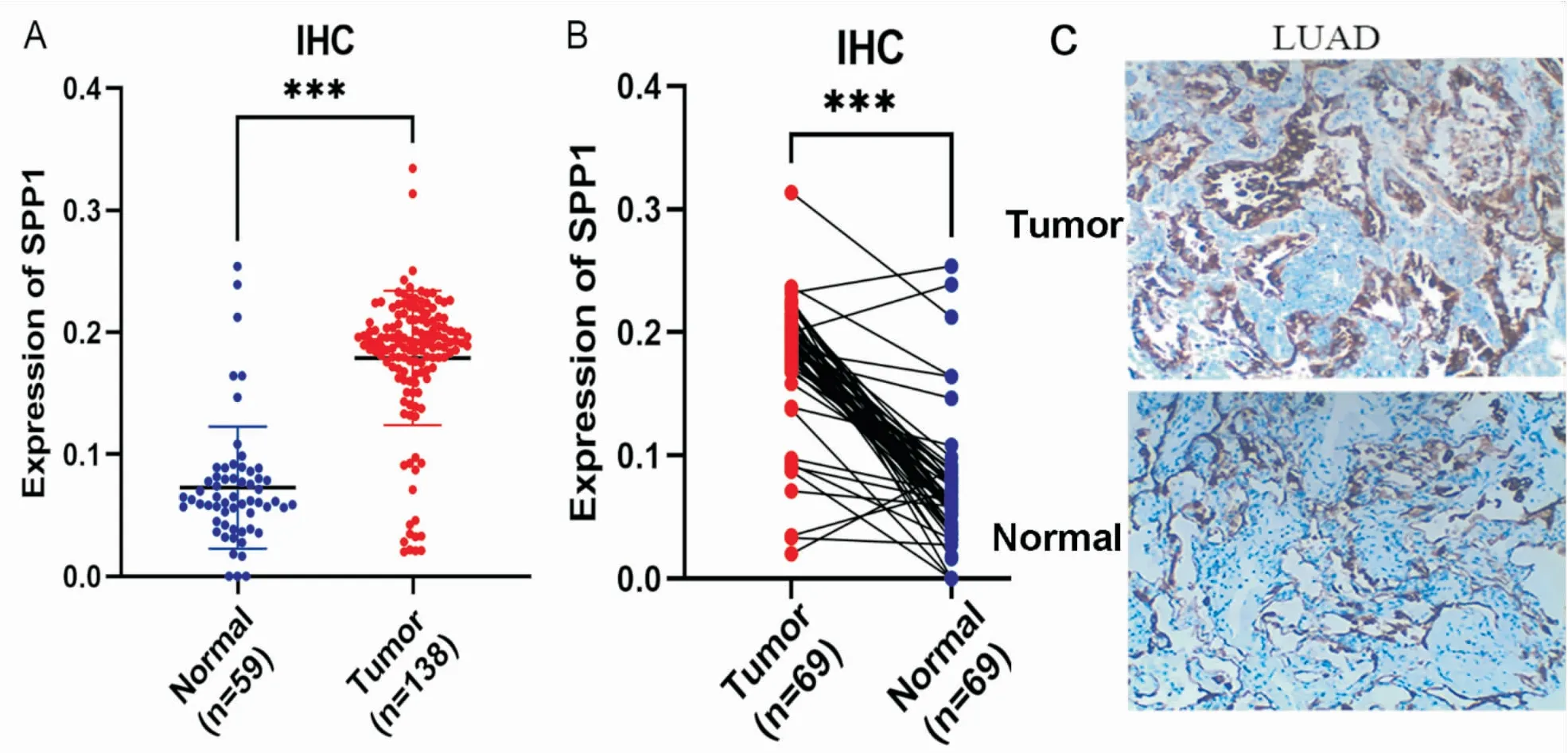
图8 免疫组化检测SPP1蛋白在肺腺癌组织和正常肺组织中的表达
五、肺腺癌组织中SPP1表达与临床数据的相关分析
我们又对SPP1蛋白表达与肺腺癌患者临床数据进行分析,以免疫组化评分中位数分为SPP1高表达组(n=69)和低表达组(n=69),结果显示在T3/4组(P=0.003)、淋巴结转移组(P=0.041)、Ⅲ/Ⅳ期(P=0.023)与死亡(P=0.003)组患者的肿瘤组织中SPP1蛋白表达显著上调(表1)。SPP1蛋白表达与肿瘤远处转移未见明显统计学意义,考虑入组数较少(n=5)有关。
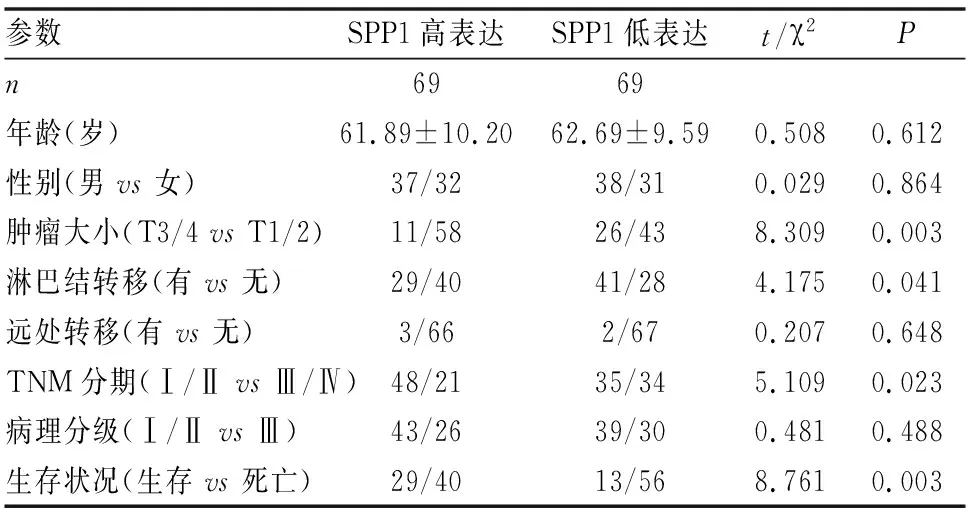
表1 肺腺癌中SPP1蛋白表达和临床病理参数关系
六、肺腺癌组织中SPP1表达与患者预后
最后我们通过免疫组化结果,分析SPP1蛋白表达对患者总体生存时间(OS)的影响,统计分析发现,高表达组中位生存时30个月,而低表达组中位生存时间52个月。K-M生存曲线表明,肺腺癌患者中SPP1高表达组OS显著降低(P=0.0017,图9)。为了进一步分析SPP1蛋白高表达与患者预后影响因素,我们通过单因素Cox分析显示LUAD患者预后的影响因素为SPP1蛋白表达(P<0.001)、TNM分期(P<0.001)和M分期(P<0.001)。多因素Cox分析显示LUAD患者预后独立影响因素为SPP1蛋白表达(P<0.001)、TNM分期(P=0.034)和M分期(P=0.001)(表2)。
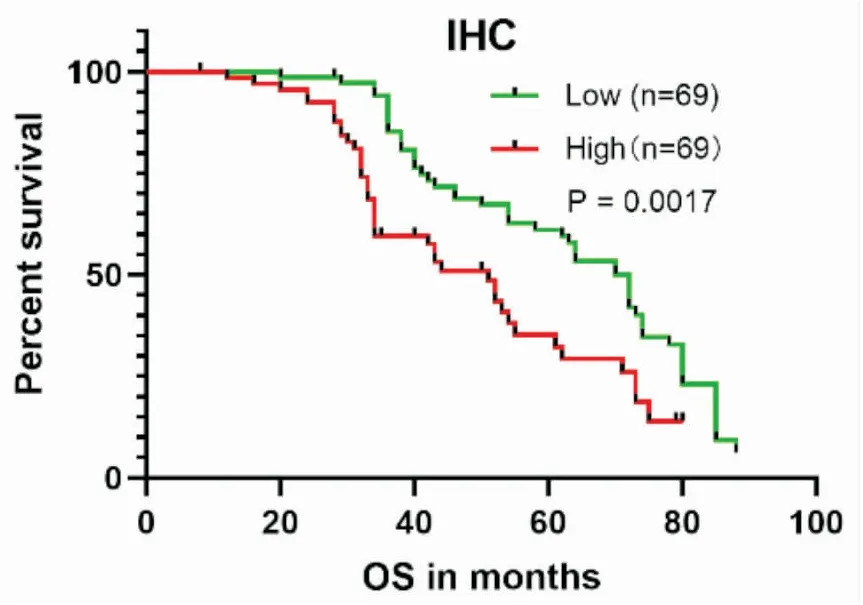
图9 SPP1蛋白高表达与肺腺癌不良预后相关
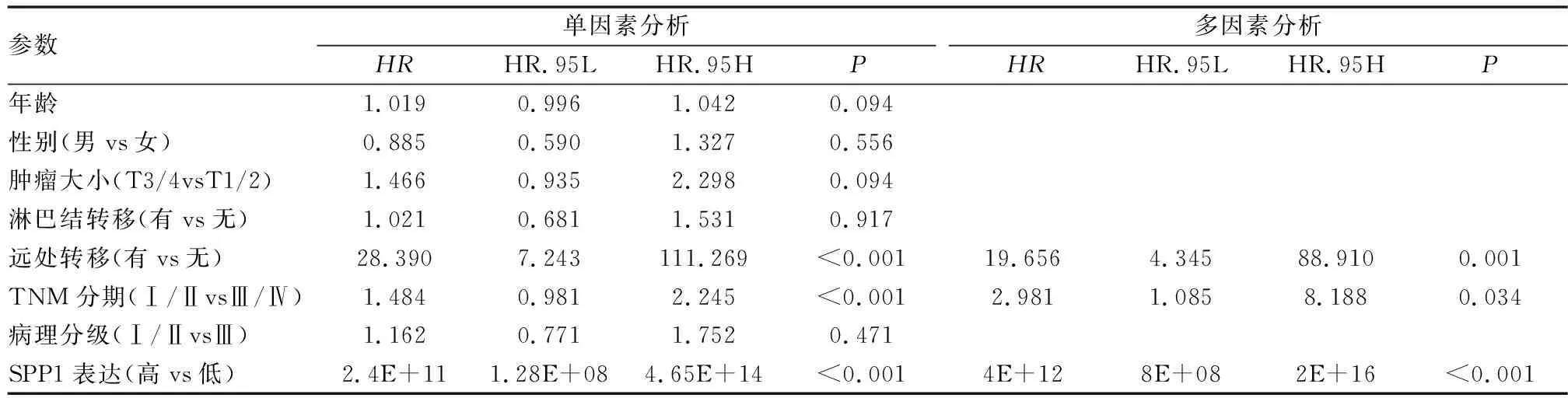
表2 138例的肺腺癌患者总体生存期单因素与多因素Cox 回归分析
讨 论
肺腺癌因其局部侵袭、远处转移及耐药等诸多原因,导致肺癌的治疗效果仍不理想[10]。2019年美国有22.8万人被诊断为肺癌,而死亡人数约16万人[11],数据表明,肺癌具有发病率高、死亡率高、预后差的特性,因此,探明肺癌发生、侵袭及转移的机制仍然是目前肺癌研究的重点及难点[12]。如今随着生物信息学、分子生物学、免疫学等诸多技术突破,分子靶向治疗、免疫抑制剂治疗的手段已广泛应用于临床,但仍未明显降低肺癌患者的死亡率[13]。
SPP1基因是一种分泌型磷酸化糖蛋白,在多种肿瘤中高表达[14]。它属于小整合素结合配体N型糖蛋白(SIBLING)家族,其在淋巴细胞、内皮细胞、骨细胞及多种恶性肿瘤细胞中高表达[15]。并且分为两个功能序列,分别为N端RGD序列以及C端非RGD序列。在肿瘤组织中,细胞外基质被各种通路分泌的uPA、MMP等影响,进而对肿瘤的侵袭和迁移影响;C端非RGD结合CD44,促进信号通路激活[16],进而可以导致免疫逃逸[17]。近年越来越多研究报道,SPP1参与多种恶性肿瘤的发生过程,如肝癌、胰腺癌、甲状腺癌、乳腺癌的生长,侵袭和转移[18]。SPP1促进肝癌细胞增长并与肺腺癌的不良预后有关,且SPP1可促进肝癌的增殖和侵袭[19]。研究发现宫颈癌细胞和组织中SPPI表达上调,下调SPPI抑制HeLa细胞的生长,并可诱导宫颈癌细胞凋亡[20]。
但SPPI在肺腺癌的相关研究未见报道,我们前期利用UALCAN数据库全面分析SPP1在人类常见恶性肿瘤中的表达,分析显示多种恶性肿瘤组织中SPP1 mRNA表达显著高于癌旁组织,进一步挖掘GEPIA数据库和TCGA数据库同样验证在肺腺癌组织中SPP1表达显著高于肺正常组织。为了深入了解SPP1的表达与患者预后之间的关系,我们通过GEPIA数据库挖掘SPP1 mRNA表达与肺腺癌患者预后关系,发现SPP1 mRNA高表达与更差的OS显著相关,鉴于GEPIA中LUAD患者病例数有限,我们又对Kaplan-Meier Plotter数据库中SPP1 mRNA表达与预后关系的进行验证,得到相似结果,从而进一步证实SPP1 mRNA高表达与肺腺癌患者不良预后密切相关。
为了验证数据库分析结果,我们从分子水平分析SPP1的表达情况,采用qPCR、western blot 和免疫组化方法检测SPP1的表达水平。结果表明,在mRNA转录水平和蛋白表达水平,均显示肺腺癌中SPP1表达上调。以上分析表明在肺腺癌中SPP1可能起到致癌作用。又对临床资料分析可见, SPP1表达与临床分期、肿瘤大小、淋巴结转移和生存状况显著相关。因多数发生肿瘤远处转移患者已无法通过手术治疗,导致远处转移病例数偏少,可能导致研究结果与实际产生偏倚。本研究收集138例肺腺癌组织标本进行免疫组化检测,进而从蛋白水平探讨SPP1在LUAD中的表达与预后的关系,发现SPP1蛋白高表达与LUAD患者的OS缩短密切相关,此结果与GEPIA数据库分析结果一致。Cox单因素和多因素回归分析表明, SPP1蛋白表达、临床分期和远处转移是影响患者预后的独立危险因素。
以上实验结果提示, SPP1在肺腺癌组织中呈高表达并可在一定程度上预测肺腺癌患者的不良预后。以上结果为肺腺癌患者在早期诊治、临床预后等多领域提供重要参考。但本研究仅从分子、蛋白水平对肺腺癌患者SPP1表达与预后分析,因而SPP1的表达与肿瘤的分子机制的研究将作为我们的后续研究方向。
