中药抗阿尔茨海默病的作用及其机制研究进展
2022-05-24田文国王春芳陈金鹏盖晓红田成旺
田文国,王春芳,陈金鹏,刘 毅,盖晓红,任 涛,田成旺*
中药抗阿尔茨海默病的作用及其机制研究进展
田文国1, 2,王春芳1, 2,陈金鹏2, 3, 4,刘 毅2, 3, 4,盖晓红2, 3, 4,任 涛2, 3, 4,田成旺2, 3, 4*
1.天津中医药大学,天津 301617 2.天津药物研究院,天津 300462 3.天津市中药质量标志物重点实验室,天津 300462 4.释药技术与药代动力学国家重点实验室,天津 300462
阿尔茨海默病是目前威胁老年人健康与生存的主要疾病之一。随着中国人口老龄化逐渐加深,其发病率和死亡率也在逐年升高。阿尔茨海默病发病机制的病理过程十分复杂,多种机制参与其中,而中药具有多成分、多途径、多靶点的作用特点,对于具有复杂病理机制的阿尔茨海默病具有独特的治疗优势和潜力。以中药防治阿尔茨海默病为切入点,对近年来单味中药及其有效部位、有效成分和中药复方抗阿尔茨海默病作用机制的相关研究进展进行综述,以期为中药治疗阿尔茨海默病提供理论依据。
阿尔茨海默病;远志皂苷;人参皂苷;钩藤碱;丹参酮IIA;五味子乙素;作用机制
阿尔茨海默病(Alzheimer’s disease,AD)是以认知功能障碍和记忆损害为特征的原发性中枢神经系统疾病,患者主要集中在中老年期,临床上多表现为记忆减退、语言障碍、定位障碍、情绪失控及行为失调等,以致患者生活无法自理,甚至会危及生命[1]。目前对AD的发病机制存在多种学说,研究主要指向其与自由基损伤、神经细胞凋亡、神经递质紊乱、β-淀粉样蛋白(β-amyloid,Aβ)沉积、Tau蛋白磷酸化等有关,病理特征主要表现为脑内神经炎症、特定脑区域神经元和突触丢失、大脑皮层含有大量的老年斑及神经原纤维缠结[2]。在中国古代医籍中类似AD的描述常见于呆证、健忘、语言错乱等病症[3],中医辨证论治常将其与心、肝、脾、肾相联系,认为气血亏虚,则神明失养;瘀血阻窍,则脑脉痹阻;痰浊上蒙,则清窍被阻;肾精不足,则髓海失养[4]。
目前临床上治疗AD的药物主要为中枢胆碱酯酶抑制剂如卡巴拉汀、加兰他敏、多奈哌齐、石杉碱甲和-甲基--天门冬氨酸受体拮抗药如美金刚[5]。但随着AD病情的加重,能释放乙酰胆碱的神经元会越来越少,所以目前这些药物并不能逆转AD的病情进展,在临床上的应用具有一定的局限性。而现代药理研究表明,中药药效物质可通过抑制神经元凋亡、减少Aβ生成、抑制Tau蛋白过度磷酸化、降低神经炎症反应、抗氧化应激、调节神经递质、改善线粒体功能、改善血脑屏障的通透性、调节胰岛素信号通路、调节肠道菌群等多途径干预AD发病进程,不良反应少,近年来在防治AD中起到了越来越重要的作用。
单味中药是传统中药方剂的基本组成单位,有效部位可以视为一个小复方,体现了中药多成分、多靶点、多途径的药效特点,有效成分则体现了药物发挥作用的最基础物质,而中药复方是中医临床用药的主要形式。所以本文以中药抗AD的作用机制为切入点,综述了近年来单味中药及其有效部位、有效成分和中药复方抗AD作用机制的相关研究进展,以期为中药治疗AD提供理论依据。
1 单味中药及其有效部位
单味中药是传统中药方剂的最基本组成单位,有效部位则可以视为一个小复方,它既能体现中药多成分、多靶点、多途径发挥药效的特点,又能使药物有效成分更加富集,从而增强疗效。在治疗AD的中药中,安神类、补虚类、平肝息风类、清热类、活血化瘀类、收涩类已有研究文献报道[4],如远志、人参、钩藤、栀子、丹参、五味子等,现代药理研究发现这些单味中药及其有效部位对AD具有较好的治疗效果。
1.1 远志及其有效部位
远志为远志科植物远志Willd.或卵叶远志L.的干燥根,最早见于《神农本草经》,因其有助于智力发育而得名。远志具有安神益智、交通心肾、祛痰、消肿的功效,可应用于治疗健忘、神智失常等大脑中枢渐退性疾病,其抗AD作用主要涉及到调节神经递质、抗炎、抗氧化应激、抑制大脑神经元凋亡等。曹杜娟等[6]用远志水煎液0.50、0.25 g/mL,连续ig-半乳糖致衰老和定向注射鹅膏蕈氨酸建立雄性Wistar AD大鼠模型2周,结果表明,远志水煎液可改善AD大鼠的学习记忆能力,其抗AD机制为可使AD大鼠海马体海马突触传递长时程增强,表明远志可通过调节神经递质改善AD病症。此外,彭芳等[7]研究发现雄性淀粉样前体蛋白(amyloid precursor protein,APP)模型AD小鼠连续3个月ig远志75%乙醇提取物50、100、200 mg/(kg∙d),研究结果表明,其可调节AD小鼠脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)/BDNF酪氨酸激酶受体B(tyrosine receptor kinase B,Trk B)信号通路及减少Aβ沉积,进而到抗AD作用。除上述作用机制外,还有研究表明,远志还可通过维护AD大鼠海马神经元正常生长[8],调节下丘脑-垂体-肾上腺轴[9],降低脑组织炎症损伤及抑制Tau蛋白过度磷酸达到抗AD的作用[10-11],以上研究提示远志可通过多种作用机制达到抗AD的治疗效果。
1.2 人参及其有效部位
人参为五加科植物人参C.A.Mey.的干燥根和根茎,《神农本草经》将其列为上品,其具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智的功效,有良好的抗衰老及调节神经系统功能的作用,现代药理研究表明其抗AD作用主要涉及到抗氧化应激、抗炎、调节神经递质、抑制大脑神经元凋亡等。如闫伟[12]发现62.5 μg/mL人参水提取物可通过抑制乙酰胆碱酯酶(acetylcholinesterase,AChE)活性和对人神经母细胞瘤细胞SH-SY5Y起保护作用,达到抗AD作用。Zhao等[13]研究了人参总皂苷对老龄C57BL/6J雄性小鼠的记忆力影响,实验表明AD小鼠连续ig人参总皂苷0.028%、0.056%、0.112% 4个月,1 mL/d,可改善老龄小鼠的认知功能损伤,其机制与增强超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性有关,表明人参皂苷可通过抗氧化应激发挥神经保护作用。以上数据证实,人参可发挥多途径抗AD作用,且人参总皂苷可能为抗AD的主要活性成分。
1.3 钩藤及其有效部位
钩藤为茜草科植物钩藤(Miq.) Miq.ex Havil.、大叶钩藤Wall.、毛钩藤Havil.、华钩藤(Oliv.) Havil.或无柄果钩藤Roxb.的干燥带钩茎枝,功效为清热平肝、息风定惊,现代药理实验证明其抗AD机制主要涉及调节神经递质、抑制氧化应激、抗神经细胞凋亡等。Shin等[14]利用5个AD相关基因家族突变的转基因AD模型小鼠实验,研究发现,AD小鼠ig钩藤水煎液400 mg/kg,隔1 d 1次,连续4周可显著缓解AD小鼠Aβ沉积及Aβ介导的神经病理。苏华等[15]用三氯化铝(AlCl3)诱发斑马鱼AD模型,实验结果表明28 ℃的养鱼用水中钩藤总生物碱33 μg/mL可明显提高AD斑马鱼的运动功能和反应能力,此外,还有研究显示钩藤可通过抑制诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)和核因子-κB(nuclear factor-κB,NF-κB)的表达,进而减轻神经炎症反应[16],钩藤总生物碱还可通过抑制AChE活性[17]及神经原纤维形成[18],发挥多途径抗AD效果,并提示其有望开发为中枢AChE抑制剂。
1.4 栀子及其有效部位
栀子为茜草科植物栀子Ellis的干燥成熟果实,具有泻火除烦、清热利尿、凉血解毒的功效。现代研究发现桅子可缓解AD病症,其抗AD机制主要涉及调节神经递质、抗炎、抗神经细胞凋亡等。张锐等[19]利用网络药理学研究栀子抗AD作用机制,分子对接表明60%以上的栀子有效成分可与AD相关靶点结合,显示了栀子防治AD的良好前景。左月明等[20]研究了栀子70%乙醇提取物对ip半乳糖与结扎双侧颈总动脉及脑室注Aβ的多因性AD(heterogeneity/multi-factors Alzheimer’s disease,H/MAD)模型大鼠的学习记忆影响,结果发现AD大鼠ig 70%乙醇提取物[1.05 g/(kg∙d)],可有效提高AD大鼠的学习记忆能力,同时AD模型大鼠显示血清中过氧化氢酶(catalase,CAT)的活力增强,AchE含量降低,表明其可通过增强CAT的活力和降低AchE含量,证实了栀子通过调节神经递质达到抗AD作用。
1.5 丹参及其有效部位
丹参为唇形科植物丹参Bunge的干燥根和根茎,具有通经止痛、凉血消痈、活血祛瘀、清心除烦的功效,丹参对AD具有多种神经保护作用,如抑制氧化应激、抗神经细胞凋亡、抗炎等。张明勇[21]将Aβ1-42多肽单体采用4 ℃孵育24 h成功制备得到Aβ1-42寡聚体,用10 μmol/L Aβ1-42寡聚体诱导细胞损伤,建立AD细胞模型,实验结果表明丹参水煎液100 μg/mL能显著地提高模型细胞的活性,表明其有神经保护作用。张淑玲等[22]观察丹参总多糖对APP小鼠模型的作用机制,发现小鼠ig丹参多糖低、中、高剂量[50、100、200 mg/(kg∙d)]60 d后可有效降低AD小鼠大脑细胞凋亡相关因子B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)相关X蛋白(Bcl-2 associated X protein,Bax)及半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)的表达,提示丹参多糖抗AD机制可能为通过抑制氧化应激,进而减少神经元的凋亡,发挥神经保护作用。
1.6 五味子及其有效部位
五味子为木兰科植物五味子(Turcz.) Baill.的干燥成熟果实,习称“北五味子”,具有收敛固涩、益气生津、补肾宁心之功效。其抗AD机制主要包括抑制氧化应激、抗神经细胞凋亡、抗炎等,如刘国辉等[23]采用‐半乳糖诱导建立AD大鼠模型,ig五味子水提液2 mL/(kg∙d),连续40 d,结果发现,五味子可使下丘脑丙二醛(malondialdehyde,MDA)含量降低,SOD活性升高,下丘脑切片中淀粉样沉淀较少,由此推测五味子抗AD的作用机制涉及抑制自由基损伤。五味子多糖及五味子总木脂素为五味子抗AD的主要有效部位,Xu等[24]研究发现,五味子多糖260 mg/(kg∙d)可显著改善Aβ1-42诱导AD小鼠的认知功能和组织病理学改变,减少Aβ的沉积,下调促炎细胞因子的表达和海马胶质细胞的活化。而五味子总木脂素可通过上调基因表达,降低和基因表达,进而抑制Aβ所致的神经元细胞凋亡,改善AD病症[25]。提示五味子及其有效部位具有良好的抗AD应用前景。
除上述单味中药及其有效部位外,近年来还有一大批单味中药被发现具有抗AD活性,为抗AD中药的开发提供了巨大的资源库,见表1。
2 中药有效成分
中药有效成分是中药发挥作用的物质基础,随着中药提取分离技术取得了一定的进展,发现中药远志中远志皂苷、人参中人参皂苷类及其糖肽类、钩藤中钩藤碱和异钩藤碱、栀子中栀子苷和西红花苷及藏红花色素、丹参中丹参酮IIA及丹参酚酸A、五味子中五味子乙素和五味子醇甲及五味子酸性多糖等多种有效成分在治疗AD中具有明显的治疗作用,已成为抗AD领域的研究热点。
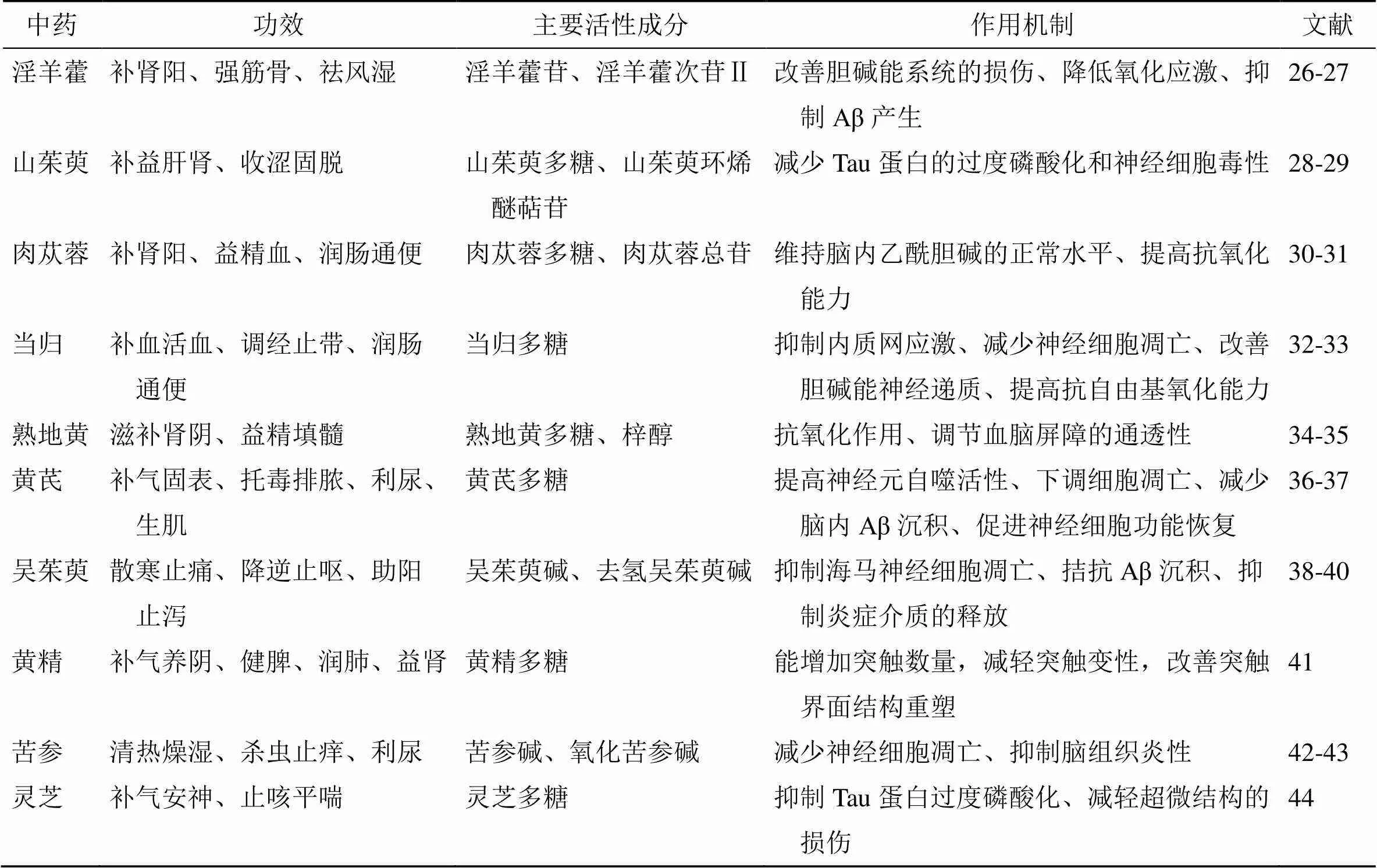
表1 抗AD的中药及其作用机制
2.1 远志皂苷
远志皂苷是远志的主要活性成分,目前远志皂苷被广泛应用于远志益智机制的研究中,如刘莹等[45]观察远志皂苷对转基因果蝇AD模型的影响,实验结果显示使用2%远志皂苷培养基连续喂养5 d,能提高转基因果蝇AD模型的运动和记忆能力,且可延长其寿命,提示远志皂苷可调节Tau蛋白表达,减轻AD病症。另有研究发现,在APP/早老蛋白1(presenilin 1,)转基因4个月大雄性AD小鼠中,连续ig低、中、高剂量[20、40、80 mg/(kg∙d)]细叶远志皂苷3个月,发现低、中、高剂量细叶远志皂苷均可逆转AD小鼠海马区神经元凋亡,进而改善小鼠的学习记忆能力,推测其抗AD机制与抑制线粒体膜电位丢失进而逆转神经元凋亡有关[46]。以上报道表明远志皂苷可通过抑制氧化应激及改善线粒体功能等多途径发挥抗AD作用,提示其具有潜力开发为抗AD治疗药物。
2.2 人参皂苷类及糖肽类
人参作为传统的安神益智类中药,其抗AD有效成分主要指人参皂苷类及糖肽类,已有大量文献证实其抗AD疗效。如Wang等[47]研究了人参皂苷Rg1对慢性拘束应激AD雄性小鼠的影响,结果表明,连续ig人参皂苷Rg12、5 mg/(kg∙d) 8周能降低小鼠额叶皮层活性氧化物的生成,进而减轻神经元氧化损伤。Quan等[48]观察人参皂苷Rg1对Aβ1–42诱导的AD模型大鼠海马组织中过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)和胰岛素降解酶(insulin degrading enzyme,IDE)表达的影响,发现ip 10 mg/(kg∙d)人参皂苷Rg128 d可显著改善AD大鼠的学习记忆功能,减轻海马组织病理异常,降低Aβ水平,提高PPARγ和IDE表达,达到抗AD作用。还有研究发现人参皂苷Rg5可改善链脲佐菌素(streptozotocin,STZ)诱导AD大鼠的空间学习记忆能力,研究表明,高剂量[20 mg/(kg∙d)]人参皂苷Rg5组连续给药28 d,能显著降低STZ诱导AD大鼠大脑皮层及海马中AChE活性和抑制促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,表明人参皂苷Rg5可通过调节胆碱能系统、降低神经炎症反应进而改善AD病症[49]。此外,人参皂苷Re、Rd在促进神经元分化,改善胆碱能系统中也发挥了重要作用[50]。除人参皂苷具有抗AD作用外,还有研究表明连续ip人参糖肽-6高、中剂量[160、80 mg/(kg∙d)]35 d,可显著改善Aβ25-35诱导的AD大鼠,其机制可能为通过抑制炎症反应,从而减少AD大鼠老年斑的形成,达到改善AD的效果[51]。以上研究报道证实了人参多种皂苷具有广泛的抗AD活性,且在人参总皂苷中含量最高的人参皂苷Rg1可发挥多途径抗AD疗效,提示其可作为抗AD单体药物。
2.3 钩藤碱和异钩藤碱
钩藤的主要活性成分为生物碱类,主要有异钩藤碱、钩藤碱、毛钩藤碱、去氢毛钩藤碱等,其中以异钩藤碱和钩藤碱的含量最高,对神经元有良好的保护作用。研究表明,分别用钩藤碱和异钩藤碱10、50 μg/mL预处理Aβ25−35诱导的AD大鼠嗜铬细胞瘤PC12细胞,显著提高了PC12细胞活力[52],其神经保护作用可能是通过抑制细胞内钙超载和Tau蛋白过度磷酸化介导的,而且异钩藤碱还可通过抑制PC12细胞氧化应激反应和细胞凋亡的线粒体信号通路[53],进而影响AD病程进展。以上研究提示异钩藤碱及钩藤碱可作为治疗AD及其他中枢神经系统的潜在疗效药物,为将来作为治疗中枢神经系统疾病的有效药物提供科学依据。
2.4 栀子苷、西红花苷及藏红花色素
栀子苷是栀子中含有的一种环烯醚萜苷类化合物,具有多种药理活性,如降血糖、抗炎、抗肿瘤、神经退行性疾病等作用,被视为栀子主要的抗AD活性成分,董璐萌[54]采用APP/PS1/Tau蛋白三转基因AD模型小鼠研究栀子苷抗AD机制,结果显示,连续ig栀子苷100 mg/(kg∙d) 8周,小鼠海马神经元糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)蛋白表达水平显著降低,基因表达水平上调,提示栀子苷能够通过减少Aβ沉积、抑制Tau蛋白磷酸化和抗神经元凋亡达到抗AD的目的。陈安春等[55]采用AlCl3建立AD大鼠模型,连续ip栀子苷高剂量溶液90 mg/(kg∙d) 70 d,苏木精-伊红染色法(hematoxylin-eosin staining,HE)检测海马细胞形态变化,结果表明栀子苷对大鼠海马组织的损伤有抑制作用,进而达到抗AD作用。此外,Morelli等[56]研究发现栀子中西红花苷可通过抑制Aβ聚集,减轻Aβ的神经毒性进而发挥抗AD作用。藏红花色素GJ-4是从栀子中提取分离出的一种藏红花色素富集的活性成分,臧彩霞等[57]发现其也能提高AD小鼠的空间探索和学习记忆能力,其作用机制为抑制大脑皮层及海马神经元的凋亡和小胶质细胞的激活。以上研究表明除栀子苷外,栀子西红花苷及藏红花色素GJ-4在治疗AD等中枢神经系统疾病方面也具有良好的应用前景。
2.5 丹参酮IIA及丹参酚酸A
丹参的主要活性成分为丹参酮类,有抗炎、抗氧化、调节细胞凋亡等药理作用,近年来研究发现,丹参酮类在AD的预防和治疗中表现出了潜在价值和巨大前景,其中丹参酮IIA在抗AD作用中处于首要地位。蒋平等[58]采用Aβ蛋白注射法建立AD大鼠模型,连续ig丹参酮IIA50 mg/(kg∙d) 15 d,发现其可降低AD大鼠颞叶中基质金属蛋白酶-2(matrix metalloproteinases-2,)mRNA及iNOS的表达,进而改善AD大鼠的学习记忆能力,提示其机制为通过抑制氧化应激来实现的。还有研究发现,在Aβ1-42诱导的AD大鼠模型中,持续ip丹参酮IIA8 mg/(kg∙d) 30 d,丹参酮IIA组能显著抑制NF-κB的活性,减少星形胶质细胞的增殖,激活SOD进而减少超氧化物的生成,发挥抗AD作用[59]。此外,还有研究发现丹参酚酸A可显著抑制Aβ的自聚集和预先分解神经原纤维缠结,通过螯合金属离子减少活性氧簇(reactive oxygen species,ROS)的形成,达到抗AD的效果[60]。以上研究表明,丹参酮IIA及丹参酚酸A在防治AD方面起到了一定的作用。
2.6 五味子乙素、五味子醇甲及五味子酸性多糖
五味子的成分主要有木脂素、有机酸、挥发油和多糖等,在木脂素中,五味子乙素、五味子醇甲及多糖类五味子酸性多糖具有抗氧化、保护神经元等药理作用。李佳芮等[61]研究发现,五味子乙素能改善-半乳糖和氢溴酸东莨菪碱诱导的AD小鼠学习记忆能力,研究表明,连续ip五味子乙素0.5 g/(kg∙d) 30 d,HE染色显示AD小鼠海马神经细胞水肿明显减轻,流式细胞术显示凋亡细胞明显减少,免疫印迹法与免疫组织化学显示Bax、C型Caspase-3(C-Caspase-3)、C型Caspase-9(C-Caspase-9)蛋白的表达明显降低,提示五味子乙素抗AD机制与抑制神经细胞凋亡有关。李贺等[62]观察五味子酸性多糖对Aβ25-35致AD模型小鼠学习记忆能力的改善作用,发现连续ig五味子酸性多糖20 mg/(kg∙d)14 d,免疫印迹法检测结果表明小鼠海马组织中磷酸化蛋白TauSer199、TauSer396、TauSer404及GSK-3β表达水平明显降低,提示五味子酸性多糖抗AD作用与其降低海马组织中Tau蛋白磷酸化水平有关。此外,还有研究表明五味子醇甲可通过抗氧化作用防治AD,其机制可能与降低ROS含量、下调晚期糖基化终产物受体(receptor for advanced glycation end-products,RAGE)蛋白表达有关[63-64]。除上述中药有效成分外,其他中药有效成分对AD的作用见表2。

表2 抗AD的中药有效成分及其作用机制
3 中药复方
中药复方及其制剂是目前中医临床用药的主要形式,凝聚了世代医者的智慧经验总结,是中医药宝库的精华部分。研究发现许多经典名方和现代中药复方制剂具有较好的防治AD的作用,如补肾益智方、六味地黄汤、黄连解毒汤、地黄饮子、补阳还五汤、涤痰汤等。
3.1 补肾益智方
补肾益智方由枸杞、党参、山萸肉、白术、熟地、益智仁、郁金、当归、石菖蒲、远志、川芎11味药组成,具有补肾健脑、活血益气、醒脑开窍等功效,在干预老年遗忘型轻度认知障碍中取得了较好的临床效果[85]。Hou等[86]通过-半乳糖加鹅膏蕈氨酸(ibotenic acid,IBO)建立了大鼠AD模型,实验发现,ip补肾益智方低、中、高剂量[1.46、2.92、5.84 g/(kg∙d)]连续4周,可改善AD大鼠学习记忆能力,其作用机制可能为通过调节神经生长因子(nerve growth factor,NGF)信号通路及中枢胆碱能系统等途径发挥抗AD作用。Cai等[87]利用系统药理学研究补肾益智方对APP/PS1 AD模型小鼠认知功能障碍的治疗作用,发现其可通过调节Aβ代谢和抑制神经元凋亡来实现抗AD作用。此外,还有研究表明,补肾益智方还能够通过减轻氧化应激反应,抑制大脑炎症反应,从而达到改善AD症状的作用[88-89]。
3.2 六味地黄汤
六味地黄汤中含有茯苓、山药、山茱萸、牡丹皮、泽泻、熟地黄6味中药,具有滋阴补肾的功效,因其可治疗肾阴虚引起的相关症状,还可以起到降血糖的作用,并且其在保护神经系统方面有一定影响,可增强机体免疫力,改善自由基代谢和大脑功能,所以适用于AD患者。李孟宇[90]利用10月龄雄性/双转基因AD小鼠研究六味地黄汤抗AD机制,实验表明,连续ig六味地黄汤10 g/(kg∙d) 117 d后,可增加AD小鼠海马CA3区尼氏小体数量,降低AD小鼠脑中小胶质细胞活化和增加神经元数量,发挥神经保护作用。此外,还有研究表明,该复方中地黄糖苷还可通过调节免疫系统和肠道菌群的紊乱进而改善认知功能障碍,达到治疗AD的效果[91-92]。
3.3 黄连解毒汤
黄连解毒汤为清热解毒代表方剂,由黄连、黄芩、黄柏、栀子4味中药组成。现代药理学研究表明,其具有预防神经元损伤、延长睡眠时间和抑制免疫反应等多种功能[93]。Gu等[94]发现大鼠连续ig黄连解毒汤3.5 g/(kg∙d) 1周,可上调注射-半乳糖和Aβ25-35-IBO AD大鼠外周系统AMP-活化蛋白激酶(AMP-activated protein kinase,AMPK)、SOD及转录沉默信息调节因子1(silent information regulator of transcription 1,SIRT1)水平,下调MDA含量,其治疗AD的潜在机制与缓解氧化应激、抗炎、调节神经递质和能量代谢有关。冯佩[95]探讨黄连解毒汤对/双转基因AD模型小鼠影响,结果表明,连续ig黄连解毒汤433 mg/(kg∙d) 6个月,可显著抑制AD小鼠脑内基因表达,阻止Aβ沉积,表明其具有较好的预防及治疗AD作用。除上述机制外,还有研究表明,黄连解毒汤可通过抑制肠道失调和脂质代谢紊乱及相关的Aβ积累,调节脑-肠轴进而逆转认知障碍[96]。
3.4 地黄饮子
地黄饮子由肉苁蓉、巴戟天、熟地黄、山茱萸、附子、肉桂、麦冬、石斛、五味子、远志、石菖蒲、茯苓、薄荷、生姜、大枣15味药组成,具有补肾填精、化痰开窍的功效。临床研究表明,地黄饮子可明显改善AD患者的认知功能,且不良反应少[97]。张丽等[98]研究表明,AD患者地黄饮子复方颗粒剂1剂/d,治疗3个月,免疫印迹法检测发现AD患者血清Notch1信号蛋白及解整合素-金属蛋白酶10(A-disitegrin and metalloprotease 10,ADAM10)显著上升、β类淀粉前体蛋白内切酶1(β-site APP-cleaving enzyme 1,BACE1)显著下降,酶联免疫吸附测定检测血清学丙烯醛浓度降低,表明其抗AD机制可能为增加Notch1促进神经再生,上调ADAM10、降低BACE1浓度以促进APP分解,达到抗AD作用。此外,地黄饮子还可通过保护线粒体免受病理损伤而改善APP/PS1模型AD小鼠的认知功能和能量代谢[99]。
3.5 补阳还五汤
补阳还五汤由黄芪、赤芍、川芎、当归、地龙、桃仁、红花7味药组成,具有补气、活血、化瘀通络的功效。临床对AD患者应用补阳还五汤治疗,发现其能显著提高AD患者的认知功能及活动能力,治疗效果显著[100]。费洪新等[101]利用雄性/双转基因小鼠研究补阳还五汤对AD小鼠的作用机制,发现连续ig补阳还五汤高、中剂量[37.06、18.53 g/(kg∙d)]28 d后,海马CA1区、CA3区神经元形态明显改善,其抗AD机制可能为维持AD小鼠海马神经元形态结构,降低Aβ,从而起到抗AD的作用。此外,补阳还五汤高、中剂量还可以有效抑制/双转基因AD小鼠海马组织中凋亡因子的表达,减少海马神经细胞的凋亡,从而提高AD模型小鼠的学习记忆能力[102]。另有研究发现,补阳还五汤还能通过RAGE/低密度脂蛋白受体相关蛋白1(low-density lipoprotein receptor-related protein 1,LRP1)通路调节24 μmol/L Aβ25-35建立的AD大鼠模型的Aβ代谢,发挥抗AD作用[103],且补阳还五汤还可通过改善血脑屏障通透性,发挥抗AD作用[104]。
3.6 涤痰汤
涤痰汤由天南星、半夏、枳实、茯苓、橘红、石菖蒲、人参、竹茹、甘草9味药组成,其功效为化痰开窍,因而可减轻AD患者的记忆障碍。研究表明,海马定位注射Aβ1-42雄性SD模型AD大鼠连续ig涤痰汤10 mg/(kg∙d) 4周,可通过激活磷酸酯酶2A(phosphoesterase 2A,PP2A)、抑制GSK-3β表达,从而减轻AD大鼠Tau蛋白的过度磷酸化,发挥神经保护作用[105]。彭静等[106]研究涤痰汤对-半乳糖诱导的AD模型大鼠的影响,结果发现连续ig涤痰汤低、高剂量[4.275、8.55 g/(kg∙d)]4周,AD大鼠GSH-Px水平和抗氧化能力较模型组明显上升,表明其也可通过对氧自由基清除达到抗AD的效果。此外,还有研究表明涤痰汤通过减少AD模型大鼠大脑Aβ的生成,从而发挥神经保护作用[107]。除上述复方外,其他中药复方对AD的治疗也具有较好的疗效,见表3。
4 结语与展望
中药作为我国宝贵的医疗文化遗产,资源十分丰富,有着悠久的应用历史。中医一直强调整体论和辨证法,在治疗上具有多途径、多靶点、多层次的特点。目前中药在预防和治疗AD方面已积累了丰富的理论和大量的宝贵经验,中药防治AD的优势在于中药多靶点调控可能比单靶点拮抗剂更具有优势,并且中药多成分可发挥多种协同作用,能降低药物的不良反应。
本文围绕中药抗AD的作用及其机制研究,综述了中药可通过抑制神经元的凋亡、减少Aβ的生成、抑制Tau蛋白过度磷酸化、降低神经炎症反应、抗氧化应激、调节神经递质、改善线粒体功能、调节血脑屏障、调节胰岛素信号通路、调节肠道菌群等发挥抗AD作用,对病情渐进加重,难以逆转的这种慢性中枢神经系统疾病,可延缓其病程发展,极大地减轻患者家庭和社会的经济负担,提高患者的生活质量,因而具有良好的应用开发前景。但目前中药抗AD的研究还存在着亟待解决的关键问题。首先,中药有效成分复杂多样,可以作用于多个靶点和多个信号通路,各成分关系有待明确,致使很多中药抗AD的作用疗效稳定性不佳。其次,AD是一种慢性神经退行性疾病,其病理过程复杂,受多种因素影响,中药抗AD机制研究起步较晚,目前主要保持在体外和动物实验研究阶段,因此,要注意药理实验与临床验证相结合,推动中药抗AD的临床应用。再者,传统的药理实验方法,如免疫印迹法或测量单一的酶活性,往往不足以阐明中药疗效,为了解决这一问题,一些组学技术包括蛋白质组学和代谢组学等的发展,可系统地研究中药抗AD的整体效应。相信随着运用现代科学技术和理论,加强多学科、交叉研究的合作,开展更深入的研究,中药治疗AD将会取得突破性进展。

表3 抗AD的中药复方的功效及作用机制
利益冲突 所有作者均声明不存在利益冲突
[1] Nguyen T T, Giau V V, Vo T K.Current advances in transdermal delivery of drugs for Alzheimer’s disease [J]., 2017, 49(2): 145-154.
[2] Ahmed T F, Ahmed A, Imtiaz F.History in perspective: How Alzheimer’s disease came to be where it is? [J]., 2021, 1758: 147342.
[3] 张占军, 王永炎.肾虚-痰瘀-酿毒-病络—中医对老年性痴呆早期发病病机认识 [J].中国中医基础医学杂志, 2015, 21(3): 244-246.
[4] 刘禹.中药治疗阿尔茨海默病的文献研究 [D].通辽: 内蒙古民族大学, 2020.
[5] Piton M, Hirtz C, Desmetz C,.Alzheimer’s disease: Advances in drug development [J]., 2018, 65(1): 3-13.
[6] 曹杜娟, 李新毅, 郭芬, 等.远志对阿尔茨海默病模型大鼠学习记忆及在体海马LTP的影响 [J].世界中西医结合杂志, 2010, 5(8): 661-664.
[7] 彭芳, 崔渊博, 宋文颖, 等.远志提取物对阿尔茨海默病小鼠学习记忆能力的干预效果 [J].郑州大学学报: 医学版, 2017, 52(4): 407-412.
[8] Park H J, Lee K, Heo H,.Effects ofroot extract on proliferation of neural stem cells in the hippocampal CA1 region [J]., 2008, 22(10): 1324-1329.
[9] Hu Y, Liao H B, Liu P,.A bioactive compound fromregulates efficiency of chronic stress on hypothalamic-pituitary-adrenal axis [J]., 2009, 64(9): 605-608.
[10] 耿志辉, 宣兆宇, 张丽娇, 等.中药远志改善-半乳糖模型鼠学习记忆能力及其机制研究 [J].神经解剖学杂志, 2010, 26(2): 189-191.
[11] 穆俊霞, 郭锋, 崔丽霞, 等.远志对阿尔茨海默病大鼠海马神经元Tau蛋白磷酸化的影响 [J].山西中医学院学报, 2013, 14(1): 22-24.
[12] 闫伟.人参抗阿尔兹海默症有效成分分析研究 [D].长春: 吉林农业大学, 2018.
[13] Zhao H F, Li Q, Li Y.Long-term ginsenoside administration prevents memory loss in aged female C57BL/6J mice by modulating the redox status and up-regulating the plasticity-related proteins in hippocampus [J]., 2011, 183((2)): 189-202.
[14] Shin S J, Jeong Y, Jeon S G,.ameliorates amyloid beta deposition and amyloid beta-mediated pathology in 5XFAD mice [J]., 2018, 121: 114-124.
[15] 苏华, 何飞, 韦桂宁, 等.钩藤总碱治疗阿尔茨海默病的药理作用研究 [J].中医药导报, 2019, 25(21): 48-51.
[16] Shi Z H, Xi Z W, Wang H,.The neuroprotective effect of batch-2, an aqueous extract from cat’s claw () on 6-OHDA-induced SH-SY5Y cell damage [J]., 2010, 37(7): 769-778.
[17] Yang Z D, Zhang D B, Ren J,.Acetylcholinesterase inhibitory activity of the total alkaloid from traditional Chinese herbal medicine for treating Alzheimer’s disease [J]., 2012, 21(6): 734-738.
[18] Xian Y F, Mao Q Q, Wu J C Y,.Isorhynchophylline treatment improves the amyloid-β-induced cognitive impairment in rats via inhibition of neuronal apoptosis and tau protein hyperphosphorylation [J]., 2014, 39(2): 331-346.
[19] 张锐, 张季林, 李冰涛, 等.基于网络药理学研究栀子入血成分抗阿尔茨海默病的作用机制 [J].中国中药杂志, 2020, 45(11): 2601-2610.
[20] 左月明, 蔡妙婷, 张忠立, 等.栀子提取物对异质性及多因性阿尔茨海默病模型大鼠空间学习记忆的影响 [J].时珍国医国药, 2014, 25(9): 2055-2057.
[21] 张明勇.丹参防治阿尔茨海默病的细胞代谢组学和跨血脑屏障转运机制研究 [D].上海: 中国人民解放军海军军医大学, 2019.
[22] 张淑玲, 韦玮.丹参总多糖对阿尔茨海默病小鼠神经保护活性的研究 [J].现代中药研究与实践, 2016, 30(6): 38-41.
[23] 刘国辉, 欧阳芬, 卢佳怡, 等.五味子对-半乳糖致阿尔茨海默病大鼠下丘脑的影响及其作用机制 [J].医学理论与实践, 2013, 26(12): 1541-1542.
[24] Xu M J, Yan T X, Fan K Y,.Polysaccharide ofameliorates cognitive decline in a mouse model of Alzheimer’s disease [J]., 2019, 237: 354-365.
[25] 邵琼, 吕露, 王艳梅.五味子总木脂素对阿尔茨海默病模型大鼠记忆障碍的影响 [J].国际中医中药杂志, 2017, 39(11): 1011-1015.
[26] Li Y, Dai S R, Huang N Q,.Icaritin and icariin reduce p-Tau levels in a cell model of Alzheimer’s disease by downregulating glycogen synthase kinase 3β [J]., 2022, 69(1): 355-363.
[27] 晏灵莉.淫羊藿次苷II减轻阿尔茨海默病模式小鼠学习记忆减退作用及机制研究 [D].遵义: 遵义医学院, 2017.
[28] Yang C C, Li X L, Gao W B,.Cornel iridoid glycoside inhibits tau hyperphosphorylation via regulating cross-talk between GSK-3β and PP2A signaling [J]., 2018, 9: 682.
[29] 苏亚楠, 张晓波, 姚海涛, 等.山茱萸多糖对阿尔茨海默病模型大鼠认知能力和海马磷酸化-tau蛋白表达的影响 [J].中国老年学杂志, 2017, 37(13): 3152-3154.
[30] Wu C R, Lin H C, Su M H.Reversal by aqueous extracts offrom behavioral deficits in Alzheimer’s disease-like rat model: Relevance for amyloid deposition and central neurotransmitter function [J]., 2014, 14: 202.
[31] 尹刚, 龚道恺, 刘帮会, 等.肉苁蓉多糖对阿尔茨海默病大鼠学习记忆及氧化应激影响的实验研究 [J].中风与神经疾病杂志, 2013, 30(6): 504-507.
[32] 车敏, 安方玉, 王燕, 等.当归多糖对阿尔茨海默病模型大鼠海马神经元内质网应激的影响 [J].中医临床研究, 2021, 13(2): 7-11.
[33] Du Q, Zhu X Y, Si J R.polysaccharide ameliorates memory impairment in Alzheimer’s disease rat through activating BDNF/TrkB/CREB pathway [J]., 2020, 245(1): 1-10.
[34] 付昊, 龙虎, 蔡自建, 等.熟地黄多糖的体内抗氧化活性研究 [J].食品研究与开发, 2019, 40(4): 57-61.
[35] 刘晨阳.梓醇对纤维状Aβ1-42介导的体外血脑屏障的损伤具有保护作用 [D].南京: 南京中医药大学, 2018.
[36] 贾宁, 张泽, 韩锟.黄芪多糖对/转基因小鼠认知功能的自噬及凋亡的改善作用机制研究 [J].中国临床药理学杂志, 2020, 36(20): 3328-3331.
[37] Lin J, Kang H, Liang J,.CpG oligonucleotides andpolysaccharides are effective adjuvants in cultures of avian bone-marrow-derived dendritic cells [J]., 2015, 56(1): 30-38.
[38] 韩兆丰, 刘士敏, 刘晓倩, 等.吴茱萸碱对AD模型小鼠的保护作用及学习记忆能力的调节作用 [J].现代中药研究与实践, 2018, 32(6): 28-30.
[39] Shin K Y, Noh S J, Park C H,.Dehydroevodiamine·HCl protects against memory impairment and cerebral amyloid-β production in Tg2576 mice by acting as a β-secretase inhibitor [J]., 2016, 15(8): 935-944.
[40] Wang D M, Wang C Y, Liu L,.Protective effects of evodiamine in experimental paradigm of Alzheimer’s disease [J]., 2018, 12(3): 303-313.
[41] 成威, 李友元, 邓洪波, 等.黄精多糖对阿尔茨海默病小鼠海马CA1区突触界面的影响 [J].临床与病理杂志, 2014, 34(4): 400-404.
[42] 丁未尧, 周凯, 谢航, 等.氧化苦参碱对阿尔茨海默病认知功能障碍的作用研究 [J].湖北科技学院学报: 医学版, 2017, 31(5): 372-374.
[43] Li J, Cheng X Y, Yang H,.Matrine ameliorates cognitive deficits via inhibition of microglia mediated neuroinflammation in an Alzheimer’s disease mouse model [J]., 2020, 75(7): 344-347.
[44] 李宜培, 王雪银, 陈洁, 等.灵芝多糖肽对阿尔茨海默病大鼠β淀粉样蛋白含量和tau蛋白过度磷酸化的影响 [J].中华实用诊断与治疗杂志, 2015, 29(9): 862-865.
[45] 刘莹, 刘莉, 关慧波.远志皂苷对转基因果蝇阿尔茨海默病模型行为学及寿命的影响 [J].吉林中医药, 2021, 41(2): 234-237.
[46] Wang L, Jin G F, Yu H H,.Protective effects of tenuifolin isolated fromWilld roots on neuronal apoptosis and learning and memory deficits in mice with Alzheimer’s disease [J]., 2019, 10(11): 7453-7460.
[47] Wang Y C, Kan H W, Yin Y Y,.Protective effects of ginsenoside Rg1on chronic restraint stress induced learning and memory impairments in male mice [J]., 2014, 120: 73-81.
[48] Quan Q K, Wang J, Li X,.Ginsenoside Rg1decreases Aβ1–42level by upregulating PPARγ and IDE expression in the hippocampus of a rat model of Alzheimer's disease [J]., 2013, 8(3): e59155.
[49] Chu S H, Gu J F, Feng L,.Ginsenoside Rg5improves cognitive dysfunction and beta-amyloid deposition in STZ-induced memory impaired rats via attenuating neuroinflammatory responses [J]., 2014, 19(2): 317-326.
[50] Kim M S, Yu J M, Kim H J,.Ginsenoside Re and Rd enhance the expression of cholinergic markers and neuronal differentiation in Neuro-2a cells [J]., 2014, 37(5): 826-833.
[51] 狄良娇.人参糖肽对Aβ25-35诱导的认知障碍大鼠抗炎与抗凋亡机制研究 [D].长春: 吉林大学, 2015.
[52] Xian Y F, Lin Z X, Mao Q Q,.Bioassay-guided isolation of neuroprotective compounds fromagainst beta-amyloid-induced neurotoxicity [J]., 2012, 2012: 802625.
[53] Xian Y F, Lin Z X, Mao Q Q,.Protective effect of isorhynchophylline against β-amyloid-induced neurotoxicity in PC12 cells [J]., 2012, 32(3): 353-360.
[54] 董璐萌.中药栀子对//三转基因阿尔茨海默症小鼠药理活性研究 [D].遵义: 遵义医学院, 2018.
[55] 陈安春, 任杰, 张培哲, 等.栀子苷对阿尔茨海默病模型大鼠学习记忆能力的影响 [J].河南科技大学学报: 医学版, 2013, 31(1): 9-11.
[56] Morelli S, Salerno S, Piscioneri A,.Neuronal membrane bioreactor as a tool for testing crocin neuroprotective effect in Alzheimer’s disease [J]., 2016, 305: 69-78.
[57] 臧彩霞, 鲍秀琦, 张丹.栀子藏红花色素部位GJ-4治疗阿尔茨海默症的药效学与作用机制研究 [J].神经药理学报, 2018, 8(3): 38.
[58] 蒋平, 孙秀佳, 向正华, 等.丹参酮对于阿尔茨海默症大鼠颞叶iNOS, MMP-2表达的影响及机理研究 [J].现代生物医学进展, 2014, 14(18): 3401-3404.
[59] Li J, Wen P Y, Li W W,.Upregulation effects of tanshinone IIAon the expressions of NeuN, Nissl body, and IκB and downregulation effects on the expressions of GFAP and NF-κB in the brain tissues of rat models of Alzheimer’s disease [J]., 2015, 26(13): 758-766.
[60] Cao Y Y, Wang L, Ge H,.Salvianolic acid A, a polyphenolic derivative fromBunge, as a multifunctional agent for the treatment of Alzheimer’s disease [J]., 2013, 17(3): 515-524.
[61] 李佳芮, 聂文博, 张佳悦, 等.五味子乙素对阿尔茨海默病小鼠学习记忆能力及神经细胞凋亡的影响 [J].中国老年学杂志, 2017, 37(14): 3390-3394.
[62] 李贺, 刘聪, 李宁, 等.北五味子酸性多糖对阿尔茨海默病模型小鼠学习记忆能力的改善作用 [J].吉林大学学报: 医学版, 2017, 43(6): 1115-1120.
[63] 宋琳, 朴钟源, 郑倩, 等.五味子醇甲对Aβ1-42诱导SH-SY5Y细胞的RAGE-ROS-凋亡通路的影响 [J].中华中医药学刊, 2020, 38(3): 36-39, 259.
[64] Qi Y, Cheng X H, Jing H T,.Combination of schisandrin and nootkatone exerts neuroprotective effect in Alzheimer’s disease mice model [J]., 2019, 34(6): 1689-1703.
[65] Xu T T, Zhang Y, He J Y,.Bajijiasu ameliorates β-amyloid-triggered endoplasmic reticulum stress and related pathologies in an Alzheimer’s disease model [J]., 2018, 46(1): 107-117.
[66] Cai H B, Wang Y J, He J Y,.Neuroprotective effects of bajijiasu against cognitive impairment induced by amyloid-β in/mice [J]., 2017, 8(54): 92621-92634.
[67] Chen D L, Zhang P, Lin L,.Protective effects of bajijiasu in a rat model of Aβ25-35-induced neurotoxicity [J]., 2014, 154(1): 206-217.
[68] Sun J Y, Zhang X, Wang C,.Curcumin decreases hyperphosphorylation of tau by down-regulating caveolin-1/GSK-3β in N2a/APP695swe cells and/double transgenic Alzheimer’s disease mice [J]., 2017, 45(8): 1667-1682.
[69] Wang X L, Wang W Z, Li L,.Oxidative stress and mitochondrial dysfunction in Alzheimer’s disease [J]., 2014, 1842(8): 1240-1247.
[70] Zhou A, Wu H F, Pan J,.Synthesis and evaluation of paeonol derivatives as potential multifunctional agents for the treatment of Alzheimer’s disease [J]., 2015, 20(1): 1304-1318.
[71] Zhou N N, Tang Y, Keep R F,.Antioxidative effects ofsaponins in brain cells [J]., 2014, 21(10): 1189-1195.
[72] Zhang T, Dong K L, Xiao L,.Effects of co-administration of icariin andsaponins on intestinal microbiota and hippocampal protein expression in a mouse model of Alzheimer’s disease [J]., 2020, 16: 2169-2179.
[73] 范军朝, 宋俊杰, 陈勇.酸枣仁皂苷缓解阿尔茨海默病模型小鼠的机制研究 [J].中国比较医学杂志, 2020, 30(9): 32-37.
[74] Song P P, Zhang Y, Ma G J,.Gastrointestinal absorption and metabolic dynamics of jujuboside A, A saponin derived from the seed of[J]., 2017, 65(38): 8331-8339.
[75] 殷贺, 许保磊, 牛天童, 等.银杏内酯对阿尔茨海默病细胞模型细胞活性的影响及其作用机制研究 [J].中国医药, 2020, 15(8): 1253-1257.
[76] Hu Y K, Li C Y, Shen W.Gastrodin alleviates memory deficits and reduces neuropathology in a mouse model of Alzheimer’s disease [J]., 2014, 34(4): 370-377.
[77] Zhang J S, Zhou S F, Wang Q,.Gastrodin suppresses BACE1 expression under oxidative stress condition via inhibition of the PKR/eIF2α pathway in Alzheimer’s disease [J]., 2016, 325: 1-9.
[78] Wang H L, Li Q Q, Sun S Y,.Neuroprotective effects of salidroside in a mouse model of Alzheimer’s disease [J]., 2020, 40(7): 1133-1142.
[79] Gao J, He H, Jiang W J,.Salidroside ameliorates cognitive impairment in a-galactose-induced rat model of Alzheimer’s disease [J]., 2015, 293: 27-33.
[80] Jiao Y N, Kong L, Yao Y J,.Osthole decreases beta amyloid levels through up-regulation of miR-107 in Alzheimer’s disease [J]., 2016, 108: 332-344.
[81] Li S H, Gao P, Wang L T,.Osthole stimulated neural stem cells differentiation into neurons in an Alzheimer’s disease cell model via upregulation of microRNA-9 and rescued the functional impairment of hippocampal neurons in/transgenic mice [J]., 2017, 11: 340.
[82] Li S H, Yan Y H, Jiao Y N,.Neuroprotective effect of osthole on neuron synapses in an Alzheimer’s disease cell model via upregulation of microRNA-9 [J]., 2016, 60(1): 71-81.
[83] 黄雅兰, 黄江, 宋大强, 等.积雪草苷对阿尔茨海默病模型大鼠海马组织中PPAR-γ蛋白表达的影响 [J].中国药房, 2016, 27(34): 4791-4794.
[84] Hossain S, Hashimoto M, Katakura M,.Medicinal value of asiaticoside for Alzheimer’s disease as assessed using single-molecule-detection fluorescence correlation spectroscopy, laser-scanning microscopy, transmission electron microscopy, and in silico docking [J]., 2015, 15: 118.
[85] 张晶, 张彪.“补肾益智方”治疗老年遗忘型轻度认知功能障碍31例临床研究 [J].江苏中医药, 2016, 48(5): 33-34.
[86] Hou X Q, Zhang L, Yang C,.Alleviating effects of Bushen-Yizhi Formula on ibotenic acid-induced cholinergic impairments in rat [J]., 2015, 18(2): 111-127.
[87] Cai H B, Luo Y X, Yan X,.The mechanisms of Bushen-Yizhi Formula as a therapeutic agent against Alzheimer’s disease [J]., 2018, 8(1): 3104.
[88] 王改凤.补肾益智方对-半乳糖联合β-淀粉样蛋白25-35致老年痴呆模型大鼠的作用及机制 [J].中国组织工程研究, 2016, 20(49): 7307-7313.
[89] 顾晓群, 余黎, 武相, 等.补肾益智方治疗阿尔茨海默病斑马鱼模型的作用及机制研究 [J].南京中医药大学学报, 2020, 36(1): 56-62.
[90] 李孟宇.六味地黄汤及其活性部位对阿尔茨海默病模型小鼠神经发生的作用研究 [D].南宁: 广西医科大学, 2018.
[91] Wang J H, Zhang X R, Cheng X R,.LW-AFC, A new formula derived from Liuwei Dihuang Decoction, ameliorates cognitive deterioration and modulates neuroendocrine-immune system in SAMP8 mouse [J]., 2017, 14(2): 221-238.
[92] Cheng X R, Huang Y, Zhang Y X,.LW-AFC, a new formula from the traditional Chinese medicine Liuwei Dihuang Decoction, as a promising therapy for Alzheimer’s disease: Pharmacological effects and mechanisms [J]., 2020, 87: 159-177.
[93] Durairajan S S K, Huang Y Y, Yuen P Y,.Effects of Huanglian-Jie-Du-Tang and its modified formula on the modulation of amyloid-β precursor protein processing in Alzheimer’s disease models [J]., 2014, 9(3): e92954.
[94] Gu X R, Zhao H Y, Zhou J Y,.Effects of Huang-Lian-Jie-du Decoction on oxidative stress and AMPK-SIRT1 pathway in Alzheimer’s disease rat [J]., 2020, 2020: 6212907.
[95] 冯佩.黄连解毒汤对/双转基因阿尔茨海默病模型小鼠脑内β-淀粉样前体蛋白基因表达影响研究 [J].亚太传统医药, 2015, 11(24): 14-16.
[96] Gu X R, Zhou J Y, Zhou Y Y,.Huanglian Jiedu Decoction remodels the periphery microenvironment to inhibit Alzheimer’s disease progression based on the “brain-gut” axis through multiple integrated omics [J]., 2021, 13(1): 44.
[97] 贾茜, 罗海, 许微微, 等.地黄饮子加减治疗阿尔茨海默病的疗效观察 [J].中国医院用药评价与分析, 2018, 18(4): 499-500.
[98] 张丽, 汪园园, 周静波, 等.地黄饮子干预阿尔茨海默病患者的疗效观察及作用机制探讨 [J].中华中医药杂志, 2018, 33(11): 4948-4952.
[99] 马涛, 王新祥, 张允岭, 等.地黄饮子对阿尔茨海默病小鼠学习记忆及脑组织能量代谢的影响 [J].国际中医中药杂志, 2014, 36(6): 539-543.
[100]张春梅.补阳还五汤治疗阿尔茨海默病的疗效及对MMSE积分、ADL评分的影响研究 [J].中国现代医生, 2016, 54(31): 126-128.
[101]费洪新, 韩玉生, 杜徽, 等.补阳还五汤对阿尔茨海默病小鼠海马形态学和β淀粉样蛋白水平的影响 [J].中国实验方剂学杂志, 2014, 20(23): 142-145.
[102]于修芳, 雷霞, 曹玲, 等.补阳还五汤对阿尔茨海默病小鼠海马凋亡因子及学习记忆能力的影响 [J].中国实验方剂学杂志, 2018, 24(3): 109-113.
[103]Liu B, Liu G L, Wang Y Y,.Protective effect of Buyang Huanwu Decoction on neurovascular unit in Alzheimer’s disease cell model via inflammation and RAGE/LRP1 pathway [J]., 2019, 25: 7813-7825.
[104]费洪新, 周忠光, 韩玉生, 等.补阳还五汤对阿尔茨海默病小鼠血脑屏障通透性的影响 [J].时珍国医国药, 2015, 26(5): 1028-1031.
[105]尹漾阳, 廖文莉, 王平.涤痰汤及其拆方对阿尔茨海默病大鼠行为及tau蛋白磷酸化的影响 [J].中华中医药杂志, 2020, 35(6): 2799-2802.
[106]彭静, 刘玲, 陈钢, 等.涤痰汤对痰浊阻窍型MCI模型大鼠血脂及氧化应激指标的影响 [J].时珍国医国药, 2018, 29(3): 530-533.
[107]尹漾阳, 王平.涤痰汤及其拆方对阿尔茨海默病大鼠神经保护作用的研究 [J].中国中西医结合杂志, 2019, 39(11): 1385-1389.
[108]王晓宁, 李浩, 刘剑刚, 等.还脑益聪方对老年认知障碍大鼠学习记忆及脑组织β淀粉样蛋白和Tau蛋白表达的影响 [J].中国老年学杂志, 2015, 35(9): 2336-2339.
[109]Cao Y, Jia X X, Wei Y,.Traditional Chinese medicine Huannao yicong decoction extract decreases tau hyperphosphorylation in the brain of Alzheimer’s disease model rats induced by Aβ1-42[J]., 2016, 2016: 6840432.
[110]Wang N, Jia Y M, Zhang B,.Neuroprotective mechanism of Kai Xin San: Upregulation of hippocampal insulin-degrading enzyme protein expression and acceleration of amyloid-beta degradation [J]., 2017, 12(4): 654-659.
[111]李妍, 时悦, 李巍, 等.开心散调控PI3K/Akt/GSK3β信号通路促进AD模型小鼠脑内神经再生 [J].中药药理与临床, 2020, 36(5): 73-78.
[112]Qiang W J, Chen Y, He F Y,.Molecular biological mechanisms of Yuan Zhi Powder in the treatment of Alzheimer’s disease: An analysis based on network pharmacology [J]., 2018, 1(1): 90-101.
[113]Li B, Xie P J, Hao Y W,.Yuan‑Zhi‑San inhibits tau protein aggregation in an Aβ1‑40‑induced Alzheimer’s disease rat model via the ubiquitin‑proteasome system [J]., 2021, 23(4): 279.
[114]杨晓娟, 袁耀, 张生林.健脑益智汤对阿尔茨海默病大鼠学习记忆和氧化应激的影响 [J].山西医科大学学报, 2006, 37(5): 456-458.
[115]杨晓娟, 郝慧宁, 张生林, 等.健脑益智汤对阿尔茨海默病大鼠海马凋亡蛋白表达的影响 [J].中国药物与临床, 2016, 16(6): 781-783.
[116]钱红月, 肖移生, 侯吉华, 等.黄精丸抑制-半乳糖和冈田酸所致学习记忆障碍小鼠海马神经元tau蛋白过磷酸化的作用机制 [J].中国实验方剂学杂志, 2021, 27(1): 72-80.
[117]杨晶莹, 肖移生, 姜劼琳, 等.黄精丸对阿尔茨海默病大鼠大脑的抗氧化作用及Aβ1-42APP蛋白表达的影响[J].中国实验方剂学杂志, 2020, 26(6): 32-38.
[118]陈耀辉, 燕波, 官扬, 等.二精丸对去卵巢+-半乳糖联合Aβ1-40致肾阴虚AD大鼠学习记忆能力的影响 [J].中药新药与临床药理, 2019, 30(12): 1421-1427.
[119]Yang X Y, Guan Y, Yan B,.Evidence‑based complementary and alternative medicine bioinformatics approach through network pharmacology and molecular docking to determine the molecular mechanisms of Erjing pill in Alzheimer’s disease [J]., 2021, 22(5): 1252.
[120]马春林, 吴红彦, 段永强, 等.黑逍遥散对/双转基因小鼠海马和脑皮层CaMKⅡα蛋白及其磷酸化表达的影响 [J].中国实验方剂学杂志, 2020, 26(6): 25-31.
[121]崔淑梅, 吴红彦, 马春林, 等.黑逍遥散对AD模型小鼠海马区APP, PERK表达的影响[J].中国实验方剂学杂志, 2019, 25(22): 8-14.
[122]林映仙, 杨文静, 曹宁宁, 等.逍遥散及其加减方的抗抑郁作用比较研究 [J].中草药, 2021, 52(1): 137-144.
[123]李高申, 郭梅珍, 赵唯贤.逍遥散对阿尔茨海默病模型大鼠海马mRNA表达的影响 [J].中国老年学杂志, 2015, 35(15): 4199-4201.
[124]纪云飞, 王瑞君, 李晓波.复方四君子汤的化学成分和药理作用研究进展 [J].中草药, 2016, 47(5): 837-843.
[125]刘美琪, 卫东锋, 马涛, 等.天芪益智颗粒对Aβ1-42诱导的阿尔茨海默病大鼠学习记忆能力及蛋白质组的影响 [J].中国中医药信息杂志, 2019, 26(6): 42-50.
[126]Zhao J S, Wu Y M, Ma T.Effects of Tianqi-Yizhi Granules on oxidative stress in the brain tissue, and learning and memory in Alzheimer’s disease model rats [J]., 2015, 37: 239-242.
[127]Wang K, Sun W M, Xu J C,.Yishen Huazhuo Decoction induces autophagy to promote the clearance of Aβ1-42in SAMP8 mice: Mechanism research of a traditional Chinese formula against Alzheimer’s disease [J]., 2020, 19(4): 276-289.
[128]Lin C R, Zhou Z, Xu J C,.Changes of brain activity during a functional magnetic resonance imaging stroop task study: Effect of Chinese herbal formula in Alzheimer’s disease [J]., 2017, 16: 46-53.
[129]Zhang Y L, Lin C R, Zhang L L,.Cognitive improvement during treatment for mild Alzheimer’s disease with a Chinese herbal formula: A randomized controlled trial [J]., 2015, 10(6): e0130353.
[130]齐越, 姜鸿, 李纪彤, 等.益智聪明汤对Aβ25-35致阿尔茨海默病小鼠tau蛋白磷酸化的影响[J].中成药, 2017, 39(10): 1999-2003.
[131]齐越, 王亚斌, 李纪彤, 等.益智聪明汤对Aβ25-35致阿尔茨海默病小鼠模型Tau蛋白影响 [J].中国公共卫生, 2018, 34(1): 63-66.
[132]Yang C C, Jia X Y, Zhang L,.Shenqi Xingnao Granules ameliorates cognitive impairments and Alzheimer’s disease-like pathologies in/mouse model [J]., 2020, 12(4): 421-429.
[133]贾晓玉, 张兰, 罗艺, 等.参芪醒脑方对痴呆模型小鼠学习记忆能力及脑组织胆碱乙酰转移酶、乙酰胆碱酯酶含量的影响 [J].中国中医药信息杂志, 2018, 25(4): 56-61.
[134]Song Y C, Yuan H X, Chen T Y,.An Shen Ding Zhi Ling alleviates symptoms of attention deficit hyperactivity disorder via anti-inflammatory effects in spontaneous hypertensive rats [J]., 2021, 11: 617581.
[135]王欣波, 赵宇, 袁星星.安神定志方对阿尔茨海默病大鼠海马组织miR-103a-3p及其介导的Tau蛋白磷酸化的影响 [J].中国中医药信息杂志, 2021, 28(2): 62-68.
[136]盛望, 李旭华, 胡国恒, 等.肾脑复元汤对阿尔茨海默病模型大鼠学习记忆及凋亡相关蛋白的影响 [J].世界中西医结合杂志, 2017, 12(8): 1072-1076.
Research progress on anti-Alzheimer’s disease and mechanism of traditional Chinese medicine
TIAN Wen-guo1, 2, WANG Chun-fang1, 2, CHEN Jin-peng2, 3, 4, LIU Yi2, 3, 4, GAI Xiao-hong2, 3, 4, REN Tao2, 3, 4, TIAN Cheng-wang2, 3, 4
1.Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2.Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3.Tianjin Key Laboratory of Quality Marker of Traditional Medicine, Tianjin 300462, China 4.State Key Laboratory of Drug Delivery and Pharmacokinetics, Tianjin 300462, China
Alzheimer’s disease is one of the major diseases currently threatening the health and survival of older people.With the aging of China’s population, its morbidity and mortality are also increasing year by year.The pathogenesis of Alzheimer’s disease is complex, with multiple mechanisms involved.With multi-component, multi-pathway and multi-target action characteristics, traditional Chinese medicine has unique therapeutic advantages and potential for Alzheimer’s disease which has complex pathological mechanisms.This paper focuses on the prevention and treatment of Alzheimer’s disease with traditional Chinese medicine.Research progress on anti-Alzheimer’s disease and mechanism of single traditional Chinese medicine and their active fractions, active constituents, and traditional Chinese medicine compound were reviewed in this paper, in order to provide reference for anti-Alzheimer’s disease of traditional Chinese medicine.
Alzheimer’s disease; tenuigenin; ginsenoside; rhynchophylline;tanshinone IIA; schisandrin B; mechanism
R282.710.5
A
0253 - 2670(2022)10 - 3195 - 14
10.7501/j.issn.0253-2670.2022.10.030
2022-02-05
国家自然科学基金青年科学基金项目(82003936)
田文国,硕士研究生,研究方向为药物分析与质量标志物研究。E-mail: tian_wen_guo@163.com
通信作者:田成旺 E-mail: tiancw@tjipr.com
[责任编辑 崔艳丽]
