淫羊藿素通过Akt/mTOR调控糖酵解抑制肝内胆管癌细胞增殖的作用机制研究
2022-05-24邓冬杰谈相云王楚婷郑国华王桂红胡俊杰
邓冬杰,李 励,谈相云,孙 懿,王楚婷,郑国华, 2,王桂红*,胡俊杰*
淫羊藿素通过Akt/mTOR调控糖酵解抑制肝内胆管癌细胞增殖的作用机制研究
邓冬杰1,李 励1,谈相云1,孙 懿1,王楚婷1,郑国华1, 2,王桂红1*,胡俊杰1*
1.湖北中医药大学药学院,湖北 武汉 430065 2.湖北中医药大学中药资源与中药复方教育部重点实验室,湖北 武汉 430065
探究淫羊藿素对人肝内胆管癌HuCCT1细胞增殖的影响及其作用机制。CCK-8法检测淫羊藿素对HuCCT1细胞增殖活性的影响;平板克隆法检测淫羊藿素对HuCCT1细胞集落形成能力的影响;流式细胞术检测淫羊藿素对HuCCT1细胞周期的影响;分光光度法检测淫羊藿素对HuCCT1细胞葡萄糖摄取量、乳酸生成量、三磷酸腺苷(adenosine triphosphate,ATP)生成量以及己糖激酶(hexokinase,HK)和丙酮酸激酶(pyruvate kinase,PK)活性的影响;Western blotting法检测淫羊藿素对HuCCT1细胞中增殖相关蛋白和蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路及糖酵解相关蛋白表达的影响;Western blotting检测淫羊藿素对瞬时转染基因质粒的HuCCT1细胞中Akt/mTOR及糖酵解相关蛋白表达的影响。淫羊藿素显著抑制HuCCT1细胞的活力,并呈时间和剂量相关性;淫羊藿素呈剂量相关性地抑制HuCCT1细胞的集落形成(<0.001);淫羊藿素可以将HuCCT1细胞周期阻滞在G1期,并显著降低增殖相关蛋白的表达水平(<0.05);淫羊藿素可以显著降低HuCCT1细胞葡萄糖摄取量、乳酸生成量及ATP生成量(<0.05、0.01、0.001);淫羊藿素显著抑制糖酵解相关酶(HK、PK)的活性以及蛋白表达水平(<0.05、0.01、0.001);淫羊藿素显著降低磷酸化Akt(phosphorylated Akt,p-Akt)、磷酸化mTOR(phosphorylated mTOR,p-mTOR)、磷酸化核糖体蛋白S6(phosphorylatedribosomal protein S6,p-RPS6)的蛋白表达水平(<0.05、0.01);淫羊藿素显著降低基因过表达的HuCCT1细胞中p-Akt、p-mTOR、p-RPS6、HK1、HK2、PKM1、PKM2的蛋白表达水平(<0.05、0.01、0.001)。淫羊藿素能够抑制HuCCT1细胞的增殖,其作用机制可能与Akt/mTOR信号通路调控的糖酵解途径有关。
淫羊藿素;肝内胆管癌;增殖;糖酵解;蛋白激酶B/哺乳动物雷帕霉素靶蛋白
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是起源于肝内胆管上皮细胞的原发性恶性肿瘤,是继肝细胞癌(hepatocellular carcinoma,HCC)之后第2常见的肝恶性肿瘤,占原发性肝癌的10%~15%[1]。临床上主要以药物化疗为主,吉西他滨联合铂类仍是治疗ICC的一线选择,但会使患者出现不良反应或产生耐药性[2]。因此,寻找更加安全有效的药物对临床上治疗ICC具有重要意义。
能量代谢的异常改变是肿瘤细胞的主要特征之一,这种代谢表型的特征是优先依赖有氧糖酵解产生能量[3]。有研究表明,抑制肿瘤糖酵解途径可以有效抑制肿瘤细胞的增殖,甚至起到杀灭肿瘤细胞的作用[4]。同时,研究证实蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)可以促进糖酵解途径中关键酶的表达,导致肿瘤细胞的葡萄糖摄取增强和糖酵解途径异常活跃,增加能量供应,促使肿瘤细胞无限增殖[5-7]。以上结果表明,Akt/mTOR信号通路与糖酵解密切相关。因此,抑制Akt/mTOR信号通路调控的糖酵解途径,降低肿瘤细胞的能量供应,可以成为治疗ICC的有效策略。
淫羊藿素是从中药小檗科植物淫羊藿中分离得到的异戊二烯类黄酮衍生物。研究发现,淫羊藿素可以通过诱导细胞周期阻滞、促进细胞凋亡和坏死、干预肿瘤相关信号通路、抑制血管生成等途径对肝细胞癌、乳腺癌、肺癌、前列腺癌等多种癌症起到抑制作用[8-12]。Li等[13]研究发现淫羊藿素可以抑制恶性胶质瘤细胞的糖酵解,减少细胞的葡萄糖消耗量和乳酸生成量,进而抑制肿瘤细胞的增殖。但是,目前关于淫羊藿素对ICC的调控作用尚未见报道。因此,本研究基于肿瘤糖酵解途径,以人肝内胆管癌HuCCT1细胞为研究对象,探究淫羊藿素对HuCCT1细胞增殖的影响及其作用机制,为临床开发治疗ICC的药物提供参考。
1 材料
1.1 细胞株
HuCCT1细胞购自上海信裕生物科技有限公司。
1.2 药品与试剂
淫羊藿素(质量分数≥98%,批号PS001091)购自成都普思生物科技股份有限公司;Akt质粒(pT3-EF1α-HA-myr-AKT1)由美国加州大学Chenxin实验室构建;Neofect转染试剂(批号D210102)购自北京零客创智生物技术有限公司;RPMI 1640培养基(批号AG29546226)、0.25%胰蛋白酶(批号J200033)、青霉素和链霉素(批号J120017)购自美国Hyclone公司;PBS缓冲液(批号MA0015-Jul-29G)购自大连美仑生物技术有限公司;胎牛血清(批号2059461RP)购自美国Gibco公司;CCK-8试剂盒(批号KQ749)购自日本同仁化学研究所;结晶紫(批号SLBP0250V)购自美国Sigma公司;细胞周期试剂盒(批号EG20201109)购自广州捷倍斯生物科技有限公司;葡萄糖氧化酶测定试剂盒(批号2021A1GE1011)购自北京普利莱基因技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号710N0317)、乳酸含量检测试剂盒(批号20200612)、三磷酸腺苷(adenosine triphosphate,ATP)含量检测试剂盒(批号20211215)、己糖激酶(hexokinase,HK)活性检测试剂盒(批号20211116)、丙酮酸激酶(pyruvate kinase,PK)活性检测试剂盒(批号20210610)购自北京索莱宝生物科技有限公司;M-PERTM哺乳动物蛋白抽提试剂(批号VI311347)、BCA蛋白定量试剂盒(批号SI251119)、ECL超敏化学发光液(批号VF304274)均购自美国Thermo Fisher Scientific公司;蛋白酶抑制剂(批号06021)、磷酸酶抑制剂(批号07121)均购自康为世纪科技有限公司;兔源磷酸化mTOR(phosphorylated mTOR,p-mTOR)单克隆抗体(批号ab109268)、兔源核糖体蛋白S6(ribosomal protein S6,RPS6)单克隆抗体(批号ab225676)均购自英国Abcam公司;兔源Akt多克隆抗体(批号10176-2-AP)、周期蛋白E1(Cyclin E1)单克隆抗体(批号11554-1-AP)、鼠源β-actin单克隆抗体(批号HRP-60008)购自Proteintech公司;兔源磷酸化Akt(phosphorylated Akt,p-Akt)单克隆抗体(批号13038)、兔源磷酸化RPS6(phosphorylated RPS6,p-RPS6)单克隆抗体(批号4858)、兔源HK1单克隆抗体(批号2024)、兔源HK2单克隆抗体(批号2867)、兔源PKM1单克隆抗体(批号7067)、兔源PKM2单克隆抗体(批号4053)、兔源增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)单克隆抗体(批号13110)、兔源Cyclin D1单克隆抗体(批号2978)、HRP标记的山羊抗兔IgG二抗(批号7074)、HRP标记的山羊抗鼠IgG二抗(批号7076)购自美国CST公司;十二烷基硫酸钠-聚丙烯酰胺凝胶试剂盒(批号18D250)购自美国EpiZyme Scientific公司;其余试剂为分析纯,水为去离子水。
1.3 仪器
MCO-15AC型CO2细胞培养箱(日本Sanyo公司);VCX750型超声波破碎仪(美国Sonics公司);CKX31型倒置显微镜、TC20型细胞计数器(日本Olympus公司);Trans-Blot TurboTM型全能型蛋白转膜仪、Power Pac Basic型电泳仪、xMark型全波长酶标仪(美国Bio-Rad公司);Centrifuge 5424R型高速冷冻离心机(德国Eppendorf公司);XB220A型分析天平(瑞士Precisa公司);G-BOX型成像分析系统(英国Syngene公司);Vortex-Genie2型漩涡混合器(美国Scientific Industries公司);NovoCyte D2060R型流式细胞仪(艾森生物科技有限公司)。
2 方法
2.1 淫羊藿素母液的配制
精密称取淫羊藿素3.68 mg溶于2 mL DMSO中,配成浓度为5 mmol/L的淫羊藿素母液,经0.22 μm微孔滤膜滤过,避光保存于4 ℃,使用时用培养基稀释。
2.2 细胞培养
HuCCT1细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养基,于37 ℃、5% CO2的培养箱中培养。
2.3 淫羊藿素对HuCCT1细胞存活率的影响
取处于对数生长期的HuCCT1细胞,以5000个/孔接种于96孔板中,设置药物组、对照组(不含药物)和空白组(只含空白培养基)。于培养箱中培养过夜后,药物组加入一系列浓度梯度的淫羊藿素,对照组加入等体积的培养基。每个剂量设6个复孔。分别培养24、48 h后,每孔加入10 μL CCK-8溶液,继续培养2 h后,采用酶标仪测定450 nm处的吸光度()值,计算细胞存活率,并计算淫羊藿素给药24、48 h的半数抑制浓度(50% concentration of inhibition,IC50)值,根据IC50值设置后续实验的给药浓度,设置低、中、高3个剂量。
细胞存活率=(给药-空白)/(对照-空白)
2.4 淫羊藿素对HuCCT1细胞集落形成能力的影响
取处于对数生长期的HuCCT1细胞,以1000个/孔接种于6孔板中,培养24 h。设置对照组(不加药物)和低、中、高剂量(12.5、25.0、50.0 µmol/L)给药组,每组设置3个复孔。培养14 d,每2天换液,直至形成肉眼可见的细胞克隆。弃去细胞培养液,用PBS清洗3次,用4%多聚甲醛固定15 min,用0.5%结晶紫染色15 min,倒掉染液,放入清水中清洗干净残留在6孔板中的染液,沥干水分。相机拍摄记录每孔集落的大致情况,于显微镜下计数1 cm2正方格内细胞集落数(黏连在一起的多个细胞落算作多个,边角处数上不数下,数左不数右),再乘以每孔的面积即为总的细胞集落数。
2.5 淫羊藿素对HuCCT1细胞周期的影响
取处于对数生长期的HuCCT1细胞,接种于直径为5 cm的培养皿中,于培养箱中培养。待细胞生长至60%~70%时,吸弃旧培养基,加入PBS清洗2次。设置对照组(不加药物)和低、中、高剂量(12.5、25.0、50.0 µmol/L)给药组,每组设置3个复孔。给药24 h后收集细胞,加入1 mL冰浴预冷的PBS重悬,离心沉淀细胞,弃去上清。加入1 mL在4 ℃冰浴预冷的70%乙醇重悬细胞,于4 ℃固定细胞2 h。离心沉淀细胞,弃去乙醇。每个样品加入0.5 mL碘化丙啶染色液,缓慢并充分重悬细胞。锡箔纸包裹EP管避光,于37 ℃孵育30 min后采用流式细胞仪检测。
2.6 淫羊藿素对HuCCT1细胞葡萄糖摄取、乳酸生成量以及ATP生成量的影响
细胞培养、实验分组以及给药浓度同“2.5”项下方法。给药24 h后收集细胞,取少量细胞悬液于细胞计数器中计量细胞数。离心后收集细胞,按照试剂盒操作步骤,采用酶标仪分别在555 nm(葡萄糖)、570 nm(乳酸)、340 nm(ATP)处检测值,计算葡萄糖消耗量、乳酸生成量和ATP生成量。
2.7 淫羊藿素对HuCCT1细胞HK和PK活性的影响
细胞培养、实验分组以及给药浓度同“2.5”项下方法。给药24 h后收集细胞,取少量细胞悬液于细胞计数器中计量细胞数。离心收集细胞至EP管中,弃上清。按照试剂盒操作步骤,采用酶标仪检测340 nm处的值,计算HK和PK的活性。
2.8 淫羊藿素对瞬时转染Akt基因质粒的HuCCT1细胞中糖酵解相关蛋白表达的影响
取处于对数生长期的HuCCT1细胞,接种于10 cm培养皿中,设置对照组、模型组和淫羊藿素低、中、高剂量(12.5、25.0、50.0 µmol/L)组。待细胞生长至60%时,进行转染实验。先将基因质粒与不含血清的RPMI 1640培养基稀释并充分混匀,在质粒稀释液中加入Neofect转染试剂(培养基∶质粒∶转染试剂=1 mL∶1 μg∶1 μL),轻轻混匀,室温静置15~30 min。将转染复合物加入细胞培养基中,轻轻混匀,培养24 h后进行药物干预。
2.9 淫羊藿素对HuCCT1细胞中Akt/mTOR信号通路、细胞周期、增殖以及糖酵解相关蛋白的表达
从细胞中分离出总蛋白,采用BCA蛋白检测试剂盒检测蛋白浓度。取30 µg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺电泳分离后,转至PVDF膜上,用5%脱脂牛奶封闭1 h后,分别加入Cyclin D1、Cyclin E1、PCNA、p-Akt、Akt、p-mTOR、p-RPS6、RPS6、HK1、HK2、PKM1、PKM2和β-actin抗体孵育过夜;然后用TBST缓冲溶液清洗3次,每次10 min,室温孵育二抗1 h后,用TBST缓冲溶液清洗3次,每次10 min。用ECL化学发光液反应,并于G-BOX成像分析系统获得蛋白免疫印记图。采用Image J软件对图像进行分析,以β-actin为内参,以相对灰度值表示目标蛋白的表达。
2.10 统计学方法
采用GraphPad Prism 7.0软件对数据进行统计分析,计量资料以表示,两组间均数采用检验比较,多组间均数采用One-Way ANOVA检验。
3 结果
3.1 淫羊藿素对HuCCT1细胞存活率的影响
如图1所示,与对照组比较,淫羊藿素(40、60、80 µmol/L)组24、48 h的细胞存活率均明显降低,并呈时间和剂量相关性,其IC50值为50.48 µmol/L。参考以上结果,故确定12.5、25.0、50.0 µmol/L作为淫羊藿素的给药剂量,并选择作用24 h作为淫羊藿素的给药条件。
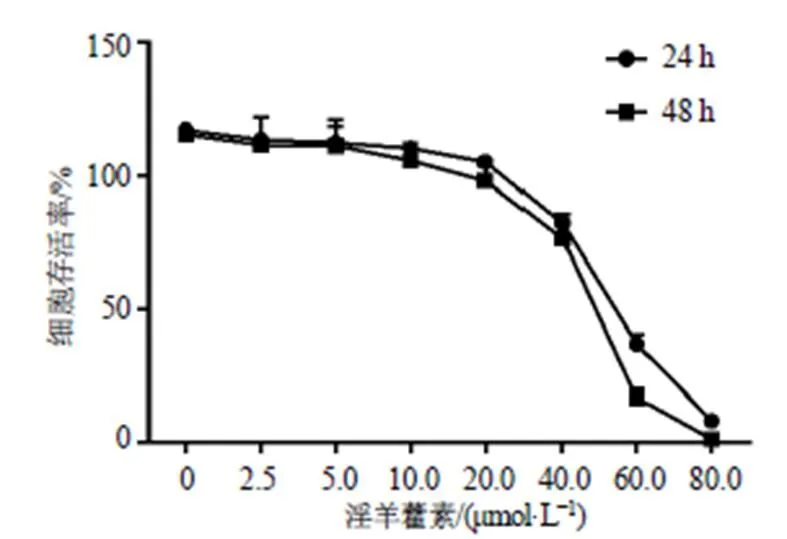
图1 淫羊藿素对HuCCT1细胞存活率的影响(, n = 3)
3.2 淫羊藿素抑制HuCCT1细胞集落形成能力
如图2所示,与对照组比较,淫羊藿素(12.5、25.0、50.0 µmol/L)组细胞克隆形成数均显著降低(<0.001),且呈剂量相关性,表明淫羊藿素能够抑制HuCCT1细胞的集落形成能力,即抑制HuCCT1细胞的增殖。
3.3 淫羊藿素将HuCCT1细胞周期阻滞于G1期
不同浓度的淫羊藿素处理细胞24 h后,流式细胞仪检测结果如图3所示,与对照组比较,随着淫羊藿素浓度的增加,处于G1期的HuCCT1细胞数量显著增加(<0.05、0.01),表明淫羊藿素可将HuCCT1细胞周期阻滞于G1期。随后检测了G1期的特异性周期蛋白Cyclin D1、Cyclin E1以及增殖蛋白PCNA的表达水平,相比于对照组,淫羊藿素组细胞中Cyclin D1、Cyclin E1和PCNA的表达水平均有所降低,且高剂量更为显著(<0.05)。
3.4 淫羊藿素抑制HuCCT1细胞中葡萄糖摄取、乳酸生成量以及ATP生成量
如图4所示,与对照组相比,淫羊藿素显著抑制HuCCT1细胞的葡萄糖摄取、乳酸生成量以及ATP生成量(<0.05、0.01、0.001),且呈剂量相关性。

图2 淫羊藿素对HuCCT1细胞集落形成的影响(, n = 3)

图3 淫羊藿素对HuCCT1细胞周期(A) 和细胞周期相关蛋白表达(B) 的影响(, n = 3)

图4 淫羊藿素对HuCCT1细胞葡萄糖摄取、乳酸生成量以及ATP生成量的影响(, n = 3)
3.5 淫羊藿素抑制HuCCT1细胞中糖酵解相关酶的表达及活性
如图5-A所示,与对照组相比,淫羊藿素给药组中糖酵解途径相关酶HK1、HK2、PKM1、PKM2的蛋白表达水平均显著降低(<0.05、0.01、0.001),表明淫羊藿素可以抑制糖酵解相关酶的表达水平。由于糖酵解进程不仅与酶的含量有关,也与酶的活力有关,因此进一步检测了淫羊藿素对HuCCT1细胞糖酵解相关酶活力的影响。如图5-B所示,淫羊藿素处理细胞24 h后,与对照组相比,HK和PK的活力均显著降低(<0.01),并呈剂量相关性。

图5 淫羊藿素对HuCCT1细胞HK、PK蛋白表达(A) 及活性(B) 的影响(, n = 3)
3.6 淫羊藿素抑制HuCCT1细胞中Akt/mTOR信号通路的活化
如图6所示,淫羊藿素处理细胞24 h后,与对照组相比,p-Akt、p-mTOR、p-RPS6蛋白表达水平均显著降低(<0.05、0.01),Akt、RPS6蛋白表达水平无明显差异,表明淫羊藿素抑制HuCCT1细胞中Akt/mTOR信号通路的活化。
3.7 淫羊藿素抑制瞬时转染Akt基因质粒的HuCCT1细胞中糖酵解相关蛋白的表达
为了进一步探究淫羊藿素调控HuCCT1细胞糖酵解的作用机制,对HuCCT1细胞进行瞬时转染基因质粒来激活Akt/mTOR信号通路,并检测其下游糖酵解途径相关蛋白的表达。Western blotting结果如图7所示,与对照组相比,瞬时转染基因质粒的HuCCT1细胞模型组中p-Akt、p-mTOR、p-RPS6、HK1、HK2、PKM1、PKM2等蛋白表达水平显著升高(<0.01、0.001),表明转染基因质粒的HuCCT1细胞中Akt/mTOR信号通路被激活,并进一步促进其下游糖酵解相关蛋白的表达水平;与瞬时转染基因质粒的模型组相比,不同浓度的淫羊藿素给药24 h后,p-Akt、p-mTOR、p-RPS6、HK1、HK2、PKM1、PKM2等蛋白表达水平显著降低(<0.05、0.01、0.001),表明淫羊藿素可以通过Akt/mTOR信号级联来调控HuCCT1细胞的糖酵解途径。
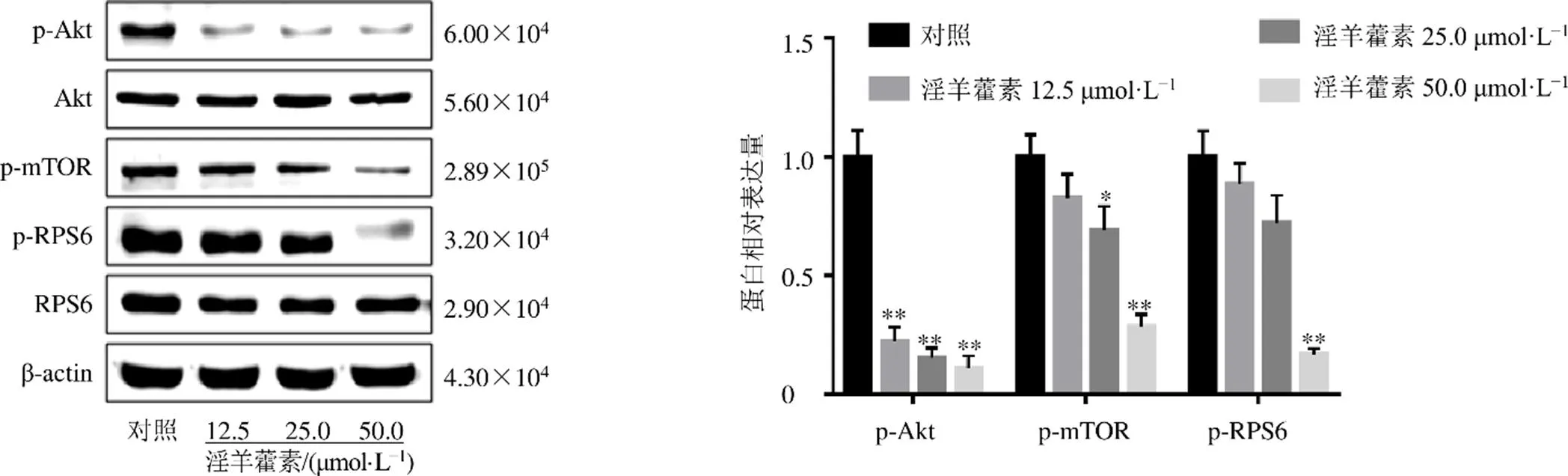
图6 淫羊藿素对HuCCT1细胞中Akt/mTOR信号通路相关蛋白表达的影响(, n = 3)
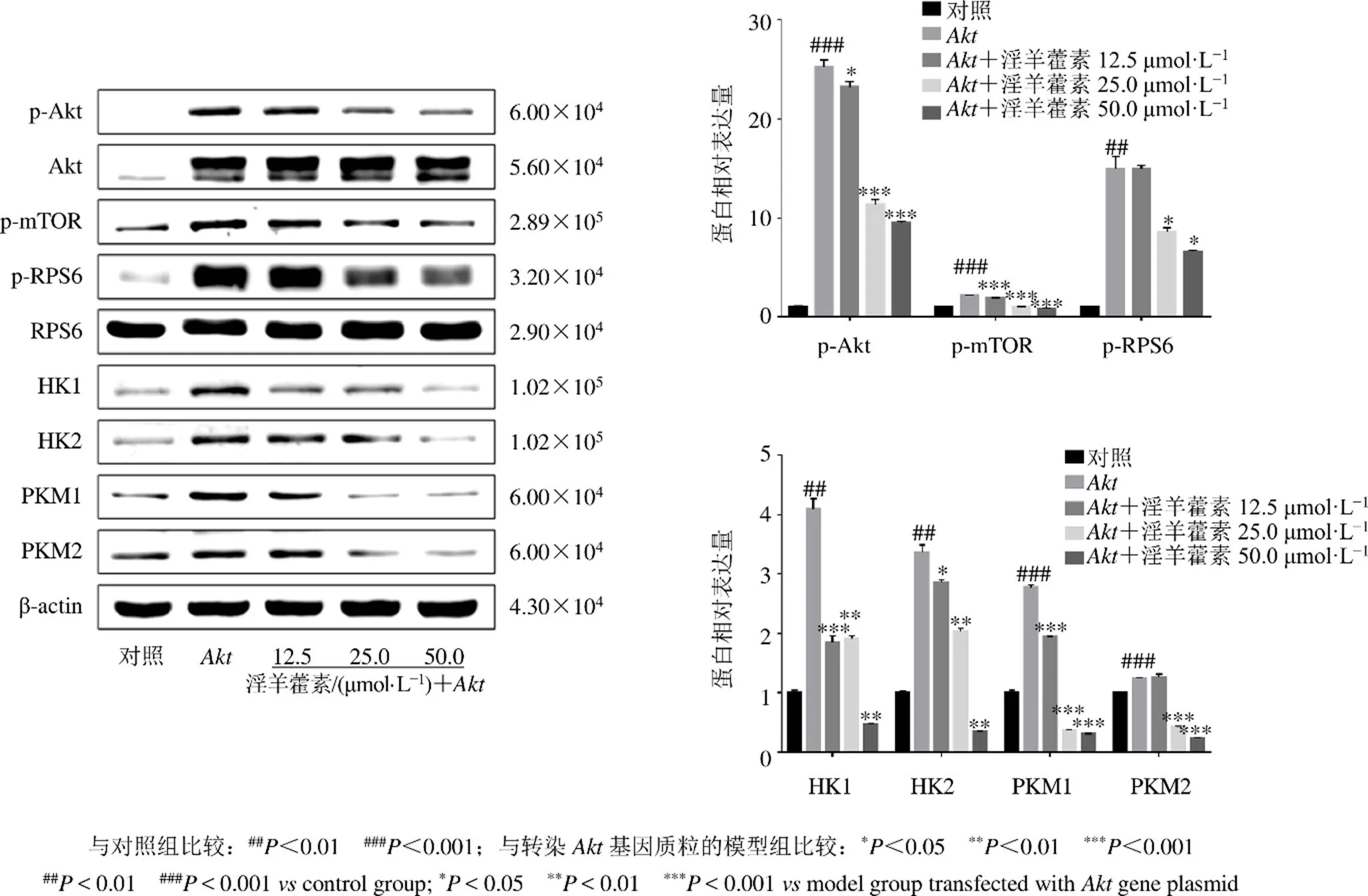
图7 淫羊藿素对瞬时转染Akt质粒的HuCCT1细胞中糖酵解相关蛋白表达的影响(, n = 3)
4 讨论
越来越多的证据表明,淫羊藿素是一种新型的抗癌药物,可以通过多种途径抑制肿瘤的发展[14]。Zhao等[9]发现淫羊藿素呈剂量和时间依赖的方式抑制肝癌PLC、PRF/5、Huh7细胞的活力,这种抑制活性是通过白细胞介素-6(interleukin-6,IL-6)/Janus激酶2(Janus kinase 3,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路发挥作用的。在肾细胞癌细胞中,淫羊藿素可降低Cyclin D、CyclinE1等增殖相关蛋白的表达[15]。同时,在三阴性乳腺癌中,淫羊藿素也可以通过抑制雌激素受体-α36(estrogen receptor-α36,ER-α36)介导的有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号传导和雌激素对Cyclin D1的诱导来抑制肿瘤细胞增殖[16]。本研究结果表明,淫羊藿素呈时间和剂量依赖性地抑制HuCCT1细胞的活性,并有效抑制HuCCT1细胞的克隆形成。流式细胞术结果表明,淫羊藿素能将HuCCT1细胞的周期阻滞于G1期,并降低HuCCT1细胞中Cyclin D1、Cyclin E1的表达水平。然而具体的调控机制尚不清楚,因此在后续研究中进行了进一步探索。
肿瘤细胞中葡萄糖代谢的主要特征为葡萄糖摄取量增加和有氧糖酵解[3]。尽管有氧糖酵解在ATP净产量方面不如氧化磷酸化,但其产能快捷,可以满足肿瘤细胞对快速增殖的能量需求[17]。同时,肿瘤细胞也会通过增加葡萄糖摄取来促进糖酵解途径。高水平的糖酵解为肿瘤细胞的无限增殖快速提供了能量,而此过程中产生的中间产物也成为了促进肿瘤增殖的诱因。糖酵解途径关键酶的表达水平增强或活性增加是肿瘤细胞糖酵解途径异常活跃的主要原因之一[4]。HK作为糖酵解过程中的重要限速酶,可以将进入细胞的葡萄糖转化为6-磷酸-葡萄糖(glucose 6-phosphate,G6P),在多种癌症中表达异常升高[18]。PK是糖酵解过程最后一步的标志性限速酶,负责将细胞质中的磷酸烯醇丙酮酸(phosphoenolpyruvate,PEP)和二磷酸腺苷(adenosine diphosphate,ADP)转化为丙酮酸盐和ATP以促进肿瘤生长[19-20]。该酶在多种肿瘤进展中起着至关重要的作用,其中的1个亚型PKM2在ICC中高表达,因此被作为ICC的预测标志[21-22]。本研究发现,淫羊藿素可以显著降低HuCCT1细胞中葡萄糖摄取量、乳酸生成量以及ATP生成量,并且也可以降低HK、PK的酶活力。同时,不同浓度的淫羊藿素给药干预后,HuCCT1细胞中糖酵解相关蛋白HK1、HK2、PKM1、PKM2蛋白的表达水平显著降低。以上结果说明淫羊藿素可以降低HuCCT1细胞糖酵解相关酶的表达水平及活力,抑制糖酵解途径,减少葡萄糖摄取量、乳酸生成量和ATP生成量。另外,有研究表明,调控肿瘤细胞的糖酵解,可以使细胞周期相关蛋白表达升高,刺激肿瘤细胞增殖[23]。说明淫羊藿素可能通过调控细胞的糖酵解,阻断肿瘤细胞能量供应,诱导细胞周期阻滞,从而有效抑制ICC细胞快速增殖。
研究发现,Akt/mTOR信号传导途径在调节糖酵解过程中发挥重要作用[24]。Akt是肿瘤糖酵解表型的重要驱动因素,并通过增加葡萄糖转运蛋白的表达和膜易位以及磷酸化关键糖酵解酶来调控糖酵解[25]。同时,Akt可被磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)磷酸化而激活,活化的Akt可以激活下游的关键效应分子mTORC并可与Raptor结合形成mTOR复合物1。mTORC1可以磷酸化p70核糖体蛋白S6激酶进而激活RPS6来促进蛋白质合成用于肿瘤细胞增殖[2]。另外,活化的mTORC1也可以通过调控下游的转录因子影响糖酵解相关酶的表达水平[25]。本研究发现淫羊藿素可以降低HuCCT1细胞中p-Akt、p-mTOR、p-RPS6等Akt/mTOR信号通路相关蛋白的表达水平,因此推测淫羊藿素可能通过Akt/mTOR调控HuCCT1细胞的糖酵解途径。为了进一步探究淫羊藿素是否是通过Akt/mTOR信号级联来调控HuCCT1细胞糖酵解抑制其增殖。本研究在HuCCT1细胞中瞬时转染基因质粒激活Akt/mTOR信号级联,并通过Western blotting检测Akt/mTOR信号通路以及其下游的糖酵解相关蛋白的表达水平。结果表明,在HuCCT1细胞中,Akt/mTOR信号级联激活后可以使其下游的HK1、PKM1、HK2、PKM2等糖酵解关键蛋白的表达水平显著升高。而在采用淫羊藿素干预24 h后,HuCCT1细胞中糖酵解相关蛋白的表达水平显著降低。这说明淫羊藿素可以通过Akt/mTOR信号级联调控HuCCT1细胞糖酵解,进而抑制其增殖。
综上所述,本研究结果表明淫羊藿素可能通过抑制Akt/mTOR信号通路,阻断细胞糖酵解,限制肿瘤细胞能量供应,将细胞阻滞于G1期,进而抑制肝内胆管癌细胞增殖。今后将进一步结合体内实验深入研究淫羊藿素的作用机制,为淫羊藿素治疗肝内胆管癌的药物研究开发提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang H, Yang T, Wu M C,.Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management [J]., 2016, 379(2): 198-205.
[2] 张姗姗.第二代mTOR抑制剂MLN0128在AKT/Yap诱导的小鼠肝内胆管癌模型中的疗效及机制研究 [D].上海: 第二军医大学, 2017.
[3] Ganapathy-Kanniappan S, Geschwind J F H.Tumor glycolysis as a target for cancer therapy: Progress and prospects [J]., 2013, 12: 152.
[4] Li X, Yu C, Luo Y C,.Aldolase A enhances intrahepatic cholangiocarcinoma proliferation and invasion through promoting glycolysis [J]., 2021, 17(7): 1782-1794.
[5] Jia L J, Huang S, Yin X R,.Quercetin suppresses the mobility of breast cancer by suppressing glycolysis through Akt-mTOR pathway mediated autophagy induction [J]., 2018, 208: 123-130.
[6] Wu H J, Zhao H M, Chen L.Deoxyshikonin inhibits viability and glycolysis by suppressing the Akt/mTOR pathway in acute myeloid leukemia cells [J]., 2020, 10: 1253.
[7] Gao X, Han H.Jolkinolide B inhibits glycolysis by downregulating hexokinase 2 expression through inactivating the Akt/mTOR pathway in non-small cell lung cancer cells [J]., 2018, 119(6): 4967-4974.
[8] Zhang C J, Sui X X, Jiang Y D,.Antitumor effects of icaritin and the molecular mechanisms [J]., 2020, 29(156): 5-16.
[9] Zhao H, Guo Y M, Li S,.A novel anti-cancer agent Icaritin suppresses hepatocellular carcinoma initiation and malignant growth through the IL-6/Jak2/Stat3 pathway [J]., 2015, 6(31): 31927-31943.
[10] Guo Y M, Zhang X T, Meng J,.An anticancer agent icaritin induces sustained activation of the extracellular signal-regulated kinase (ERK) pathway and inhibits growth of breast cancer cells [J]., 2011, 658(2/3): 114-122.
[11] Zheng Q, Liu W W, Li B,.Anticancer effect of icaritin on human lung cancer cells through inducing S phase cell cycle arrest and apoptosis [J]., 2014, 34(4): 497-503.
[12] Hu J M, Wu X B, Yang C,.Anticancer effect of icaritin on prostate cancer via regulating miR-381-3p and its target gene[J]., 2019, 8(18): 7833-7845.
[13] Li H C, Liang Q H, Wang L.Icaritin inhibits glioblastoma cell viability and glycolysis by blocking the IL-6/Stat3 pathway [J]., 2018, doi: 10.1002/jcb.28000.
[14] 曾华婷, 郭健, 陈彦.淫羊藿素药理作用及其新型给药系统的研究进展[J].中草药, 2020, 51(20): 5372-5380.
[15] Li S S, Priceman S J, Xin H,.Icaritin inhibits JAK/STAT3 signaling and growth of renal cell carcinoma [J]., 2013, 8(12): e81657.
[16] Wang X, Zheng N, Dong J,.Estrogen receptor-α36 is involved in icaritin induced growth inhibition of triple-negative breast cancer cells [J]., 2017, 171: 318-327.
[17] Locasale J W, Cantley L C.Altered metabolism in cancer [J]., 2010, 8: 88.
[18] LIS P, Dyląg M, Niedźwiecka K,.The HK2dependent “Warburg effect” and mitochondrial oxidative phosphorylation in cancer: Targets for effective therapy with 3-bromopyruvate [J]., 2016, 21(12): E1730.
[19] Wong N, de Melo J, Tang D M.PKM2, a central point of regulation in cancer metabolism [J]., 2013, 2013: 242513.
[20] Li Z W, Yang P, Li Z Y.The multifaceted regulation and functions of PKM2 in tumor progression [J]., 2014, 1846(2): 285-296.
[21] Qian Z, Hu W D, Lv Z,.PKM2 upregulation promotes malignancy and indicates poor prognosis for intrahepatic cholangiocarcinoma [J]., 2020, 44(2): 162-173.
[22] Fu K, Yang X L, Wu H,.Diabetes and PKM2 affect prognosis in patients with intrahepatic cholangiocarcinoma [J]., 2020, 20(5): 265.
[23] Leal-Esteban L C, Fajas L.Cell cycle regulators in cancer cell metabolism [J]., 2020, 1866(5): 165715.
[24] Chen G Q, Tang C F, Shi X K,.Halofuginone inhibits colorectal cancer growth through suppression of Akt/mTORC1 signaling and glucose metabolism [J]., 2015, 6(27): 24148-24162.
[25] Cairns R A, Harris I S, Mak T W.Regulation of cancer cell metabolism [J]., 2011, 11(2):85-95.
Effect and mechanism of icaritin on inhibiting proliferation of intrahepatic cholangiocarcinoma cells by Akt/mTOR-mediated glycolysis
DENG Dong-jie1, LI Li1, TAN Xiang-yun1, SUN Yi1, WANG Chu-ting1, ZHENG Guo-hua1, 2, WANG Gui-hong1, HU Jun-jie1
1.School of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430065, China 2.Key Laboratory of Chinese Medicine Resource and Compound Prescription, Ministry of Education, Hubei University of Chinese Medicine, Wuhan 430065, China
To investigate the effect and mechanism of icaritin on proliferation of human intrahepatic cholangiocarcinoma HuCCT1 cells.CCK-8 method was used to detect the effect of icaritin on proliferation activity of HuCCT1 cells.Plate cloning method was used to detect the effect of icaritin on colony formation ability of HuCCT1 cells.Flow cytometry was used to detect the effect of icaritin on cell cycle of HuCCT1 cells.Spectrophotometric method was used to detect the effect of icaritin on glucose uptake, lactate production and adenosine triphosphate (ATP) production of HuCCT1 cells and activities of hexokinase (HK) and pyruvate kinase (PK) in cells.Western blotting was used to detect the effect of icaritin on expression levels of proliferation-related proteins, protein kinase B (Akt)/mammalian target of rapamycin (mTOR) pathway and glycolysis-related proteins in HuCCT1 cells.Western blotting was used to detect the effect of icaritin on expression levels of Akt/mTOR and glycolysis-related proteins in HuCCT1 cells transiently transfected withplasmids.Icaritin significantly inhibited the viability of HuCCT1 cells in a time-and dose-dependent manner.Icaritin significantly inhibited the colony formation of HuCCT1 cells in a dose-dependent manner (< 0.001).Icaritin blocked cell cycle of HuCCT1 in G1phase, and significantly reduced the expression levels of proliferation-related proteins (< 0.05).Icaritin significantly reduced glucose uptake, lactate production and ATP production in HuCCT1 cells (< 0.05, 0.01, 0.001).Icaritin significantly inhibited the activities of glycolysis-related enzymes and protein expression levels (< 0.05, 0.01, 0.001).Icaritin significantly reduced the expression levels of phosphorylated Akt (p-Akt), phosphorylated mTOR (p-mTOR) and phosphorylated ribosomal protein S6 (p-RPS6) (< 0.05, 0.01).Icaritin significantly reduced the expression levels of p-Akt p-mTOR, p-RPS6, HK1, HK2, PKM1 and PKM2 in HuCCT1 cells over-expressinggene (< 0.05, 0.01, 0.001).Icaritin can inhibit the proliferation of HuCCT1 cells, and its mechanism may be related to Akt/mTOR-mediated glycolysis pathway.
icaritin; intrahepatic cholangiocarcinoma; proliferation; glycolysis; protein kinase B/mammalian target of rapamycin
R285.5
A
0253 - 2670(2022)10 - 3061 - 09
10.7501/j.issn.0253-2670.2022.10.016
2022-01-18
湖北省自然科学基金资助项目(2020CFB523)
邓冬杰(1997—),女,硕士,研究方向为中药新制剂、新剂型的研究。Tel: 15926974750 E-mail: 1819493671@qq.com
通信作者:胡俊杰(1984—),男,博士,高级实验师,主要从事中药物质基础及作用机制研究。 Tel: 13407126284 E-mail: hero0712@163.com
王桂红(1964—),女,硕士生导师,主任药师,主要从事中药新制剂、新剂型的研究。Tel: 18986026269 E-mail: 843773585@qq.com
[责任编辑 李亚楠]
