β-榄香烯对骨癌痛大鼠吗啡耐受的影响及作用机制研究
2022-05-24周琴飞龚黎燕鲍关爱丁群芳季晶晶
周琴飞,龚黎燕,鲍关爱,丁群芳,季晶晶
β-榄香烯对骨癌痛大鼠吗啡耐受的影响及作用机制研究
周琴飞,龚黎燕*,鲍关爱,丁群芳,季晶晶
中国科学院大学附属肿瘤医院(浙江省肿瘤医院),中国科学院基础医学与肿瘤研究所罕见病及头颈内科,浙江 杭州 310022
研究β-榄香烯对骨癌痛大鼠吗啡耐受的影响及作用机制。雄性Wistar大鼠随机分为对照组、吗啡组及β-榄香烯低、高剂量(0.7、2.8 mg/kg)组和艾芬地尔(5 mg/kg)组,每组15只;对照组予以生理盐水胫骨注射并ip二甲基亚砜,其余各组构建骨癌痛-慢性吗啡耐受模型后,分别ip相应药物,通过检测机械撤退阈值和热退潜伏期对各组大鼠进行疼痛行为学评估;采用qRT-PCR检测各组大鼠脊髓组织肿瘤坏死因子(tumor necrosis factor-α,)、白细胞介素-1β(interleukin-1β,)、、μ阿片受体(μ opioid receptor,)、-甲基--门冬氨酸受体亚单位2B(-methyl--asparate receptor subunit 2B,)和环磷酸腺苷(cyclic adenosine monophosphate,)的mRNA表达;采用Western blotting检测各组大鼠脊髓组织NR2B、cAMP和MOPR的蛋白表达。分别采用不同质量浓度(5、10、20、25 µg/mL)的β-榄香烯处理人神经母细胞瘤SH-SY5Y细胞,采用CCK-8法检测SH-SY5Y细胞活性,采用试剂盒测定细胞内cAMP含量,确定β-榄香烯作用于SH-SY5Y细胞的适宜质量浓度;设置对照组、吗啡组、β-榄香烯(5 µg/mL)组和艾芬地尔(10 µmol/L)组,对照组予以常规培养,其余各组采用10 µmol/L吗啡作用SH-SY5Y细胞48 h,以构建吗啡耐受细胞模型,而后β-榄香烯组和艾芬地尔组分别给予相应药物,采用qRT-PCR检测、、、、和的mRNA表达,采用Western blotting检测NR2B、cAMP和MOPR的蛋白表达。给药第1天,相较于对照组,其余各组大鼠机械撤退阈值和热退潜伏期明显升高(<0.001),随给药时间延长,吗啡组机械撤退阈值和热退潜伏期逐渐下降,各给药组机械撤退阈值和热退潜伏期明显高于吗啡组(<0.05、0.01、0.001)。β-榄香烯显著抑制SH-SY5Y细胞活性(<0.001),且呈剂量和时间相关性;β-榄香烯对SH-SY5Y细胞内cAMP含量无明显影响。吗啡耐受可促进大鼠脊髓组织和SH-SY5Y细胞中TNF-α、IL-1β、IL-6、NR2B及cAMP表达(<0.001),抑制MOPR表达(<0.001);给予艾芬地尔或β-榄香烯后,则呈现相反趋势(<0.01、0.001),且β-榄香烯的作用呈剂量相关性。β-榄香烯具有一定的镇痛作用,可通过调控MOPR/NR2B有效缓解骨癌痛大鼠吗啡耐受。
β-榄香烯;骨癌痛;吗啡耐受;μ阿片受体/-甲基--门冬氨酸受体亚单位2B;炎症因子
骨癌痛是一种慢性顽固性癌痛,临床多采用吗啡等阿片类药物治疗,但长期使用吗啡易产生耐受现象,即吗啡耐受,导致吗啡镇痛效果逐渐减弱甚至消失,需要增加吗啡剂量才能获得同等的镇痛效果[1]。研究表明,μ阿片受体(μ opioid receptor,MOPR)是阿片类药物发挥镇痛作用最主要因子,当MOPR与阿片类激动剂结合时,其分子构象发生改变,与G蛋白结合形成G蛋白-阿片受体复合物,可降低胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)等信号浓度,阻止痛觉冲动的传导,发挥镇痛作用[2]。但长期使用阿片类药物的情况下,可引起MOPR蛋白磷酸化,导致MOPR脱敏,进而造成吗啡耐受。因此,探寻改善患者吗啡耐受的有效药物及作用机制是骨癌痛临床治疗中亟待解决的问题,对骨癌痛患者预后的改善具有重要意义。
β-榄香烯是从天然中草药姜科植物温郁金Y.H.Chen et.Ling中提取获得的萜烯类化合物,是该类中药主要活性成分[3-4]。研究发现β-榄香烯作为非细胞毒性抗肿瘤药物,具有选择性抑制肿瘤细胞增殖和提高免疫功能的“双重效应”[5];此外,《中国药典》记载郁金提取物可“治经闭痛经,胸腹胀痛,刺痛,热病神昏,癫痫发狂,黄疸尿赤”[6];《新华本草纲要》记载郁金提取物“治癥瘕积聚,气血凝滞,脘腹胀痛,食积胀痛,经闭腹痛等症”[7];可见郁金提取物除抗肿瘤作用外,还具有“止痛”的功效。另有研究发现,β-榄香烯可能通过抑制-甲基--门冬氨酸受体亚单位2B(-methyl--asparate receptor subunit 2B,NR2B)表达,调节MOPR、cAMP等因子表达,发挥镇痛作用[8]。但目前β-榄香烯在骨癌痛患者吗啡耐受改善方面的疗效及具体作用机制仍有待研究。此外,艾芬地尔是一种-甲基--门冬氨酸(-methyl--asparate,NMDA)受体的拮抗剂,对NR2B亚基具有高度的选择性。故在本研究中将艾芬地尔作为阳性对照药物,探讨β-榄香烯对骨癌痛大鼠吗啡耐受的影响及作用机制,为骨癌痛的临床治疗提供科学依据。
1 材料
1.1 动物
SPF级雄性Wistar大鼠75只,6~8周龄,体质量(250±15)g,购自上海斯莱克实验动物有限公司,动物合格证号[SCXK(沪)0036875]。动物饲养于SPF级动物房,12 h/12 h明暗交替,温度(20±2)℃,湿度40%~60%。动物实验经浙江省肿瘤医院伦理委员会批准(批准号2020-110-003),遵循中国动物护理和机构伦理指导方针。
1.2 细胞株
大鼠乳腺癌Walker 256细胞购自ATCC细胞库,人神经母细胞瘤SH-SY5Y细胞购自ICLC-IST细胞库。
1.3 药品与试剂
盐酸吗啡注射液(批号040203,国药准字H21022436,10 mg/mL)购自东北制药集团沈阳第一制药有限公司;β-榄香烯(批号0408251,国药准字H20110114)购自大连石药集团远大制药有限公司;艾芬地尔(批号12892)购自美国Sigma-Aldrich公司;生理盐水(1.5 mL/支,批号200801255,国药准字S10870001)购自北京生物制品研究所有限责任公司;蛋白提取试剂盒(批号BC3710)购自北京索莱宝生物科技有限公司;BCA蛋白浓度测定试剂盒(批号AB102536)购自艾博抗上海贸易有限公司;Trizol试剂(批号15596026)、逆转录试剂盒(批号4374966)购自美国Thermo Fisher Scientific公司;CCK-8试剂盒(批号ab228554)、MOPR一抗(批号ab5392)、NR2B一抗(批号ab254356)、cAMP一抗(批号ab76238)、β-actin一抗(批号ab8226)、HRP标记的山羊抗兔IgG抗体(批号ab6721)、HRP标记的山羊抗小鼠IgG抗体(批号ab205719)购自英国Abcam公司。
1.4 仪器
371型CO2培养箱、ST16R型高速冷冻离心机、Multiskan Fc型酶标仪(美国Thermo Fisher Scientific公司);DYCZ-20E型电泳设备(北京六一生物科技有限公司);LightCycler 96型qRT-PCR仪(罗氏集团);热辐射测痛仪、纤维丝测痛仪(美国ITC Life Science)。
2 方法
2.1 动物分组、造模及给药
按照随机数字表法将Wistar大鼠分为对照组、吗啡组及β-榄香烯低、高剂量(0.7、2.8 mg/kg)组和艾芬地尔(5 mg/kg)组,每组15只。对照组予以生理盐水胫骨注射,其余各组大鼠构建骨癌痛-慢性吗啡耐受模型[9]:首先进行大鼠骨癌痛模型建立,大鼠ip 7%戊巴比妥钠(3 mL/kg)麻醉后,腹部朝下,左侧后肢先用10 mL注射器穿刺打孔,然后换10 μL微量移液器进入胫骨骨髓腔,缓慢注射3 μL Walker 256乳腺癌细胞悬液(3×103~3×104个),注射完毕后用骨蜡封住针孔,清洁创口,缝合肌肉皮肤;而后进行慢性吗啡耐受模型建立,大鼠癌细胞接种术后10 d时,腰3~4椎间隙穿刺鞘内置管,注射吗啡(20 µL/kg),1次/d,连续10 d,大鼠在注射吗啡10 d后形成较为稳定的机械痛敏,标志慢性吗啡耐受模型建立成功。而后对照组、吗啡组ip 200 μL二甲基亚砜(dimethyl sulfoxide,DMSO),各给药组ip溶于200 μL DMSO的相应药物,1次/d,连续10 d。各组大鼠行为学测定完毕后,ip 2%戊巴比妥钠深度麻醉后快速断头处死,于冰上取腰L4、L5段脊髓背角组织标本。
2.2 疼痛行为学评估
大鼠建模成功后1~10 d,按照以下指标观察并记录大鼠疼痛行为学变化。
2.2.1 机械撤退阈值检测 将大鼠置于玻璃板小室中,放置于金属筛网上,让大鼠适应环境10 min后,在安静清醒的状态下将刺激仪细纤维接触大鼠左侧足底中部,在5 s内最大可追加至50 g力量,观察大鼠缩爪反应并记录机械撤退阈值。
2.2.2 热退潜伏期检测 将大鼠置于玻璃板小室中,在安静清醒的状态下调整热痛刺激仪光源焦距照射动物后肢掌心,记录从照射到缩爪逃避的时间,即热退潜伏期,每只大鼠测量5次,间隔时间5 min,上限20 s,以避免造成组织损伤。
2.3 qRT-PCR检测大鼠脊髓背角组织肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、NR2B、cAMP和MOPR的mRNA表达
取各组大鼠脊髓背角组织,充分剪碎组织,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。反应条件:95 ℃预变性3 min,然后95 ℃预变性10 s,60 ℃退火30 s,70 ℃延伸30 s;40个循环。引物序列:上游引物5’-GCAAGTTCAACGGCACAG-3’,下游引物5’-CGCCAGTAGACTCCACGAC-3’;上游引物5’-TCCACA ATTA CICCTCGACG-3’,下游引物5’-TCCGATTCTTCTICTGAGCC-3’;上游引物5’-TGCTCCTGGCTCAACTTGTCC-3’,下游引物5’-GCGTGCTAGTGGCTAAGGCATCTG-3’;上游引物5’-AGGTCCTCAGCTACAAGGAAG-3’,下游引物5’-TCTTGAAGTCACAATCCTCTGGT-3’;上游引物5’-CACCGGCAAGGATTCCAA-3’,下游引物5’-CACTCAGGCATCGACATTCG-3’;上游引物5’-AGCCTTTGTCCTCTGCCAAGT-3’,下游引物5’-CCAGAATGTGCCACGGTTTT-3’;上游引物5’-TGTTCTCAGGGAGATCTTGGAAAT-3’,下游引物5’-CATCGCTGTTCATACAATCAGAATT-3’。
2.4 Western blotting检测大鼠脊髓背角组织NR2B、cAMP和MOPR蛋白表达
采用蛋白提取试剂盒提取大鼠脊髓背角组织蛋白,根据BCA蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1 h,分别加入NR2B(1∶1000)、cAMP(1∶50 000)、MOPR(1∶20 000)和β-actin(1∶1000)抗体,4 ℃孵育过夜;加入二抗(1∶2000),孵育1 h,采用ECL化学发光法显影,采用Image J软件分析条带灰度值。
2.5 体外实验
2.5.1 细胞培养 SH-SY5Y细胞接种于含100 IU/mL青霉素、100 μg/mL链霉素、10%胎牛血清的DMEM高糖培养基中,于37 ℃、5% CO2细胞培养箱中培养至对数生长期。
2.5.2 CCK-8法检测细胞存活率 SH-SY5Y细胞以3×104/mL接种至96孔板中,每孔100 µL,加入不同质量浓度(5、10、20、25 µg/mL)的β-榄香烯,对照组加入不含药物的培养基,培养48 h后,每孔加入10 μL CCK-8溶液,孵育4 h,采用酶标仪测定450 nm处的吸光度()值,计算细胞活性。
2.5.3 细胞内cAMP含量检测 SH-SY5Y细胞以3×104/mL接种至96孔板中,每孔100 µL,加入不同质量浓度(5、10、20、25 µg/mL)的β-榄香烯,对照组加入不含药物的培养基,培养48 h后,按照试剂盒说明书测定cAMP含量。
2.5.4 吗啡耐受细胞模型的构建及给药 对照组予以常规培养,采用10 µmol/L吗啡作用细胞48 h以构建吗啡耐受细胞模型[10],同时,各给药组分别加入β-榄香烯(5 µg/mL)和艾芬地尔(10 µmol/L),作用48 h。
2.5.5 qRT-PCR检测细胞、、、、和的mRNA表达 按“2.5.4”项下方法处理细胞,按“2.3”项下方法提取总RNA并合成cDNA,进行qRT-PCR分析。
2.5.6 Western blotting检测细胞NR2B、cAMP和MOPR蛋白表达 按“2.5.4”项下方法处理细胞,按“2.4”项下提取蛋白,检测NR2B、cAMP和MOPR蛋白表达。
2.6 统计分析
使用GraphPad Prism 8.0进行统计分析,计量资料以表示,多组间比较使用单因素方差分析(One-way ANOVA),组间两两比较采用LSD检验。
3 结果
3.1 各组大鼠疼痛行为学评估
如图1所示,在构建大鼠骨癌痛-慢性吗啡耐受模型前(0 d),各组大鼠机械撤退阈值、热退潜伏期无明显差异;给药第1天(1 d),相较于对照组,其余各组机械撤退阈值、热退潜伏期明显升高(<0.001);随给药时间延长,吗啡组机械撤退阈值、热退潜伏期逐渐下降,β-榄香烯低、高剂量组和艾芬地尔组机械撤退阈值、热退潜伏期明显高于吗啡组(<0.05、0.01、0.001);至第10天(10 d),吗啡组与对照组机械撤退阈值、热退潜伏期比较无明显差异,β-榄香烯低、高剂量组和艾芬地尔组机械撤退阈值、热退潜伏期明显高于吗啡组(<0.01、0.001),β-榄香烯高剂量组机械撤退阈值、热退潜伏期高于β-榄香烯低剂量组,说明β-榄香烯和艾芬地尔均可有效改善大鼠吗啡耐受,且β-榄香烯剂量增加,效果更优。
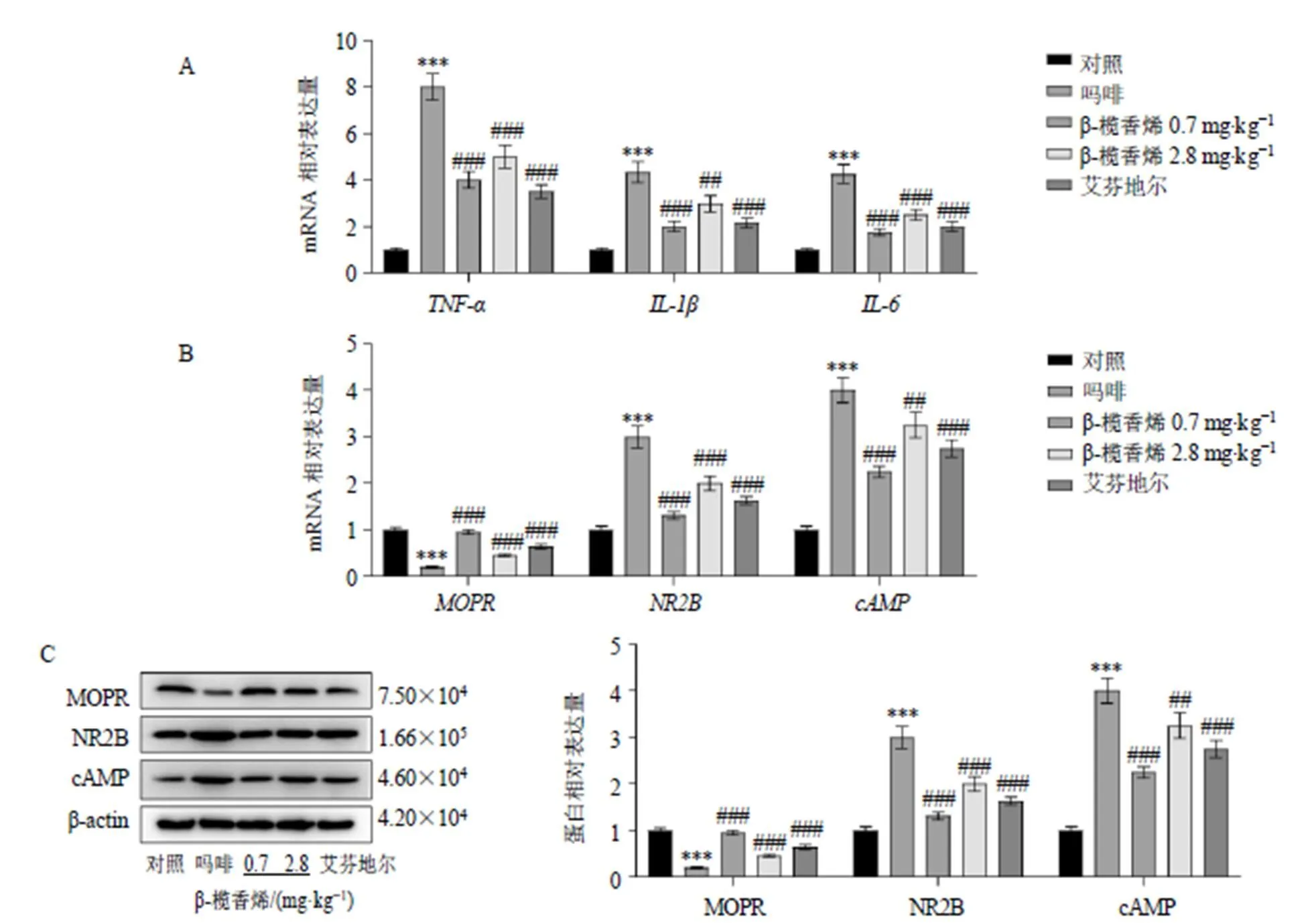
3.2 各组大鼠脊髓背角组织TNF-α、IL-1β、IL-6、NR2B、cAMP和MOPR的mRNA和蛋白表达
如图2-A、B所示,相较于对照组,吗啡组大鼠脊髓组织、、、和mRNA表达水平明显升高(<0.001),mRNA表达水平明显降低(<0.001);相较于吗啡组,β-榄香烯低、高剂量组和艾芬地尔组脊髓组织、、、和mRNA表达水平明显降低(<0.01、0.001),mRNA水平明显升高(<0.001)。如图2-C所示,相较于对照组,吗啡组脊髓组织NR2B和cAMP蛋白表达水平明显升高(<0.001),MOPR蛋白表达水平明显降低(<0.001);相较于吗啡组,β-榄香烯低、高剂量组和艾芬地尔组脊髓组织NR2B和cAMP蛋白表达水平明显降低(<0.01、0.001),MOPR蛋白表达水平明显升高(<0.001)。
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与吗啡组比较:#P<0.05 ##P<0.01 ###P<0.001,下图同
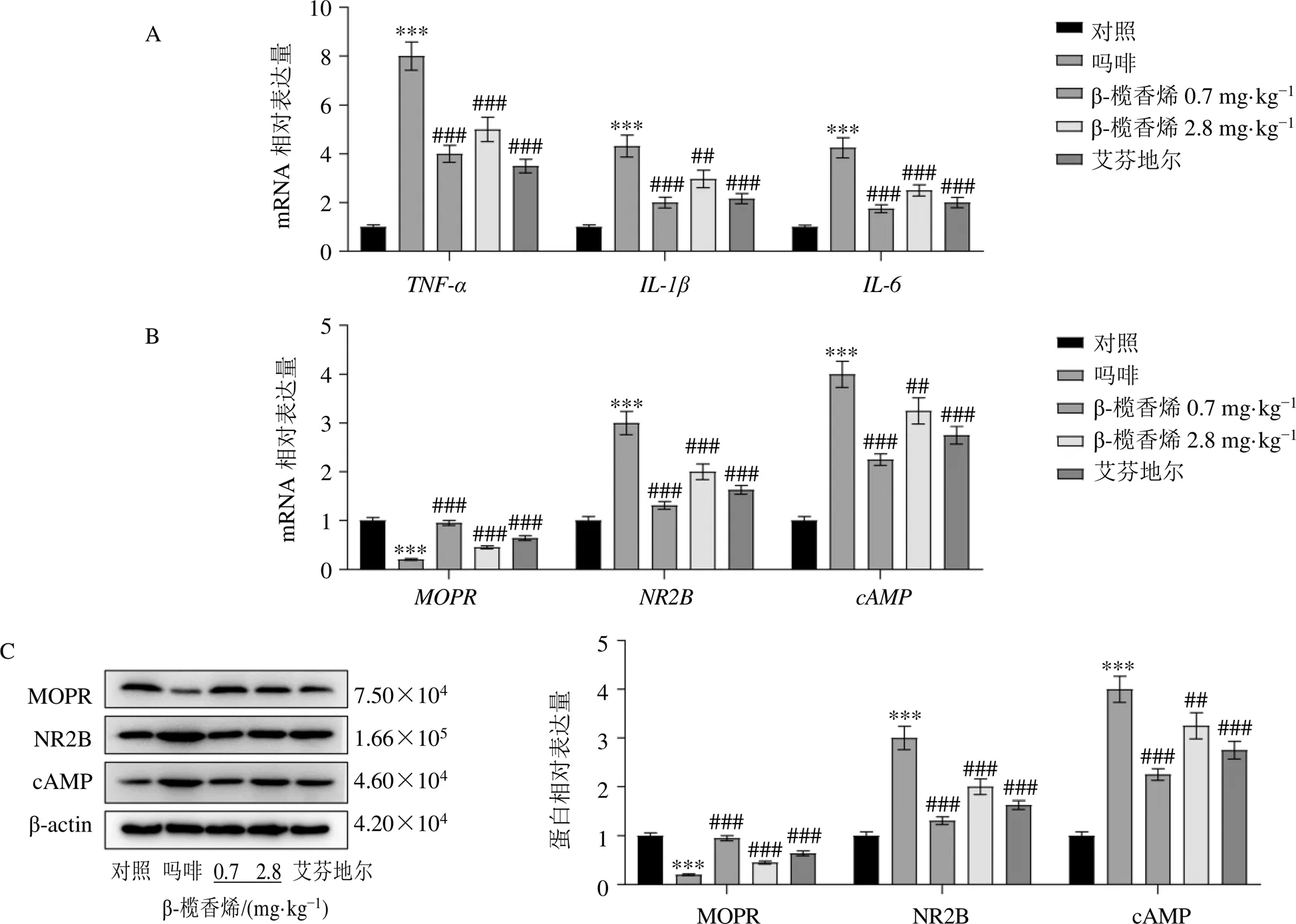
图2 各组大鼠脊髓背角组织TNF-α、IL-1β、IL-6、NR2B、cAMP和MOPR的mRNA(A、B) 和蛋白表达(C) (, n = 3)
3.3 不同浓度的β-榄香烯对SH-SY5Y细胞活性及cAMP含量的影响
采用不同质量浓度的β-榄香烯处理正常培养的SH-SY5Y细胞,并采用CCK-8法检测SH-SY5Y细胞活性,结果见图3-A,β-榄香烯显著抑制SH-SY5Y细胞活性(<0.001),且呈剂量和时间相关性。因此,以5 µg/mL β-榄香烯作用SH-SY5Y细胞48 h为最佳实验条件。采用cAMP检测试剂盒测定SH-SY5Y细胞cAMP含量,结果见图3-B,β-榄香烯对SH-SY5Y细胞内cAMP含量无明显影响。
3.4 β-榄香烯对吗啡耐受细胞模型cAMP含量和TNF-α、IL-1β、IL-6、NR2B、cAMP和MOPR的mRNA和蛋白表达的影响
对照组予以常规培养,吗啡组、β-榄香烯组、艾芬地尔组采用10 µmol/L吗啡作用SH-SY5Y细胞48 h,以构建吗啡耐受细胞模型,而后β-榄香烯组、艾芬地尔组予以β-榄香烯、艾芬地尔处理,采用cAMP检测试剂盒进行各组细胞cAMP含量测定,如图4-A所示,相较于对照组,吗啡组cAMP水平明显升高(<0.001;相较于吗啡组,β-榄香烯、艾芬地尔组cAMP水平明显降低(<0.001)。如图4-B、C所示,相较于对照组,吗啡组、、、和mRNA表达水平明显升高(<0.001),mRNA表达水平明显降低(<0.001);相较于吗啡组,β-榄香烯组、艾芬地尔组、、、和mRNA表达水平明显降低(<0.001),mRNA表达水平明显升高(<0.001)。如图4-D、E所示,相较于对照组,吗啡组NR2B和cAMP蛋白表达水平明显升高(<0.001),MOPR蛋白表达水平明显降低(<0.001);相较于吗啡组,β-榄香烯组、艾芬地尔组NR2B和cAMP蛋白表达水平明显降低(<0.001),MOPR蛋白表达水平明显升高(<0.001)。
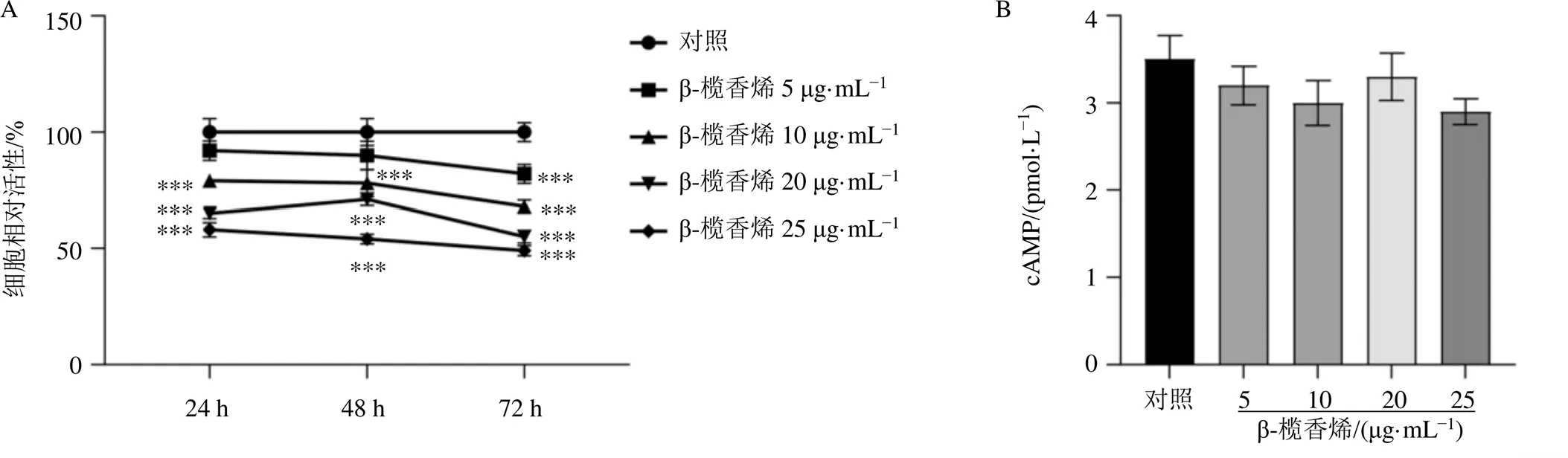
图3 不同质量浓度的β-榄香烯对SH-SY5Y细胞活性(A) 及cAMP含量(B) 的影响(, n = 3)
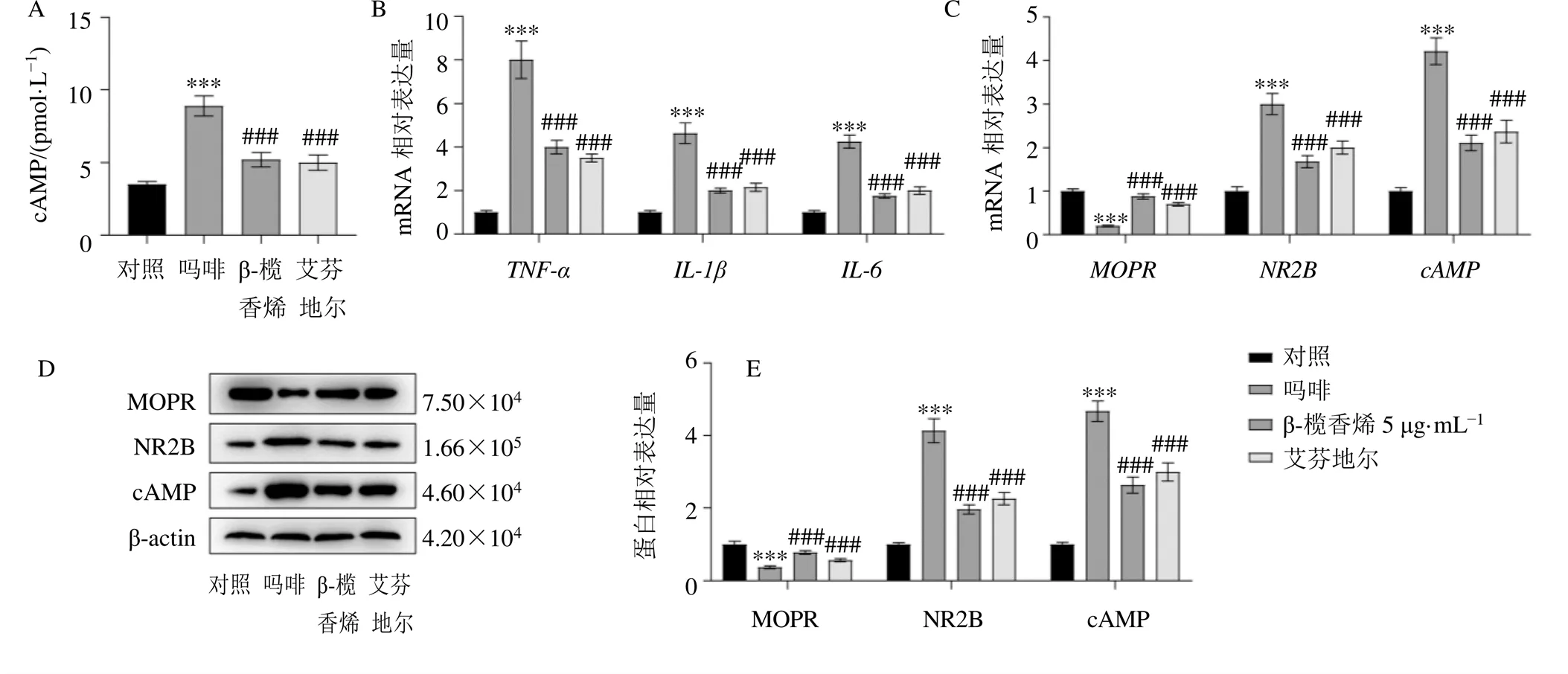
图4 β-榄香烯对吗啡耐受细胞模型cAMP含量(A) 和TNF-α、IL-1β、IL-6、NR2B、cAMP和MOPR的mRNA (B、C) 和蛋白表达(D、E) 的影响(, n = 3)
4 讨论
骨癌痛是由于骨癌患者晚期瘤体明显肿大、组织坏死、侵蚀等造成富含神经的被膜、血管、神经纤维等严重受压、损害与刺激,而出现难以忍受、剧烈的刺激性疼痛,是晚期骨癌的主要症状之一[11-12]。吗啡广泛用于疼痛治疗,尤其是晚期骨癌痛患者,但长期应用会产生吗啡耐受,影响其镇痛效果,其机制可能与MOPR脱敏和内化有关,故对吗啡耐受的改善是目前癌痛治疗的重点[13]。β-榄香烯是从姜科植物温郁金挥发油中分离出来的油状单体,可通过对肿瘤细胞增殖、凋亡、分化、转移等环节的调控发挥抗肿瘤作用[14]。近年来β-榄香烯的止痛功效引起研究者的广泛关注,但β-榄香烯在骨癌痛患者吗啡耐受改善方面的效果仍有待进一步研究[15]。因此,本研究构建大鼠骨癌痛-慢性吗啡耐受模型,予以β-榄香烯或艾芬地尔处理,结果显示,随吗啡给药时间的增加,可使大鼠机械撤退阈值、热退潜伏期逐渐下降,艾芬地尔、β-榄香烯可有效抑制大鼠机械撤退阈值、热退潜伏期的下降,且β-榄香烯的作用呈剂量相关性,说明β-榄香烯具有一定的镇痛作用,可有效缓解骨癌痛大鼠吗啡耐受。
近年来研究发现,调节疼痛相关基因的表达水平是吗啡等阿片类药物发挥镇痛作用的重要机制[16]。MOPR是阿片类药物发挥镇痛作用的最主要亚基,阿片类药物与MOPR结合时,可有效发挥镇痛作用[17]。当MOPR与阿片类激动剂结合时,胞内cAMP等信号浓度降低,Ca2+内流下降,K+外流增加,导致突触前膜P物质的释放减少,阻止痛觉冲动的传导,进而发挥镇痛作用[18]。NMDA受体由亚基NR1、NR2、NR3组成,其中NR2B是参与疼痛产生的主要调节亚基[19]。但在阿片类药物的长期作用下,MOPR由G蛋白偶联受体激酶(G protein-coupled receptor kinases,GRKs)催化发生磷酸化机解偶联,可激活下游磷脂酶C、腺苷酸环化酶通路,从而导致cAMP、甘油二酯、三磷酸肌醇在胞内的表达水平逐渐上升,引起Ca2+内流增加,激活蛋白激酶C(protein kinase C,PKC);PKC激活后转位至细胞膜,同时使NR2B激活,进一步活化PKC,调节神经元敏感状态[20]。为进一步研究β-榄香烯缓解吗啡耐受的具体作用机制,本研究构建了大鼠骨癌痛-慢性吗啡耐受模型及吗啡耐受细胞模型,发现吗啡耐受可促进NR2B、cAMP表达,抑制MOPR表达,给予艾芬地尔或β-榄香烯后,则呈现相反趋势,且β-榄香烯的作用呈剂量相关性,说明β-榄香烯可通过促进MOPR的表达,抑制NR2B、cAMP的表达,缓解神经元敏感状态,阻止痛觉冲动的传导,进而发挥镇痛作用,改善吗啡耐受。
在病理性疼痛产生和维持的整个过程中,神经元和胶质细胞是一个相互作用的信息网络[21]。有研究表明,骨癌痛等外周病理性疼痛刺激可使初级传入神经纤维中枢端及传导疼痛的二级神经元释放神经递质激活胶质细胞,活化的胶质细胞释放TNF-α、IL-1β、IL-6等促炎性细胞因子,进一步促进初级传入纤维中枢端和二级神经元神经递质的释放,产生和维持病理性疼痛状态,并使疼痛扩大化[22]。另有研究表明,炎症反应在吗啡镇痛耐受中也发挥重要作用,在吗啡镇痛耐受模型中,促炎因子TNF-α、IL-1β、IL-6表达水平明显升高,阻断炎性因子产生能够有效缓解吗啡耐药性[23]。本研究结果发现,吗啡耐受可促进、和mRNA表达,给予艾芬地尔或β-榄香烯后,则呈现相反趋势,且β-榄香烯的作用呈剂量相关性,说明β-榄香烯可通过抑制TNF-α、IL-1β和IL-6的表达,减少痛觉冲动的传导,进而发挥镇痛作用,改善吗啡耐受。
综上所述,β-榄香烯具有一定的镇痛作用,可通过调控MOPR/NR2B表达从而有效缓解骨癌痛大鼠吗啡耐受。
利益冲突 所有作者均声明不存在利益冲突
[1] Boland J W, Pockley A G.Influence of opioids on immune function in patients with cancer pain: From bench to bedside [J]., 2018, 175(14): 2726-2736.
[2] 吴强, 林静, 刘民强, 等.去甲基化调控μ阿片受体对神经病理性疼痛痛觉过敏和吗啡耐受的影响 [J].中国药理学通报, 2020, 36(6): 803-808.
[3] Wang K, Wang Z L, Cui R S,.Polysaccharopeptide fromblocks inflammatory osteoarthritis pain-morphine tolerance effects via activating cannabinoid type 2 receptor [J]., 2019, 126: 805-810.
[4] 麻杰, 陈娟, 赵冰洁, 等.抗癌药物β-榄香烯及其衍生物的研究进展[J].中草药, 2018, 49(5): 1184-1191.
[5] 窦磊, 陈洋, 李芳梅, 等.β-榄香烯抑制卵巢癌细胞Cavo-3增殖的作用靶点及机制 [J].解剖科学进展, 2020, 26(3): 255-257.
[6] 中国药典 [S].一部.2020: 278.
[7] 江苏省植物研究所.新华本草纲要 [M].上海: 上海科学技术出版社, 1988: 345.
[8] Gong L Y, Cai H, Zhou Q F,.β-Elemene alleviates bone cancer-related pain in rats by modulating-methyl--aspartate receptor 2B subunit [J]., 2018, 17(4): 597.
[9] 张亚军, 田玉科, 杨承祥, 等.大鼠骨癌痛-慢性吗啡耐受模型的建立 [J].中华麻醉学杂志, 2011, 31(1): 63-66.
[10] 张秀宁, 文迪, 徐贯杰, 等.小剂量氯胺酮对吗啡耐受细胞δ阿片受体及NMDA受体2B亚型表达的影响 [J].中国药理学通报, 2012, 28(1): 70-74.
[11] 徐龙生, 冯勤丽, 张小平, 等.蜈蚣全蝎散对骨癌痛大鼠行为学及其脊髓背角c-fos蛋白表达的影响 [J].中华全科医学, 2018, 16(4): 523-525.
[12] Bu H L, Xia Y Z, Liu P M,.The roles of chemokine CXCL13 in the development of bone cancer pain and the regulation of morphine analgesia in rats [J]., 2019, 406: 62-72.
[13] 冯鹏玖, 张爱民, 苏明, 等.骨癌痛吗啡耐受疼痛模型大鼠脊髓缝隙连接蛋白43的表达情况及其对环磷酸腺苷/蛋白激酶A通路、炎症的影响 [J].广西医学, 2019, 41(23): 3017-3022.
[14] 毛雨秋.β-榄香烯注射液对人肝癌HepG-2细胞侵袭、迁移的作用及其相关机制 [J].实用癌症杂志, 2018, 33(5): 700-703.
[15] 元建华, 廖燕, 李建旺, 等.榄香烯注射液联合盐酸羟考酮缓释片治疗中重度癌痛的效果及对患者免疫功能的影响 [J].现代中西医结合杂志, 2019, 28(24): 2673-2676.
[16] Corder G, Tawfik V L, Wang D,l.Loss of μ opioid receptor signaling in nociceptors, but not microglia, abrogates morphine tolerance without disrupting analgesia [J]., 2017, 23(2): 164-173.
[17] 卢志鹏, 白洁.μ受体在吗啡成瘾及免疫抑制等疾病中的作用和机制 [J].中国药理学通报, 2020, 36(12): 1636-1639.
[18] 潘东, 邢士超, 徐杰丰, 等.简易滴定法治疗阿片类药物耐受癌痛的疗效分析 [J].浙江医学, 2019, 41(14): 1541-1544.
[19] 曾宪政, 郑碧鑫, 樊宇超, 等.阿片药物耐受病人疼痛阈值变化的临床研究 [J].中国疼痛医学杂志, 2019, 25(1): 35-39.
[20] 王春兰.阿片类药物治疗癌性疼痛的止痛效果及影响因素分析 [J].中国医师杂志, 2018, 20(7): 1083-1085.
[21] Ma C, Zhang M Y, Liu L,.Low-dose cannabinoid receptor 2 agonist induces microglial activation in a cancer pain-morphine tolerance rat model [J]., 2021, 264: 118635.
[22] Tu H A, Chu H C, Guan S,.The role of the M1/M2 microglia in the process from cancer pain to morphine tolerance [J]., 2021, 68: 101438.
[23] 梁冰, 方洁.靶向沉默ANXA3对大鼠吗啡镇痛耐受及炎症反应的影响 [J].解放军医学杂志, 2020, 45(1): 68-72.
Effect of β-elemene on morphine tolerance in rats with bone cancer pain and its molecular mechanism
ZHOU Qin-fei, GONG Li-yan, BAO Guan-ai, DING Qun-fang, JI Jing-jing
Department of Rare Diseases and Head and Neck Medicine, Institute of Basic Medicine and Cancer of Chinese Academy of Sciences, The Cancer Hospital of University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Hangzhou 310022, China
To study the effect and mechanism of β-elemene on morphine tolerance in rats with bone cancer pain.Male Wistar rats were randomly divided into control group, morphine group, β-elemene low- and high-dose (0.7, 2.8 mg/kg) groups and ifenprodil (5 mg/kg) group, with 15 rats in each group.Control group was given normal saline tibia injection and ip dimethyl sulfoxide.After bone cancer pain-chronic morphine tolerance model was established in other groups, rats were ip corresponding drugs respectively, mechanical withdrawal threshold and thermal withdrawal latency were detected to evaluate pain behavior; qRT-PCR was used to detect tumor necrosis factor-α (), interleukin-1β (),, μ opioid receptor (),-methyl--aspartate receptor subunit 2B () and cyclic adenosine monophosphate () mRNA expressions in spinal cord tissues of rats in each group; Western blotting was used to detect the protein expressions of NR2B, cAMP and MOPR in spinal cord tissues of rats in each group.Human neuroblastoma SH-SY5Y cells were treated with β-elemene (5, 10, 20, 25 µg/mL), activity of SH-SY5Y cells was detected by CCK-8 method, and kit was used to detect intracellular cAMP content of SH-SY5Y cells, to determine the appropriate concentration of β-elemene acting on SH-SY5Y cells; Control group, morphine group, β-elemene (5 µg/mL) group and ifenprodil (10 µmol/mL) group were set, control group was routinely cultured, and other groups were treated with 10 µmol/L morphine for 48 h to build a morphine-resistant cell model, and then β-elemene group and ifenprodil group were given with corresponding drugs, mRNA expressions of,,,,andwere detected by qRT-PCR, protein expressions of NR2B, cAMP and MOPR were detected by Western blotting.On 1st day of administration, compared with control group, mechanical withdrawal threshold and thermal withdrawal latency of rats in other groups were significantly increased (< 0.001).With the extension of administration time, mechanical withdrawal threshold and thermal withdrawal latency decreased gradually in morphine group.Mechanical withdrawal threshold and thermal withdrawal latency of rats in each administration group were significantly higher than those of morphine group (< 0.05, 0.01, 0.001).β-Elemene significantly inhibited the activity of SH-SY5Y cells (< 0.001) in a dose- and time-dependent manner; β-elemene had no significant effect on intracellular cAMP content of SH-SY5Y cells.Morphine tolerance promoted the expressions of TNF-α, IL-1β, IL-6, NR2B and cAMP in spinal cord tissue of rats and SH-SY5Y cells (< 0.001), and inhibited the expression of MOPR (< 0.001).The opposite trend (< 0.01, 0.001) was observed after the addition of ifenprodil or β-elemene, and the effect of β-elemene was dose-related.β-Elemene has a certain analgesic effect, and can effectively relieve morphine tolerance in rats with bone cancer pain by regulating MOPR/NR2B.
β-elemene; bone cancer pain; morphine tolerance; MOPR/NR2B; inflammatory factors
R285.5
A
0253 - 2670(2022)10 - 3070 - 08
10.7501/j.issn.0253-2670.2022.10.017
2022-01-06
浙江省中医药科技计划项目(2019ZB018);浙江省自然科学基金资助项目(LY19H290001);浙江省医药卫生科技项目(2018KY312,2020374375,2021433869)
周琴飞,硕士,主治医师,研究方向为难治性癌痛。E-mail: zqfbb@126.com
通信作者:龚黎燕,硕士,主任医师,研究方向为难治性癌痛。E-mail: gongliyanhz_hly@163.com
[责任编辑 李亚楠]
