三七总皂苷传递体中5种皂苷类成分含量与包封率的测定研究
2022-05-24范煜航费雅蓉程碧欣丘鹰昆郑杭生
范煜航,徐 畅#,费雅蓉,程碧欣,丘鹰昆,郑杭生*
三七总皂苷传递体中5种皂苷类成分含量与包封率的测定研究
范煜航1,徐 畅1#,费雅蓉,程碧欣1,丘鹰昆2,郑杭生1*
1.浙江中医药大学药学院,浙江 杭州 310053 2.厦门大学药学院,福建 厦门 361102
建立三七总皂苷(saponins,PNS)传递体(transfersomes,TFSs)(PNS-TFSs)中5种皂苷类成分含量与包封率的测定方法,并探讨药物包封特性。采用超高效液相色谱(UPLC)法测定PNS-TFSs制剂中三七皂苷R1(NGR1)、人参皂苷Rg1(GRg1)、人参皂苷Re(GRe)、人参皂苷Rb1(GRb1)与人参皂苷Rd(GRd)的含量,色谱柱为Hypersil Gold柱(100 mm×2.0 mm,1.9 μm),流动相为乙腈-水,梯度洗脱,检测波长为203 nm,柱温为28 ℃。以离心超滤法结合UPLC测定传递体包封率。NGR1、GRg1、GRe、GRb1与GRd对应的各色谱峰专属性与分离度良好(≥1.5),且分别在4.04~505.00、3.98~498.00、4.03~504.00、3.99~499.00、4.00~500.00 μg/mL呈良好的线性关系(≥0.999 7),精密度(RSD≤2.40%)、准确度(97.23%≤回收率≤104.50%)与供试品溶液稳定性(RSD≤0.90%)均符合要求;测得PNS传递体中NGR1、GRg1、GRe、GRb1与GRd质量浓度依次为98.14、380.80、41.68、317.50、75.61 μg/mL,包封率依次为75.48%、69.68%、69.51%、92.35%、95.97%。UPLC法与离心超滤法可用于PNS传递体中多成分含量与包封率的测定,方法快速、准确、可靠。
三七总皂苷;传递体;超高效液相色谱;离心超滤法;包封率;包封特性;三七皂苷R1;人参皂苷Rg1;人参皂苷Re;人参皂苷Rb1;人参皂苷Rd
三七是五加科人参属植物三七(Burk.) F.H.Chen的干燥根及根茎,是中医传统用于体内外各种出血之证及跌打损伤、瘀滞肿痛的要药。其主要活性成分为三七总皂苷(saponins,PNS),PNS中主要成分包括三七皂苷R1(notoginsenoside R1,NGR1)、人参皂苷Rg1(ginsenoside Rg1,GRg1)、人参皂苷Re(ginsenoside Re,GRe)、人参皂苷Rb1(ginsenoside Rb1,GRb1)与人参皂苷Rd(ginsenoside Rd,GRd)等。PNS具有多种药理作用,包括保护心脑血管系统、保护神经系统、抗肿瘤、抗菌、抗炎等[1],并对骨折的愈合、骨关节损伤及肢体功能的恢复等也具有显著疗效[2],同时,也被广泛用于治疗软组织损伤[3]。目前,PNS临床给药方式主要为和iv,然而,容易引起胃肠道药物分解,且存在肝首关效应,导致生物利用度低,而注射给药存在患者顺应性差、安全性等问题。此外,这2种给药途径均难以实现PNS在损伤局部组织分布,从而影响其治疗局部损伤的作用。故在PNS的局部闭合性损伤治疗中经皮给药成为一种更具优势的给药途径,因其可避免口服途径存在的肝首过效应和胃肠道分解,用药安全性高,给药次数少,且可明显提高PNS在用药部位皮下局部组织的浓度,从而提高对局部疾病的疗效[4]。然而,因PNS中各成分相对分子质量较大,难以透过角质层屏障,故需要设计合理的透皮给药剂型以达到理想的经皮吸收效果。
传递体(transfersomes,TFSs)作为透皮给药的优良载体,已受到广泛的关注,它是由磷脂、胆固醇形成的双分子层与边缘活化剂(edge activator,EA)共同构成的可变形囊泡,后者的加入使TFSs具有良好的弹性和变形性,同时,由于天然存在的皮肤水化梯度的驱动作用,故TFSs能通过仅为其自身粒径十分之一大小(被TFSs诱导扩张后)的皮肤角质层中的水性通道,到达皮肤深层部位[5],其中部分包载的药物释放后被吸收入血而发挥全身作用,而另一部分药物则可实现皮下较深部位的靶向递送[6]。故在临床上局部疾病的治疗中,相较于其他给药途径,TFSs能够增加皮下局部组织中的药物浓度,并显著降低进入体循环的药量,从而发挥增效减毒的作用[7]。TFSs中常用的EA有胆酸钠、聚山梨酯等表面活性剂。有研究发现,以柠檬烯与柠檬醛等单萜挥发油成分作为EA的TFSs具有相似的药物经皮渗透特性[8],本课题组前期研究结果也证实了以挥发油作为EA的TFSs可明显促进药物的透皮吸收与关节腔的局部药物递送[9-10]。
药物包封率对于囊泡型药物制剂的生物效应有重要影响,《中国药典》2020年版四部微囊、微球与脂质体制剂指导原则中也明确规定脂质体制剂中药物的包封率不得低于80%[11],而TFSs是脂质体处方中加入EA后形成的脂质囊泡载体,其包封率的高低会影响经皮给药后产生疗效的优劣,故包封率亦为TFSs处方工艺筛选和质量评价的重要依据。为了提高PNS透皮与局部组织递送效率,改善对局部闭合性损伤的疗效,本课题组前期以单萜挥发油成分柠檬烯与柠檬醛作为EA将中药有效部位PNS制备成传递体(PNS-TFSs)[12]。为了对该制剂进行更加全面、合理的质量评价,本实验建立了一种同时测定PNS-TFSs中多种主要皂苷类成分含量的UPLC方法,并将离心超滤法与之结合,测定制剂中多种皂苷类成分的包封率,进而探讨TFSs对PNS中皂苷类成分的包封特性。本研究可为PNS-TFSs制剂质量标准的建立与处方工艺的进一步优化奠定基础。
1 仪器与试剂
H-class超高效液相色谱仪,美国Waters公司;Hypersil Gold C18液相色谱柱(100 mm×2.0 mm,1.9 μm),美国Thermo公司;R-502系列旋转蒸发器,上海申生科技有限公司;DK-S24型电热恒温水浴锅,上海精宏实验设备有限公司;SHB-111S型循环水式多用真空泵,郑州长城科工贸有限公司;XL2000型超声破碎仪,美国Misonix公司;Nano-ZS90动态激光散射粒度仪,英国Malvern公司;JEM-1200EX型透射电子显微镜(TEM),日本Jeol公司;聚碳酸酯径迹蚀刻膜,0.10、0.05 µm,英国Whatman公司;Olympus BX51型光学显微镜,日本奥林巴斯公司;Homoe X-25型高压膜挤出仪,上海赫默仕机电科技有限公司;BS124S型电子天平,德国萨多利斯公司;FE20型台式pH计,梅特勒-托利多仪器有限公司;5804R型冷冻离心机,德国Eppendorf公司;Pall Nanosep离心浓缩管,截留相对分子质量10 000,美国Pall公司。
PNS,注射级,批号HB20081103,云南植物药业有限公司;对照品GRg1(质量分数95.6%,批号110703-201426)、GRb1(质量分数96.1%,批号110704-201424)、GRd(质量分数96.3%,批号111818-201302)、GRe(质量分数95.7%,批号110754-201322)、NGR1(质量分数93.8%,批号110745-201015)均由中国食品药品检定研究院提供;大豆卵磷脂(sbPC),注射级,批号131002,上海太伟药业有限公司;柠檬烯(批号140825,质量分数≥98.3%)与柠檬醛(批号141006,质量分数≥97.5%)均购自吉安市聚鹏天然香料油有限公司;胆固醇(CH),注射级,批号B40333,上海艾韦特医药科技有限公司;维生素E(VE),批号MKCD4493,Sigma公司;磷酸二氢钾,分析纯,批号20110801,温州市化学用料厂;磷酸氢二钠,分析纯,批号130801,湖州湖试化学试剂有限公司;甲醇、二氯甲烷,分析纯,均购自国药集团化学试剂有限公司;乙腈,色谱纯,美国Honeywell公司;UPLC用水为超纯水;其余试剂均为分析纯。
2 方法与结果
2.1 PNS-TFSs的制备及物理性质表征
2.1.1 PNS-TFSs的制备 本课题组前期研究确定了采用薄膜分散法制备PNS-TFSs,并以TFSs的弹性为指标,通过均匀设计试验得到优化处方与可行工艺[12]。本实验参照相关处方工艺进行TFSs的制备。
分别配制0.067 mol/L磷酸二氢钾溶液和0.067 mol/L磷酸氢二钠溶液,两者按124∶1的体积比混合,混合液稀释10倍,即得需要浓度的pH值为5.0的磷酸盐缓冲液(PBS 5.0),作为薄膜分散法中脂质薄膜的水化液。
处方:PNS 100 mg、CH 30 mg、sbPC 120 mg、VE 2 mg、柠檬烯-柠檬醛(质量比4∶1)混合挥发油80 mg、PBS 5.0 10 mL。
工艺:按处方量称取处方中除水化液之外的各组分,溶解于甲醇-二氯甲烷(3∶4)混合有机溶剂中,转移至茄形瓶中,减压旋转蒸发除去溶剂,得到干膜,继续旋转蒸发2 h以除尽有机溶剂,加入水化液进行水化,静置12 h后进行超声破碎处理,最后依次挤压通过0.10 μm与0.05 μm孔径的聚碳酸酯径迹蚀刻膜,即得PNS-TFSs。按相同处方工艺重复制备3批。
以同样方法制备不含药物PNS的TFSs,即得空白TFSs。
2.1.2 粒径与ζ电位的测定 取适量PNS-TFSs样品,以蒸馏水稀释10倍后,在室温下用激光散射粒度仪分别进行粒径与ζ电位测定。所有样品的各项测定均重复3次,结果PNS-TFSs的平均粒径为(66.92±4.34)nm,多分散指数(PDI)为0.074± 0.016,平均ζ电位为(−25.1±1.5)mV(=3),代表性粒径与ζ电位分布图见图1。

图1 PNS-TFSs的粒径(A)和ζ电位(B)分布
2.1.3 显微形态的观察 对PNS-TFSs样品进行适当倍数稀释,吸取少量置于铜网正面,用滤纸吸去多余样品液,用2%磷钨酸溶液进行负染2 min,取出铜网,用滤纸吸取过多染液,将铜网正面朝上置于玻璃皿中,自然晾干,置于TEM下观察并拍照。结果见图2,样品中的囊泡呈圆形或类圆形,大小及分布较均匀,粒子之间未见黏连与聚集现象。

图2 PNS-TFSs的TEM图
2.2 PNS-TFSs制剂中5种皂苷类成分含量测定
2.2.1 色谱条件 色谱柱为Hypersil Gold C18柱(100 mm×2.0 mm,1.9 μm);流动相为乙腈-水,梯度洗脱:0~2 min,19%乙腈;2~12 min,19%~22%乙腈;12~12.1 min,22%~40%乙腈;12.1~17.4 min,40%~45%乙腈;17.4~17.5 min,45%~19%乙腈;体积流量为0.22 mL/min;进样量为2.5 µL;柱温为28 ℃;检测波长为203 nm。
2.2.2 混合对照品储备液的制备 分别精密称取NGR1、GRg1、GRe、GRb1与GRd对照品适量,置于10 mL量瓶中,加入甲醇溶解并定容,摇匀,即得含5种成分的混合对照品储备液,各成分质量浓度依次为0.505、0.498、0.504、0.499、0.500 mg/mL。
2.2.3 供试品溶液的制备 精密量取PNS-TFSs 1 mL,置于10 mL量瓶中,加入适量甲醇,用超声波清洗器浴式超声(功率200 W、频率40 kHz)处理2 min,以甲醇定容,摇匀,用0.22 μm的有机相过滤膜滤过,即得供试品溶液。
2.2.4 色谱峰的专属性 分别取空白TFSs与PNS- TFSs样品,按照“2.2.3”项下方法进行处理,得空白TFSs与PNS-TFSs的供试品溶液;精密称取PNS 9.50 mg,按“2.2.2”项下从“置于10 mL量瓶中”开始进行配液,得PNS供试品溶液;另取“2.2.2”项下制备的混合对照品储备液适量,稀释适当倍数,得混合对照品供试品溶液。按照“2.2.1”项下色谱条件分别分析以上4份供试品溶液。色谱图见图3,由图3可以看出,NGR1、GRg1、GRe、GRb1与GRd各成分的色谱峰峰形良好,分离度(≥1.5)良好,空白传递体中的组分对各成分的色谱峰均无干扰。
2.2.5 线性关系考察 吸取“2.2.2”项下混合对照品储备液,用甲醇逐级稀释成不同质量浓度的对照品溶液系列,按照“2.2.1”项下色谱条件分别分析,记录峰面积,以峰面积()为纵坐标、各对照品质量浓度()为横坐标作图,并进行线性回归,得回归方程依次为NGR1=2.78-1.49(=0.999 9,=8)、GRg1=3.21-1.92(=0.999 8,=8)、GRe=3.30-2.56(=0.999 8,=8)、GRb1=2.73-1.33(=0.999 7,=8)与GRd=3.47-3.04(=0.999 7,=8),结果表明,NGR1、GRg1、GRe、GRb1、GRd分别在4.04~505.00、3.98~498.00、4.03~504.00、3.99~499.00、4.00~500.00 μg/mL呈良好的线性关系。
2.2.6 精密度试验 在1 d内,分别取高、中、低3种质量浓度(200、20、10 μg/mL,按GRd计)的混合对照品溶液,按照“2.2.1”项下色谱条件进行分析,分别连续进样6次,记录峰面积,分别计算各成分在不同质量浓度下的RSD,以示日内精密度;在连续5 d内,高、中、低3种质量浓度的混合对照品溶液分别各进1次,记录峰面积,分别计算各成分在各质量浓度下的RSD,以示日间精密度。结果见表1,NGR1、GRg1、GRe、GRb1与GRd的RSD均小于3.0%,精密度符合要求。
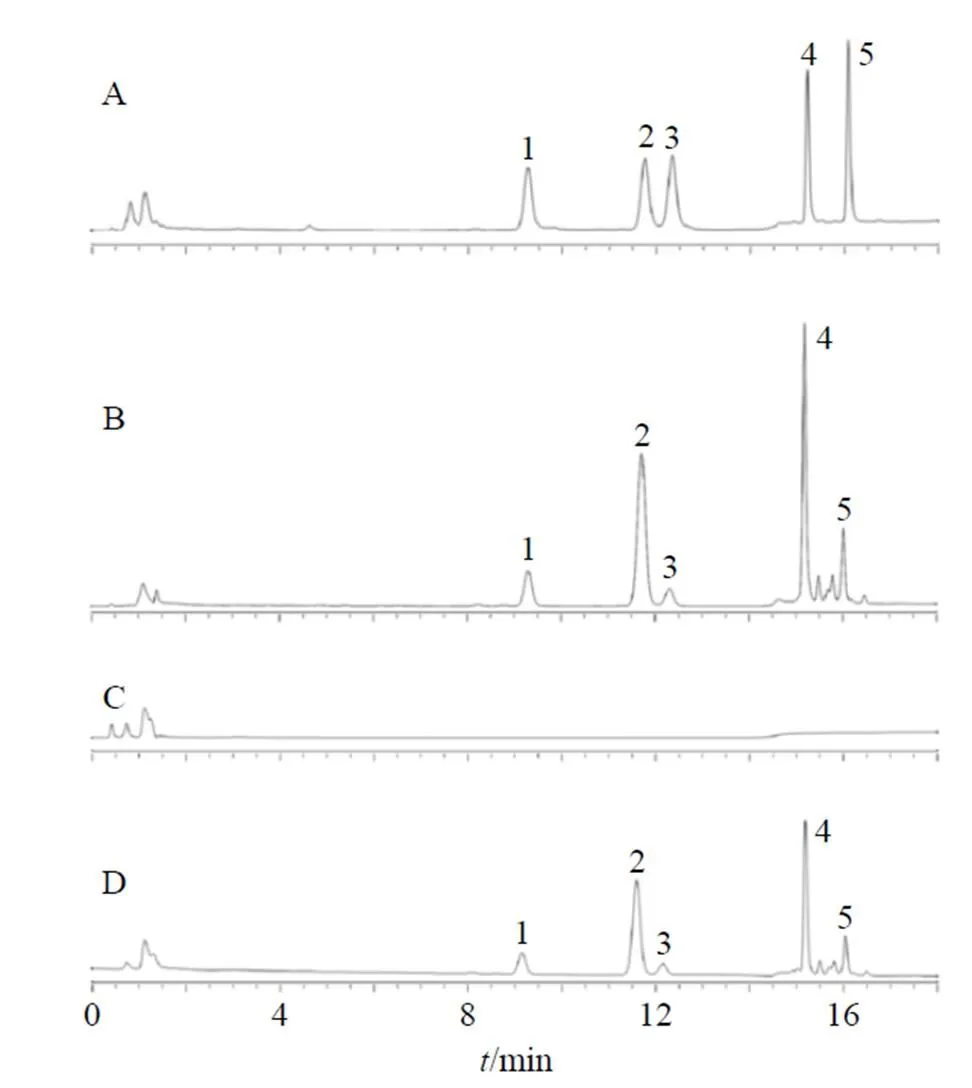
1-NGR1 2-GRg1 3-GRe 4-GRb1 5-GRd
2.2.7 回收率试验 精密量取空白TFSs样品9份,每份1 mL,分别精密加入高、中、低(分别为1 mL样品中各成分含量的80%、100%、120%[11])3种不同质量的各测定成分对照品,各个质量分别平行3份,均按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进行分析,按“2.2.5”项下标准曲线进行定量,测得量相对于加入量的百分比为回收率,结果见表2,可见,该方法准确度良好。

表1 NGR1、GRg1、GRe、GRb1与GRd精密度试验结果
2.2.8 稳定性试验 取PNS-TFSs样品1份,按照“2.2.3”项下方法制备供试品溶液,置于室温下,分别在0、1、2、3、4、8、12 h,按“2.2.1”项下色谱条件进行分析,记录各成分峰面积,分别计算NGR1、GRg1、GRe、GRb1与GRd在不同时间点的RSD,结果依次为0.6%、0.9%、0.4%、0.7%、0.6%,结果表明供试品溶液中各待测成分在12 h内稳定。
表2 NGR1、GRg1、GRe、GRb1与GRd回收率试验结果 (, n = 3)
Table 2 Results of recovery test with NGR1, GRg1, GRe, GRb1 and GRd (, n = 3)

表2 NGR1、GRg1、GRe、GRb1与GRd回收率试验结果 (, n = 3)
加样水平回收率/% NGR1GRg1GReGRb1GRd 低102.1±1.4102.2±1.9102.5±1.6103.5±1.099.5±1.2 中101.4±1.7101.8±2.199.8±1.0102.0±0.9101.0±1.1 高99.1±1.499.1±1.498.4±1.398.0±1.698.1±1.4
2.2.9 重复性试验 取“2.1.1”项下PNS-TFSs混悬液,按“2.2.3”项下方法制备供试品溶液,平行6份,按照“2.2.1”项下色谱条件进行分析,按照“2.2.5”项下回归方程进行定量测定。测得NGR1、GRg1、GRe、GRb1与GRd各成分质量浓度的RSD分别为0.6%、0.5%、1.0%、0.5%、1.6%,结果表明该方法重复性良好。
2.2.10 PNS-TFSs中三七皂苷成分的含量测定 取“2.1.1”项下PNS-TFSs混悬液,按“2.2.3”项下方法制备供试品溶液,按照“2.2.1”项下色谱条件进行分析,按照“2.2.5”项下回归方程进行定量,平行3份。计算得各成分的质量浓度,结果见表3。
2.3 包封率的测定
2.3.1 离心超滤法测定PNS-TFSs的包封率 取“2.1.1”项下PNS-TFSs混悬液样品,摇匀,取少量于光学显微镜下观察,确认其中不含药物结晶后精密量取100 µL,置于离心超滤管内,进行冷冻离心(离心力10 000×,温度4 ℃),收集全部外水相,转移至1 mL量瓶中,以甲醇定容,摇匀,按“2.2.1”项下色谱条件进行分析,测得PNS中各种成分的峰面积分别代入“2.2.5”项下的各种成分回归方程以计算外水相中药物含量;另外,取等量样品,按“2.2.9”项下测定样品中各成分的含量,并按下式计算包封率。
表3 PNS-TFSs中NGR1、GRg1、GRe、GRb1与GRd含量的测定结果(, n = 3)
Table 3 Content determination of NGR1, GRg1, GRe, GRb1 and GRd in PNS-TFSs (, n = 3)

表3 PNS-TFSs中NGR1、GRg1、GRe、GRb1与GRd含量的测定结果(, n = 3)
样品质量浓度/(mg∙mL−1) NGR1GRg1GReGRb1GRd 10.098±0.0010.381±0.0020.042±0.0010.318±0.0020.076±0.001 20.097±0.0020.378±0.0010.043±0.0060.320±0.0070.078±0.003 30.099±0.0130.379±0.0050.041±0.0040.319±0.0190.075±0.006
包封率=(s-EA)/s
s为取样量样品中各成分的质量EA为取样量样品外水相中各成分的质量
2.3.2 超滤滤出液中的脂质体监测 采用2种方法监测滤出液中脂质体是否存在。①紫外分光光度法测定450 nm处样品浊度;②光学显微镜观察。其中,测定450 nm处样品浊度时,合并多份滤出液以满足测定体积要求。结果表明,滤出液中无脂质体存在。
2.3.3 超滤膜对溶液中游离药物的吸附 取混合对照品储备液,用PBS 5.0逐级稀释成高、中、低3个不同质量浓度(500、100、20 μg/mL,按GRd计)各3份,每份500 μL,按“2.3.1”项中条件进行超滤,收集全部超滤液,转移至1 mL量瓶中,以甲醇定容,摇匀,按“2.2.1”项下色谱条件分别测定超滤前溶液中PNS各成分对应的峰面积(before)与滤出液中PNS各成分对应的峰面积(after),计算超滤膜吸附率,结果见表4。可以看出,超滤膜对药物吸附较小,超滤对药物溶液质量浓度的影响可以忽略。
超滤膜吸附率=(before-after)/before
2.3.4 稀释对PNS-TFSs包封率测定结果的影响 取“2.1.1”项下PNS-TFSs混悬液样品适量,分别用PBS 5.0稀释1倍和2倍,得PNS-TFSs1/2、PNS-TFSs1/3。按“2.3.1”分别测定传递体PNS-TFSs、PNS- TFSs1/2、PNS-TFSs1/3的包封率,每份平行测定3次,结果见表5。可以看出,稀释1倍后传递体中各成分的包封率均不同程度降低,稀释2倍使传递体中NGR1、GRg1、GRe的包封率均降低20%以上,而GRb1和GRd即使稀释2倍,包封率也在80%以上,下降较少。

表4 超滤膜对高、中、低质量浓度溶液中PNS各种成分的吸附结果(n = 3)
2.3.5 空白TFSs与PNS PBS溶液混合法制得TFSs的包封率 按如下处方(记作TFSsblank):CH 30 mg、sbPC 120 mg、VE 2 mg、柠檬烯-柠檬醛(4∶1)混合挥发油80 mg、PBS 5.0 10 mL,以“2.1.1”项工艺条件薄膜分散法制备空白TFSs混悬液,将5 mL TFSsblank与20 mg/mL的PNS PBS溶液5 mL混匀,得TFSsblank+PNS。按“2.3.1”测定TFSsblank+PNS的包封率,平行测定3次,结果见表5。可以看出,TFSsblank+PNS的PNS各成分包封率均较高,只比PNS-TFSs低了不足15%。
2.3.6 PNS-TFSs包封率测定的方法重复性考察 按“2.3.1”项方法操作,将1份PNS-TFSs样品平行测定6次,结果表明,NGR1、GRg1、GRe、GRb1、GRd各成分包封率的RSD分别为2.0%、0.6%、2.6%、0.1%、1.1%,说明该方法重复性良好。

表5 稀释对包封率测定结果的影响及空白传递体与PNS PBS溶液混合制得脂质体的包封率
2.3.7 PNS-TFSs包封率的测定 按“2.3.1”项方法操作,将1份PNS-TFSs样品平行测定3次,结果见表6。
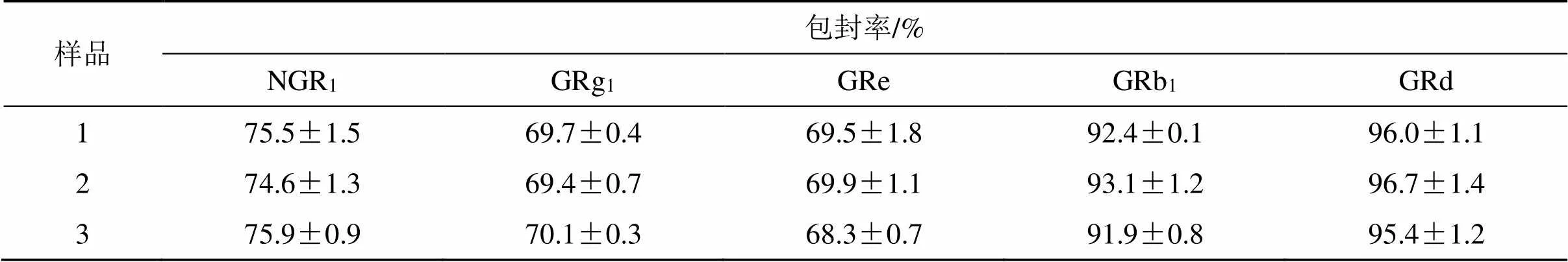
表6 PNS-TFSs中NGR1、GRg1、GRe、GRb1与GRd包封率的测定结果
3 讨论
中药具有多成分、多靶点的特点,意味着通过单一成分控制很难全面评价其质量,需要对其进行多成分同时测定,然而,定量指标成分的增多,也相应地增加了检测的周期和成本[13]。《中国药典》2020年版一部中以NGR1、GRg1、GRe、GRb1和GRd为PNS含量测定的指标成分,采用HPLC法测定,需要60 min完成[14],本课题组前期尝试了药典的条件,发现GRg1与GRe这2种成分无法达到完全分离[15]。因此,本实验建立了一种可一次进样同时测定PNS-TFSs中5种主要皂苷类成分的UPLC方法,该方法不仅可以实现这5种皂苷成分的良好色谱分离,且相较于HPLC法,UPLC法测定具有分析速度快、分离效率高、准确度与灵敏度高、溶剂使用少、废液产生少等优点[16],可以节约经济成本与时间成本,同时更加环保。此外,测定结果与原料药PNS的中各成分的含量比例基本一致,从一个方面佐证了结果合理、可信。
离心超滤法测定传递体包封率是将一定量传递体放入配有超滤膜的超滤管中,在适宜的转速下离心一段时间,游离药物在离心力的作用下可通过超滤膜,而传递体则被超滤膜截留,从而实现二者的分离。而后收集滤液用于测定游离药物的量,取等量未滤过的传递体测定药物总量,计算包封率[17-18]。该方法快速,易于操作,且不需要复杂的设备,与其他技术(如超速离心)相比,它只需要少量的样品。然而,离心超滤法有一个明显的缺点就是药物可能会被吸附在超滤膜上而引起损失,从而影响测定结果。因此,本实验考察了超滤膜对高、中、低3个质量浓度溶液中游离PNS各成分的吸附,发现超滤膜对PNS各成分吸附均较小。
其次,超滤膜的选择对于离心超滤法测定包封率也尤为重要,因过大或过小的滤孔均无法实现传递体与游离药物良好分离。本实验以离心超滤法结合UPLC法测定制剂的包封率,因PNS-TFSs平均粒径约为67 nm,大多数皂苷成分的相对分子质量约为1000,对应分子尺寸为2~3 nm,故采用截留相对分子质量10 000(对应膜孔径约为10 nm)的超滤膜进行冷冻离心,使PNS-TFSs中囊泡与游离药物实现分离。
为了验证超滤膜对于囊泡的分离效果,本实验考察了2种监测滤出液中脂质体的方法,发现紫外分光光度法灵敏度较高,可用于检测;光学显微镜只能观察到大的脂质囊泡,难以观察到一些小单室脂质体,灵敏度欠佳,但该方法简便、快速,可用于囊泡初步监测。此外,定磷法是通过检测滤出液中的磷的含量来监测滤出液中是否存在囊泡的方法,该法准确、灵敏[19],但是本研究中TFSs制备时使用了PBS作为水化液,会对本法测定产生影响,故未采用。
离心超滤法是一种在平衡状态下测定传递体包封率的方法,为了探究药物与囊泡相互作用和药物泄漏行为以及非平衡状态对于PNS-TFSs包封率测定结果是否存在影响,将PNS-TFSs进行稀释,发现在稀释1倍和2倍后PNS-TFSs中各成分的包封率均有所降低,但GRb1与GRd的降低程度远小于其他成分。除此以外,还发现空白传递体直接与PNS溶液混合载药也具有较高的包封率,这可能与PNS中各成分良好的亲脂性有关,这使得它们能较好地分配于双分子层上。
为了探明传递体中5种皂苷的包封特性,运用软件(ACD/Labs 10.0)进行了最优构象预测和基团间距离的计算,这样可以综合分析分子间亲水基团之间的相互作用、疏水部分的相互作用与分子大小适应性等影响因素。sbPC双分子层的厚度约5.0 nm,5种皂苷分子均含有1个亲脂部分和2个亲水部分,其中NGR1、GRg1与GRe的分子优势构象均呈U形,2个亲水端距离2.0 nm,亲脂链长1.5 nm,故嵌入sbPC形成的双分子层时因分子大小适应性差使系统能量很高,而GRb1与GRd的分子优势构象为线型,2个亲水端距离3.0 nm,亲脂链长2.0 nm,嵌入磷脂双分子层时,亲脂部分大小合适,在双分子层内部的糖基可相互作用,体系能量降低[20]。由上述结果可知,对于相对分子质量接近的不同皂苷分子,其优势构象影响分子中亲水基团之间的距离,进而影响分子与磷脂双分子层的相互作用及药物包封率,GRb1与GRd分子嵌入sbPC双分子层产生的体系能量更低,表明两者与sbPC双分子层结合更稳定,这就解释了与NGR1、GRg1、GRe相比GRb1和GRd为何具有更高的包封率(<0.01),以及稀释后包封率变化较小的原因。
此外,还发现一个大致的趋势,即UPLC色谱分析保留时间越长的PNS成分,其对应在PNS-TFSs中包封率越高,也说明PNS成分亲脂性与包封率存在一定相关性,即其亲脂性越高,所对应的包封率越高,进一步地,可以推测PNS成分主要包封于PNS-TFSs的脂质双分子层中。
本研究建立了一种同时测定PNS-TFSs中NGR1、GRg1、GRe、GRb1、GRd含量的UPLC法,此法精密、准确、快速,进而以离心超滤法结合UPLC测定PNS-TFSs多成分的包封率,方法简便、准确、重复性良好,并根据实验结果探讨了PNS各主要成分在TFSs中的包封特性。本研究可以为单萜挥发油边缘活化的PNS-TFSs的质量评价与处方优化提供参考,为其透皮研究的开展奠定实验基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄依丹, 成嘉欣, 石颖, 等.近五年三七化学成分、色谱分析、三七提取物和药理活性的研究进展 [J].中国中药杂志, 2022, 47(10): 2584-2596.
[2] Ji Z, Cheng Y Z, Yuan P W,.stimulates alkaline phosphatase activity, collagen synthesis, and mineralization in osteoblastic MC3T3-E1 cells [J]., 2015, 51(9): 950-957.
[3] 贺延新.三七散治疗急性软组织损伤的疗效观察 [J].中医正骨, 2007, 19(4): 14.
[4] 赖玲, 刘华钢, 陈明, 等.三七总皂苷非注射途径给药剂型研究进展 [J].中国新药杂志, 2011, 20(3): 235-238.
[5] 梁秉文, 刘淑芝, 梁文权.中药经皮给药制剂技术 [M].3版.北京: 化学工业出版社, 2017: 182-184.
[6] Cevc G.Lipid vesicles and other colloids as drug carriers on the skin [J]., 2004, 56(5): 675-711.
[7] Peralta M F, Guzmán M L, Pérez A P,.Liposomes can both enhance or reduce drugs penetration through the skin [J]., 2018, 8(1): 13253.
[8] El Maghraby G M, Williams A C, Barry B W.Interactions of surfactants (edge activators) and skin penetration enhancers with liposomes [J]., 2004, 276(1/2): 143-161.
[9] Wang J, Wei Y, Fei Y R,.Preparation of mixed monoterpenes edge activated PEGylated transfersomes to improve thetransdermal delivery efficiency of sinomenine hydrochloride [J]., 2017, 533(1): 266-274.
[10] Zheng H S, Xu C, Fei Y R,.Monoterpenes- containing PEGylated transfersomes for enhancing joint cavity drug delivery evidenced by CLSM and double-sited microdialysis [J]., 2020, 113: 110929.
[11] 中国药典 [S].四部.2020: 474-476, 482-483.
[12] 陈思思, 郑杭生, 王娟, 等.三七总皂苷传递体的制备及其治疗大鼠急性软组织损伤作用研究 [J].中草药, 2015, 46(14): 2070-2075.
[13] 魏会宇.一测多评法同时测定注射用血栓通(冻干)中5个主要皂苷含量 [J].药物分析杂志, 2017, 37(6): 975-981.
[14] 中国药典 [S].一部.2020: 411-412.
[15] 方蓉, 郑杭生, 李范珠, 等.HPLC法测定三七总皂苷传递体中2个成分的含量和包封率 [J].药物分析杂志, 2014, 34(2): 264-268.
[16] 王亚茹, 商云霞, 尉小慧, 等.UPLC-MS/MS法同时测定三七总皂苷中5种皂苷类成分在大鼠血浆中的含量 [J].中国临床药理学杂志, 2021, 37(14): 1878-1882.
[17] 郑杭生, 佐拉·沙肯迪克, 王湘林, 等.离心沉淀-离心超滤法测定盐酸青藤碱脂质体的包封率 [J].中草药, 2011, 42(8): 1523-1527.
[18] 张艺, 杭太俊, 宋敏.载药脂质体包封率测定方法的研究进展 [J].中国药科大学学报, 2021, 52(2): 245-252.
[19] Stewart J C.Colorimetric determination of phospholipids with ammonium ferrothiocyanate [J]., 1980, 104(1): 10-14.
[20] 方蓉, 郑杭生, 陈思思.离体皮肤渗透法测定三七总皂苷传递体经皮吸收特性 [J].中草药, 2015, 46(4): 513-519.
Determination of contents and encapsulation efficiencies of five saponins insaponins transfersomes
FAN Yu-hang1, XU Chang1, FEI Ya-rong1, CHENG Bi-xin1, QIU Ying-kun2, ZHENG Hang-sheng1
1.School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2.School of Pharmaceutical Sciences, Xiamen University, Xiamen 361102, China
To develop methods for the determination of contents and encapsulation efficiencies of five saponins insaponins (PNS) transfersomes (PNS-TFSs) and probe the drug encapsulation features.UPLC was adopted to determine the contents ofnotoginsenoside R1(NGR1), ginsenoside Rg1(GRg1), ginsenoside Re (GRe), ginsenoside Rb1(GRb1) and ginsenoside Rd (GRd) in the preparation of PNS-TFSs.An Hypersil Gold column (100 mm × 2.0 mm, 1.9 μm) was used to separate the analytes with acetonitrile-water mixture as the mobile phase in gradient elution mode, and the detection wavelength was set at 203 nm, the column temperature was 28 ℃.Encapsulation efficiencies were determined by centrifugal ultrafiltration method combined with UPLC.The specificity and resolution (≥ 1.5) of the peaks corresponding to each analyte met requirements of methodology.The calibration curves were linear (≥ 0.9997) and in the ranges of 4.04—505.00, 3.98—498.00, 4.03—504.00, 3.99—499.00, 4.00—500.00 μg/mL for NGR1, GRg1, GRe, GRb1and GRd respectively.RSD (≤ 2.4%) of repeated measurements with working solution of chemical reference substances (CRS) and recoveries (97.23%—104.50%) of the analytes from the blank transfersomes spiked with their CRS demonstrated respectively the precision and accuracy of the method.The test solutions were stable (RSD ≤ 0.90%) in 12 h.The contents of NGR1, GRg1, GRe, GRb1and GRd in the transfersomes were 98.14, 380.80, 41.68, 317.50, 75.61 μg/mL, and their encapsulation efficiencies were 75.48%, 69.68%, 69.51%, 92.35%, 95.97%, respectively.UPLC is fast, accurate, precise and applicable to the determination of the contents of NGR1, GRg1, GRe, GRb1and GRd in the transfersomes and the centrifugal ultrafiltration method coupled with UPLC is applicable to the determination of their encapsulation efficiencies.
saponins; transfersomes; UPLC; centrifugal ultrafiltration; encapsulation efficiencies; encapsulation features; notoginsenoside R1; ginsenoside Rg1; ginsenoside Re; ginsenoside Rb1; ginsenoside Rd
R283.6
A
0253 - 2670(2022)10 - 3006 - 08
10.7501/j.issn.0253-2670.2022.10.010
2022-02-24
国家自然科学基金资助项目(82174096);校级科研基金(国家自然科学基金预研专项)资助项目(2019ZG37)
范煜航,硕士研究生,研究方向为经皮吸收脂质囊泡新剂型及其体内过程。Tel: 18768131106 E-mail: fanyuhang1016@163.com
通信作者:郑杭生,硕士生导师,主要从事经皮吸收新剂型及其体内过程研究。Tel: (0571)61768157 E-mail: hs-zheng@163.com
#共同第一作者:徐 畅,硕士研究生,研究方向为经皮吸收脂质囊泡新剂型及其体内过程。Tel: 17826865411 E-mail: xu_xile@163.com
[责任编辑 郑礼胜]
