基于UHPLC-MS/MS的钩藤生物碱在大鼠体内的组织分布研究
2022-07-07吴依松李士伟李昊举魏文龙吴士飞果德安
吴依松,李士伟,李昊举,魏文龙,吴士飞,果德安*
基于UHPLC-MS/MS的钩藤生物碱在大鼠体内的组织分布研究
吴依松1, 2,李士伟1, 2,李昊举2,魏文龙2,吴士飞2,果德安1, 2*
1. 长春中医药大学药学院,吉林 长春 130117 2. 中国科学院上海药物研究所 上海中药现代化研究中心,中药标准化技术国家工程研究中心,上海 201203
建立超高效液相串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)法测定大鼠不同组织中钩藤碱、异钩藤碱、去氢钩藤碱、异去氢钩藤碱、毛钩藤碱、去氢毛钩藤碱与缝籽嗪甲醚的含量,并用于钩藤的组织分布研究。大鼠ig钩藤水煎液后,分别于0.083、0.25、0.5、0.75、1、2、4、8、12 h取心、肝、脾、肺、肾、脑组织。以长春胺为内标,采用液液萃取法提取后进行样本检测。建立的UHPLC-MS/MS方法中,7个生物碱在不同的组织中最低定量限范围为0.05~1.00 ng,响应与浓度的相关性2≥0.991。方法学考察中的专属性、基质效应、回收率、精密度与准确度以及稳定性等方法学考察均满足要求。各个组织中均为异钩藤碱含量最高,其次为去氢钩藤碱;异钩藤碱与去氢钩藤碱含量均远高于其对应的异构体钩藤碱与异去氢钩藤碱;而3个四环单萜吲哚生物碱(毛钩藤碱、去氢毛钩藤碱、缝籽嗪甲醚)在各组织中均含量最低。比较不同组织中生物碱成分含量可以发现,7个生物碱均在肝脏中含量最高,其次为肾脏与肺部,推测钩藤生物碱在肝脏与肾脏的蓄积是因为两者分别是生物碱成分的主要代谢部位与排泄部位。建立的方法灵敏度高、准确性好、专属性好,适用于大鼠不同组织中钩藤生物碱的组织分布研究。
钩藤;生物碱;钩藤碱;异钩藤碱;去氢钩藤碱;异去氢钩藤碱;毛钩藤碱;去氢毛钩藤碱;缝籽嗪甲醚;定量分析;组织分布
钩藤为茜草科植物钩藤(Miq.) Miq. ex Havil.、华钩藤(Oliv.) Havil.、毛钩藤Havil.、大叶钩藤Wall.或无柄果钩藤Roxb.的干燥带钩茎枝,其性味甘、凉,归肝、心包经,具有息风定惊、清热平肝的功效,临床用于治疗小儿惊啼、妊娠子痫、感冒夹惊、高热惊厥、惊痫抽搐、肝风内动、头痛眩晕等症状[1]。钩藤含有黄酮、生物碱、香豆素、三萜酸等多种成分,其中生物碱为主要活性成分[2-3]。现代药理学研究表明,钩藤具有降血压[4-5]、镇静催眠和抗老年痴呆等作用[6-7]。
钩藤的代谢研究主要集中于其中所含的生物碱成分,国内王英峰等[8]最早开展了钩藤药动学研究,结果显示,小鼠ig钩藤碱2 h后达到最高血药浓度。目前钩藤的组织分布研究,大多为生物碱单体的研究。例如以新西兰大白兔为动物模型,开展钩藤碱在兔体内的组织分布[9-10],结果显示钩藤碱在家兔体内吸收快、消除快、动力学呈线性等特征;其他药动学与组织分布研究也表明,钩藤碱的体内过程具有吸收快、消除快的特点,且在肝脏、心脏、脑、肺组织、肾组织等器官中均有分布[11-12]。然而关于钩藤的体内组织分布研究较少,需要构建高灵敏的多指标含量测定方法用于体内钩藤生物碱的定量分析。
在中药体内的多成分定量研究中,常使用QqQ或Q-trap的多反应监测(multiple reaction monitoring,MRM)模式,待测物去溶剂化带电后通过Q1对母离子进行筛选,在碰撞池q2进行二级碎裂,随后在Q3中对子离子进行筛选[13],与其他方式比较,MRM模式对待测物具有较高的选择性与灵敏度,已广泛应用于药材中微量成分或体内成分的定量研究。本研究构建了超高效液相串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)方法用于定量分析不同组织中的7个生物碱,并应用于钩藤的体内分布研究,明确钩藤生物碱类的成分体内分布规律,为钩藤的药物靶向治疗提供参考依据。
1 材料
1.1 药材
钩藤药材为从市场购买,经中国科学院上海药物研究所中药现代化中心姚帅高级实验师鉴定为茜草科植物钩藤(Miq.) Miq. ex Havil.的干燥带钩茎枝,钩藤样本(样本号20161202)储存于中国科学院上海药物研究所。
1.2 试药与仪器
色谱级乙腈(批号UCNA1H)购自美国Honeywell公司;质谱级氨水(批号H2119089)购自美国Sigma-Aldrich公司;醋酸乙酯(批号20200306)购自国药试剂有限公司;去离子水由Millipore Alpha-Q纯水制备系统制备获得;对照品钩藤碱、异钩藤碱、异去氢钩藤碱、去氢钩藤碱、去氢毛钩藤碱、毛钩藤碱、缝籽嗪甲醚由本实验制备获得,经HPLC-UV检测,质量分数均大于98%;内标长春胺(批号8492)购自上海诗丹德标准技术有限公司。
Agilent 1290 infinityII串联Agilent Triple Quad 6495(美国安捷伦科技公司),液相系统包括二元泵系统、样品管理器与色谱柱管理器;IKA®VIBRAX VXR BS25型涡旋混匀仪(德国IKA公司);2200型超声波清洗仪(上海睿祺电子设备有限公司);氮吹仪(美国Organomation Associates. Jnc公司);BT25S型分析天平(德国Sartorius公司)。
1.3 动物
SPF级Wistar雄性大鼠,7~8周龄,体质量200~250 g,购自上海斯莱克动物实验中心,合格证号SYXK(沪)2020-0042。动物于温度20~24 ℃,相对湿度40%~70%,单向通风环境,12 h光照循环环境中饲养,自由进食饮水。大鼠在实验前饲养1周适应环境,正式实验前,禁食12 h不禁水。动物实验方案通过中国科学院上海药物所动物管理委员会的许可(IACUC审批号2020-10-GDA-75)。
2 方法
2.1 对照品与钩藤水提物的制备
精密称定对照品钩藤碱、异钩藤碱、异去氢钩藤碱、去氢钩藤碱、去氢毛钩藤碱、毛钩藤碱、缝籽嗪甲醚和内标,用纯乙腈溶解获得1 mg/mL溶液备用。用纯乙腈对对照品溶液进行稀释,获得标准曲线不同质量浓度点与质控样本的储存液,于4 ℃保存备用。
称取钩藤药材100 g,加入1 L去离子水,浸泡30 min后用武火煎煮至沸,转文火煎煮30 min后滤过,获得煎煮液,连续煎煮2次,合并煎煮液,减压旋蒸浓缩后冷冻干燥,获得钩藤水煎液冻干粉。
2.2 给药和样品制备
钩藤水煎液冻干粉用0.5%羧甲基纤维素钠溶液溶解。大鼠ig钩藤水煎液(1 g/kg)后,分别于0.083、0.25、0.5、0.75、1、2、4 、8、12 h麻醉,腹主动脉取血后,分别摘取心、肝、脾、肺、肾、脑组织,于液氮中淬灭后,于−80 ℃保存备用。
由于化合物在组织的整体空间分布情况不同,为尽可能降低取样不均匀引起的误差,故取样为不同时间点下相同组织的同一部位,如心脏的心尖位置、脑的左侧部分沿外侧矢状面切割、左肾的左下方位置、肝脏的三角叶部分等。精确称定各组织100 mg,按照1∶5的比例加入生理盐水匀浆6 min,每匀浆20 s间隔10 s,即得组织匀浆液。取组织匀浆液100 μL置于离心管中,加入5 μL内标溶液,涡旋均匀后加入1 mL醋酸乙酯溶液,涡旋3 min后,14 000 r/min离心10 min,取900 μL上清液氮气吹干,随后在离心管中加入100 μL乙腈复溶,超声5 min,涡旋3 min,14 000 r/min离心10 min,取上清液进样。
精确称定各空白组织,按照1∶5的比例加入生理盐水进行匀浆。取组织匀浆液95 μL加入5 μL的标准曲线溶液或质控样本溶液,然后加入5 μL内标溶液,其余操作同样品制备方法,即得标准曲线与质控样本。
2.3 色谱与质谱条件
2.3.1 色谱条件 Phenomenex Kinetex®EVO C18色谱柱为(100 mm×2.1 mm,2.6 μm),流动相为0.1%氨水(A)-乙腈(B),梯度洗脱:0~0.1 min,10% B;0.1~5 min,10%~25% B;5~13 min,25%~40% B;13~15 min,40%~50% B;15~19 min,50%~95% B;19~22 min,95% B。柱温35 ℃;体积流量0.4 mL/min。
2.3.2 质谱条件 ESI源;正离子模式;数据采集模式为MRM模式。分别对待测物进行离子对优化,离子对参数见表1,其他参数为:干燥气温度200 ℃;雾化气压力35 psi(1 psi=6.895 kPa);干燥气体积流量14 L/min;毛细管电压4000 V;鞘气温度250 ℃;鞘气体积流量11 L/min;喷嘴电压500 V。仪器控制、质谱参数优化、数据采集与数据后处理使用Agilent Masshunter Workstation Software 9.0软件。
表1 MRM定量用质谱参数
Table 1 Parameters of mass spectrometer for MRM
对照品母离子(m/z)子离子(m/z)驻留时间/min碎裂电压/V碰撞能/eV加速电压/V 去氢钩藤碱383.2160.1110380414 异去氢钩藤碱383.2108.1110380374 钩藤碱385.2353.2110380254 异钩藤碱385.2160.1110380414 去氢毛钩藤碱367.2144.0110380334 毛钩藤碱369.2144.0110380374 缝籽嗪甲醚367.2144.0110380334 内标355.2337.1110380174
2.4 方法学考察
根据FDA生物分析方法验证指南的指导意见进行LC-MS/MS定量的方法学考察[18]。通过各组织间基质效应比较,发现质控样本在不同基质中无明显的基质效应影响,在保证准确度的前提下,随机选取肝、心、脑3个组织进行方法学考察。
2.4.1 专属性考察 专属性是指在相同保留时间范围内,空白基质中相应位置的空白峰面积应小于待测物最低定量限(lower limit of quantification,LLOQ)的20%,内标小于5.0%。
2.4.2 基质效应与提取回收率 基质效应是指在生物样品评价过程中,生物基质对不同浓度点样品的测定值浓度影响是否一致,其考察方法是比较3个不同质量浓度的质控溶液在含有和不含有基质的样本中检测结果之间的差异。
提取回收率是指在样本处理过程中,在样本提取前后加入质控样本,比较不同浓度点差异变化。
2.4.3 精密度与准确度考察 精密度与准确度包括日内精密度、日内准确度、日间精密度与日间准确度,用于考察仪器的稳定性。日内精密度与准确度是比较在连续进样的情况下,不同浓度点的组内值变化大小以及与理论值的差异大小,包括LLOQ、低浓度质控(lower quantity control,LQC)、中间浓度质控(middle quantify control,MQC)与高浓度质控(high quantity control,HQC)4个部分,LQC、MQC、HQC组内相对标准偏差(relative standard deviation,RSD)应小于15%,LLOQ组内RSD应小于20%,质控样本与理论值的相对偏差(relative error,RE)应小于15%。
日间精密度与日间准确度是考察连续3 d进样的测量值之间的变化以及与理论值的偏差,要求连续3 d 3个质控样本的RSD应小于15%,LLOQ的RSD应小于20%,不同质控样本的RE应小于15%。
2.4.4 稳定性考察 稳定性考察包括室温4 h稳定性、自动进样器24 h(4 ℃)稳定性、冻融3个循环稳定性(−20 ℃)和短期稳定性(−20 ℃放置7 d)。考察方式为将空白组织均浆液分别与不同浓度质控样本进行混合,加入内标溶液后混匀分别于室温放置4 h、−20 ℃放置1周以及冻融3个循环,冻融循环每次大于12 h,自动进样器稳定性为质控样本处理完成提取、吹干和复溶等过程后置于自动进样器24 h进样。各浓度点的RE应小于15%,组内RSD应小于15%。
3 结果
3.1 方法学考察
3.1.1 线性范围 根据预实验结果与质谱检灵敏度确定定量线性范围,线性结果见表2。在除肝脏组织以外,异去氢钩藤碱与异钩藤碱在不同组织中的线性范围为1~2500 ng/mL,异去氢钩藤碱与钩藤碱的线性范围为0.5~1250 ng/mL,去氢毛钩藤碱、毛钩藤碱和缝籽嗪甲醚的线性范围为0.05~125 ng/mL。在肝组织中,去氢钩藤碱与异钩藤碱的线性范围为1~5000 ng/mL,异去氢钩藤碱与钩藤碱的线性范围为0.5~2500 ng/mL,去氢毛钩藤碱、毛钩藤碱和缝籽嗪甲醚的线性范围为0.05~250 ng/mL。
表2 不同组织中7个成分的回归方程与线性范围
Table 2 Linear range and regression equation of seven alkaloids in different tissue
组织成分线性方程R2线性范围/(ng·mL−1)LLOQ/(ng·mL−1) 心异去氢钩藤碱y=2.523 446 x+0.006 2150.9920.5~1 250.00.50 去氢钩藤碱y=0.701 396 x+0.000 56720.9931.0~2 500.01.00 钩藤碱y=3.018 928 x+0.032 6720.9940.5~1 250.00.50 异钩藤碱y=1.503 035 x+0.057 9480.9951.0~2 500.01.00 去氢毛钩藤碱y=2.712 177 x-0.010 6040.9910.05~125.000.05 缝籽嗪甲醚y=2.504 551 x-0.012 4650.9930.05~125.000.05 毛钩藤碱y=1.761 823 x-0.007 270.9920.05~125.000.05 肝异去氢钩藤碱y=4.996 761 x-0.057 1760.9960.5~2 500.00.50 去氢钩藤碱y=0.721 232 x+0.004 0830.9951.0~5 000.01.00 钩藤碱y=3.091 612 x+0.007 5770.9960.5~2 500.00.50 异钩藤碱y=3.260 915 x−0.005 660.9961.0~5 000.01.00 去氢毛钩藤碱y=1.155 277 x−0.003 3090.9930.05~250.000.05 缝籽嗪甲醚y=1.738 354 x+0.001 9450.9920.05~250.000.05 毛钩藤碱y=1.288 939 x+0.004 8030.9930.05~250.000.05 脾异去氢钩藤碱y=2.070 328 x-0.022 4420.9930.5~1 250.00.50 去氢钩藤碱y=0.570 833 x-0.012 7930.9911.0~2 500.01.00 钩藤碱y=2.720 595 x-0.037 110.9920.5~1 250.00.50 异钩藤碱y=1.283 3 x-0.024 9050.9921.0~2 500.01.00 去氢毛钩藤碱y=3.192 123 x-0.003 1790.9920.05~125.000.05 缝籽嗪甲醚y=2.500 705 x-0.003 7880.9930.05~125.000.05 毛钩藤碱y=1.954 904 x+0.002 2180.9960.05~125.000.05 肺异去氢钩藤碱y=2.608 458 x+0.030 2740.9940.5~1 250.00.50 去氢钩藤碱y=0.726 214 x+0.010 5010.9961.0~2 500.01.00 钩藤碱y=2.922 682 x+0.047 6190.9940.5~1 250.00.50 异钩藤碱y=1.590 665 x+0.059 3090.9931.0~2 500.01.00 去氢毛钩藤碱y=3.645 983 x-0.002 4640.9920.05~125.000.05 缝籽嗪甲醚y=2.857 352 x-0.008 0490.9930.05~125.000.05 毛钩藤碱y=2.260 964 x+0.003 0810.9940.05~125.000.05 肾异去氢钩藤碱y=3.102 039 x-0.053 7780.9950.5~1 250.00.50 去氢钩藤碱y=0.830 579 x-0.034 5250.9921.0~2 500.01.00 钩藤碱y=3.806 784 x-0.055 5670.9930.5~1 250.00.50 异钩藤碱y=0.922 039 x-0.067 7960.9921.0~2 500.01.00 去氢毛钩藤碱y=4.049 22 x-0.009 8230.9930.05~125.000.05 缝籽嗪甲醚y=2.952 23 x-0.009 2610.9930.05~125.000.05 毛钩藤碱y=2.471 191 x-0.004 5970.9950.05~125.000.05 脑异去氢钩藤碱y=3.085 289 x-0.032 5770.9960.5~1 250.00.50 去氢钩藤碱y=0.662 539 x-0.019 2380.9971.0~2 500.01.00 钩藤碱y=3.439 665 x-0.041 070.9960.5~1 250.00.50 异钩藤碱y=1.289 731 x-0.017 1160.9961.0~2 500.01.00 去氢毛钩藤碱y=1.640 211 x-0.003 3390.9910.05~125.000.05 缝籽嗪甲醚y=1.201 973 x-0.001 4940.9930.05~125.000.05 毛钩藤碱y=0.863 487 x+0.002 8430.9920.05~125.000.05
3.1.2 专属性考察 心、肝、脾、肺、肾与脑组织待测物保留时间位置均无明显色谱峰,表明方法专属性较好(图1)。分别在不同组织的线性最高点后进样空白,空白中均未发现7个生物碱和内标,表明该方法无残留效应。
3.1.3 基质效应与回收率 选取心、脑、肝3个组织进行基质效应与回收率考察,结果如表3、4所示,在3个组织中,7个生物碱的基质效应为86.43%~118.85%,均在可接受范围内;7个生物碱与内标的回收率为76.28%~99.37%,均在可接受范围内。
3.1.4 精密度与准确度 选取心、脑、肝3个组织对钩藤7个生物碱进行精密度与准确度进行评价,结果如表5、6所示,7个生物碱的日内精密度、日内准确度、日间精密度、日间准确度均在接受范围内(±15%)。

RHY-钩藤碱 IRHY-异钩藤碱 ICOE-异去氢钩藤碱 COE-去氢钩藤碱 HTE-去氢毛钩藤碱 HTI-毛钩藤碱 GSM-缝籽嗪甲醚,下图同
表3 生物碱在不同组织中基质效应
Table 3 Matrix effect of alkaloids in different tissues
成分心脑肝 LQC/%MQC/%HQC/%LQC/%MQC/%HQC/%LQC/%MQC/%HQC/% 异去氢钩藤碱99.78101.04103.5087.0994.4895.7699.0286.4388.33 去氢钩藤碱101.91110.6995.5395.43110.5999.29105.3797.3289.67 钩藤碱104.52106.3993.1293.9799.1895.6998.6693.6189.80 异钩藤碱103.29111.7999.1398.93110.14102.35105.6396.1992.05 去氢毛钩藤碱107.02113.4896.43102.44105.68106.15106.88109.00106.45 缝籽嗪甲醚101.00112.0089.91109.23106.92113.76110.06106.83106.78 毛钩藤碱105.22111.5897.83107.53118.85106.64104.67111.41104.30
表4 生物碱在不同组织中提取回收率
Table 4 Recovery of alkaloids in different tissues
成分心脑肝 LQC/%MQC/%HQC/%LQC/%MQC/%HQC/%LQC/%MQC/%HQC/% 异去氢钩藤碱86.3683.1589.4783.3591.7399.3783.4384.7483.70 去氢钩藤碱93.9383.3988.0580.8890.1087.0283.1282.9589.20 钩藤碱88.5883.2786.4481.2490.3985.4083.1481.2488.29 异钩藤碱92.2185.6484.7680.6791.4787.4782.5481.6579.42 去氢毛钩藤碱97.7591.0090.0484.0596.9788.7692.3693.7284.16 缝籽嗪甲醚84.2397.5698.4086.3797.3088.7487.4792.8481.90 毛钩藤碱94.1089.6993.9876.2895.8587.2691.3591.6985.22 内标89.3882.3782.9982.7892.1084.7980.9189.2886.32
表5 日内精密度与准确度
Table 5 Intra-day precision and accuracy
组织成分LLOQLQCMQCHQC 实测值/ (ng·mL−1)精密度/%准确度/%实测值/ (ng·mL−1)精密度/%准确度/%实测值/ (ng·mL−1)精密度/%准确度/%实测值/ (ng·mL−1)精密度/%准确度/% 心异去氢钩藤碱0.50±0.023.410.921.49±0.031.74−0.6239.74±0.481.205.98980.69±46.414.73−1.93 去氢钩藤碱1.09±0.032.928.832.82±0.196.77−7.9277.55±2.353.033.412 050.74±132.576.462.54 钩藤碱0.52±0.012.043.581.41±0.064.03−7.7237.34±0.350.95−0.441 042.85±32.993.164.28 异钩藤碱1.03±0.044.313.502.87±0.020.73−4.3373.71±1.291.75−1.722 056.86±57.312.792.84 去氢毛钩藤碱0.05±0.002.481.830.14±0.019.09−7.673.58±0.123.27−4.65107.00±2.081.947.00 缝籽嗪甲醚0.05±0.004.31−0.930.13±0.014.70−12.073.58±0.154.15−4.60104.17±2.792.684.17 毛钩藤碱0.05±0.005.230.530.14±0.0210.54−7.803.56±0.092.58−5.12107.74±2.252.097.74 脑异去氢钩藤碱0.48±0.024.53−3.251.45±0.085.22−4.3940.36±2.987.397.621 064.49±41.883.936.45 去氢钩藤碱1.00±0.022.31−0.492.96±0.248.14−0.1382.53±1.682.0310.032 170.42±33.111.538.52 钩藤碱0.48±0.012.61−3.611.44±0.032.36−4.1939.50±2.075.245.341 057.85±41.323.915.79 异钩藤碱1.01±0.033.191.402.93±0.186.32−1.0779.79±2.162.716.392 174.82±41.401.908.74 去氢毛钩藤碱0.05±0.000.91−0.870.15±0.0211.32−1.153.99±0.4110.386.53108.14±1.901.768.14 缝籽嗪甲醚0.05±0.004.945.900.15±0.017.181.113.90±0.4210.913.88108.06±3.483.228.06 毛钩藤碱0.04±0.003.88−10.730.13±0.014.15−10.403.83±0.4511.752.06107.18±2.622.457.18 肝异去氢钩藤碱0.50±0.036.24−0.011.55±0.063.951.9453.56±2.875.35−2.621 869.11±89.34.78−6.54 去氢钩藤碱1.08±0.043.318.042.96±0.092.99−1.93109.56±5.114.67−0.403 609.18±111.173.08−9.77 钩藤碱0.55±0.023.1810.351.52±0.021.161.7453.22±2.815.28−3.231 806.96±61.753.42−9.65 异钩藤碱0.87±0.022.55−13.372.83±0.103.42−5.56104.86±4.754.53−4.674 059.01±121.853.001.48 去氢毛钩藤碱0.05±0.004.670.570.15±0.015.04−2.615.31±0.244.50−3.51205.84±6.713.262.92 缝籽嗪甲醚0.06±0.005.2611.030.15±0.002.191.395.19±0.234.38−5.55195.28±7.363.77−2.36 毛钩藤碱0.06±0.002.5910.670.15±0.014.160.635.13±0.203.95−6.70198.26±8.084.08−0.87
3.1.5 稳定性 选取心、脑、肝3个组织对钩藤7个生物碱的稳定性进行考察,结果如表7~10所示,表明生物碱在不同储存条件下[室温4 h稳定性、自动进样器24 h(4 ℃)稳定性、冻融3个循环稳定性(−20 ℃)和短期稳定性(−20 ℃放置7 d)]较为稳定,均在±15%以内。
3.2 检测结果
基于构建的定量方法对钩藤给药后不同时间点大鼠心、肝、脾、肺、肾、脑组织中7个生物碱进行了定量分析,结果如图2所示。
文献报道钩藤中的主要成分为钩藤碱、异钩藤碱、去氢钩藤碱和去氢钩藤碱。药动学报道表明,大鼠ig钩藤后血浆中异钩藤碱含量最高,异钩藤碱与钩藤碱之间存在显著差异[14-15]。组织分布结果与文献报道数据相对应,可以观察到在各个组织中均为异钩藤碱含量最高,其次为去氢钩藤碱;异钩藤碱与去氢钩藤碱均远高于其对应的异构体钩藤碱与异去氢钩藤碱;3个四环单萜吲哚生物碱(去氢毛钩藤碱、毛钩藤碱、缝籽嗪甲醚)在各组织中均含量最低。比较不同组织中生物碱成分含量可以发现,7个生物碱均在肝脏中含量最高,其次为肾脏与肺部,而相比较,脑中各生物碱的含量均比较低,推测是血脑屏障限制了生物碱进入脑部,但是缝籽嗪甲醚在脑部的含量比其他成分高,可能是其发挥神经系统作用的基础。
表6 日间精密度与准确度
Table 6 Inter-day precision and accuracy
组织成分LLOQLQCMQCHQC 实测值/ (ng·mL−1)精密度/%准确度/%实测值/ (ng·mL−1)精密度/%准确度/%实测值/ (ng·mL−1)精密度/%准确度/%实测值/(ng·mL−1)精密度/%准确度/% 心异去氢钩藤碱0.52±0.035.573.681.50±0.031.780.1839.28±1.193.044.751 008.07±41.624.130.81 去氢钩藤碱1.04±0.054.454.232.78±0.124.14−7.2077.55±1.842.373.412 104.02±90.94.325.20 钩藤碱0.51±0.023.202.081.41±0.043.05−6.0937.86±0.832.200.951 037.75±23.112.233.78 异钩藤碱1.00±0.044.01−0.022.83±0.082.71−5.5574.74±2.052.74−0.352 074.07±56.82.743.70 去氢毛钩藤碱0.05±0.006.29−1.690.14±0.016.51-4.943.66±0.143.91−2.40107.75±3.022.807.75 缝籽嗪甲醚0.05±0.005.22−1.360.14±0.016.27−6.333.52±0.113.13−6.07106.03±2.732.576.03 毛钩藤碱0.05±0.004.580.130.14±0.016.34−4.013.65±0.154.13−2.57108.35±2.402.218.35 脑异去氢钩藤碱0.51±0.035.711.641.54±0.106.453.0039.93±2.065.176.481 080.18±28.692.668.02 去氢钩藤碱1.01±0.032.700.722.99±0.165.27−0.2782.71±1.672.0210.282 152.59±84.273.917.63 钩藤碱0.50±0.023.21−0.671.50±0.053.390.1839.68±2.025.095.811 059.46±48.644.595.95 异钩藤碱1.01±0.022.451.493.00±0.144.55−0.0880.38±2.993.727.172 112.42±71.473.385.62 去氢毛钩藤碱0.05±0.006.31−1.440.15±0.017.69−0.963.93±0.287.194.92107.94±3.603.337.94 缝籽嗪甲醚0.05±0.007.211.420.14±0.017.84−5.133.78±0.287.500.77107.21±3.393.177.21 毛钩藤碱0.05±0.006.82−5.480.14±0.017.57−5.113.84±0.318.172.27107.12±4.103.827.12 肝异去氢钩藤碱0.52±0.047.634.551.53±0.053.051.9755.86±3.355.991.561 836.61±117.056.37−8.17 去氢钩藤碱1.05±0.087.625.243.00±0.103.47−0.03110.84±4.133.730.773 783.60±404.0610.68−5.41 钩藤碱0.53±0.036.265.201.42±0.085.30−5.1254.25±2.204.05−1.361 809.92±68.083.76−9.50 异钩藤碱0.98±0.099.11−2.062.95±0.134.57−1.56106.08±3.963.74−3.563 963.55±213.645.39−0.91 去氢毛钩藤碱0.05±0.009.061.410.15±0.016.200.705.72±0.396.833.97209.41±14.586.964.71 缝籽嗪甲醚0.05±0.006.135.370.16±0.015.374.565.50±0.356.430.03201.12±17.078.490.56 毛钩藤碱0.05±0.008.682.040.15±0.029.861.535.57±0.458.091.34205.65±19.319.392.83
表7 短期稳定性 (室温放置4 h)
Table 7 Stability within 4 h in room temperature
组织成分LQCMQCHQC 精密度/%准确度/%精密度/%准确度/%精密度/%准确度/% 心异去氢钩藤碱5.26−0.201.710.740.98−10.40 去氢钩藤碱3.760.260.406.031.244.51 钩藤碱2.111.671.597.361.334.72 异钩藤碱2.165.063.697.552.315.49 去氢毛钩藤碱4.562.172.556.000.378.17 缝籽嗪甲醚5.00−7.332.290.661.388.32 毛钩藤碱7.692.393.1311.372.048.15 脑异去氢钩藤碱2.157.562.597.441.359.83 去氢钩藤碱1.91−1.081.628.062.156.65 钩藤碱4.490.631.6511.251.0611.05 异钩藤碱2.173.752.9111.352.649.25 去氢毛钩藤碱6.61−6.289.10−2.695.287.95 缝籽嗪甲醚3.34−11.569.93−5.043.416.23 毛钩藤碱4.19−12.805.37−9.144.866.25 肝异去氢钩藤碱5.60−5.925.07−6.435.38−9.20 去氢钩藤碱4.22−3.513.390.176.38−10.63 钩藤碱2.46−7.652.98−3.027.46−10.15 异钩藤碱5.00−6.233.12−2.968.83−1.61 去氢毛钩藤碱2.28−12.694.83−9.578.48−6.86 缝籽嗪甲醚3.01−8.793.22−10.573.17−12.37 毛钩藤碱6.235.523.63−9.795.29−9.64
表8 进样器稳定性 (4 ℃放置24 h)
Table 8 Stability within 24 h in autosampler at 4 ℃
组织成分LQCMQCHQC 精密度/%准确度/%精密度/%准确度/%精密度/%准确度/% 心异去氢钩藤碱7.70−5.390.792.206.53−7.37 去氢钩藤碱2.32−5.321.723.802.444.29 钩藤碱0.99−3.351.704.382.827.04 异钩藤碱0.74−1.921.58−0.313.345.69 去氢毛钩藤碱2.455.796.437.881.556.24 缝籽嗪甲醚4.92−4.491.942.612.334.86 毛钩藤碱3.335.802.896.140.978.10 脑异去氢钩藤碱2.17−0.903.062.611.8511.16 去氢钩藤碱2.130.022.598.632.1410.90 钩藤碱1.145.682.5711.261.219.96 异钩藤碱2.18−0.842.654.232.588.57 去氢毛钩藤碱9.71−3.525.62−0.441.759.05 缝籽嗪甲醚3.28−6.524.76−0.582.506.74 毛钩藤碱6.34 −2.365.640.222.9910.65 肝异去氢钩藤碱2.70−1.483.48−2.593.11−3.59 去氢钩藤碱1.68−1.582.991.664.42−9.20 钩藤碱3.63−3.583.440.164.78−6.82 异钩藤碱2.33−7.683.19−4.915.94−3.01 去氢毛钩藤碱5.302.495.31−4.7210.08−0.55 缝籽嗪甲醚3.566.055.04−0.4811.51−5.61 毛钩藤碱3.935.553.00−3.779.83−3.43
表9 冻融3个循环稳定性
Table 9 Stability in frozen-thawed cycle for three times
组织成分LQCMQCHQC 精密度/%准确度/%精密度/%准确度/%精密度/%准确度/% 心异去氢钩藤碱2.345.091.1510.990.789.79 去氢钩藤碱3.891.771.567.451.0810.24 钩藤碱1.770.731.116.890.443.22 异钩藤碱1.59−2.772.537.781.106.92 去氢毛钩藤碱4.16−9.290.63−8.120.988.90 缝籽嗪甲醚3.89−5.331.33−10.262.609.52 毛钩藤碱5.21−4.210.87−9.731.258.87 脑异去氢钩藤碱4.198.392.399.343.597.06 去氢钩藤碱3.891.933.096.914.603.35 钩藤碱2.730.642.450.792.69−2.17 异钩藤碱3.058.834.049.693.544.78 去氢毛钩藤碱3.5910.252.289.442.658.28 缝籽嗪甲醚3.257.733.826.181.788.18 毛钩藤碱3.358.312.576.061.0410.17 肝异去氢钩藤碱3.824.544.741.377.87−8.51 去氢钩藤碱2.523.090.528.737.63−1.09 钩藤碱2.040.822.134.457.85−4.11 异钩藤碱3.369.351.103.3111.304.54 去氢毛钩藤碱2.766.472.347.3711.121.54 缝籽嗪甲醚5.157.353.015.455.84−9.28 毛钩藤碱2.987.591.629.1510.92−2.35
表10 长期稳定性(−20℃放置7 d)
Table 10 Short-term stability at −20 ℃ for 7 d
组织成分LQCMQCHQC 精密度/%准确度/%精密度/%准确度/%精密度/%准确度/% 心异去氢钩藤碱2.345.091.1510.990.789.79 去氢钩藤碱3.891.771.567.451.0810.24 钩藤碱1.630.661.587.230.443.22 异钩藤碱2.58−1.082.537.781.106.92 去氢毛钩藤碱4.16−9.290.95−8.281.038.94 缝籽嗪甲醚3.89−5.331.33−10.262.609.52 毛钩藤碱5.21−4.210.98−9.781.258.87 脑异去氢钩藤碱1.505.062.724.661.368.12 去氢钩藤碱3.036.071.864.891.325.51 钩藤碱0.29−1.522.30−2.941.31−2.75 异钩藤碱2.189.081.687.362.275.46 去氢毛钩藤碱1.719.631.598.081.728.90 缝籽嗪甲醚3.147.795.498.933.187.38 毛钩藤碱2.3010.682.146.261.8812.47 肝异去氢钩藤碱9.5712.492.832.842.961.48 去氢钩藤碱4.134.387.88−5.477.26−5.27 钩藤碱3.343.282.373.464.83−4.13 异钩藤碱2.1110.870.902.475.411.91 去氢毛钩藤碱5.573.951.308.834.318.62 缝籽嗪甲醚3.728.315.623.156.130.59 毛钩藤碱2.863.481.0012.144.469.46

图2 6个组织中不同生物碱含量(, n = 3)
各组织中生物碱浓度随时间变化轮廓(图3)与药动学相关研究的结果相似,ig钩藤水煎液冻干粉15 min左右各组织即达到最高浓度(max),说明生物碱的吸收速率快,并能够迅速达到各个组织。肝脏中部分生物碱在给药1 h时含量出现双峰现象,与肝脏比较,在心、脾、肺、肾中,部分生物碱成分(异钩藤碱)浓度降低的速度较慢,两者可能存在潜在的因果关系。在给药12 h大多组织中的生物碱含量低于LLOQ,说明钩藤生物碱在体内能够被迅速代谢。
4 讨论
本研究建立了同时对钩藤中7个主要吲哚生物碱的LC-MS/MS定量方法,采用具有较高的选择性与灵敏度的MRM模式进行数据采集,并应用于大鼠体内组织分布研究。本研究中使用的生物碱对照品溶解在乙腈溶剂中稳定性良好,且长春胺作为常用内标同样具有较好的稳定性[19-20]。通过对多个组织进行方法学考察更具可靠性,且结果显示该方法下生物碱在各组织中的专属性、基质效应、回收率、精密度与准确度以及稳定性均在可接受范围内,各成分在各组织中线性关系良好,说明该方法准确可靠。大鼠ig钩藤提取物后,分析不同时间下的心、肝、脾、肺、肾、脑组织中7个生物碱含量变化。从不同时间各组织生物碱含量变化方面分析,发现分布在6个组织中的多数生物碱能够在1 h内均快速达到最高浓度,表明生物碱能够通过肠道-血液-组织的路径快速转移至各组织内。随后在给药12 h后大多数组织中生物碱几乎代谢完全(含量低于LLOQ),说明钩藤生物碱具有吸收快、代谢快的特点。
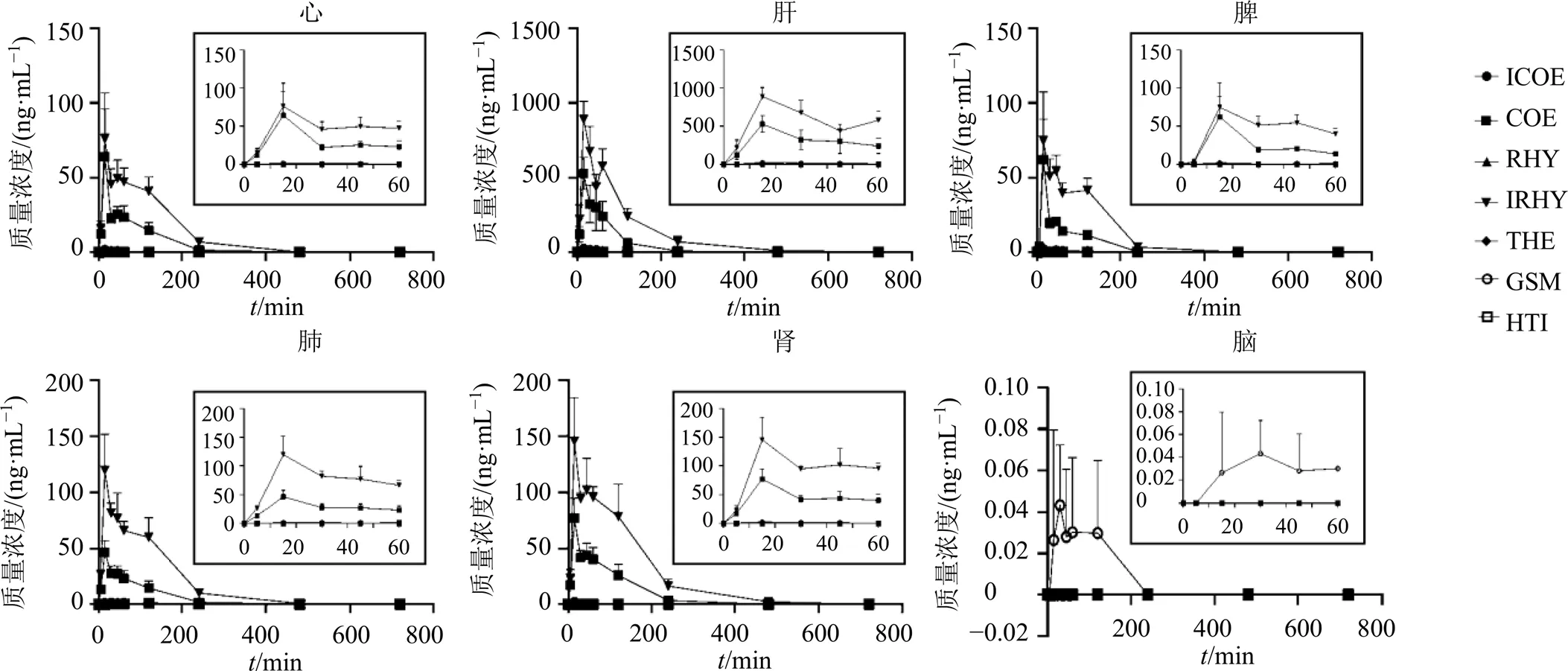
图3 6个组织中生物碱浓度随时间变化轮廓(, n = 3)
从不同组织含量方面分析,生物碱主要在肝脏蓄积,尤其异钩藤碱和去氢钩藤碱含量最高,并在1 h内含量持续分布较高,其次分布依次为肺>肾>脾>心>脑。比较不同组织中钩藤生物碱的含量发现,7个生物碱均在肝脏中表达出最高的浓度含量,其次为肾,此结果与文献报道的结果基本一致[10],推测是因为肝脏为生物碱的主要代谢部位,肾为排泄部位,在单体注射给药的相关实验中也观察到肺部的蓄积效应,生物碱肺部的蓄积可能会引起不良反应,临床用药时需要重点关注。而在脑中生物碱的含量基本低于LLOQ,虽然缝籽嗪甲醚在钩藤药材中含量较少,但是组织分布中仍能看到在脑中的分布,与文献报道缝籽嗪甲醚更容易入脑结果一致[16],并且Yang等[17]发现缝籽嗪甲醚有较强的乙酰胆碱酯酶抑制活性,说明缝籽嗪甲醚能透过血脑屏障,可能是钩藤发挥神经系统作用的物质基础,这为钩藤生物碱可以对中枢神经、脑缺血保护作用的药理活性提供了一定的体内数据支持,值得进一步研究。钩藤中7个主要生物碱的定量方法开发和组织分布研究,对钩藤生物碱靶向给药和体内代谢研究具有一定的参考价值。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 268.
[2] 于潇, 祝琳琳, 刘婕, 等. 钩藤中单萜吲哚类生物碱成分及其药理活性的研究进展 [J]. 中草药, 2021, 52(19): 6052-6065.
[3] 辛文波, 侴桂新, 王峥涛. 钩藤生物碱类成分研究 [J]. 中草药, 2009, 40(2): 204-207.
[4] Guo H P, Zhang X, Cui Y Q,. Isorhynchophylline protects against pulmonary arterial hypertension and suppresses PASMCs proliferation [J]., 2014, 450(1): 729-734.
[5] 何飞, 苏华, 韦桂宁, 等. 钩藤属部分不同种植物药材对正常大鼠血压的影响 [J]. 中国实验方剂学杂志, 2013, 19(2): 270-275.
[6] Yuan D, Ma B, Yang J Y,. Anti-inflammatory effects of rhynchophylline and isorhynchophylline in mouse N9 microglial cells and the molecular mechanism [J]., 2009, 9(13/14): 1549-1554.
[7] Shi J S, Yu J X, Chen X P,. Pharmacological actions ofalkaloids, rhynchophylline and isorhynchophylline [J]., 2003, 24(2): 97-101.
[8] 王英锋, 魏璐雪, 王保中. 钩藤生物碱实验动物体内药物分析 [J]. 药物分析杂志, 1999, 19(1): 58-60.
[9] 胡岚岚. 生物样本中钩藤碱的浓度测定及其动物体内药代动力学和组织分布研究 [D]. 重庆: 第三军医大学, 2013.
[10] Hu L L, Tang J L, Zhou S W. Quantification of rhynchophylline in rabbit plasma by UPLC-MS/MS and its application in a pharmacokinetic study [J]., 2015, 24(6): 393-399.
[11] Wang W, Ma C M, Hattori M. Metabolism and pharmacokinetics of rhynchophylline in rats [J]., 2010, 33(4): 669-676.
[12] Wu Y T, Lin L C, Tsai T H. Determination of rhynchophylline and hirsutine in rat plasma by UPLC-MS/MS after oral administration ofextract [J]., 2014, 28(3): 439-445.
[13] Yu Y, Yao C L, Guo D A. Insight into chemical basis of traditional Chinese medicine based on the state-of-the-art techniques of liquid chromatography-mass spectrometry [J]., 2021, 11(6): 1469-1492.
[14] 王建伟. 中药钩藤吲哚生物碱体内代谢研究 [D]. 南京: 中国药科大学, 2017.
[15] Wang X, Zheng M, Liu J,. Stereoselective pharmacokinetic study of rhynchophylline and isorhynchophylline epimers in rat plasma by liquid chromatography-tandem mass spectrometry [J]., 2017, 47(6): 479-487.
[16] Kushida H, Fukutake M, Tabuchi M,. Simultaneous quantitative analyses of indole and oxindole alkaloids ofHook in rat plasma and brain after oral administration of the traditional Japanese medicine Yokukansan using high-performance liquid chromatography with tandem mass spectrometry [J]., 2013, 27(12): 1647-1656.
[17] Yang Z D, Duan D Z, Du J,. Geissoschizine methyl ether, a corynanthean-type indole alkaloid fromas a potential acetylcholinesterase inhibitor [J]., 2012, 26(1): 22-28.
[18] U.S. Food and Drug Administration. Guidance for Industry Bioanalytical Method Validation [EB/OL]. [2018-05-24]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatory.
[19] 梁颖欣, 朱旦, 黄舒婷, 等. 一测多评法测定钩藤中7种生物碱类成分的含量 [J]. 中药材, 2019, 42(8): 1820-1823.
[20] 潘惠勤. 基于液相-高分辨质谱的多基原钩藤生物碱系统表征研究 [D]. 上海: 中国科学院大学(中国科学院上海药物研究所), 2018.
Tissues distribution of alkaloids fromin rats by UHPLC-MS/MS
WU Yi-song1, 2, LI Shi-wei1, 2, LI Hao-ju2, WEI Wen-long2, WU Shi-fei2, GUO De-an1, 2
1. College of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China 2. Shanghai Research Center for Modernization of Traditional Chinese Medicine, National Engineering Research Center for TCM Standardization Technology, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
To establish an ultra-high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS) method for determination of contents of rhynchophylline (RHY), isorhynchophylline (IRHY), corynoxeine (COE), isocorynoxeine (ICOE), hirsutine (HTI), hirsuteine (HTE) and geissoschizine methyl ether (GSM) and applied for tissue distribution of.Rats were igdecoction, then heart, liver, spleen, lung, kidney and brain tissue were acquired at 0.083, 0.25, 0.5, 0.75, 1, 2, 4, 8, 12 h. Vincamine was used as internal standard, samples were extracted by liquid-liquid extraction.For the established UHPLC-MS/MS method, minimum quantitative limits of seven alkaloids in different tissues ranged from 0.05 to 1.00 ng, and correlation between response and concentration was2≥ 0.991. The specificity, matrix effect, recovery rate, precision and accuracy and stability met the requirements. IRHY content was the highest in each tissue, followed by COE; Both IRHY and COE were much higher than their corresponding isomers (RHY and ICOE), while three tetracyclic monoterpene indole alkaloids (HTE, HTI and GSM) were the lowest in all tissues. Comparing the contents of alkaloids in different tissues, it was found that content of seven alkaloids was the highest in liver, followed by kidney and lung. The cause of accumulation was probably due to kidney and liver to be the main sites of metabolism and excretion.The established method has high sensitivity, good accuracy and specificity, which was suitable for tissue distribution study of alkaloids fromin different tissues of rats.
(Miq.) Miq. ex Havil.; alkaloids; rhynchophylline; isorhynchophylline; corynoxeine; isocorynoxeine; hirsutine; hirsuteine; geissoschizine methyl ether; quantitative analysis; tissue distribution
R285.5
A
0253 - 2670(2022)13 - 4035 - 11
10.7501/j.issn.0253-2670.2022.13.017
2022-04-02
上海市青年科技英才扬帆计划资助项目(21YF1455800)
吴依松,硕士研究生,中药化学研究方向。E-mail: wuys0828@163.com
果德安,研究员,博士生导师,主要从事中药化学与现代质量标准研究。Tel: (021)50271516 E-mail: daguo@simm.ac.cn
[责任编辑 李亚楠]
