外显子测序联合体细胞突变检测发现汗孔角化症八个突变位点
2022-05-17魏腾超王真真孙乐乐付希安陈声利王建文张福仁
魏腾超 王真真 孙乐乐 付希安 陈声利 王建文 张福仁 刘 红
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,山东济南,250022
汗孔角化症(porokeratosis, PK)是一组罕见的、具有遗传异质性的角质形成细胞克隆异常性皮肤病。目前,已发现7个基因与PK发病密切相关,包括甲羟戊酸代谢通路中的4个基因(MVK、PMVK、MVD、FDPS)和另外3个基因(SSH1、SART3、 SLC17A9)[1-6]。2015年,Zhang等[3]报道MVK、PMVK、MVD、FDPS 可以解释98%家系及73%散发患者的发病风险。2019年本课题组对137例PK患者进行甲羟戊酸通路上的全部12个基因和另外3个PK致病基因(SSH1、SART3和SLC17A9)的外显子区域进行高通量测序,共检测到108例在5个基因(MVK、PMVK 、MVD、FDPS和SLC17A9)上携带有害突变,其余29例患者未检测到相关突变[7],患者的突变携带率为78.8%。未检测到突变位点的家系,推测原因为:(1)由于引物设计等目标区域测序可能导致遗漏剪切区域的突变位点;(2)另有报道4%的PK患者发病是由拷贝数变异(CNV) 导致的[3],此类变异目标区域测序也无法检出;(3)存在体细胞突变的可能;(4)存在未知的新的基因。2019年Atzmony和Kubo先后发现体细胞突变与线状汗孔角化症(LP)、光照播散型汗孔角化症(DSAP)的关联,患者同时携带不同的体细胞突变[8,9]。本研究对课题组在已知基因上未发现有害突变的29例患者进行外周血DNA全外显子组测序(WES)和体细胞DNA Sanger测序,寻找是否存在目标区域测序遗漏的已知致病基因上的突变、CNV、体细胞突变,通过全血DNA全外显子组测序寻找是否有新的PK致病基因。
1 资料与方法
1.1 临床资料 选取上述29例(3个家系,26例散发) 患者,年龄5~73岁,诊断均经我院临床及病理组织检查确诊为汗孔角化症。部分患者皮损见图1。患者签署知情同意书,收集病史资料及库存外周血并切取病理组织蜡块,该研究通过医院伦理委员会审查。
1.2 方法
1.2.1 DNA提取 从-80℃超低温冰箱取出外周血5 mL,使用TIANamp Blood DNA Kit DP318-02(天根血液基因组DNA提取试剂盒) 按照说明提取外周血基因组DNA。从我院病理科切取患者病理组织蜡块,厚度6~8 μm每片,每人切取10片。使用QIAamp DNA Mini Kit试剂盒,按照Qiagen官网步骤提取体细胞基因组DNA。
1.2.2 全外显子组测序 使用超微分光光度计Nanodrop 8000检测上述外周血DNA样品的质量和纯度,使用Biorupter核酸剪切仪获得150~200 bp大小片段,使用AIExome Enrichment Kit V4试剂盒[艾吉泰康生物科技(北京)有限公司]进行富集,采用Illumina NovaSeq 6000平台进行大规模并行高通量测序。使用FastQC v0.11.8软件检查原始测序数据的基本质量。然后利用Trimmonmatic v0.38软件对数据进行修剪和过滤。使用BWA v0.7.17比对工具将得到的过滤后的数据映射到人类基因组参考(hg19版本),然后利用GATK v4.0.12.0软件并按照其最佳操作流程(the best practices ) 得到所有变异位点。
以200名正常人的数据构建CNV分析基线,使用CNVKit和Adtex软件以基线为参考对目标区域进行分析。
1.2.3 Sanger测序 在基因组数据库网站http://asia.ensembl.org/index.html找到Grch37版本下载基因序列,进入NCBI网站的Primer-BLAST进行引物设计,分别获取外显子的跨侧翼的上下游引物序列。并采用温度梯度法探索每一对引物的最佳退火温度。PCR反应在9700型PCR扩增仪(美国ABI公司)上完成,PCR产物采用琼脂糖凝胶电泳仪进行电泳,切取荧光条带凝胶并回收后,使用醋酸钠乙醇沉淀法纯化PCR产物。对于组织DNA质量不佳或存在DNA断裂的,采用二次PCR方法:以PCR产物为模板重复上述步骤一次。最后在ABI 3500XL遗传分析仪(美国ABI公司) 直接测序。
1.2.4 突变注释 首先,我们基于hg19参考基因组用ANNOVAR软件对所有变异位点进行注释。去除在千人基因组计划数据库、ExAC数据库以及gnomAD数据库中次等位基因频率>0.01%的位点后,满足下面任一条件的变异位点被认为是有害的:(1)SIFT评分<0.025且Polyphen-2评分>0.95的错义突变位点;(2)无义突变、移码突变;(3)剪切位点突变且dbscSNV评分>0.6的变异;(4)在基因突变数据库(HGMD)中被定义为有害突变(DM)的位点。
2 结果
2.1 外周血DNA 全外显子组测序结果 28例患者(1例DNA质检不合格)中,有3例患者(F1,S1,S2)在已知基因上发现致病突变,F1、S2携带MVD: c.70+5 G>A突变,S1携带MVK:c.371+5 G>A突变,MVD上的突变已被报道[8],MVK上的突变为新发现突变位点。剩下的25例患者未在已知基因上发现致病突变或CNV变异。
携带突变的3例患者均为DSAP分型,并通过Sanger测序排除假阳性(图2) 。
2.2 组织DNA Sanger测序结果 成功提取了16例患者的组织DNA(表1)。16例患者中6例(S2、S3、S4、S5、S6、S7)检出致病突变,10例未检出致病突变。6例突变中S7为WES携带突变的患者,组织DNA与外周血DNA携带相同突变位点。另外5例突变位于MVD、MVK、PMVK基因上(突变位点均已报道),Sanger测序验证生殖细胞相应位点均未发生突变,证实患者仅为体细胞突变(图3)。

图1 面颈部、前胸、后背见环形小丘疹,中央萎缩,边缘隆起,边界清晰
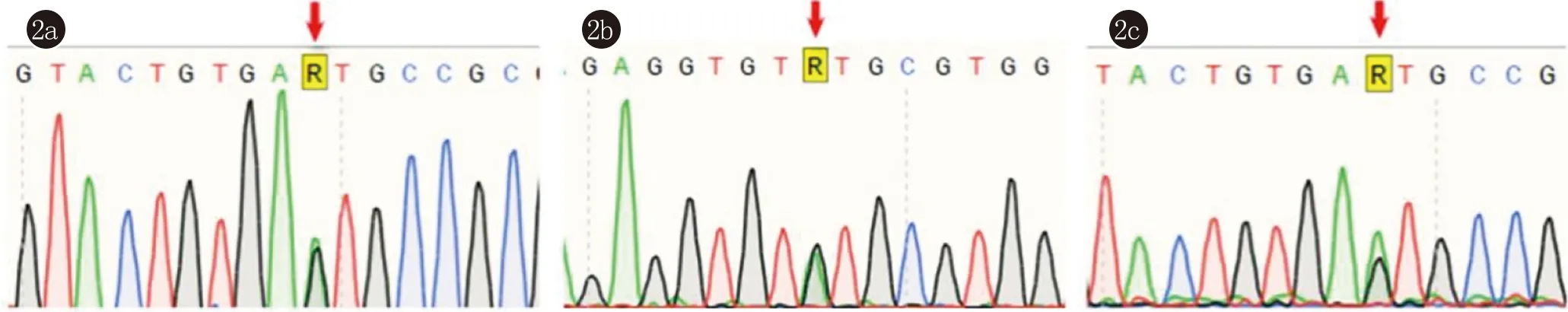
2a:MVD c.70+5 G>A;2b:MVK: c.371+5 G>A;2c:MVD c.70+5 G>A

3a:PMVK c.412 C>T无义突变;3b:MVK c.467 C>A 错义突变;3c:MVD c.746 T >C错义突变
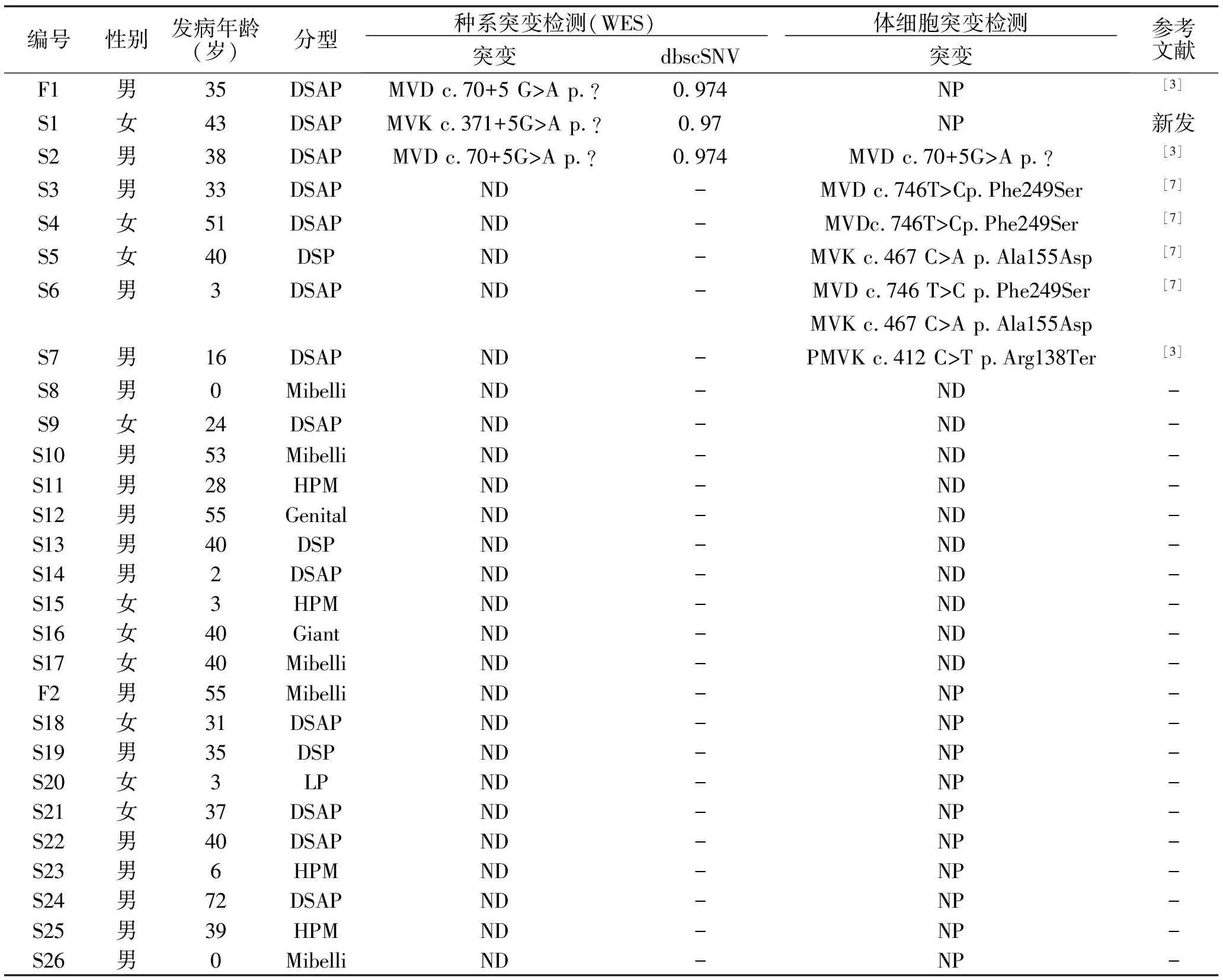
表1 28个样本实验结果
3 讨论
汗孔角化症遗传模式主要表现为单基因常染色体显性遗传,但其外显不完全,也有部分无遗传史的散发病例。 2015年Zhang等[3]对134例PK患者的外周血DNA进行突变检测,发现位于甲羟戊酸通路上的4个基因(MVK、PMVK、MVD、FDPS)与PK发病的关联, 98%家系及73%散发患者至少存在1个基因突变,未发现突变的患者4%存在CNV变异。同时发现体细胞中存在野生等位基因表达失衡(AEI)现象。2019年Atzmony和Kubo等[8,9]发现LP、DSAP患者生殖系突变基础上,体细胞遭受“二次打击”导致基因突变或杂合性缺失(CN-LOH)。这表明胚胎期基因突变和出生后外界环境的“二次打击”的累加效应会导致LP和DSAP发病。
本研究通过WES技术,在外周血DNA中鉴定了目标区域测序遗漏的2个已报道剪切位点突变和1个新的剪切位点突变MVK: c.371+5 G>A,dbscSNV[10]得分0.97,预测为有害突变。
最近Atzmony等[8]报道了3例LP患者同时存在生殖系和体细胞突变,1/3病例为体细胞杂合缺失,Kubo等[9]报道2例LP和7例DSAP患者同时存在生殖系和体细胞突变,8/9患者存在体细胞杂合缺失现象。Saleva-Stateva等[11]在6例散发LP患者中发现生殖系和体细胞突变,5/6患者存在体细胞杂合缺失现象。以上报道病例疾病分型为DSAP或LP,突变基因涉及MVD、PMVK和 MVK,后天的“二次基因突变”是DSAP和LP发生的基础[12,13],LP的二次突变通常发生在生殖细胞,因此临床上发病相对较早,DSAP的二次突变发生在体细胞,可以为同源重组或紫外线导致的点突变,临床发病相对LP较晚。在Kubo的报道中,一例DSAP患者的体细胞中发现多达5种突变形式,提示DSAP患者可能经受多次体细胞突变事件。Kubo根据Knudson’s“二次打击”假说[14]把DSAP描述为表皮内良性肿瘤。本研究在进行体细胞DNA测序时,由于试剂盒提取体细胞基因组DNA的洗脱体积为60 μL,且质量不佳,不满足WES测序要求,因此采用Sanger测序。限于DNA洗脱体积,选取相对热点的突变基因MVK、MVD、PMVK[8,9]进行测序,最终鉴定了5例已报道突变。5例患者均为散发病例,其中4例为DSAP分型、1例DSP分型,表现出DSAP分型和后天体细胞突变的关联性[9]。有1例患儿发病年龄早,考虑与MVD和MVK均突变有关。5例患者仅检出体细胞突变,患者可能遭受二次甚至多次体细胞突变致病,包括Sanger测序难以分辨的体细胞纯合突变或其他突变形式。
编号F2、S18~S26的患者,病理组织存放时间过长,提取到的DNA无法满足测序要求,因此未进行Sanger测序。通过WES和体细胞检测未发现突变的患者均为散发患者,可能的解释:(1)这些患者可能存在现有突变筛查方法无法检测到的突变形式。虽然WES有帮助,但有些突变可能很难通过这种方法检测出来,如非编码区的突变[15]和杂合的大面积缺失、插入或复制[16]。同时由于Sanger测序的局限性,不能排除患者存在其他体细胞突变或其他突变形式。(2)这些患者可能是无突变的免疫抑制引起的PK,有学者认为该病是一种具有遗传性的皮肤特异性自身炎症性疾病,与免疫抑制有关[17]。(3)研究中采用二次PCR扩增方法,可能使DNA被稀释,导致检测突变遗漏。
基因突变按照突变部位可分为生殖系突变和体细胞突变,生殖系突变遗传给后代,而体细胞突变不会。因此建议对PK患者进行跨侧翼序列的基因突变检测[18]。对于未发现生殖系突变的患者,可进行体细胞突变检测,为遗传咨询提供更准确的建议。
