梗阻性黄疸合并肌肉减少症的相关影响因素
2022-05-16蔡婷婷胡凤爱陈强谱
王 蕾 蔡婷婷 胡凤爱 陈强谱
1 滨州医学院附属医院临床营养科 山东 滨州 256603;2 滨州医学院附属医院医学研究中心 山东 滨州 256603;3 滨州医学院附属医院肝胆外科 山东 滨州 256603
2019年亚洲老年人肌少症工作组(Asian working group for sarcopenia,AWGSOP)将肌肉减少症(sarcopenia,SA)定义为与年龄相关的肌肉质量减少症,同时存在肌肉力量和/或躯体功能下降[1]。除了年龄因素,其他因素也可引起SA,全身性炎症反应和慢性消耗性疾病,比如恶性肿瘤、营养不良、缺乏锻炼等因素会导致SA的发生。
梗阻性黄疸是肝胆外科较为常见的疾病,多因胆道炎症、结石、肿瘤造成胆汁排出障碍而引起血清胆红素浓度升高所致,极易发生营养不良。Foschi等[2]以体质量丢失>10%和肱三头肌皮褶厚度下降作为营养不良的指标,结果表明,50%~70%的梗阻性黄疸患者存在营养不良。SA是肝病营养不良的一个主要特征,目前关于梗阻性黄疸合并SA的研究较少。本研究旨在就梗阻性黄疸患者人体成分、生化指标及其他相关因素与SA的关系进行系统性分析,探究梗阻性黄疸患者合并SA的危险因素,以期为临床防治提供参考依据。
1 研究对象与方法
1.1 研究对象 本研究纳入2019年12月至2020年12月在我院肝胆外科住院的梗阻性黄疸患者104例。纳入标准为:确诊为梗阻性黄疸患者;能配合完成SA诊断测试;患者知情同意,自愿参与本研究。排除标准为:手部严重关节炎、腕管综合征等影响握力测定者;脑卒中病史、运动神经元病等影响活动能力者;植入心脏起搏器或金属支架等影响生物电阻抗分析者;急性起病或病情严重者;周围血管疾病患者。
1.2 研究方法
1.2.1 SA的诊断 依据AWGS2019年诊断标准。四肢骨骼肌质量指数(appendicular skeletal mass index,ASMI)的诊断标准为:BIA法测定男性<7.0 kg/m2,女性<5.7 kg/m2;或 DXA法测定男性<7.0 kg/m2,女性<5.4 kg/m2。肌肉力量的诊断标准为:男性握力<28 kg,女性握力<18 kg。身体活动能力的诊断标准为:6米步行速度<1 m/s ;或5次坐起时间≥12 s;或简易体能测量表(SPPB)≤9。符合ASMI +肌肉力量和/或身体活动能力的诊断标准即可诊断为SA。将纳入104例患者分为SA组和无SA组。
1.2.2 营养风险筛查(nutritional risk screening,NRS2002)量表评分 包括疾病严重程度评分+营养状态评分+年龄评分。
1.2.3 人体测量 测量患者身高、体质量、握力。评估握力时使用Jamar测力计的第二个手柄位置,测试者取端坐位90°屈肘,使用优势手最大力量抓握测力计,以连续3次测试的平均值作为衡量握力的标准。体质量指数(body mass index, BMI)=体质量(kg)/身高2(m2)。
1.2.4 人体成分分析 本研究采用韩国Biospace公司生产的InBodyS10仪器进行人体分析。测量前禁食禁饮8 h以上,无输液,排空大小便,受试者脱去鞋袜,取下身上电子物品及金属配饰,仰卧位躺下,使双臂外展与躯干约15°夹角,双腿分开与肩同宽,平卧10 min进行测量。测量指标包括去脂体质量、细胞外水分比率(ECW/TBW)、左上臂肌肉围度、相位角(phase angle,PA)。ASMI=四肢骨骼肌质量/身高2。
1.2.5 实验室检查 入院后第二天清晨空腹抽取静脉血送检验科行血常规、生化检验,记录血清白蛋白、外周淋巴细胞计数,计算预后营养指数(prognostic nutritional index,PNI)。PNI =白蛋白(g/L)+5×外周淋巴细胞计数(109/L)。记录血红蛋白、血小板、中性粒细胞绝对值、血沉、总胆红素、葡萄糖、总胆固醇、甘油三酯、血钠、血钾。黄疸程度按血清总胆红素分为4个等级(表1)。

表1 黄疸严重程度分级
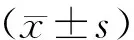
2 结果
2.1 梗阻性黄疸合并SA的占比情况 本研究共纳入104例梗阻性黄疸患者,按AWGS 2019年诊断标准,其中32例(30.76%)合并SA,72例(69.23%)无SA。
2.2 SA组和无SA组患者一般临床特征的比较 本研究采用NRS2002营养风险筛查,SA组存在营养风险的患者共22例(68.75%),无营养风险患者10例(31.25%);无SA组存在营养风险的患者共29例(40.28%),无营养风险患者43例(59.72%),两组间例数比较,P=0.007<0.01。SA组的体重、握力、BMI、去脂体质量、四肢骨骼肌指数、上臂肌肉围度、相位角均低于无SA组,P<0.001。SA组的ECW/TBW高于无SA组,P=0.007<0.01。SA组的PNI略低于无SA组,两组间PNI比较,P=0.003<0.01。SA组的血红蛋白略低于无SA组,两组间血红蛋白比较,P=0.012<0.05。两组间的血小板、中性粒细胞、血沉、甘油三酯、总胆红素、总胆固醇、血钠、血钾的差异无统计学意义(表2)。
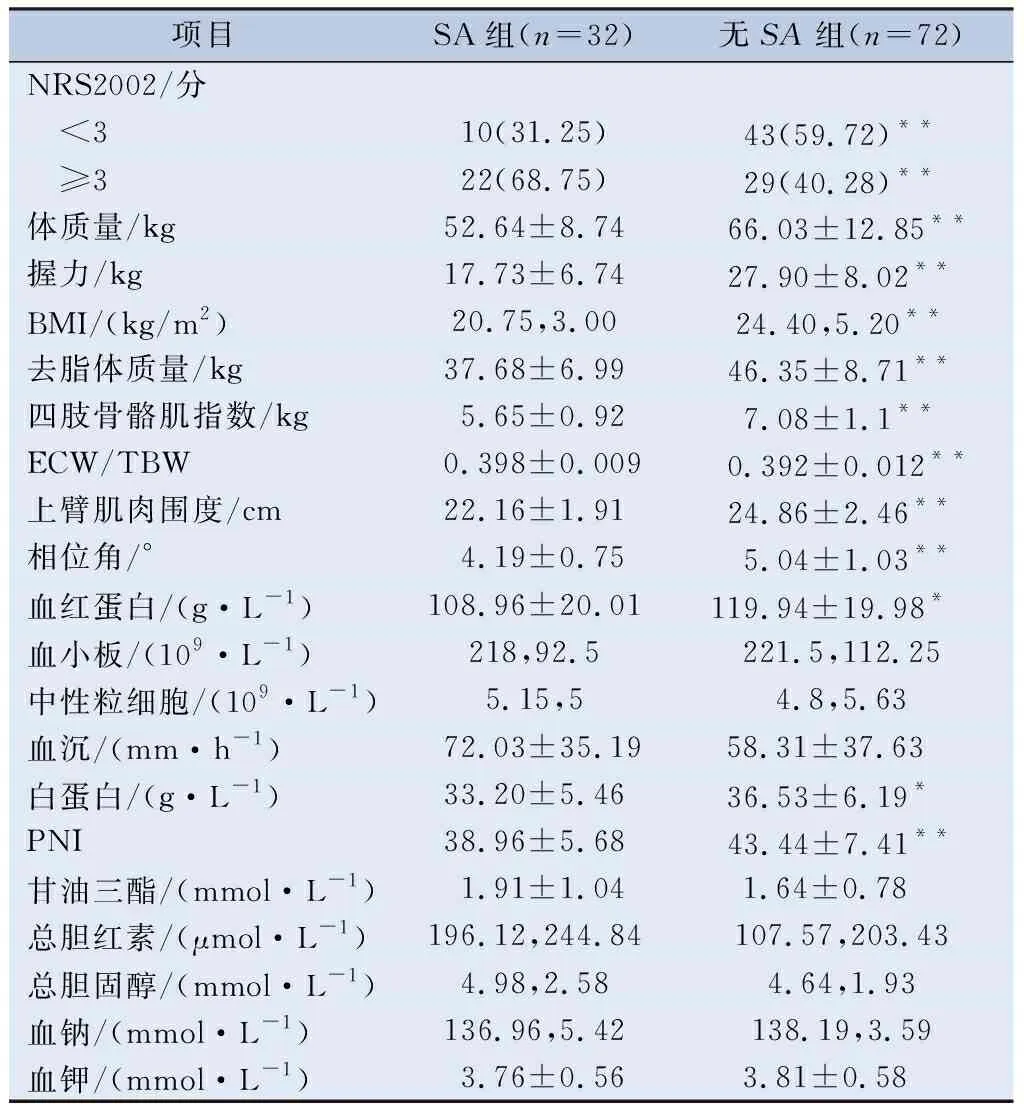
表2 SA组和无SA组一般临床特征的比较
2.3 多因素二元logistic回归分析 本研究以是否发生SA为因变量,以体重、握力、去脂体重、BMI、四肢骨骼肌指数、ECW/TBW、上臂肌肉围度、相位角、白蛋白、PNI、血红蛋白为自变量,进行多因素二元logistic回归分析,结果显示,握力和PNI是梗阻性黄疸患者合并肌肉减少症的保护因素(表3)。

表3 黄疸合并肌肉减少症患者的多因素logistic回归分析
2.4 不同黄疸程度患者SA发生率的比较 不同黄疸程度患者按照血清总胆红素水平分为四组,其中隐性黄疸组2例,轻度黄疸组12例,中度黄疸组13例,重度黄疸组5例。四组患者SA发生率比较,χ2=12.895,P=0.005<0.01(表4)。

表4 不同黄疸程度患者肌肉减少症发生率的比较
3 讨论
目前我国的老龄化速度加快导致SA对我国民众健康的影响与日俱增。根据EWGSOP和AWGS的不同定义,骨骼肌减少的发病率可能存在很大差异。本研究采用AWGS2019年诊断标准发现,梗阻性黄疸患者中的SA占比高达30.67%。
本研究显示,SA与营养评估风险评分和黄疸严重程度呈正相关。梗阻性黄疸患者营养不良的发生与胆管梗阻程度及年龄有关。年龄大于68岁,血清胆红素和谷丙转氨酶水平升高会增加严重营养不良的风险[3]。SA也是胰腺癌患者预后不良的危险因素[4]。肌肉蛋白质合成减少和降解增加是SA发生的主要原因之一。梗阻性黄疸患者发生SA的原因复杂。食物摄入不足和营养不良导致骨骼肌维持受损,加之消耗自身蛋白增多,影响肌肉质量和力量[5]。胆道梗阻导致肠道内胆汁缺乏,出现食欲低下、厌油、腹胀等症状使患者进食量减少。肠道粘膜屏障受损,影响营养物质的吸收。恶性梗阻性黄疸因肿瘤消耗易并发营养不良。长期胆汁淤积形成肝硬化,蛋白质合成减少,蛋白质分解代谢增加以及骨骼肌卫星细胞增殖和分化受损。压力增高及胆汁本身对胆道系统的损害使得胆道梗阻后更容易发生炎症反应,在SA发生之前,炎症可能已经随着促炎细胞因子的释放而持续发病,梗阻性黄疸患者需要更多的蛋白质来抵抗炎症和急慢性疾病伴随的异常分解代谢状态。梗阻性黄疸患者术前SA的发生率高,术后营养和免疫状况下降会进一步加重SA。所以,术后早期肠内营养可以有效减少梗阻性黄疸患者炎性介质的释放[6]。
生物电阻抗分析(bioelectrical impedance analysis,BIA)是评估SA的有效工具。本研究相关因素分析结果显示,梗阻性黄疸合并SA与ECW/TBW呈正相关,这与新修订的AWGS2019年诊断标准中SA与ECW/TBW之间的相关性是一致的。水是人体的主要组成部分,约占肌肉总量的76%。细胞脱水会对肌肉产生严重影响,使肌肉收缩力下降,导致肌肉萎缩[7]。本研究显示,梗阻性黄疸合并SA与BMI、四肢骨骼肌指数、上臂肌肉围度、相位角呈负相关。调整混杂因素后,骨骼肌减少与BMI呈负相关[8],高BMI对减少SA的发生及可逆性有保护作用[9]。低AMC显著增加了患SA的风险[10-11]。相位角与SA呈负相关,即使在SA前期阶段也是如此。相位角≤4.55°可以用于老年人SA的诊断,尤其是对于不能测量握力的人群[12]。本研究显示,血红蛋白与梗阻性SA呈负相关。一项对澳大利亚 70 岁以上男性的研究发现,血红蛋白水平下降会增加SA的风险[13]。本研究采用多因素logistic回归分析首次证实握力和PNI是梗阻性黄疸患者发生肌肉减少症的保护因素。PNI由日本学者首次提出,主要用于评估多种疾病患者的营养状况、手术风险和预后情况[14]。肌肉过度丢失的患者放射治疗后的白蛋白和PNI水平显著降低[15-16]。
综上所述,梗阻性黄疸患者SA的发生率较高。SA会影响患者肌肉质量、肌肉力量和躯体功能,从而导致患者预后不良。因此,临床医师可通过患者握力和PNI减低及早发现和诊断此类患者,在治疗其原发病的同时,适当给予营养支持、运动锻炼等干预来延缓SA的发展。
