小檗碱干预缺血性脑卒中大鼠的作用机制研究
2022-05-14杨鲁杰邢树礼王雪贞
杨鲁杰,邢树礼,司 婕,王雪贞
缺血性脑卒中(ischemic stroke,IS)是脑卒中的常见类型,具有发病率高、致残率高、病死率高、复发率高的特点,且近年来发病率呈上升趋势,并逐渐低龄化[1]。脑组织对缺氧极为敏感,缺血性脑卒中导致的缺血、缺氧常常会损伤病人认知功能,造成感觉功能、运动神经障碍及精神意识失常。目前,缺血性脑卒中治疗以6 h内动、静脉溶栓及血管介入治疗为主,尽管效果明显,但不适用于时间窗外病人[2]。有研究显示,治疗时间窗短及药物作用机制单一是治疗缺血性脑卒中失败的主要原因[3]。因此,探究作用机制多样并具有宽时间窗的药物对于治疗缺血性脑卒中具有重要作用。小檗碱是一种小檗科植物根茎提取的季铵类生物碱,除具有抗炎、抗菌、抗病毒等药理活性外,对糖尿病、心脑血管疾病、肿瘤等亦有治疗效果。既往研究显示,小檗碱可介导相关信号通路调节缺血性脑卒中小胶质细胞分化,且可通过抑制炎性因子的释放减轻缺血再灌注损伤,提示其在治疗脑血管方面的作用[4-5]。目前,关于小檗碱对缺血性脑卒中认知功能影响的研究较少。本研究通过建立缺血性脑卒中模型大鼠,探究小檗碱对缺血性脑卒中的治疗作用,并分析相关机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 85只无特定病原体(SPF)级SD雄性大鼠,6周龄,体质量(200±20)g,购自北京瑞博开拓医药科技有限公司,动物生产许可证号:SYXK(京)2019-0038,自由进食、饮水,环境温度(24±1) ℃,12 h/12 h明暗交替,适应性饲养1周。
1.1.2 药物、主要试剂和仪器 小檗碱(纯度>98%)(成都瑞芬思生物科技有限公司生产);尼莫地平片(黑龙江天宏药业股份有限公司生产;国药准字H20113486;20 mg)。氯化三苯基四氮唑(TTC)溶液(购自青岛海博生物技术有限公司)。超氧化物歧化酶(superoxide dismutase,SOD)试剂盒及一氧化氮(nitric oxide,NO)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)酶联免疫吸附法(euzymelinked immunosorbent assay,ELISA)试剂盒均购自武汉默沙克生物科技有限公司;三磷酸腺苷(ATP)试剂盒、三氯醋酸均购自北京迈瑞达科技有限公司;脱氧核苷酸转移酶标记技术(TUNEL)细胞凋亡检测试剂盒(绿色荧光)购自美国Abcam公司;RIPA细胞裂解液购自上海碧云天生物技术有限公司;5-单磷酸腺苷活化蛋白激酶(AMPK)、脱氧核苷酸转移酶标注技术(p-AMPK)、沉默信息调节因子2相关酶类1(silent mating type information regulation 2 homolog-1,SIRT1)一抗购自美国Thermo Fisher Scientific公司。Morris水迷宫购自北京友诚嘉业生物科技有限公司;RM2235病理切片机购自徕卡显微系统(上海)贸易有限公司;Synergy-HD显微镜购自日本Toshiba公司;Mini Protean 3 Cell小型垂直电泳购自美国伯乐公司。
1.2 实验方法
1.2.1 模型建立及分组 采用改良Longa线栓法建立缺血性脑卒中大鼠模型[6]。将70只大鼠用2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,剪开左侧颈部皮肤,钝性分离肌群,游离颈总动脉及颈内、外动脉,结扎颈总动脉近心端、颈外动脉,夹闭颈内动脉远端,距离颈总动脉1 cm位置切小口,将鱼线从颈总动脉插入内动脉,直到感受到阻力,深度18~20 mm,线栓即到达并阻塞左侧大脑中动脉开口处,扎紧动脉残端,常规缝合、消毒。大鼠清醒后单笼饲养,采用Longa提出的神经功能评价方法评价其神经功能:无明显神经功能缺失表现为0分;提尾时左侧前肢屈曲且不能伸展为1分;爬行时出现追尾表现或向左侧划圈为2分;爬行困难,向左侧倾倒为3分;意识丧失,不能爬行为4分。评分1~3分提示建模成功,0分、4分剔除。剩余15只大鼠将阻塞线插入颈内动脉深度约5 mm,剩余步骤同上,设为健康组。70只大鼠造模成功62只,随机分为缺血性脑卒中组(15只)、小檗碱低剂量组(15只)、小檗碱高剂量组(16只)、尼莫地平组(16只)。
1.2.2 干预方式 确定建模成功后即根据前期实验研究结果,结合参考文献确定小檗碱低剂量组、高剂量组分别以100 mg/kg、200 mg/kg小檗碱与生理盐水混合后灌胃[7],每日1次;尼莫地平组采用40 mg/kg尼莫地平片干预,与生理盐水混合后灌胃,每日1次;健康组与缺血性脑卒中组采用等量生理盐水灌胃,每日1次。干预时间为14 d。
1.2.3 Morris水迷宫实验观察大鼠认知功能 末次干预后次日行Morris水迷宫实验。水池120 cm×60 cm×25 cm,水温23 ℃,分为4个象限,第3象限正中放置高23 cm、直径10 cm的圆形平台。随机选取1个象限将大鼠面向池壁放入,记录大鼠60 s内找到平台的时间(逃避潜伏期),超过60 s未找到平台,记录潜伏期为60 s,每日训练2次,每次间隔15 min,共训练5 d。第6天撤走平台,将大鼠从原象限的对侧放入水中,记录逃避潜伏期、穿越原平台次数、目标象限停留时间。
1.2.4 组织取材 水迷宫实验完成后,颈部断头处死大鼠,剪开头颅,血管钳去除颅骨,暴露脑组织,取出脑组织后用预冷生理盐水清除血污,每组取5只大鼠脑组织置于冰上用于TTC染色;10只大鼠去除小脑及枕叶后,取缺血侧周围脑组织,分3份保存于液氮中,1份用于脑组织SOD、NO、eNOS含量检测,以及Ca2+,Mg2+-ATP酶和Na+,K+-ATP酶活性测定;1份用于HE染色、TUNEL荧光染色;其余用于蛋白免疫印迹法(Western Blot)实验。
1.2.5 TTC染色法测定脑梗死体积 取冰上保存脑组织,置于-20 ℃冰箱中30 min后取出,沿冠状面自前脑额部向后连续切片(每片2 mm),迅速置入含2% TTC的磷酸缓冲盐溶液(PBS)溶液中,37 ℃遮光孵育25 min,每5 min轻晃容器,随后置入4%多聚甲醛中固定12 h,取出脑片后用PBS溶液充分洗涤,拍照后经图像分析软件Image Pro Plus 6.0分析图像,正常脑组织为鲜红色,梗死灶为苍白色。测量每片梗死面积、总面积,梗死体积为层厚与梗死面积乘积,总梗死体积为各层梗死体积之和。
1.2.6 测定脑组织SOD、NO、eNOS含量 取冷冻保存脑组织,称重后加入生理盐水,剪刀剪碎,置于预冷玻璃匀浆器中,捣杆充分研磨约5 min,制成10%脑组织匀浆液,3 000 r/min、离心半径10 cm离心10 min,-80 ℃保存备用。分别采用羟胺法测定脑组织SOD水平,采用ELISA法测定NO、eNOS含量,严格按照试剂盒要求设计实验步骤。
1.2.7 测磷法测定脑组织Ca2+,Mg2+-ATP和Na+,K+-ATP活性 取冷冻保存脑组织,匀浆后以3 000 r/min、离心半径10 cm离心10 min,取上清定磷,以比色法检测ATP酶水平。操作步骤为:取匀浆液0.1 mL,加入反应液至1 mL,37 ℃水浴孵育60 min,加入10%三氯醋酸1 mL以终止反应,3 500 r/min、离心半径10 cm离心5 min,取上清0.5 mL测定脑组织线粒体Ca2+,Mg2+-ATP和Na+,K+-ATP活性。以每小时分解每克组织蛋白产生无机磷的含量表示酶活力单位。
1.2.8 HE染色法观察脑皮质病理变化 取40%中性甲醛固定的脑组织,脱水、包埋,病理切片机制作成4 μm连续切片,二甲苯脱蜡、乙醇水化,HE染色后观察脑皮质病理变化。
1.2.9 TUNEL荧光染色法测定海马区神经元凋亡情况 取40%中性甲醛固定的脑组织,脱水、包埋,病理切片机制作成4 μm连续切片,严格按照TUNEL细胞凋亡检测试剂盒(绿色荧光)说明书要求加入TUNEL反应混合液,湿盒中37 ℃孵育1 min,PBS冲洗,加入过氧化物酶(POD)转化剂,37 ℃湿盒中继续孵育30 s,磷酸缓冲盐溶液(PBS)冲洗,加入二氨基联苯胺(DAB)底物溶液,室温孵育10 min,PBS冲洗,甘油封片,荧光显微镜下计数海马区凋亡细胞。凋亡率=阳性细胞数/细胞总数×100%。每张切片任选5个视野计数,求平均值。
1.2.10 Western Blot法测定脑组织SIRT1、AMPK、p-AMPK蛋白相对表达量 取冷冻保存脑组织40 mg,研磨后转至离心管,RIPA细胞裂解液冰上裂解,10 000 r/min,离心半径10 cm离心20 min,BCA试剂盒测定蛋白浓度,取40 μg待检测样本混合5倍体积上样缓冲液,沸水浴5 min使蛋白变性,10 000 r/min离心半径10 cm离心20 min,取上清,电泳后湿转至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,加入1∶1 000兔抗大鼠SIRT1、AMPK、p-AMPK一抗,4 ℃摇床孵育过夜,TBST洗涤,加入1∶8 000山羊抗兔IgG二抗,室温孵育2 h,TBST洗涤,暗室中曝光、显影,凝胶成像系统分析灰度值,以SIRT1、AMPK、p-AMPK灰度值/内参β-actin灰度值表示蛋白相对表达量。
2 结 果
2.1 各组认知功能比较 与健康组比较,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组逃避潜伏期延长,穿越原平台次数减少,目标象限停留时间缩短,差异均有统计学意义(P<0.05);与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组逃避潜伏期缩短,穿越原平台次数增加,目标象限停留时间延长,差异均有统计学意义(P<0.05);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组逃避潜伏期缩短,穿越原平台次数增加,目标象限停留时间延长,差异均有统计学意义(P<0.05);与小檗碱高剂量组比较,尼莫地平组逃避潜伏期缩短,穿越原平台次数增加,目标象限停留时间延长,差异均有统计学意义(P<0.05)。详见表1。
表1 各组大鼠认知功能比较(±s)
2.2 各组脑梗死体积比较 缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑梗死体积分别为(45.23±5.24)mm3、(37.52±5.02)mm3、(29.65±4.51)mm3、(22.04±4.62)mm3。与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑梗死体积减小,差异均有统计学意义(P<0.001);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组脑梗死体积减小,差异均有统计学意义(P<0.001);与小檗碱高剂量组比较,尼莫地平组脑梗死体积减小,差异有统计学意义(P=0.030)。各组脑梗死体积TTC染色图详见图1。
图1 各组脑梗死体积TTC染色(A为健康组;B为缺血性脑卒中组;C为小檗碱低剂量组;D为小檗碱高剂量组;E为尼莫地平组)
2.3 各组脑组织SOD、NO、eNOS含量比较 与健康组比较,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑组织SOD含量减少,NO、eNOS含量增加,差异均有统计学意义(P<0.05);与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑组织SOD含量增加,NO、eNOS含量减少,差异均有统计学意义(P<0.05);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组脑组织SOD含量增加,NO、eNOS含量减少,差异均有统计学意义(P<0.05);与小檗碱高剂量组比较,尼莫地平组脑组织SOD含量增加,NO、eNOS含量减少,差异均有统计学意义(P<0.05)。详见表2。
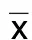
表2 各组脑组织SOD、NO、eNOS含量比较(±s)
2.4 各组脑组织Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性比较 与健康组比较,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑组织Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性降低,差异均有统计学意义(P<0.05);与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组脑组织Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性增强,差异均有统计学意义(P<0.05);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组脑组织Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性增强,差异均有统计学意义(P<0.05);与小檗碱高剂量组比较,尼莫地平组脑组织Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性增强,差异均有统计学意义(P<0.05)。详见表3。
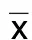
表3 各组脑组织Na+,K+-ATP酶、Ca2+,Mg2+-ATP酶活性比较(±s)单位:μmol Pi/mg prot·h
2.5 各组脑组织病理形态学比较 健康组神经元、神经胶质细胞核膜清晰、核仁明显,无明显炎性细胞浸润及神经细胞变性坏死;缺血性脑卒中组神经元结构模糊,胞体肿胀,尼氏体消失,呈现胞核深染、固缩、溶解,核体不规则,并出现软化灶、炎性细胞浸润;小檗碱低、高剂量组尼莫地平组干预后神经元胞核深染、固缩、溶解程度有所减轻,软化灶缩小,炎性细胞浸润减少,其中尼莫地平组改善最为明显,其次为小檗碱高剂量组,最后为小檗碱低剂量组。详见图2。
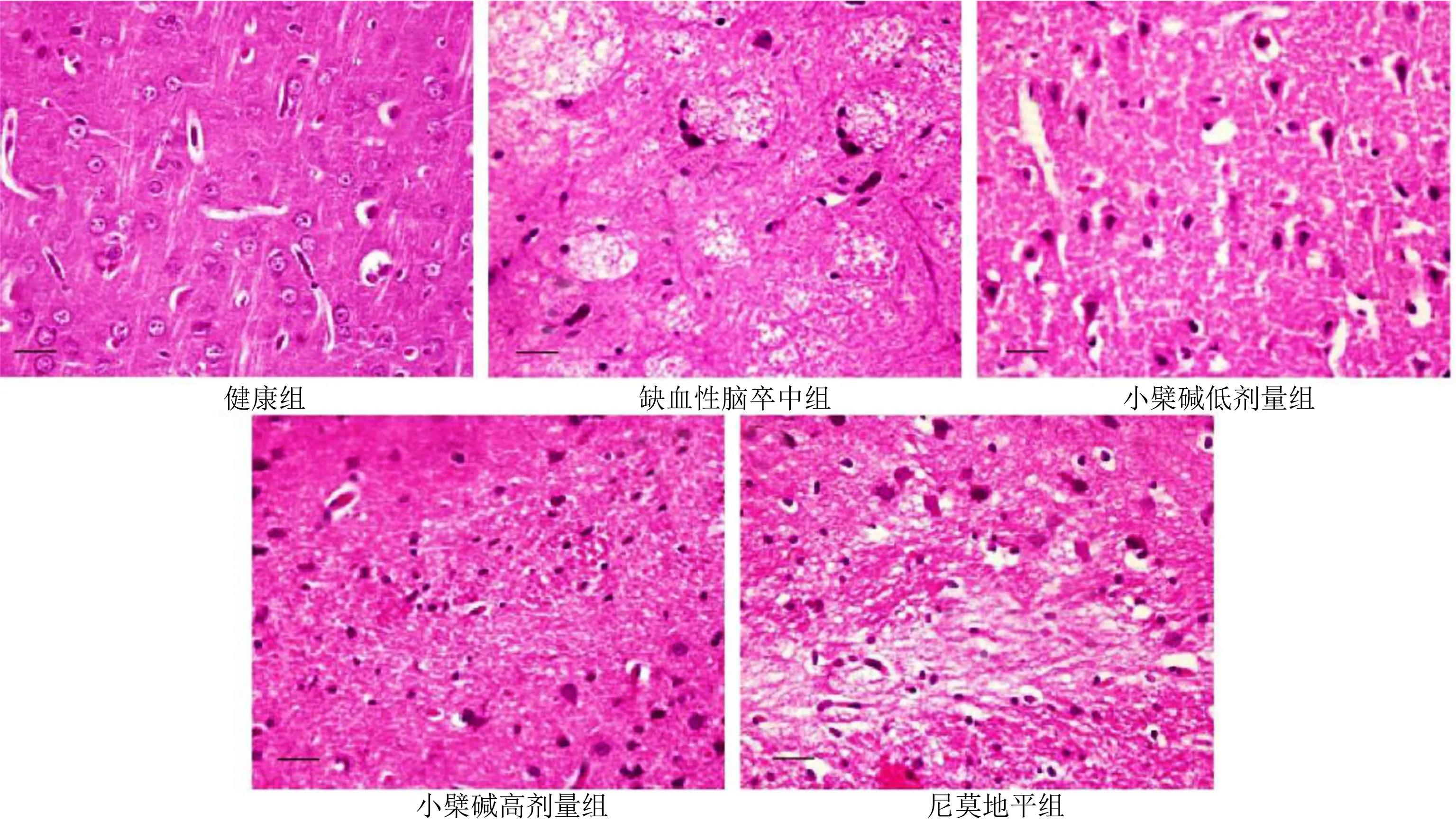
图2 各组脑组织病理形态学观察(HE染色,×400,标尺50 μm)
2.6 各组海马区神经元凋亡率比较 健康组、缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组海马区神经元凋亡率分别为(1.25±0.32)%、(71.52±9.27)%、(50.98±6.88)%、(33.85±4.02)%、(19.96±3.14)%。与健康组比较,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组海马区神经元凋亡率均降低,差异均有统计学意义(P<0.001);与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组海马区神经元凋亡率均降低,差异均有统计学意义(P<0.001);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组海马区神经元凋亡率均降低,差异均有统计学意义(P<0.001);与小檗碱高剂量组比较,尼莫地平组海马区神经元凋亡率降低,差异有统计学意义(P<0.001)。详见图3。
图3 海马区神经元凋亡TUNEL荧光染色(×100)
2.7 各组脑组织SIRT1蛋白相对表达量、p-AMPK/AMPK比较 与健康组比较,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组SIRT1蛋白相对表达量、p-AMPK/AMPK均降低,差异均有统计学意义(P<0.05);与缺血性脑卒中组比较,小檗碱低剂量组、小檗碱高剂量组、尼莫地平组SIRT1蛋白相对表达量、p-AMPK/AMPK均升高,差异均有统计学意义(P<0.05);与小檗碱低剂量组比较,小檗碱高剂量组、尼莫地平组SIRT1蛋白相对表达量、p-AMPK/AMPK均升高,差异均有统计学意义(P<0.05);与小檗碱高剂量组比较,尼莫地平组SIRT1蛋白相对表达量、p-AMPK/AMPK均升高,差异均有统计学意义(P<0.05)。详见表4、图4。
表4 各组脑组织SIRT1蛋白相对表达量、p-AMPK/AMPK比较(±s)
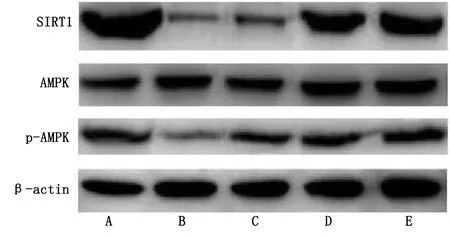
图4 脑组织SIRT1、AMPK、p-AMPK蛋白表达条带图(A为健康组;B为缺血性脑卒中组;C为小檗碱低剂量组;D为小檗碱高剂量组;E为尼莫地平组)
3 讨 论
缺血性脑卒中是脑动脉短暂或持续性闭塞所致的脑供血不足,进而引发一系列级联反应,最终导致缺血区域脑组织发生不可逆损伤[8]。目前,临床关于缺血性脑卒中发病机制通常被认为与脑细胞能量耗竭、脑组织酸中毒、神经毒素毒性作用、海马神经元凋亡、梗死灶周围半暗带去极化、炎性细胞因子及氧自由基损伤有关[9-10]。认知功能异常是缺血性脑卒中后高发神经心理学表现,且是影响病人日常生活及各项功能的重要因素。因此,探究促进缺血性脑卒中后认知功能改善的有效方式,并分析相关分子机制具有广阔前景。
研究显示,能量衰竭是导致脑卒中后脑组织损伤最直接的原因[11]。缺血性脑卒中后经氧自由基等途径导致线粒体结构及功能异常,诱发能量衰竭,进而造成神经元凋亡或坏死数量增加。本研究结果显示,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组、尼莫地平组大鼠逃避潜伏期依次缩短、穿越原平台次数依次增加、目标象限停留时间依次延长、脑组织SOD含量依次增加,NO、eNOS含量依次减少,脑组织线粒体Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性依次增强,梗死体积依次缩小,脑皮质病理变化依次减轻,海马神经元凋亡率依次降低,提示小檗碱可改善缺血性脑卒中认知功能、氧化应激、能量代谢、病理损伤,缩小梗死体积,减少海马神经元凋亡,且呈剂量依赖性。小檗碱是多种具有清热解毒功效中药的共有成分,以往常用于痢疾、细菌性肠胃炎等消化道疾病的治疗。近年来研究发现,小檗碱可经多种途径发挥脑缺血的保护作用[12]。Yang等[13]研究报道,小檗碱可通过激活相关信号通路,降低凋亡蛋白表达缓解光化学法诱导的脑缺血/再灌注损伤。Martins等[14]在体外肝移植动物模型的保存溶液中加入小檗碱可保护线粒体功能和生物能,使其免受缺血/再灌注伤害,提示小檗碱对线粒体功能有保护作用。Maleki等[15]在大鼠局灶性脑缺血后1 h采用小檗碱处理,通过行为测试及含水量测定发现小檗碱可显著改善脑水肿,并有助于运动功能的恢复,证实其治疗缺血性脑卒中的有效性,本研究结果与其具有部分相似性。
SIRT1是一种对烟酰胺腺嘌呤二核苷酸具有依赖性的去乙酰化酶,通过使非组蛋白及组蛋白发生乙酰化作用进而参与细胞生物学行为及能量代谢等过程。AMPK是一种具有高度保守性的苏氨酸/丝氨酸蛋白激酶,通过影响细胞物质代谢途径促进脂肪酸氧化及ATP生成,以维持细胞能量平衡,通常作为“能量调节器”“细胞内燃料机”备受关注。既往研究显示,缺血性脑卒中后神经及认知功能损伤主要是能量供应不足所致,SIRT1可通过调控烟酰胺腺嘌呤二核苷酸水平来调节AMPK表达,增加糖酵解,抑制糖异生,增加神经细胞能量供应,且磷酸化AMPK通过激活自噬、抑制炎症反应及氧化应激、减少细胞凋亡、促血管新生等途径,减轻缺血性脑卒中后神经功能损伤[16]。董海平等[17]研究证实,激活AMPK/SIRT1通路对大鼠脑缺血再灌注损伤具有抑制作用,且通过降低炎性因子水平发挥神经保护作用。本研究结果显示,缺血性脑卒中组、小檗碱低剂量组、小檗碱高剂量组SIRT1蛋白相对表达量、p-AMPK/AMPK依次增加,提示小檗碱对缺血性脑卒中的改善作用可能是通过激活AMPK信号通路来实现的。
综上所述,小檗碱可改善缺血性脑卒中大鼠认知功能、缩小梗死体积、减轻氧化应激及脑组织病理变化,改善脑组织能量代谢,减少海马神经元凋亡,推测其作用机制与激活AMPK信号通路有关。
