术后不同时间对肺癌患者抗凝的效果分析
2022-05-14夏腾邢世贵
夏腾 邢世贵


【摘要】 目的 探讨术后不同时间给予肺癌患者低分子肝素钙抗凝的临床效果。方法 选取2020年1月- 2021年3月南京市高淳人民医院胸外科行手术治疗的肺癌患者,根据组间基本资料均衡可比的原则分为6h组(n=22)、12h组(n=25)、24h组(n=24)三组。三组患者均于术前12h使用低分子肝素钙抗凝,6h组于术后6h,12h组于12h,24h组于24h继续给予低分子肝素钙抗凝至患者出院。比较三组患者术后引流情况,患者术前,术后6、12h以及第3、7天的凝血功能,术后并发症发生情况。结果 三组患者术中出血量、术后第2天引流量、术后第3天引流量及置管时长比较,差异无统计学意义(P>0.05),但6h组患者术后第1天的引流量明显多于其他两组,差异有统计学意义(P<0.05)。三组患者围手术期的血小板计数、凝血酶时间(TT)、凝血酶原时间(PT)、纤维蛋白原(Fbg)、抗凝血酶-Ⅲ(AT-Ⅲ)等凝血功能指标组间比较差异无统计学意义(P>0.05);6h组患者术后12h的活化部分凝血活酶时间(APTT)明显高于其他两组,组间比较差异具有统计学意义(P<0.05);24h组患者术后第7天的D-二聚体水平明显高于其他两组,组间比较差异具有统计学意义(P<0.05)。12h组患者术后发生下肢肌间静脉血栓1例,24h组发生下肢肌间静脉血栓5例,组间比较差异有统计学意义(P<0.05)。结论 肺癌手术患者在术前12h使用低分子肝素钙抗凝基础上,术后12h继续给予药物抗凝,能在控制出血风险的前提下,预防静脉血栓栓塞症,且效果最佳。
【关键词】 肺癌;围手术期;抗凝;低分子肝素钙;静脉血栓栓塞症
中图分类号 R734.2 文献标识码 A 文章编号 1671-0223(2022)11--05
肺癌是我国常见的恶性肿瘤之一,其发病率和病死率在我国恶性肿瘤中均占第一位[1]。静脉血栓栓塞症(venous thromboembolism, VTE)包括:深静脉血栓形成(deep vein thrombosis, DVT)和肺栓塞(pulmonary embolism, PE),是外科术后常见并发症。癌症是VTE的高危因素之一,可增加4.1倍血栓形成的风险[2],而肺癌相对于其他恶性肿瘤更易发生VTE,因此肺癌术后VTE的发生率更高,且主要发生在术后初期[3-7]。目前,VTE已成为肺癌术后猝死的第二大原因,严重影响患者的生存和预后[8-9]。因此,抗凝治疗是肺癌患者围手术期的一个重要环节。然而,国内有学者认为药物抗凝会增加围手术期出血风险,导致肺癌患者在围手术期并不能接受正规的抗凝治疗。2018年国内专家组达成共识,即高危的VTE肺癌患者的药物抗凝预防应在术前12h开始,并于术后12h继续给予抗凝预防[10]。本研究探讨肺癌患者术后使用低分子肝素抗凝的最佳时间,现将结果报告如下。
1 对象与方法
1.1 研究对象
选取2020年1月- 2021年3月南京市高淳人民医院胸外科行手术治疗的71例肺癌患者。纳入标准:①病理明确诊断为原发性肺癌;②手术方式为胸腔镜下肺叶/肺段切除+淋巴结清扫术;③无抗凝禁忌证;④临床资料完整。排除标准:①病理证实为良性病变或转移性肺癌患者;②有出血性疾病;③对低分子量肝素钙过敏者;④术后出现严重并发症者。根据组间基本资料均衡可比的原则分为三组,分别是6h组22例,12h组25例,24h组24例。本研究经医院医学伦理委员会审批,患者及家属均知情同意。
1.2 治疗方法
三组患者均于术前12h给予低分子量肝素钙(葛兰素史克有限公司生产,批准文号:H20181136)4100IU皮下注射,并给予其他基础的血栓预防措施。6h组患者于术后6h开始皮下注射4100IU低分子量肝素钙,1次/天,持续至出院;12h组于术后12h开始皮下注射4100IU低分子量肝素钙,1次/天,持续至出院;24h组于术后24h皮下注射4100IU低分子量肝素钙,1次/天,持续至出院。如患者术后出现严重出血情况,立即停用低分子肝素。
1.3 观察指标
(1)术中出血及术后引流情况:包括术中出血量,术后第1、2、3天的胸引流量及置管时长。
(2)凝血功能:检测患者术前,术后6、12h,術后第3、7天的凝血指标,包括血小板计数(PLT)、凝血酶时间(TT)、凝血酶原时间(PT)、纤维蛋白原(Fbg)、抗凝血酶-Ⅲ(AT-Ⅲ)、活化部分凝血活酶时间(APTT)、D-二聚体(DD)。
(3)术后并发症:术后1周应用B超检测患者下肢深静脉血栓发生情况,应用肺动脉CT血管造影技术检测急性肺栓塞发生情况。
1.4 统计学处理
统计学数据分析均采用SPSS 23.0软件,计量资料用“±s”表示,组间均数比较采用t检验;计数资料计算百分率,组间率比较采用χ2检验。P<0.05为差异统计学意义。
2 结果
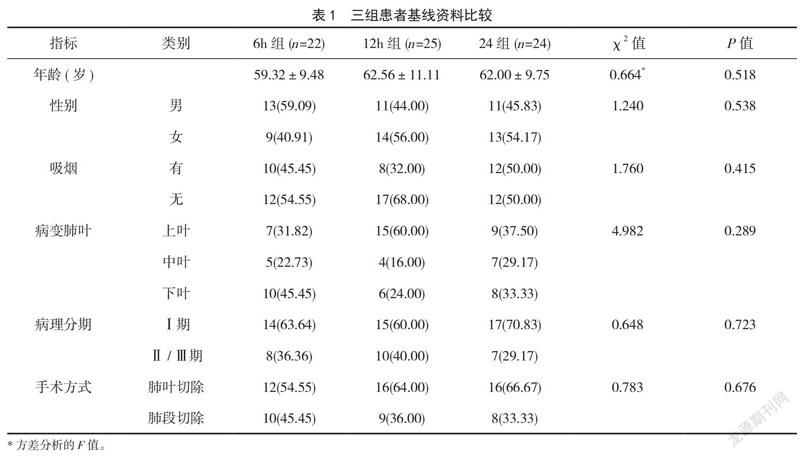
2.1 三组患者基线资料比较
三组患者的性别、年龄、吸烟史、病变肺叶、手术方式及术后病理分期等基线资料比较,差异无统计学意义(P>0.05),见表1。
2.2 三组患者术中出血及术后引流情况比较
三组患者的术中出血量、术后第2天引流量、术后第3天引流量及置管时长等组间比较,差异无统计学意义(P>0.05),但6h组患者术后第1天的引流量明显多于其他两组,差异有统计学意义(P<0.05),见表2。
2.3 三组患者凝血功能比较
三组患者围手术期的PLT、TT、PT、Fbg、AT-Ⅲ等凝血功能指标组间比较,差异均无统计学意义(P>0.05);6h组患者术后12h的APTT值明显高于其他两组,组间比较差异具有统计学意义(P<0.05);24h组患者术后第7天的DD值明显高于其他两组,组间比较差异具有统计学意义(P<0.05),见表3。
2.4 三组患者并发症情况
12h组患者术后发生下肢肌间静脉血栓1例,24h组发生下肢肌间静脉血栓5例,组间比较差异有统计学意义(χ2=4.971,P=0.026)。
3 讨论
VTE是恶性肿瘤常见并发症,已成为恶性肿瘤患者第二大死亡原因,其形成机制较复杂,涉及多种凝血因子和信号通路[11]。有研究表明,肿瘤细胞可以表达多种参与凝血级联反应激活作用的促凝因子,如组织因子、肝素酶、癌性促凝物等;肿瘤细胞也会通过分泌可溶性介质,如肿瘤坏死因子、白细胞介素-1β等,或直接与宿主血管和血细胞接触刺激这些细胞中促凝因子的表达。此外,中性粒细胞胞外诱捕网也有助于血小板黏附和血栓形成[12-13]。总之,恶性肿瘤使患者的血液处于高凝状态。在肺癌患者中,VTE的发病率比健康人群高22倍,比其他惡性肿瘤患者高出7倍[14]。而伴随的危险因素,如重大手术、中心静脉置管、化疗等,则会进一步增加血栓形成风险[15-16]。我国最近的一项研究发现,未经规范预防的肺癌患者术后VTE发生率高达16.4%[17]。发病原因包括肺部手术操作会使血管内皮细胞损伤,暴露胶原和组织因子,促进血小板聚集,激活内源性和外源性凝血系统,同时由于静脉壁电荷发生变化,会进一步激活凝血系统;肺癌手术时间长、创伤大,患者术中制动、术后长时间处于卧床状态,活动量明显下降,使下肢静脉血液淤滞、回流受阻。
针对VTE,国内外专家均采取了相关的应对措施。美国胸科医师学会(ACCP)指南推荐,对于没有明显出血风险的胸外科术后患者使用低剂量普通肝素或低分子肝素预防VTE;对于出血风险高的患者,建议在出血风险降低和药物预防开始之前,使用间歇充气加压装置进行机械预防。然而由于关于胸外科VTE预防的研究相对有限,这些建议主要是基于普外科的研究[18-19]。国内专家组于2018年达成共识,建议对肺癌VTE的高危患者,围手术期应尽早进行VTE预防,包括药物预防和机械预防[10]。在过去的一项大型性多中心试验中,结果显示于术前2h和术后8h使用低剂量肝素(5000IU)可显著降低VTE的发生率[20]。由于药物抗凝势必会增加出血风险,导致不可预测的后果,在最近的一项研究发现,术前普通肝素治疗增加了出血再次手术的风险,却没有降低肺癌术后VTE的发生率[21]。因此,为达到抗凝安全性和有效性的平衡,VTE风险因素分层以及药物的选择和时机的把握尤为重要。
目前,低分子肝素被认为是预防和治疗癌症患者发生VTE的首选方案[22]。临床上对肺癌患者多采用低分子肝素进行药物抗凝治疗[23]。一项荟萃分析报道,对于接受预防性抗凝治疗的非住院肺癌患者,低分子肝素可显著降低VTE风险,而发生出血事件的风险没有显著增加[24]。低分子肝素是普通肝素的解聚片段,既具有抗Ⅱa因子活性作用,又能灭活和血小板结合的Ⅹa因子,在保证抗血栓作用的同时,可以控制出血风险[25]。低分子肝素因其具有半衰期较长,安全性更高,生物利用度高,不需要血液学检测等优点,通常也被认为是癌症患者首选的抗凝药物。另外,有研究表明,第二代低分子肝素贝米帕素可抑制人肺癌、乳腺癌和白血病微循环内皮细胞的血管生成,具有一定抗癌作用[26]。药物抗凝预防的时机尚无明确指南,目前公认为VTE高危的肺癌患者应在术前12h开始,术后12h继续给予抗凝预防[4]。因此在本研究中,一组患者的给药时间为术后12h,一组患者术后抗凝的时间延迟至24h。同时,结合低分子肝素钙的半衰期为3.5h,5~6个半衰期即17.5~21.0h,临床上肺癌术后6h时,术前使用的药物基本从体内代谢完,相对较为安全,因此增加术后6h组作为对比,探索肺癌患者围手术期使用低分子肝素抗凝的最佳时机。有研究认为,术后7d是VTE的发病高峰期[5,27]。本研究结果显示,术后抗凝时机大于24h的患者DD值明显高于抗凝更早的患者。同时,术后VTE相关并发症方面,12h组和24h组均出现下肢肌间静脉血栓形成的患者,分别为1例和5例,而6h组无相关病例,表明术后更早的抗凝效果优于晚期抗凝(>24h)。当然,由于本次研究均于术后1周复查下肢深静脉B超,可能会遗漏部分复查前已被治愈的VTE病例。而三组患者的术中出血量、术后第2、3天引流量等组间比较并无统计学差异,但术后6h给予抗凝的患者术后第1天引流量明显多于其他两组,因此,其安全性有待进一步验证。
综上所述,肺癌患者围手术期应行预防性抗凝,且时机选择与目前国内专家共识相符,在术前12h药物抗凝基础上,术后12h继续给予药物抗凝,效果最佳,更早或更迟的使用低分子肝素综合疗效并不优于该方案。但由于该类患者的VTE防治涉及循证医学资料复杂,国内外对此的系统归纳分析仍很匮乏,在实际临床中应根据具体情况进行个体化、精准化诊疗。同时,需要更多的随机对照临床试验来确定肺癌患者围手术期预防性抗凝的利弊,为肺癌手术患者制定更好的抗凝方案,使治疗效果最优化。
4 参考文献
[1] Chen WQ, Sun KX, Zheng RS, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1):1-12.
[2] Lee AY, Levine MN. Venous thromboembolism and cancer:Risks and outcomes[J]. Circulation, 2003, 107(23 Suppl 1):I17-21.
[3] Wang H, Huang Y, Xu CW, et al. Clinical analysis of tumor and non-tumor patients complicated with pulmonary embolism[J]. Int J Clin Exp Med, 2015, 8(10):18729-18736.
[4] Vitale C, D'Amato M, Calabrò P, et al. Venous thromboembolism and lung cancer:a review[J]. Multidiscip Respir Med, 2015, 10(1):28.
[5] Tesselaar ME, Osanto S. Risk of venous thromboembolism in lung cancer[J]. Curr Opin Pulm Med, 2007, 13(5):362-367.
[6] Hicks LK, Cheung MC, Ding K, et al. Venous thromboembolism and nonsmall cell lung cancer:A pooled analysis of National Cancer Institute of Canada Clinical Trials Group trials[J]. Cancer, 2009, 115(23):5516-5525.
[7] Christensen TD, Vad H, Pedersen S, et al. Venous thromboembolism in patients undergoing operations for lung cancer:a systematic review[J]. Ann Thorac Surg, 2014, 97(2):394-400.
[8] Wang Z, Pei C, Ma L, et al. Acute pulmonary embolism after pneumonectomy[J]. J Thoracic Dis, 2012, 4(1):76-82.
[9] Hwang HG, Schulman S. Respiratory review of 2013:pulmonary thromboembolism[J]. Tuberc Respir Dis(Seoul), 2013, 75(3):89-94.
[10] 李辉,姜格宁.胸部恶性肿瘤围术期静脉血栓栓塞症预防中国专家共识(2018版)[J].中国肺癌杂志,2018,21(10):739-752.
[11] Zhang M, Wu S, Hu C. Do lung cancer patients require routine anticoagulation treatment? A meta-analysis[J]. J Int Med Res, 2020, 48(1):300060519896919.
[12] Hisada Y, Mackman N. Cancer-associated pathways and biomarkers of venous thrombosis[J]. Blood, 2017, 130(13):1499-1506.
[13] Falanga A, Schieppati F, Russo D. Cancer tissue procoagulant mechanisms and the hypercoagulable state of patients with cancer[J]. Semin Thromb Hemost, 2015, 41(7):756-764.
[14] Noble S, Pasi J. Epidemiology and pathophysiology of cancer-associated thrombosis[J]. Br J Cancer, 2010, 102 Suppl 1(Suppl 1):S2-9.
[15] Dimakakos E, Kotteas E, Gomatou G, et al. Do we need prophylactic anticoagulation in ambulatory patients with lung cancer? A review[J]. Vasc Med, 2020, 25(3):255-262.
[16] Falanga A. The incidence and risk of venous thromboembolism associated with cancer and nonsurgical cancer treatment[J]. Cancer Invest, 2009, 27(1):105-115.
[17] 宋春鳳,李辉,田博,等.胸外科术后静脉血栓栓塞症发生情况的单中心前瞻性队列研究[J].中华外科杂志,2018,56(4):284-288.
[18] Gould MK, Garcia DA, Wren SM, et al. Prevention of VTE in nonorthopedic surgical patients:Antithrombotic Therapy and Prevention of Thrombosis, 9th ed:American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl):e227S-e277S.
[19] Shargall Y, Litle VR. European perspectives in Thoracic Surgery, the ESTS venous thromboembolism (VTE) working group[J]. J Thorac Dis, 2018, 10(Suppl 8):S963-S968.
[20] Prevention of fatal postoperative pulmonary embolism by low doses of heparin. An international multicentre trial[J]. Lancet, 1975, 2(7924):45-51.
[21] Van Haren RM, Rajaram R, Correa AM, et al. Preoperative heparin for lung cancer resection increases risk of reoperation for bleeding[J]. Semin Thorac Cardiovasc Surg, 2020, 32(2):337-343.
[22] Kearon C, Akl EA, Ornelas J, et al. Antithrombotic therapy for VTE disease:CHEST guideline and expert panel report[J]. Chest, 2016, 149(2):315-352.
[23] 張霓,付向宁.不同剂量低分子肝素对胸外科手术患者术后凝血功能的影响[J].中国胸心血管外科临床杂志, 2011,18(1):30-34.
[24] Thein KZ, Yeung SJ, Oo TH. Primary thromboprophylaxis (PTP) in ambulatory patients with lung cancer receiving chemotherapy:A systematic review and meta-analysis of randomized controlled trials (RCTs)[J]. Asia Pac J Clin Oncol, 2018, 14(3):210-216.
[25] Pregowski J,Kepka C,Kalinczuk L,et al.Comparison of intravascular ultrasound,quantitative coronary angiography,and dual-source64-slice computed tomography in the preprocedural assessment of significant saphenous vein graft lesions[J]. Am J Cardiol,2011,107(10) :1453-1459.
[26] Vignoli A, Marchetti M, Russo L, et al. LMWH bemiparin and ULMWH RO-14 reduce the endothelial angiogenic features elicited by leukemia, lung cancer, or breast cancer cells[J]. Cancer Invest, 2011, 29(2):153-161.
[27] Hachey KJ, Sterbling H, Choi DS, et al. Prevention of postoperative venous thromboembolism in thoracic surgical patients:Implementation and evaluation of a caprini risk assessment protocol[J]. J Am Coll Surg, 2016, 222(6):1019-1027.
[2021-11-16收稿]
