模拟胃肠消化对羊皮胶原肽抗氧化活性的影响及其消化保护分析
2022-05-13王贝贝
王贝贝,于 哲,李 强,刘 飞,*,钟 芳
(1.江南大学食品学院,江苏 无锡 214122;2.北京秋实胶原肠衣有限公司,北京 102602)
自由基的产生是正常有氧细胞代谢的结果,体内构建的抗氧化系统在防止自由基损伤方面起着决定性的作用[1]。然而高浓度下的自由基可能会导致氧化应激,严重损害人体内的细胞功能,甚至导致细胞死亡,引发患病状态[2]。氧化性损伤会随着时间延长而累积,参与癌症、心血管和神经性疾病的发展以及衰老过程[3]。同时,免疫系统也极易受到氧化剂和抗氧化剂平衡的影响,不受控制的自由基产生会破坏免疫系统的功能和防御机制[4]。大量研究表明抗氧化活性肽具有很强的自由基清除能力,可以参与到体内抗氧化的进程[5-7]。肽链中的氨基酸残基对不同的活性氧和活性氮具有不同的抗氧化活性,其中疏水残基对清除过氧自由基有效,酸性残基及其类似物对清除过氧亚硝酸根有效[8]。
羊皮富含胶原蛋白,脯氨酸含量高,但由于脂肪含量高、气味差,严重限制了其市场潜力。碱解、热解等一系列的预处理和蛋白水解酶可用于水解羊皮,获得有益于人体的营养、功能胶原肽。许多文献报道,分子质量小于1 kDa的低分子质量肽具有很强的抗氧化活性[9-12]。然而生物活性肽在胃肠道消化过程中不稳定,会被胃蛋白酶、胰蛋白酶等消化,导致活性降低甚至失去活性,不利于抗氧化活性肽到达靶细胞发挥作用;同时,现在许多研究倾向于通过酶解和模拟消化结合的方式从蛋白中释放生物活性肽,如骆驼和牛酪蛋白被Alcalase和Pronase E同时水解后,模拟胃肠消化得到潜在的抗糖尿病肽[13];模拟胃肠道消化乳铁蛋白后得到具有血管紧张素I转化酶抑制活性的肽等[14];然而,对胶原肽在胃肠道消化过程中活性降低原因等的研究还有所欠缺。肠溶胶囊是保护活性肽免受胃液消化最常见的方式,已广泛用于红霉素、奥美拉唑等药品[15-16],具有安全、易生产、成本低等优势。
本研究通过酶法制备3种分子质量小于1 kDa的羊皮抗氧化活性肽,测定模拟消化前后胶原蛋白肽抗氧化活性的变化,结合计算机模拟消化肽段的变化,共同探讨胶原肽在胃肠道消化过程中的抗氧化活性的变化及其原因。针对消化过程中的胃消化阶段,使用肠溶胶囊对抗氧化活性肽进行保护;并进一步分析肠溶胶囊在胃消化阶段对胶原肽抗氧化活性保护的有效性,为消化过程中胶原肽抗氧化活性的保持提供一种有效的手段。
1 材料与方法
1.1 材料与试剂
绵羊皮 北京秋实农业股份有限公司;羟丙甲纤维素肠溶胶囊壳 青岛益青生物科技股份有限公司;碱性蛋白酶(Alcalase 2.4 AU/g)、中性蛋白酶(Neutrase 0.8 AU/g)、风味蛋白酶(Flavorzyme 1.5 AU/g) 丹麦诺维信生物技术有限公司;胃蛋白酶、胰蛋白酶、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 西格玛奥德里奇上海贸易有限公司;二水合磷酸氢二钠、十二水合磷酸二氢钠、乙醇、甲醛、氢氧化钠、碳酸钠等试剂(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TU-1810型紫外-可见分光光度计 上海尤尼柯仪器有限公司;Chirascan V100 CD光谱仪 英国应用光物理公司;1260高效液相色谱系统(配备有ODS柱(250 mm×4.0 mm,5 μm))、1100高效液相色谱仪(配有可变波长紫外检测器和荧光检测器) 美国安捷伦科技有限公司;JXN-26型冷冻离心机 美国贝克曼有限公司;Infinite M200 Pro型酶标仪 瑞士帝肯贸易有限公司;串联EASY-nano LC 1200高效液相色谱的Orbitrap Fusion Lumos质谱仪(配有PEAKS Studio version X+分析软件) 美国赛默飞世尔公司。
1.3 方法
1.3.1 羊皮胶原蛋白肽制备
脱毛羊皮经洗净、脱灰、脱脂、除杂蛋白等前处理工艺,提取胶原蛋白;然后采用NaOH溶液浸泡(0.5 mol/L、48 h),再采用Na2SO4溶液浸泡(0.75 mol/L、24 h)进行脱钙,脱钙后对体系进行水浴热解处理(80 ℃、5 h)。采用不同酶活力(0.006、0.048、0.096、0.160 AU/g)碱性蛋白酶、中性蛋白酶和风味蛋白酶对羊皮胶原蛋白进行酶解,将酶解液浓缩后冷冻干燥,所得肽分别命名为碱性蛋白酶解胶原肽(alcalase hydrolyzed collagen peptide,ACP)、中性蛋白酶解胶原肽(neutrase hydrolyzed collagen peptide,NCP)和风味蛋白酶解胶原肽(flavorzyme hydrolyzed collagen peptide,FCP)。对ACP、NCP和FCP分析得到,3种酶活力在0.096 AU/g时制备的胶原肽寡肽(180 Da<分子质量<1 000 Da)相对含量最高,分别为80.38%、48.44%和61.23%,故选择酶活力0.096 AU/g制备的胶原肽进行后续研究。
1.3.2 体外模拟胃肠消化
参考Minekus等[17]报道的方法制备消化体系并进行胶原肽的模拟胃肠道消化。将10 mL的模拟胃液加入消化体系中,在100 r/min下均匀搅拌模拟胃液消化2 h,保持pH值为2.0±0.2,温度为37 ℃。模拟胃消化阶段之后,使用1.0 mol/L和0.1 mol/L NaOH溶液将消化体系的pH值调至7.0,立即添加15 mL pH值为7.0的模拟肠液至消化体系中,进行模拟小肠阶段的消化,在100 r/min均匀搅拌下2 h,消化过程中保持体系pH值为7.0±0.2,温度为37 ℃。在模拟消化过程中测定胶原肽的分子质量分布和相关活性。
1.3.3 氨基酸组成测定
参照Hill[18]的方法测定氨基酸的组成。将胶原蛋白肽置于6 mol/L HCl溶液中,于120 ℃水解22 h,然后采用OPA柱前衍生化反相高效液相色谱-紫外检测法对所得的水解产物进行定量,分析氨基酸的组成。使用紫外线检测器在40 ℃下梯度洗脱,氨基酸含量以外标法定量。
1.3.4 二级结构相对含量测定
胶原肽二级结构采用圆二色光谱法进行分析。样品质量浓度为0.2 mg/mL,石英比色皿狭缝宽度为1.0 mm,扫描波长范围为180~280 nm,带宽1.0 nm,扫描速率120 nm/min,以磷酸盐缓冲液作为空白,实验重复3次。进一步采用CDNN软件计算α-螺旋、β-片层、β-转角和无规卷曲结构的相对含量。
1.3.5 分子质量测定
采用1100高效液相色谱仪测定胶原水解物的分子质量分布。使用TSK凝胶2000 SWXL柱,测试条件:样品质量浓度5 mg/mL,上样体积10 μL,流动相为乙腈/水/三氟乙酸(45∶55∶0.1,V/V),流速0.5 mL/min,紫外检测波长220 nm,柱温30 ℃。肽标准品:Gly-Gly-Gly(189 Da)、Gly-Gly-Tyr-Arg(451 Da)、杆菌肽(1 450 Da)、抑肽酶(6 511 Da)和细胞色素c(12 384 Da)。
1.3.6 液相色谱-质谱分析
1.3.6.1 样品前处理
胶原蛋白肽浓缩、冷冻干燥后,用于液相色谱-质谱分析。
1.3.6.2 色谱条件
色谱柱:Acclaim PepMap C18色谱柱(27 cm×75 μm);进样量2.0 μL;柱流速控制在400 nL/min,柱温为40 ℃;色谱梯度洗脱,其中流动相A为体积分数0.1%甲酸-水溶液;流动相B为体积分数0.1%甲酸-乙腈溶液。
1.3.6.3 质谱条件
离子源为在线纳喷雾离子源;电喷雾电压2 kV;质量扫描范围m/z100~1 500;分辨率120 000;最大注入时间50 ms;电荷状态为2~7。
1.3.7 氨基酸残基在N端的切割频率计算
氨基酸残基在N端的切割频率按式(1)计算。

式中:F为氨基酸残基在N端的切割频率;A为特定氨基酸在N端的数量;P为样品中氨基酸的百分比;M为氨基酸的摩尔质量/(g/mol)。
1.3.8 还原力测定
取0.5 mL水解物溶液,加入2.5 mL、0.2 mol/L的磷酸盐缓冲液(pH 6.6)和2.5 mL质量分数1%的铁氰化钾溶液,在试管中充分混匀,50 ℃水浴反应20 min。冷却后,加入2.5 mL质量分数10%的三氯乙酸溶液,振荡混匀,4 000 r/min离心10 min。取1 mL上清液,加入1 mL蒸馏水和0.2 mL质量分数0.1%的FeCl3溶液。静置10 min后,溶液由黄色变为绿色,取等量去离子水代替样品溶液调零,在700 nm波长处测定吸光度,以吸光度表征还原力。
1.3.9 DPPH自由基清除率测定
精确称量25 mg DPPH,溶解到1 L无水乙醇中,配制成浓度为6.5×10-5mol/L DPPH-乙醇溶液。分别吸取2 mL DPPH-乙醇溶液与无水乙醇于试管中,摇匀,在室温下反应30 min后,在517 nm波长处测定吸光度;吸取2 mL样品溶液和无水乙醇于试管中,摇匀,在室温下反应30 min后,在517 nm波长处测定吸光度;最后,吸取2 mL乙醇配制的不同肽质量浓度的样品溶液和DPPH-乙醇溶液置于试管中,摇匀,在室温下反应30 min后,在517 nm波长处测定吸光度。DPPH自由基清除率按式(2)计算。
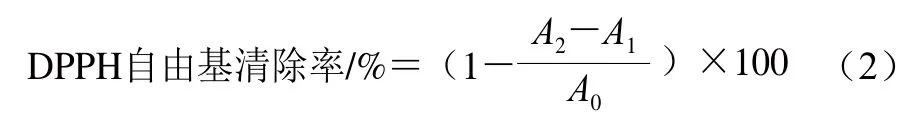
式中:A0为DPPH-乙醇溶液与无水乙醇的吸光度;A1为样品溶液与无水乙醇的吸光度;A2为样品溶液与DPPH-乙醇溶液的吸光度。
1.3.10 ABTS阳离子自由基清除率测定
配制ABTS储备液(7.4 mmol/L、0.4 mL):取ABTS 20.3 mg,加蒸馏水5 mL;配制K2S2O8储备液(2.6 mmol/L、1.43 mL):取K2S2O83.5 mg,加蒸馏水5 mL;将ABTS储备液和K2S2O8储备液混合后于黑暗中放置12 h,制备得到ABTS工作液;使用pH 7.4磷酸盐缓冲液稀释至ABTS工作液在734 nm波长处吸光度为0.70±0.02,取0.8 mL ABTS工作液和0.2 mL蒸馏水配制的不同肽质量浓度的样品溶液并充分混合,避光静置6 min后在734 nm波长处测定吸光度。ABTS阳离子自由基清除率按式(3)计算。
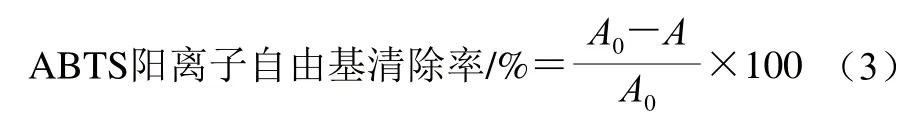
式中:A0为蒸馏水与ABTS工作液的吸光度;A为样品溶液与ABTS工作液的吸光度。
1.3.11 计算机模拟消化
采用PeptideCutter软件(https://web.expasy.org/peptide_cutter/)模拟羊皮胶原肽的胃肠道消化,预测羊皮胶原肽消化前后的理论肽序列。计算机分析中模拟胶原序列的胃肠道消化酶的组合,包括胃蛋白酶(pH 1.3)和胰蛋白酶。
1.3.12 肠溶胶囊对胶原肽的保护作用分析
分别称取250 mg不同酶解胶原肽,装入肠溶胶囊壳中,采用1.3.2节的方法模拟胃肠道消化,在模拟消化结束后,测定胶原肽溶液的分子质量分布和相关活性。
1.4 数据分析
所有样品测定均重复3次。结果表示为平均值±标准偏差。
2 结果与分析
2.1 胶原肽的基本结构分析
肽的化学结构特征是影响其抗氧化活性的主要因素,由肽序列中氨基酸的大小、组成、位置以及氨基酸的结构和疏水性决定[19-20]。具有高抗氧化活性的肽通常含有较高比例的疏水氨基酸(Ala、Leu、Ile、Val、Met、Pro)或芳香氨基酸(Trp、Tyr和Phe)残基[21]。其中,疏水氨基酸可以通过清除自由基来增强抗氧化活性[22]。一项研究表明,抗氧化肽的典型结构特征包括在肽段N端存在的疏水氨基酸残基Leu或Val[23-24]。同时,因Tyr中的酚羟基、Pro中的吡咯烷环、Trp中的吲哚环、His中的咪唑环、Cys中的硫醇、Met中的硫醚基团相对容易被氧化[25],故氨基酸侧链的抗氧化活性通常决定了肽的抗氧化活性。图1展示了羊皮中提取胶原蛋白肽的氨基酸组成,可知胶原蛋白肽主要由Gly、Glu、Pro和Hyp组成,且Ala、Leu、Val和Pro等疏水氨基酸含量较高,具有高抗氧化活性肽的氨基酸组成结构。图2是不同酶解胶原肽及其消化后胶原肽的氨基酸残基在N端切割频率的热图,能够显示不同酶对特定氨基酸的酶切频率,结果表明Leu和Val在肽段N端的切割频率较高,具有抗氧化肽的典型结构特征。
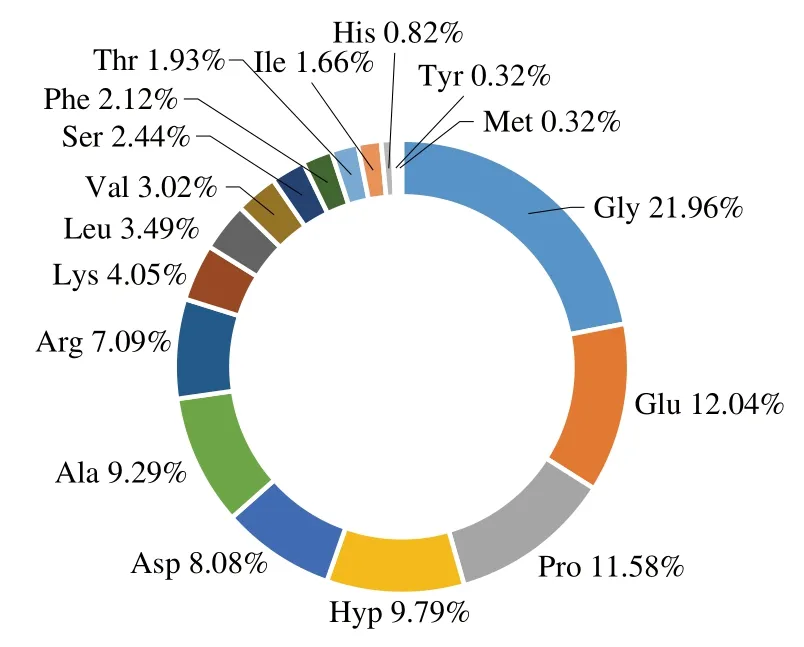
图1 胶原蛋白肽的氨基酸组成Fig. 1 Amino acid compositions of collagen peptides
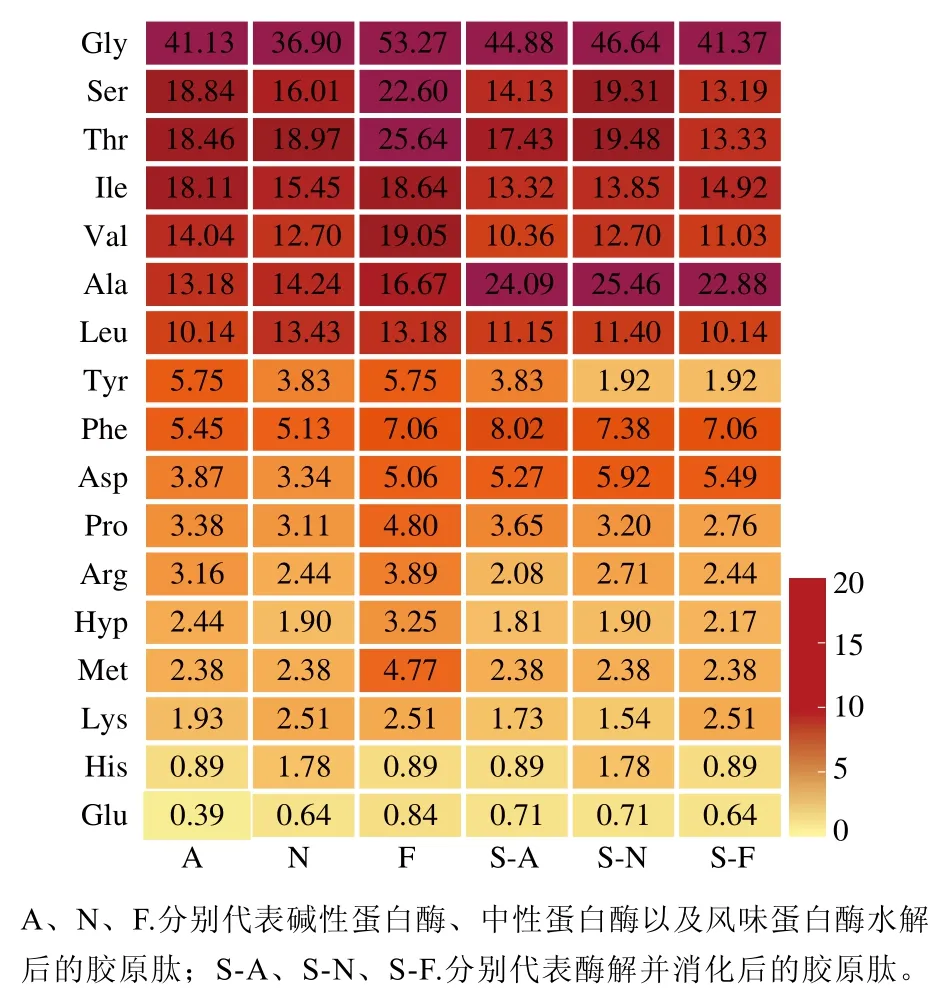
图2 氨基酸残基在N端切割频率的热图Fig. 2 Heatmap of the calculated cutting frequency of amino acid residues at the N-terminus
此外,生物活性肽的结构性质主要以无规卷曲(46%)和β-片层(30%)为主,而并非β-转角和α-螺旋[26]。抗氧化肽的无规卷曲结构有助于活性位点的暴露,进而提高其抗氧化能力[27-28]。通过图3和表1可知,FCP的β-片层相对含量最高,为48.5%,ACP和NCP的β-片层含量分别为46.0%和46.9%;而不同酶解胶原肽的无规卷曲相对含量都在28%左右。因此,不同酶解胶原肽的二级结构组成主要以β-片层和无规卷曲为主,进一步证实其具有生物活性肽的结构性质。由于胶原肽中Pro和Hyp含量高,而其中的吡咯结构使折叠受限,只能取较为伸展的β-片层结构,因此,胶原肽中的β-片层含量较高。同时,Pro残基被认为可以改变肽的二级结构,从而增强肽氨基酸残基的相互作用及其抗氧化性能[24]。综上,胶原肽富含Pro有利于抗氧化活性的体现。
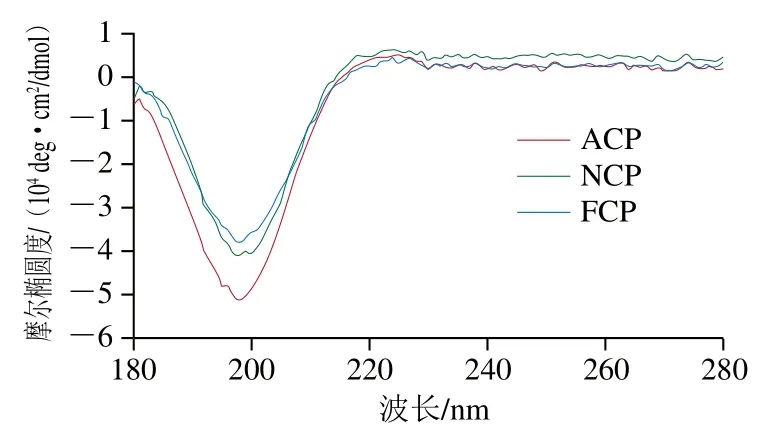
图3 不同酶解胶原蛋白肽的二级结构Fig. 3 Secondary structures of collagen peptides prepared with different proteases
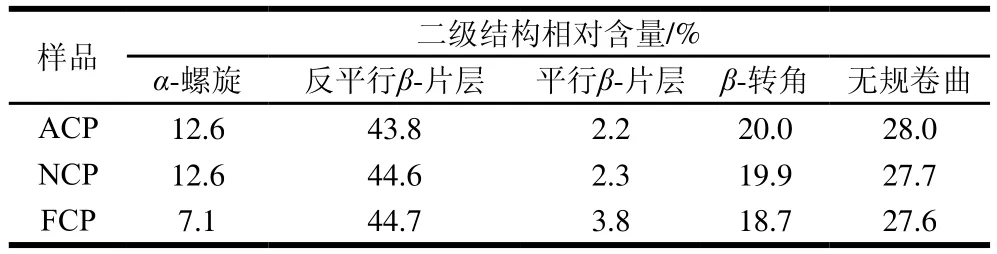
表1 不同酶解胶原蛋白肽的二级结构组成Table 1 Secondary structure composition of collagen peptides prepared with different proteases
2.2 胶原肽模拟消化过程中抗氧化活性的变化
肽作为一个整体发挥其抗氧化活性,在到达目标器官之前很可能被内源性酶消化成为氨基酸,从而失去活性。因此,通过模拟胃肠道消化考察胶原肽的抗氧化性,了解抗氧化肽在消化过程中的活性变化对实际应用具有积极的意义。采用铁氰化钾还原法测定模拟消化过程中胶原肽的还原能力,如图4所示,在不同酶解胶原肽中,FCP显示出最高的还原力,说明风味蛋白酶有利于抗氧化肽的产生。同时,不同酶解胶原肽在体外模拟消化后还原力都大幅下降,且还原力的降低主要由胃消化阶段造成,说明胃蛋白酶对肽的水解作用不利于肽还原力的保留。

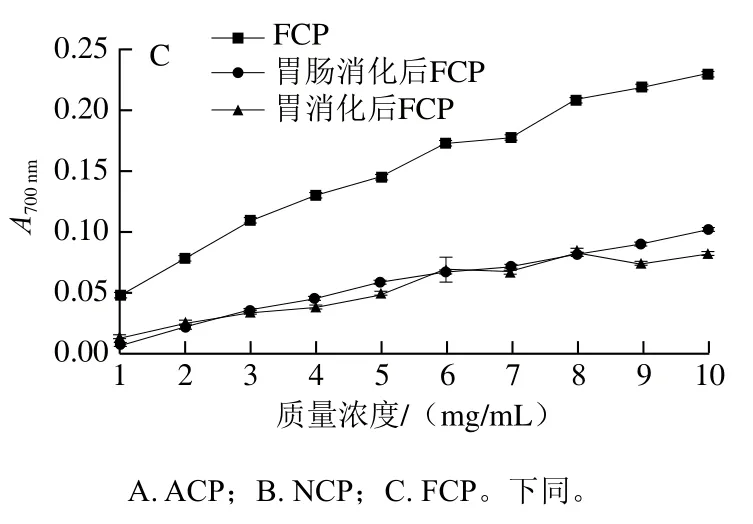
图4 模拟胃肠消化前后不同酶解胶原肽的还原力Fig. 4 Reducing power of collagen peptides before and after simulated gastric and gastrointestinal digestion
肽的抗氧化活性也体现在对自由基的清除能力方面。图5显示了模拟消化过程中胶原肽DPPH自由基清除率的变化。随着质量浓度的升高,胶原肽的DPPH自由基清除率逐渐增强,当胶原肽质量浓度大于6 mg/mL时,酶解胶原肽显示出较强的DPPH自由基清除率。但不同酶解胶原肽在体外模拟胃肠消化后DPPH自由基清除率都有不同程度的下降,其中模拟消化后NCP和FCP的DPPH自由基清除率下降幅度随着质量浓度的升高而逐渐增大,而ACP的DPPH自由基清除率下降幅度随着质量浓度的升高呈现先增大后减小的趋势。然而,胶原肽DPPH自由基清除率在胃消化阶段的降低幅度明显低于胃肠消化阶段,说明胃蛋白酶对具有DPPH自由基清除率肽段的降解作用在胃、肠消化阶段呈现递减规律。当酶解胶原肽质量浓度低于4 mg/mL时,胃消化后酶解胶原肽的DPPH自由基清除率反而高于酶解胶原肽,说明较低质量浓度的胶原肽在胃消化阶段有利于具有较高DPPH自由基清除率的肽段释放。
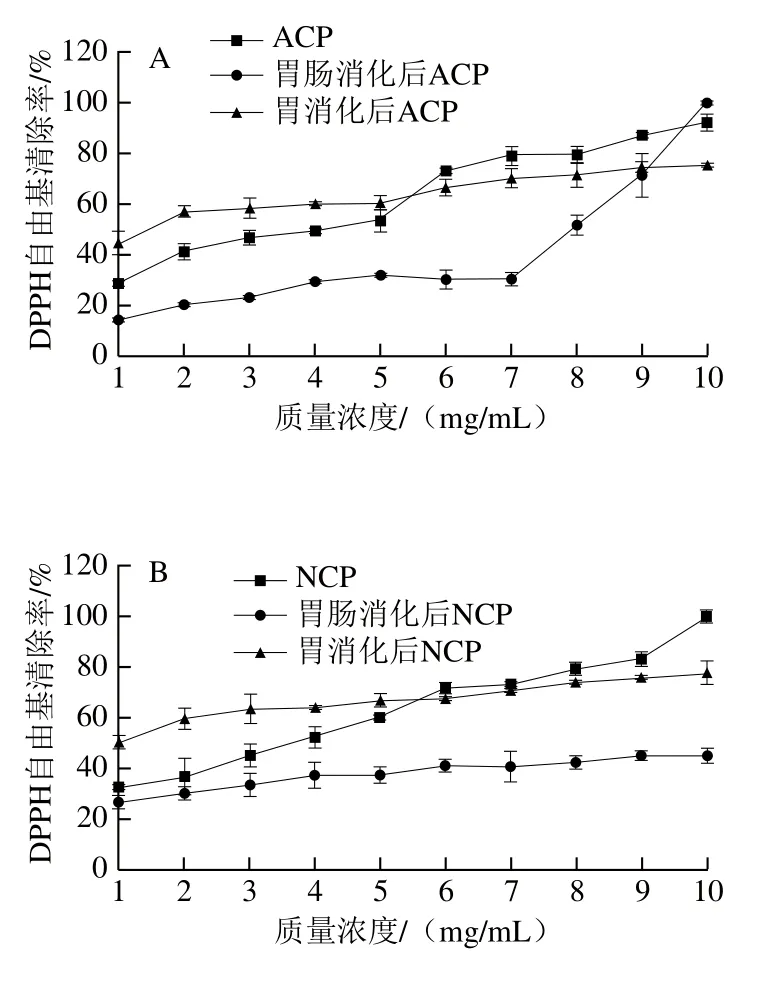
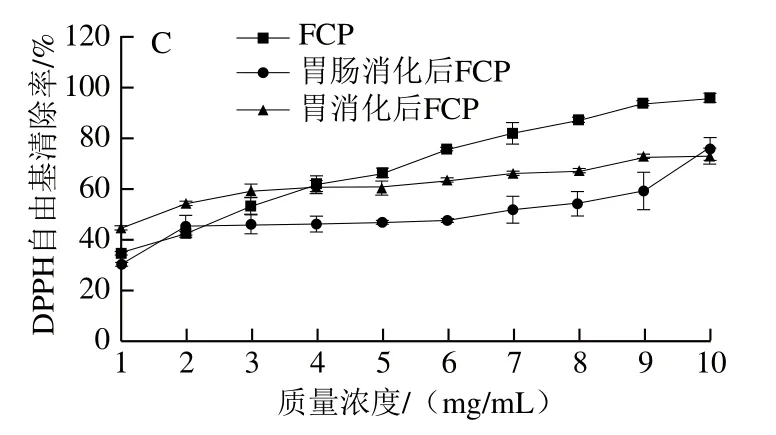
图5 模拟胃肠消化前后不同酶解胶原肽的DPPH自由基清除率Fig. 5 DPPH radical-scavenging capacity of collagen peptides before and after simulated gastric and gastrointestinal digestion
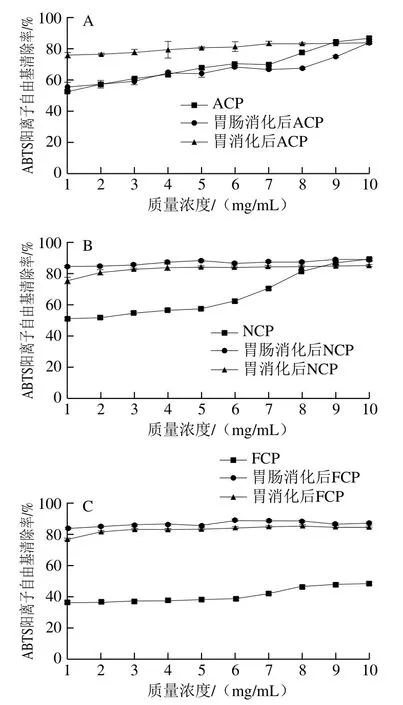
图6 模拟胃肠消化前后不同酶解胶原肽的ABTS阳离子自由基清除率Fig. 6 ABTS radical cation scavenging capacity of collagen peptides before and after simulated gastric and gastrointestinal digestion
图6显示了模拟消化过程中胶原肽ABTS阳离子自由基清除率的变化。在不同酶解胶原肽中,随着质量浓度的升高,胶原肽的ABTS阳离子自由基清除率逐渐增强。其中,ACP和NCP显示较高的ABTS阳离子自由基清除率,说明碱性蛋白酶和中性蛋白酶酶解得到的胶原肽更有利于ABTS阳离子自由基的清除。与胶原肽消化前后DPPH自由基清除率的变化趋势不同,NCP和FCP在体外模拟消化后,ABTS阳离子自由基清除率呈现上升趋势,且消化后的胶原肽随着质量浓度的增加,ABTS阳离子自由基清除率基本不变。其中模拟消化后FCP的ABTS阳离子自由基清除率上升幅度最大,ACP在模拟消化前后ABTS阳离子自由基清除率变化不大。胶原肽ABTS阳离子自由基清除率在胃消化阶段的上升幅度和胃肠消化阶段基本一致,说明胃蛋白酶有利于肽段ABTS阳离子自由基清除率的提高。
反应物质、反应机理、反应条件、反应动力学和定量方法的差异使得难以比较不同抗氧化剂测定法之间的结果。ABTS阳离子自由基清除率与DPPH自由基清除率变化趋势相反,是由于ABTS阳离子自由基只对含有Tyr和Trp的肽反应灵敏度高,对其他抗氧化氨基酸的敏感度不高[29]。液相色谱-质谱数据显示,胃肠消化后胶原肽中含Trp的肽段数量增加(表2),这与消化后胶原肽ABTS阳离子自由基清除率上升的趋势一致。分析实验结果可知,胶原肽在胃消化后,显示出高的ABTS阳离子自由基清除能力,说明胃消化后的胶原肽已经富含Trp的肽段。

表2 体外模拟消化前后含色氨酸(Trp)胶原肽的肽段Table 2 Collagen peptides containing Trp before and after simulated gastrointestinal digestion
2.3 计算机模拟胃肠道消化胶原肽的肽段变化
目前评价蛋白质中所包含生物活性肽的两种主要方法是实验检测手段和预测技术[30]。体外消化实验结果显示,胶原蛋白肽在消化过程中会被消化酶水解,从而导致抗氧化活性的降低或丧失。因此,研究消化后能够维持活性的生物活性肽[31-32]及其在消化过程中的变化具有重要的意义。通过计算机模拟胃肠道消化,分析消化过程中肽段被酶解后的变化,从而确定胶原肽活性损失的消化阶段,有针对性地保护肽段从而减少活性的损失。
采用PeptideCutter软件模拟分子质量小于1 kDa胶原肽的胃肠道消化,得到可以被胃蛋白酶和胰蛋白酶酶解的肽段。如表3所示,在计算机模拟消化过程中,有的肽段先被胃蛋白酶酶解,然后继续被胰蛋白酶酶解。如LPQPPQE在胃消化阶段被酶解成Leu和PQPPQE;AGROGEA在肠消化阶段被酶解成AGR和OGEA;LDGAKGD先在胃消化阶段被降解成Leu和DGAKGD,然后DGAKGD在肠消化阶段被降解成DGAK和GD。但是总体看来,抗氧化肽在胃消化阶段被酶解的比例高于在肠消化阶段被酶解的比例,说明抗氧化肽被胃蛋白酶降解的含量较高。结合图4、5可知,胃消化后肽段的还原力和DPPH自由基清除率都降低,也说明了部分抗氧化活性肽段在胃消化过程中被降解而失去活性。因此,对抗氧化活性胶原肽在胃肠道消化中的保护可以针对胃消化阶段进行。
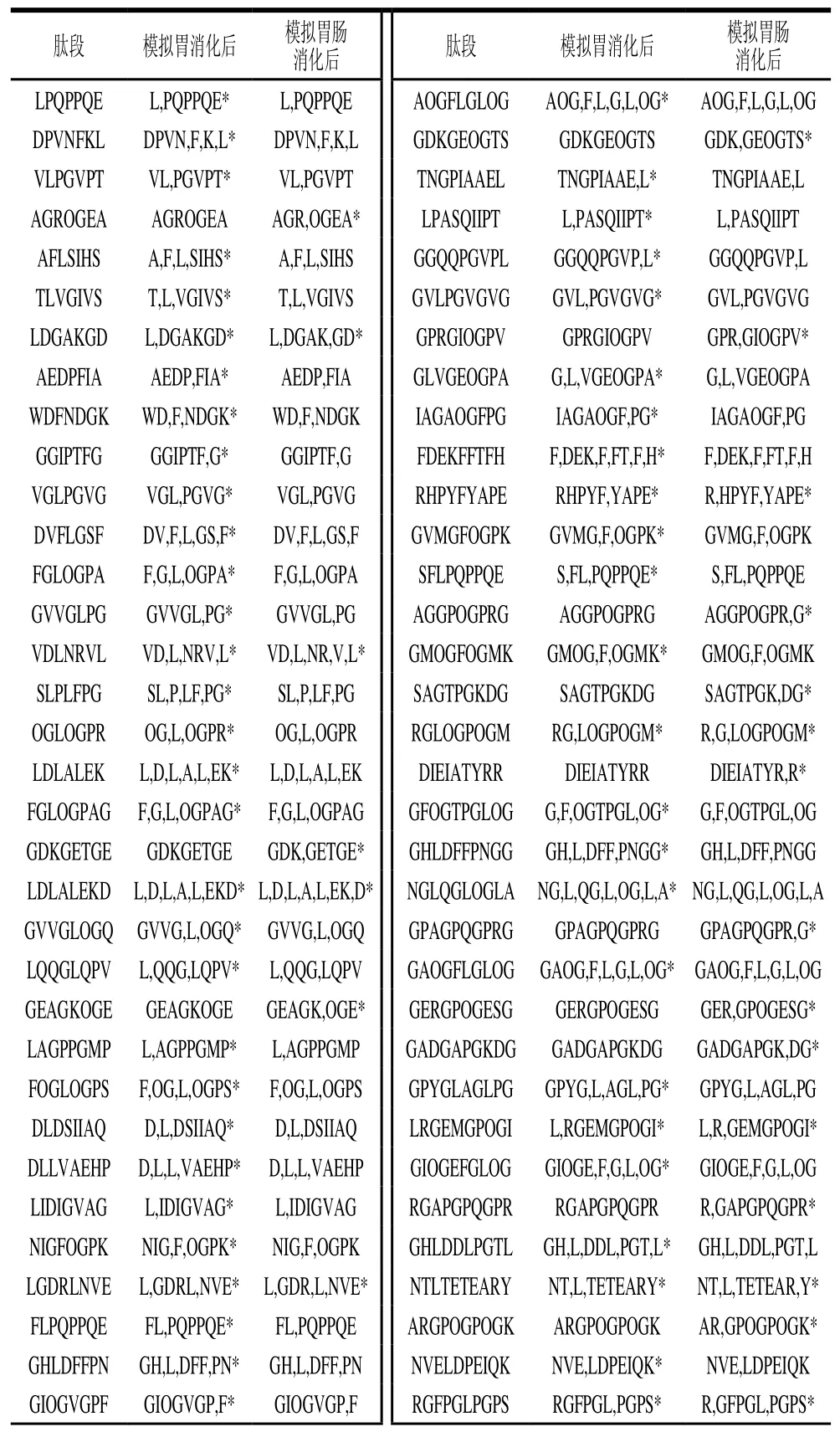
表3 计算机模拟胃肠消化后胶原肽的肽段变化Table 3 Changes in collagen peptides after in silico simulated gastric and gastrointestinal digestion
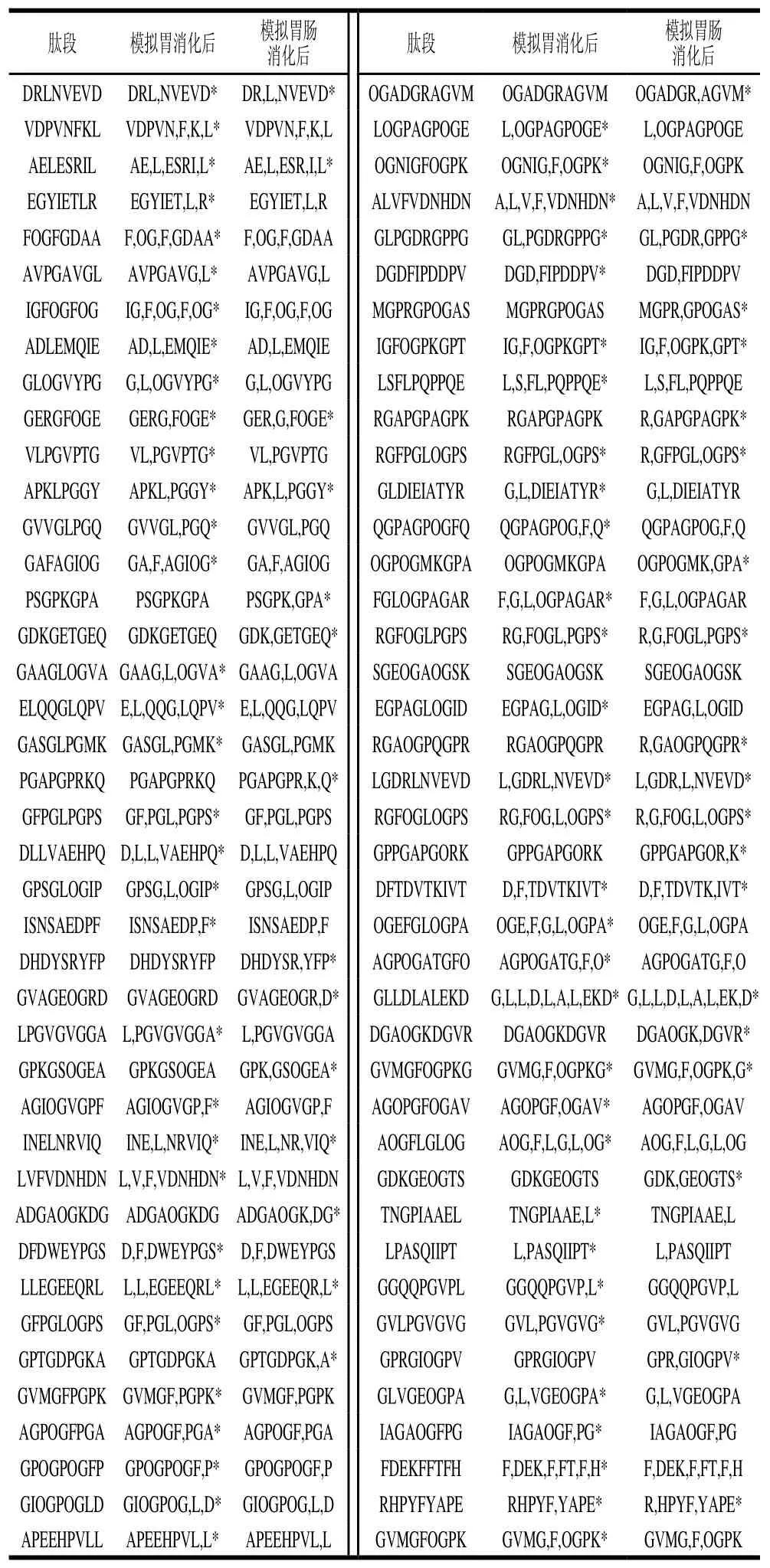
续表3
2.4 肠溶胶囊保护胶原肽模拟消化后抗氧化活性的变化
肠溶胶囊到达肠道之前不会分解,能够避免胃液的破坏从而提高内容物的生物利用度[33-34]。从图7可以看出,体外模拟消化后,肠溶胶囊保护胶原肽的还原力总体比没有肠溶胶囊保护的胶原肽高,说明肠溶胶囊的保护有效减少了胶原肽在胃消化过程中还原力的下降。其中,肠溶胶囊对FCP中还原力肽段的保护效果最好,肠溶胶囊保护的胶原肽在消化后的还原力明显高于无肠溶胶囊保护的胶原肽;并且随着胶原肽质量浓度增加,消化后有肠溶胶囊保护的胶原肽与无肠溶胶囊保护胶原肽间还原力的差异幅度逐渐增大,从0.01升至0.05左右。其次是ACP,肠溶胶囊保护的胶原肽在消化后的还原力比无肠溶胶囊保护的肽有所提高,但差异不明显。相比之下还原力保护效果最差的是NCP,消化后有肠溶胶囊保护的胶原肽与无肠溶胶囊保护的肽之间还原力无明显差异。
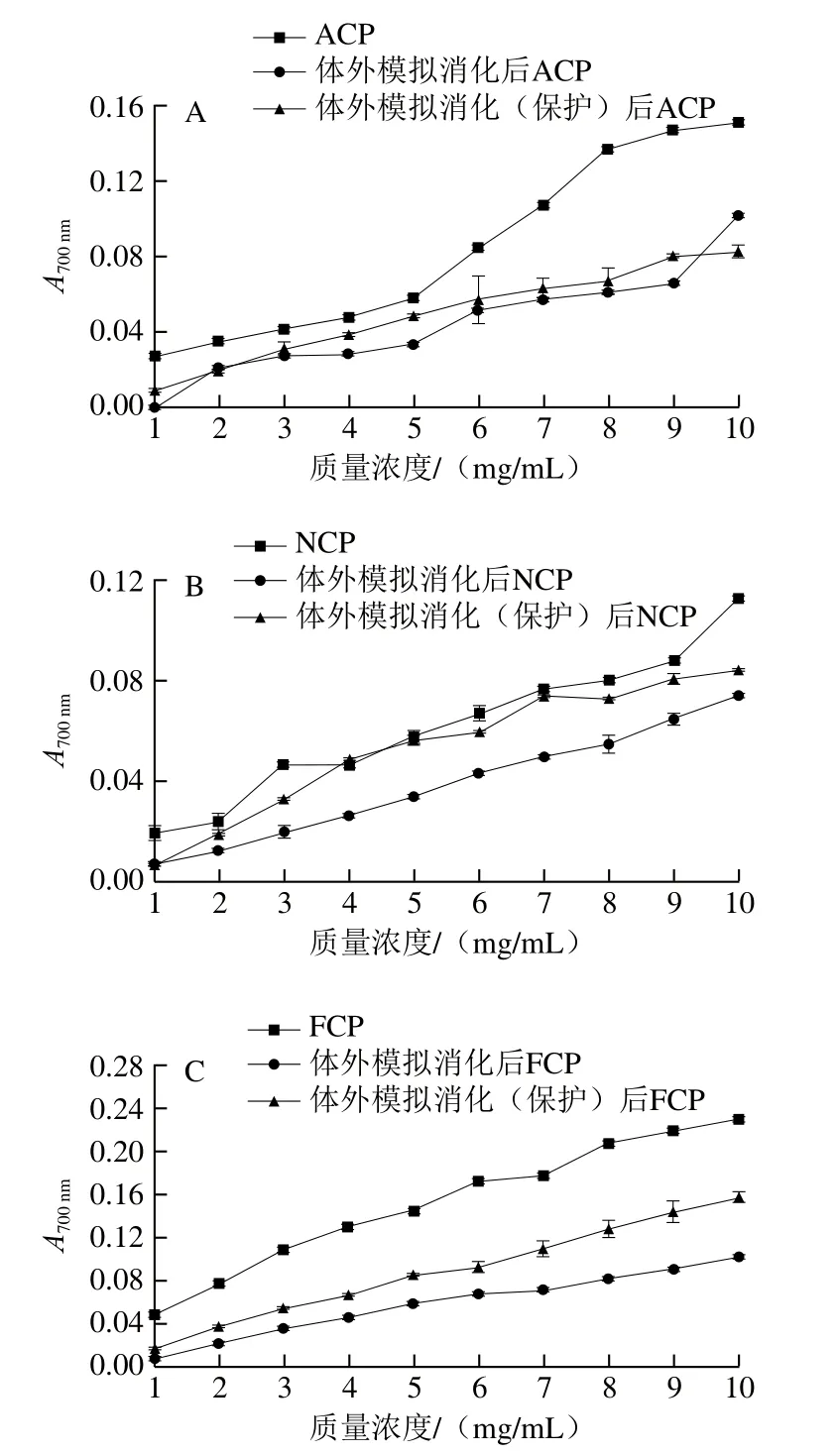
图7 有无肠溶胶囊保护的胶原肽模拟胃肠消化后的还原力Fig. 7 Reducing power of collagen peptides protected and not protected by enterosoluble vacant capsules after simulated gastrointestinal digestion
图8显示了有无肠溶胶囊保护的胶原肽模拟消化后的DPPH自由基清除率的变化,可以看出肠溶胶囊在胃消化阶段有效保护了胶原肽,使DPPH自由基清除率的下降幅度明显低于无肠溶胶囊保护的胶原肽。其中,肠溶胶囊对ACP的DPPH自由基清除率保护效果最好,肠溶胶囊保护的胶原肽在消化后的DPPH自由基清除率明显高于无肠溶胶囊保护的胶原肽,消化后有肠溶胶囊保护的胶原肽与无肠溶胶囊保护的胶原肽间DPPH自由基清除率的差异幅度约为20%;其次是NCP,肠溶胶囊保护的胶原肽在消化后的DPPH自由基清除率比无肠溶胶囊保护胶原肽提高10%~20%;保护效果最差的是FCP,有无肠溶胶囊保护的胶原肽消化后DPPH自由基清除率无明显差异。
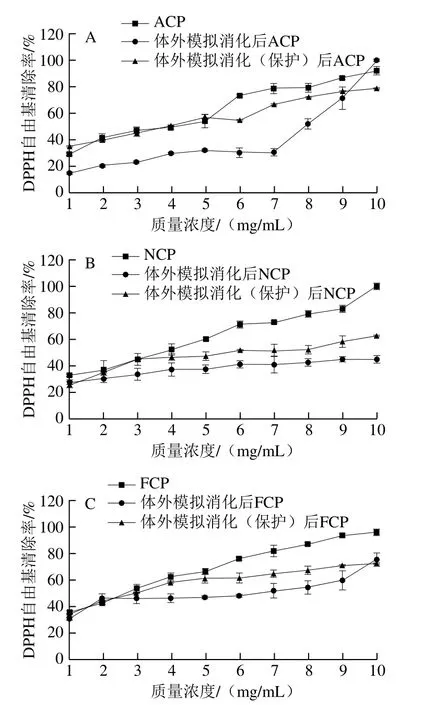
图8 有无肠溶胶囊保护的胶原肽模拟胃肠消化后的DPPH自由基清除率Fig. 8 DPPH radical scavenging capacity of collagen peptides protected and not protected by enterosoluble vacant capsules after simulated gastrointestinal digestion
有无肠溶胶囊保护的胶原肽模拟消化后的ABTS阳离子自由基清除率变化如图9所示,和DPPH自由基清除率不同的是,肠溶胶囊保护的胶原肽在体外模拟消化后,ABTS阳离子自由基清除率的上升幅度减缓。其中,肠溶胶囊对ACP的ABTS阳离子自由基清除率的影响最小,肠溶胶囊保护的胶原肽在消化后ABTS阳离子自由基清除率和无肠溶胶囊保护的胶原肽之间差异不明显。NCP和FCP中,肠溶胶囊保护的胶原肽在消化后的ABTS阳离子自由基清除率比未消化的ABTS阳离子自由基清除率总体有所提高,但是明显低于无肠溶胶囊保护胶原肽;并且随着胶原肽质量浓度的升高,有肠溶胶囊保护的胶原肽与无肠溶胶囊保护胶原肽消化后ABTS阳离子自由基清除率的差异幅度逐渐减小,其中,FCP从约25%降至约2%,NCP从约35%降至约10%。
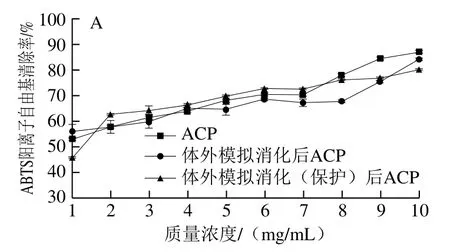
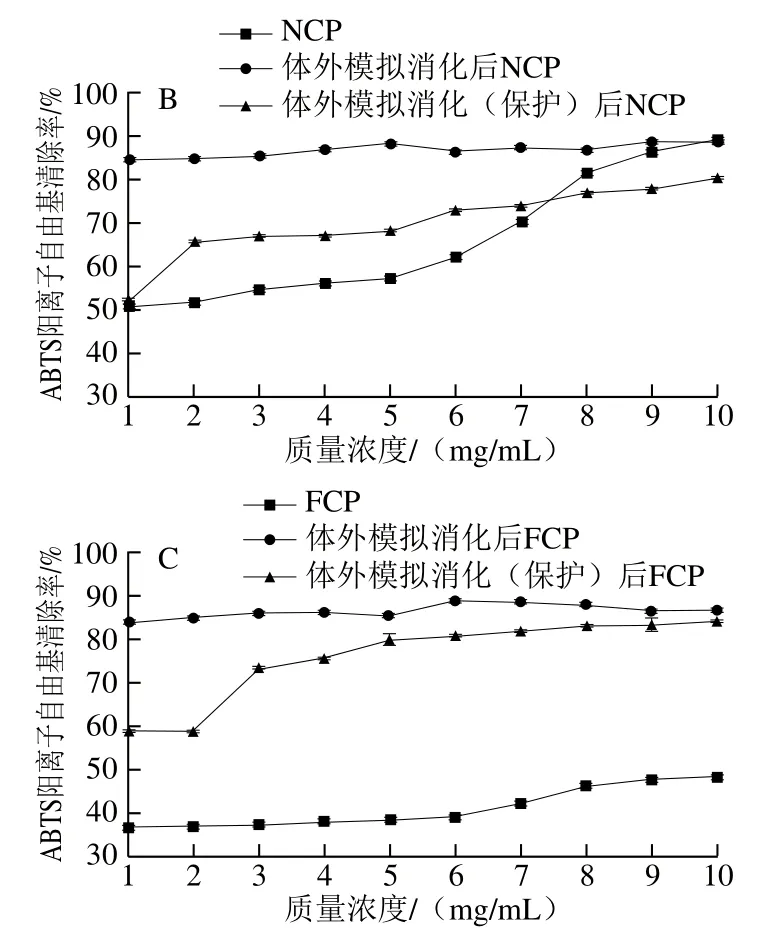
图9 有无肠溶胶囊保护的胶原肽模拟胃肠消化后的ABTS阳离子自由基清除率Fig. 9 ABTS radical cation scavenging capacity of collagen peptides protected and not protected by enterosoluble vacant capsules after simulated gastrointestinal digestion
结合有无肠溶胶囊保护的胶原肽消化前后分子质量分布数据分析可知,消化前NCP的分子质量低于1 000 Da的肽段含量最少(图10),还原力最低,但是DPPH自由基和ABTS阳离子自由基清除率与ACP和FCP相差不大;消化后NCP与ACP和FCP的分子质量分布基本一致,还原力也一致。说明肽段分子质量的分布对还原力的影响较大,对自由基的清除率影响不大,自由基清除率主要取决于氨基酸侧链的抗氧化活性[25]。消化后胶原肽中有40%~50%的游离氨基酸(分子质量低于180 Da),与未保护组相比,肠溶胶囊保护的胶原肽在消化后的游离氨基酸含量明显降低,降低幅度在75%左右。与胶原肽消化后的寡肽(180 Da<分子质量<1 000 Da)相比,肠溶胶囊保护的胶原肽消化后寡肽含量明显增加,最大增加60%左右(NCP)。有文献报道,适当的低分子质量肽对抗氧化活性的产生有重要影响,同一物质的不同组分中,分子质量低于1 000 Da肽段的抗氧化能力明显高于较高分子质量肽段[24,35]。综上,肠溶胶囊保护的胶原肽在模拟消化后极大地减少了游离氨基酸的产生,增加了寡肽含量,这与肠溶胶囊保护后胶原肽抗氧化活性的提高密切相关。
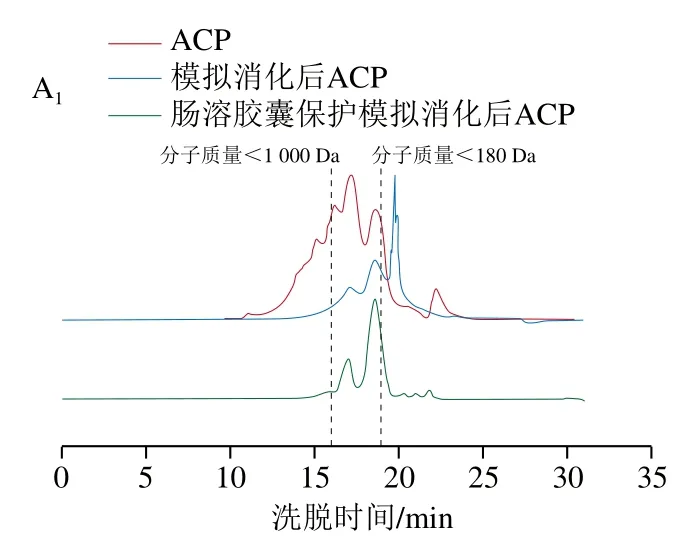
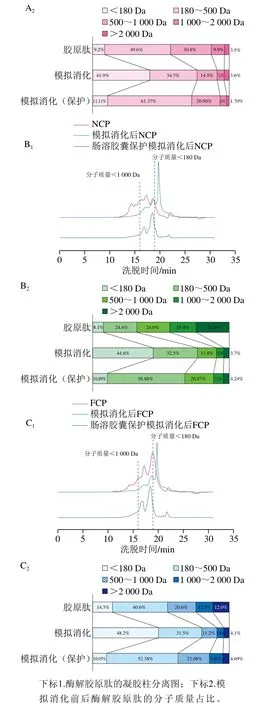
图10 有无肠溶胶囊保护的胶原肽模拟胃肠消化前后的分子质量分布Fig. 10 Molecular mass distribution of collagen peptides protected and not protected by enterosoluble vacant capsules before and after simulated gastrointestinal digestion
3 结 论
羊皮中提取的胶原蛋白肽的基本组成和结构显示了其具有抗氧化活性的特征。首先,Ala、Leu、Val和Pro等疏水氨基酸含量较高,具有高抗氧化活性肽的氨基酸组成结构;其次,Leu和Val在肽段N端的切割频率较高,具有抗氧化肽的典型结构特征;再次,胶原肽的二级结构组成主要以β-片层和无规卷曲为主,具有生物活性肽的高级结构性质。通过测定不同酶解胶原肽在体外模拟消化前后的抗氧化性可知,胶原肽在体外模拟消化后,还原力和DPPH自由基清除率大幅下降,且还原力的降低主要在胃消化阶段完成,说明胃蛋白酶对肽的酶解作用不利于肽段还原力和DPPH自由基清除能力的保留。然而,胶原肽ABTS阳离子自由基清除率在消化后却呈现上升趋势,且在胃消化阶段的上升幅度和胃肠消化阶段基本一致,说明胃蛋白酶有利于肽段ABTS阳离子自由基清除率的提高,这可能是DPPH自由基和ABTS阳离子自由基对肽链中氨基酸的敏感度不同造成的,同时也说明了选取合适的抗氧化活性评价指标的重要性。对消化前后胶原肽肽段进行了液相色谱-质谱分析,结合计算机模拟胃肠消化探讨了胶原肽在胃、肠消化过程中的肽段变化,发现胃消化阶段的酶解肽段比例高于肠消化阶段。因此,采用肠溶胶囊包裹胶原肽,对胶原肽的胃消化阶段进行针对性保护,与未保护的胶原肽,肠溶胶囊保护后的胶原肽在体外消化过程中的还原力和DPPH自由基清除能力都有一定程度的保留。其中,肠溶胶囊对ACP中还原力高的肽段和对FCP中DPPH自由基清除能力高的肽段在消化过程中具有显著的保护效果。因此,肠溶胶囊有望成为保护胶原肽抗氧化活性的一种有效方式。
