仿生取向纤维的刚度变化对巨噬细胞极化特性的影响
2022-05-13易兵成沈炎冰薛苏桐张彦中
沈 勇,易兵成,沈炎冰,唐 寒,周 璟,薛苏桐,张彦中
(东华大学 化学化工与生物工程学院,上海 201620)
各种血管疾病是导致全球死亡病例增多的重要原因之一[1]。采用组织工程化血管移植物(tissue engineered vascular grafts,TEVGs)被认为是实现患病血管组织功能恢复的最有前景的替代方法[2-3]。然而,直径在6 mm以下的小口径TEVGs植入身体后存在因生物相容性不佳引起的通畅率低的问题[4]。巨噬细胞作为与植入生物材料相遇最早的一类先天免疫细胞,其通过极化成促炎(M1)或抗炎(M2)表型来决定植入物诱导组织再生的功效[5-6]。
基于静电纺的仿生纤维在构建TEVGs方面具有巨大潜力。采用静电纺技术制备的纳/微米超细纤维与天然组织细胞外基质(extracellular matrix,ECM)中纤维组分的纤维细度类似,其高比表面积可为细胞黏附提供较多的结合位点,超细度带来的力学柔顺性可有效促进细胞的重塑基质作用[7-8],因此非常适合用于软组织工程。巨噬细胞在TEVGs植入后的早期炎症反应中发挥着重要作用,为了解这类仿生纤维对巨噬细胞表型和功能的影响,Saino等[9]将巨噬细胞RAW 264.7培养在4种不同类型的静电纺左旋聚乳酸(poly(L-lactic acid),PLLA)纤维支架上,发现RAW 264.7细胞分泌促炎分子主要取决于纤维直径,且以纳米纤维PLLA支架的炎症反应最小。Garg等[10]研究静电纺支架的纤维直径和孔径大小对鼠骨髓源巨噬细胞向M2或M1极化的影响,结果显示,与纤维直径相比,支架的孔径对巨噬细胞极性的调节更为关键。Jia等[7]将鼠骨髓源巨噬细胞接种在取向和无纺聚(L-丙交酯-co-己内酯)(poly(lactide-co-caprolactone,PLCL)支架上,发现取向纳米纤维显著引导巨噬细胞沿着纤维方向伸长并向促再生表型发展,而无纺纳米纤维引导促炎表型。这些研究虽然探索了静电纺纤维支架的直径、取向和孔尺寸等参数对巨噬细胞极化的影响,但在静电纺纤维刚度变化(尤其是具有结构特异性的取向纤维)对巨噬细胞极化影响方面的研究还少有关注。
鉴于天然血管的各向异性结构特点,笔者课题组前期研究了静电纺取向纤维的表面拓扑特征[11]、生化信号修饰[12]及刚度变化对血管细胞行为的影响[13-14]。作为对前期研究工作的一个拓展,本文仍采用调整刚性PLLA芯层和弹性PLCL壳层的组成比例作为改变PLCL/PLLA壳芯纤维刚度的策略,通过笔者课题组研发的稳定射流同轴静电纺技术(SJCES)制备了仿生取向纤维PLCL/PLLA,然后研究其刚度变化对RAW 264.7巨噬细胞响应行为(如形貌变化、增殖、迁移及极化等)的影响。
1 试验部分
1.1 PLCL/PLLA壳芯取向纤维的制备
以六氟异丙醇为溶剂,配制质量浓度为0.1 g/mL的PLCL(丙交酯与己内酯质量比为50∶50,黏度为IV 2.9 dL/g,济南岱罡生物材料)壳层溶液和PLLA(Mw=100 000,济南岱罡生物材料)芯层溶液。为消除静电纺中的射流不稳定鞭动现象[15],各纺丝溶液中分别添加质量分数为5%的超高相对分子质量聚氧化乙烯(Mw>5 000 000,Alfa Aesar公司,英国)。然后利用SJCES制备PLCL/PLLA壳芯结构纤维[14],纺丝参数:电压为5~9 kV;接收距离为20 cm;滚筒直径为10 cm;收集速度为1 000 r/min;温度为20~25 ℃,相对湿度为25%~30%。纺丝过程中通过同时调节PLCL壳层和PLLA芯层的注射速率(保持相同的总注射速率0.5 mL/h),制备4种具有不同刚度的取向纤维基质(AFSs),即0.50、0(PLCL注射速率为0.5 mL/h,PLLA注射速率为0 mL/h,作为S1组,依此类推),0.35、0.15(S2组),0.20、0.30(S3组),0.05、0.45(S4组)。将制备的纤维在真空中干燥2星期以完全去除溶剂。
1.2 取向纤维的表征
通过扫描电子显微镜(SEM,Hitachi TM-1000型,日本)在5 kV加速电压下观察AFSs的形貌,在SEM拍摄之前对AFSs喷金60 s。基于获得的SEM图像,通过ImageJ软件分析纤维直径和纤维取向度。
采用拉伸力学法测试取向纤维的弹性模量。采用与PLCL/PLLA同样的纺丝方法纺丝2 h制备取向纤维并剪成长20 mm的短纤维束,然后在环境条件下,将短纤维束夹固在台式拉力测试仪(HY-940FS型,上海)上进行拉伸测试(n≥8),所用的力传感器容量为50 N,拉伸速率为10 mm/min。根据拉伸应力-应变曲线计算弹性模量。
1.3 巨噬细胞对不同刚度取向纤维的响应检测
1.3.1 细胞培养与材料处理
RAW 264.7巨噬细胞购自美国ATCC细胞库,其完全培养基由体积分数为10%的胎牛血清、体积分数为1%的青霉素/链霉素和基础高糖培养基组成。在接种细胞之前,对AFSs进行灭菌处理:紫外照射过夜,在体积分数为75%的乙醇中浸泡2 h;用磷酸缓冲盐(phosphate buffer saline,PBS)溶液清洗3次,每次5 min;浸没于细胞培养基中在37 ℃下孵育过夜。
1.3.2 细胞形貌
以1×105个/孔的细胞密度将RAW 264.7接种于AFSs上,每孔加500 μL培养基。培养1 d后弃去培养基,用PBS溶液清洗一遍;加体积分数为2.5%的戊二醛固定细胞至少4 h,用PBS溶液清洗3次,每次3~5 min;然后用体积分数为10%、30%、50%、70%、90%及100%的乙醇分别进行15 min以上梯度脱水;脱水后将样品放入干燥箱中干燥;最后用SEM在8~10 kV的加速电压下观察细胞形貌。
以1×105个/孔的细胞密度将RAW 264.7接种于AFSs上。培养1 d后用PBS溶液清洗并用质量浓度为0.04 g/mL的多聚甲醛固定细胞30 min,然后用体积分数为0.1%的Triton X-100(Aldrich公司,美国)通透细胞10 min。每孔用200 μL的Phalloidin(Invitrogen公司,美国)染色20 min,用DAPI(Invitrogen公司,美国)染细胞核10 min。最后,PBS溶液清洗后用倒置荧光显微镜(Eclipse Ti-S型,Nikon公司,日本)观察细胞形貌。用ImageJ软件对染色图片进行细胞核取向度分析,如图1所示。

图1 细胞核取向度分析示意图Fig.1 Schematic diagram of cell nucleus orientation analysis
1.3.3 细胞增殖检测
将RAW 264.7以1×105个/孔的细胞密度接种在AFSs上后分别培养1和3 d,然后使用CCK-8(Beyotime公司,中国)检测细胞增殖情况。检测具体步骤:在指定的培养时间点,将原先的培养基替换为含有15 μL CCK-8溶液的300 μL新培养基,于37 ℃下孵育4 h,孵育结束后每孔取100 μL加到96孔板中,用酶标仪(MK3型,Thermo公司,美国)在450 nm波长处检测吸光度。
1.3.4 细胞迁移检测
参照文献[14]中的细胞迁移方法,将中间有1 mm厚隔离横杠的钢环放置在24孔板中的AFSs上,然后将RAW 264.7以5×105个/孔的细胞密度接种在AFSs上预制“人工伤口”。培养24 h后,去除钢环使细胞在“伤口”区域自由迁移24 h。最后将细胞固定并用Phalloidin染色后在倒置荧光显微镜下观察细胞迁移情况。根据拍摄的荧光图片,用ImageJ软件分析细胞集体迁移情况。按照式(1)计算细胞集体迁移速率。
(1)
式中:V为细胞集体迁移速率;H0为“人工伤口”的初始宽度;Sa为“人工伤口”的未愈合面积;L为拍摄图片宽度。
1.3.5 基因表达分析
将RAW 264.7以1×106个/孔的细胞密度接种在6孔板里的AFSs上,培养1和3 d,然后进行qRT-PCR检测。检测过程:采用总RNA提取试剂盒(天根公司,中国)从细胞中提取RNA;再用FastKing RT Kit试剂盒(天根公司,中国)将RNA反转录成cDNA;最后使用SuperReal PreMix Plus(SYBR Green)试剂盒(天根公司,中国)根据其使用说明配制反应体系,并用ABI 7500型实时荧光定量PCR仪检测基因表达情况。引物序列如表1所示,对所有检测基因均基于Gapdh进行归一化处理。

表1 引物序列Table 1 Primer sequences
1.3.6 蛋白表达分析
ELISA检测:样本孔加待测样本10 μL,再加稀释液40 μL(即样本稀释5倍),空白孔不加样本;除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,封孔后于37 ℃下温育60 min;弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次;每孔加入底物A、B各50 μL,37 ℃下避光孵育15 min;每孔加入终止液50 μL,15 min内在450 nm波长处测定各孔的吸光度。
免疫荧光染色:将支架用PBS清洗3次后再用质量浓度为0.04 g/mL的多聚甲醛固定30 min,用体积分数为0.1%的Triton X-100通透10 min后,用体积分数为10%的山羊血清封闭非特异性结合位点30 min;将小鼠单克隆抗小鼠CD206抗体(1∶100稀释比,Proteintech公司,中国)和兔多克隆抗小鼠INOS抗体(1∶400稀释比,Abcam公司,英国)在4 ℃条件下孵育过夜;在室温下加入CD206山羊抗小鼠IgG二抗 (1∶100稀释比,Abcam公司,英国)或INOS山羊抗兔IgG二抗(1∶100稀释比,Abcam公司,英国)孵育90 min,然后对细胞核进行DAPI染色;最后用激光共聚焦扫描显微镜(Carl Zeiss公司,德国)观察表型蛋白的表达情况。
测量细胞荧光强度:基于ImageJ软件,使用“任意绘图/选择工具”选择要测量的细胞;从分析菜单中选择“设置测量”,确保选择了面积、累积光密度和平均灰度值(其余部分可忽略);从分析菜单中选择“测量”,可以看到一个弹出框,其中包含第一个细胞的值;选择单元格旁无荧光的区域为背景;对视场中要测量的其他细胞重复此步骤;完成后,选择结果窗口中的所有数据,然后复制到新Excel工作表(或类似程序)中;使用式(2)计算校正后的单细胞荧光强度。
(2)
式中:A为单细胞荧光强度;I为细胞总荧光强度;Sc为选定细胞面积;F为背景读数的平均荧光强度;N为细胞数量。
1.4 统计分析
所有数据均以“平均值±标准差”形式表示。统计图的制作和数据统计分析均采用Origin 8.0软件。组间比较选择方差分析(One way ANOVA)和Tukey检验进行显著性差异分析。*p<0.05时为有显著性差异;**p<0.01时为有极显著性差异。
2 结果与讨论
2.1 AFSs的制备与表征
根据文献[14],通过SJCES法可成功制备高度取向的PLCL/PLLA复合纤维,如图2(a)所示。在纺丝过程中通过调控壳、芯纺丝液注射速率获得的S1~S4组复合纤维的平均直径,分别为(1.56±0.13)、(1.45±0.13)、(1.47±0.12)及(1.38±0.14)μm,各组间的纤维细度无显著差异。此外,从量化的纤维取向度来看,S1~S4组的纤维取向度分别为0°±2.52°、0°±1.82°、0°±1.45°及0°±1.71°,均具有极高的取向度(见图2(b))。
图2(c)为各组取向纤维典型的拉伸应力-应变曲线。在PLCL/PLLA复合纤维中,当逐渐增大刚性成分PLLA的比例使其质量分数从0增加到90%时,不仅纤维的拉伸强度得到显著提高,复合纤维的弹性模量也从(18.05 ± 1.52)MPa增加到(951.92 ± 41.83)MPa,如图2(d)所示,提高至近53倍;但是刚性PLLA的引入降低了PLCL/PLLA取向纤维的断裂伸长率,从纯PLCL的280%(S1)降低到PLLA质量分数为90%时(S4)的60%,如图2(c)所示。这些结果说明通过制备壳芯结构纤维实现对复合纤维刚度调控的可行性。由于采用壳芯纤维结构来调控纤维刚度,这将排除前人工作中因调控刚度参数带来的支架表面的化学组成和拓扑结构的干扰[16],从而为此类研究提供了一种理想的平台。

图2 通过SJCES制备的不同PLCL/PLLA纤维的表征Fig.2 Characterization of the different PLCL/PLLA fibers produced by SJCES
2.2 AFSs刚度对巨噬细胞表观行为的影响
采用SEM和细胞骨架染色两种方法首先探究了AFSs的刚度变化对RAW 264.7细胞形貌的影响,如图3(a)和(b)所示。SEM结果显示,最柔软的S1组上的细胞接近纺锤形,立体凸起状明显,几乎没有铺展,且纺锤两端与纤维方向一致。随着AFSs刚度的增加,细胞逐渐铺展开来且扁平化。从荧光染色结果看,在S1组上能观察到细胞骨架沿纤维方向取向的细胞形态,而S2~S4组的细胞具有更明显的沿取向纤维方向延伸和铺展的形貌,说明取向纤维对细胞的接触诱导作用,这些结果与文献[17]探索基质刚度影响的研究一致。AFSs刚度对RAW 264.7细胞的迁移也有明显影响,如图3(c)所示,细胞沿纤维方向的迁移速率随基质刚度的增加而增加。
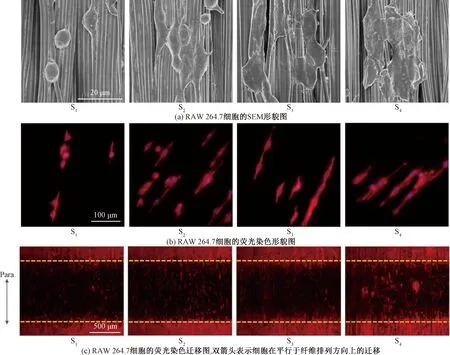
图3 RAW 264.7细胞在不同刚度AFSs上的形貌和迁移Fig.3 Morphology and migration of RAW 264.7 cells on AFSs with varying stiffness
根据荧光染色图片,对细胞黏附铺展和取向进行定量测试的结果表明:S1组上的细胞铺展面积最小,与其他3组有显著性差异;S2~S4组上的细胞铺展面积接近,组间无显著性差异,如图4(a)所示。
在取向度方面,不同刚度AFSs的细胞核取向相似,即细胞沿取向纤维方向延伸,不受纤维刚度的影响,如图4(b)所示。细胞迁移定量测试结果显示接种在最软的S1组上的巨噬细胞具有最低的迁移速率(5.12±0.24)μm/h,而在S4基质上的细胞迁移速率高达(10.42±0.54)μm/h,如图4(c)所示。巨噬细胞的迁移功能在炎症反应中必不可少[18],与其及时到达发炎区域发挥防御功能密切相关,巨噬细胞迁移受损将导致多种疾病和自身免疫疾病。然而,目前尚无关于刚度对巨噬细胞迁移影响的共识。本研究发现巨噬细胞的迁移速率与基质刚度呈正相关关系,这与文献[19]的研究结果一致。RAW 264.7细胞增殖也受AFSs刚度影响,总体上在培养1和3 d后的巨噬细胞细胞数量与AFSs纤维的刚度也呈正相关,即刚度较大的纤维基质更利于促进细胞的增殖,如图4(d)所示。文献[20-22]研究表明多种细胞类型(如平滑肌细胞、成纤维细胞和骨髓间充质干细胞等)在高刚度基质上具有更强的生长增殖能力,本研究的RAW 264.7细胞在不同刚度取向纤维上的增殖结果支持这一结论。

图4 RAW 264.7细胞在不同刚度AFSs上的铺展面积、细胞核取向度、迁移速率和增殖Fig.4 Spreading area,nuclear orientation,migration rate and proliferation of RAW 264.7 cells on AFSs with varying stiffness
近年来,基质刚度已被证明对细胞的黏附、收缩、迁移和分化等行为是至关重要的。Vatankhah等[23]制备了不同刚度的无纺纤维,研究发现低刚度的无纺纤维虽不利于细胞黏附,但却更能维持平滑肌细胞的收缩表型,由此证实支架刚度是比生物信号更能影响平滑肌细胞功能的重要因素。Merkle等[24]采用调控不同组分的比例来制备不同刚度无纺纤维的方法,研究了纤维刚度对内皮细胞和平滑肌细胞行为的影响,结果证实纤维刚度的提高能促进细胞的黏附,也能促进内皮细胞的迁移。这些研究表明特定细胞类型的细胞行为对基质刚度的高度依赖性,不仅如此,组织病变如癌症和动脉粥样硬化也与基质刚度的变化密切相关[25]。因此,研究巨噬细胞对纤维基质刚度变化的响应行为将是对这一领域的重要补充和丰富,并体现出一定的在细胞表观响应行为趋势上的一致性。
2.3 AFSs刚度对巨噬细胞的极化特性的影响
使用qRT-PCR技术在基因水平检测巨噬细胞M1相关基因(Tnf-α,Il-1β,Il-6,Mcp-1)和M2相关基因(Tgf-β,Il-10,Cd206)的表达情况,如图5所示。由图5(a)和(b)可知:培养1 d后M1表型相关基因中Il-1β和Il-6的表达无显著性差异;Tnf-α在S1组表达较少且仅与S4组有显著性差异;Mcp-1的表达总体上随着基质刚度的增加而增加。M2表型相关基因中Il-10在不同组的表达接近,组间无显著性差异;Tgf-β在S2组表达最多,且仅在S2组和S1组之间有差异;Cd206在S1组表达最多,与其他组间均有显著性差异。这些结果说明取向纤维的刚度性质在短时间内(1 d)对巨噬细胞极性的影响还比较有限。由图5(c)和(d)可知:培养3 d后M1表型相关基因中,Il-1β的表达仍无显著性差异;Tnf-α在S2组表达最少,却在S1和S3组表达较多;Il-6和Mcp-1的表达与基质刚度呈正相关。M2表型相关基因中,Tgf-β在S2组表达最多,在S1组表达最少;Il-10和Cd206的表达与基质刚度呈负相关。这些基因水平结果表明,培养3 d后刚度较低的纤维基质(S1、S2组)倾向于诱导巨噬细胞向M2表型发展。

图5 RAW 264.7细胞在不同刚度AFSs上培养1和3 d后M1相关基因和M2相关基因的表达情况(n≥3)Fig.5 The expression of M1-related genes and M2-related genes of RAW 264.7 cells cultured on AFSs with varying stiffness for 1 day and 3 days (n≥3)
进一步采用ELISA和免疫荧光染色在蛋白水平评估AFSs刚度对巨噬细胞极化特性的影响。图6为细胞培养1和3 d后ELISA检测M1相关细胞因子(TNF-α,IL-1β)和M2相关细胞因子(IL-10,TGF-β)的表达情况。由图6(a)可知,培养1 d,取向纤维的刚度变化对M1相关细胞因子(TNF-α,IL-1β)和M2相关细胞因子TGF-β的表达影响不明显,只有IL-10在S1和S4组的表达有显著性差异,IL-10在S1组的表达最多。由图6(b)可知:培养3 d,M1相关细胞因子IL-1β的表达仍然无显著性差异,而TNF-α的表达大体上与纤维刚度呈正相关;M2相关细胞因子IL-10的表达大体上与纤维刚度负相关,TGF-β在S2~S4组的表达较多,在S1组的表达最少。

图6 RAW 264.7细胞在不同刚度AFSs上的蛋白表达(n ≥ 3)Fig.6 Protein expression of the RAW 264.7 cells cultured on AFSs with varying stiffness (n≥3)
选择INOS和CD206分别作为M1和M2表型标志物进行免疫荧光染色,结果如图7所示。可以比较直观地看到:INOS的荧光强度在S2组较高,即INOS在S2组表达较多;CD206的荧光强度在S1组较高,即CD206在S1组表达较多。
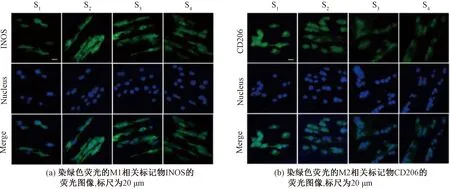
图7 不同刚度AFSs上RAW 264.7细胞INOS和CD206的免疫荧光染色Fig.7 Immunofluorescence staining of INOS and CD206 in RAW 264.7 cells cultured on AFSs with varying stiffness
荧光定量分析结果表明:INOS的表达在S2组中最多,而在S4组中最少,如图8(a)所示;CD206的表达随基质刚度的增加而降低,即在S1组中表达最多,在S4组中表达最少,如图8(b)所示。
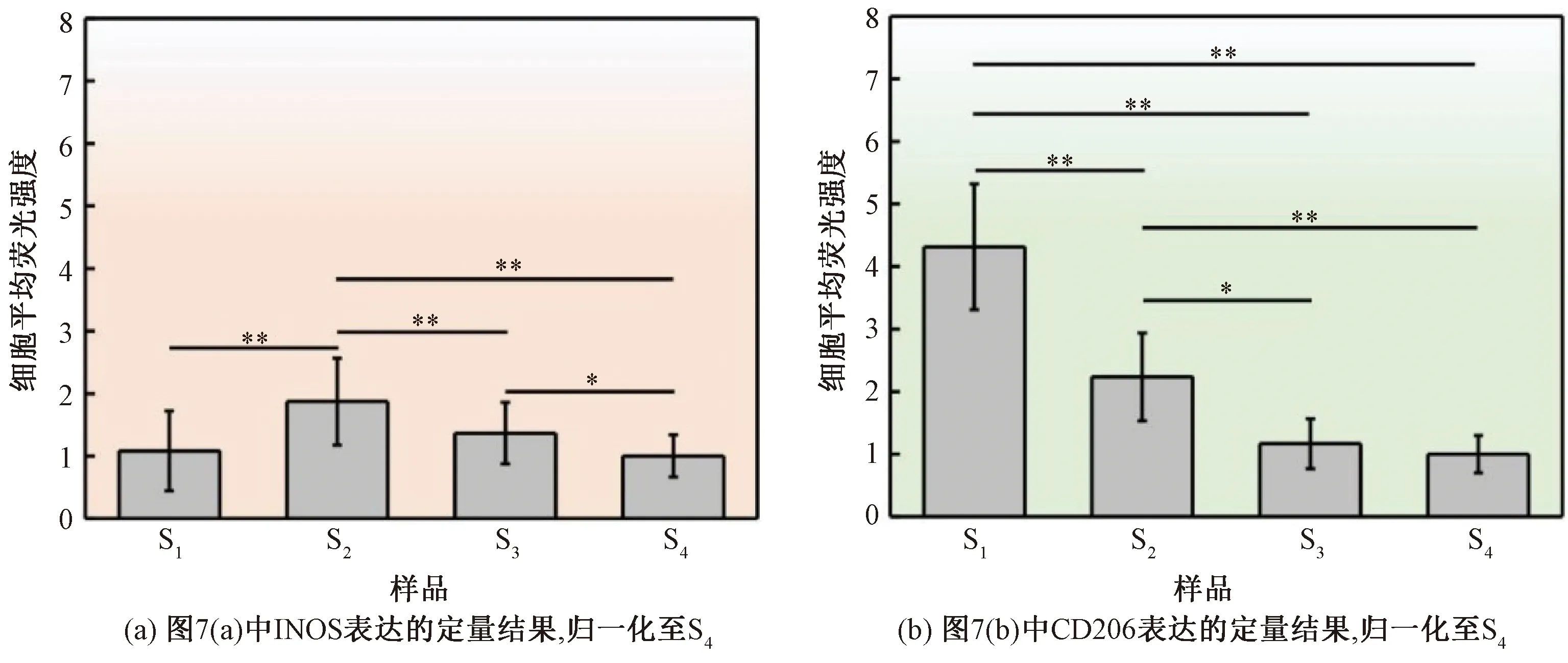
图8 不同刚度AFSs上RAW 264.7细胞INOS和CD206的定量表达(n≥3)Fig.8 Quantitative expression of INOS and CD206 in RAW 264.7 cells cultured on AFSs with varying stiffness (n ≥ 3)
根据第1 d的ELISA结果,不同刚度组AFSs之间的细胞因子分泌基本没有差异,只有抗炎因子IL-10在S1组中表达最多,并与S4组有差异,如图6(a)所示。但在第3 d可以明显看到除促炎因子IL-1β外其他3种细胞因子分泌量的差异,这暗示了力学信号(如刚度)作用的时间依赖性。无论在第1 d还是第3 d,不同AFSs上IL-1β的分泌都没有差异,因此推测IL-1β的分泌不受取向纤维的刚度调节,或者可以影响其表达的刚度不在本研究中用到的AFSs的刚度范围。培养1 d后M1促炎标志物TNF-α和IL-1β在不同组无显著性差异,而INOS在S2、S3组分泌较多,S1和S4组分泌较少,在本研究刚度范围内不呈线性表达,可能是S2和S3刚度范围较有利于INOS的表达。根据文献[17]研究的刚度范围为130~840 kPa的水凝胶基质对小鼠骨髓来源巨噬细胞表型极化的影响,可知在没有可溶性共刺激物的情况下刚度变化不会带来显著影响。Irwin等[26]发现TNF-α在不同刚度基质上的分泌无明显差异,与TNF-α相比,IL-8的分泌呈双相性,在1.4和348.0 kPa基质上分泌较低,而在10.0 kPa基质上分泌较高。基质刚度对巨噬细胞黏附和激活的影响仍有争议,目前未有一致的结论。
总体来看,研究结果表明AFSs基质刚度对巨噬细胞具有深远的影响。在细胞培养3 d后,软基质(如S1组)使巨噬细胞偏向M2表型,硬基质(如S4组)使巨噬细胞偏向M1表型。对组织微环境力学线索(如刚度)的深度理解将有助于设计能够改善组织重塑与再生的仿生纤维生物材料,促进仿生组织工程化血管的再生。
3 结 语
本研究将RAW 264.7细胞接种到不同刚度的AFSs上培养,通过SEM、荧光染色、CCK-8、ELISA、qRT-PCR等试验研究发现,AFSs的刚度会影响巨噬细胞的响应行为。在细胞培养3 d后,与软质纤维基质相比,硬质纤维基质更倾向于将巨噬细胞向促炎表型引导。巨噬细胞的表型功能对静电纺仿生纤维的刚度具有高度的依赖性,研究结果可对未来设计有效的仿生纤维基TEVGs提供指导和借鉴。
