网络药理学联合分子对接技术探究固肠止泻丸治疗溃疡性结肠炎的作用机制
2022-05-12王惟浩宋旭娇
王惟浩,宋旭娇,马 浩
网络药理学联合分子对接技术探究固肠止泻丸治疗溃疡性结肠炎的作用机制
王惟浩1,宋旭娇1,*马 浩2
(1.宜春学院化学与生物工程学院,江西,宜春 336000;2.宜春学院美容医学院,江西,宜春 336000)
网络药理学联合分子对接技术探析固肠止泻丸治疗溃疡性结肠炎(UC)的药效物质基础及其潜在作用机制。在TCMSP数据库收集固肠止泻丸各中药成分及对应靶点,并于疾病靶点取交集,获取潜在有效成分及治疗靶点。利用String数据库构建治疗靶点间蛋白互作网络,计算相关拓扑学参数,获得关键基因。将治疗靶点导入David数据库进性GO富集与KEGG富集分析。通过Auto Dock1.1.2软件对核心成分与关键基因进性分子对接验证。筛选出50个有效成分,其中槲皮素、山奈酚与小檗碱可能是参与治疗作用的关键成分;涉及16个治疗靶点,其中包括5个关键基因PTGS2、IL-1β、MMP9、CXCL8和ICAM1。GO生物过程30个,细胞成分6个,分子功能7个。涉及对炎症的反应等生物进程;细胞外域空间等细胞成分以及趋化因子活性等分子功能。与溃疡性结肠炎相关的KEGG通路共5条,包括Toll-样受体信号通路、TNF信号通路等。分子对接结果表明固肠止泻丸核心成分可以对上述核心靶点发挥调节作用。固肠止泻丸通过多成分、多靶点调控肠道免疫功能,发挥抗炎、抗氧化应激等作用,是其治疗UC的重要机制。
网络药理学;分子对接;固肠止泻丸;溃疡性结肠炎;活性成分
溃疡性结肠炎是一种常见慢性炎性疾病,以腹痛、腹泻及便血主要临床症状。近年来,溃疡性结肠炎在发展中国家的发病率呈急剧上升趋势。由于其复杂病理生理机制,涉及宿主遗传、免疫、肠道菌群失调等,临床治疗较为棘手[1]。目前治疗UC的主要药物有5-氨基水杨酸、糖皮质激素和生物制剂,取得了一定的疗效,但远期疗效不甚理想。
在祖国传统医学中,溃疡性结肠炎归属于“肠澼”、“泄泻”等范畴[2]。固肠止泻丸源于治疗UC经典名方香连丸与乌梅丸,由黄连、木香、乌梅肉、罂粟壳、干姜、延胡索六位中药组成,具有调节肝脾,固肠止泻的作用。现代药理学研究表明固肠止泻丸能显著改善UC大鼠的结肠出血、减轻水肿与增生,降低结肠组织内炎症因子的表达,对UC具有一定治疗作用[3-4]。但由于中药成分复杂多样,靶点众多,并且复方成分之间相互作用,一直是中医药研究领域的的挑战[5-8]。
近年来,随着生物大数据日趋完善以及高通量测序技术的不断发展,其在中药领域的研究逐渐深入。通过整合生物的基因数据,构建“药物-靶点-疾病”网络,这有助于中药复方成分进行多靶点,多机制的系统化探究[9-12]。分子对接技术能模拟化合物与靶蛋白结合,从一定程度上反映出两者间结合活性强弱。联合上述两者方法对于探讨固肠止泻丸的药效基础和作用靶点,揭示其复杂作用机制以及为现代化中药研究提供一定的方法学参考[13-14]。
1 方法
1.1 资料收集与方法流程
表1 本研究使用的据库及分析平台
Table 1 Involved database and related analysis platform in the study
编号名称网址版本 1TCMSP数据库[5]https://tcmspw.com/tcmsp.php2.3 2GeneCards数据库[6]https://www.genecards.org/5.1 3Uniprot数据库[7]https://www.uniprot.org/2021.2.21 4GEO数据库[8]https://www.ncbi.nlm.nih.gov/geo/2020.11.16 5Cytoscapehttps://cytoscape.org/3.7.2 6David数据库[9]http://kobas.cbi.pku.edu.cn/6.8 7STRING数据库[10]https://string-db.org/11.0 8微生信云平台http://www.bioinformatics.com.cn/2020.12 9Hiplot云平台[11]https://hiplot.com.cn/0.1.0. beta 6 10RCSB数据库[12]https://www.rcsb.org2020.11.24 11AutoDock Tools[13]http://autodock.scripps.edu/1.5.6 12AutoDock Vina[14]http://vina.scripps.edu/1.1.2 13Pymolhttps://pymol.org/2/2.4.1
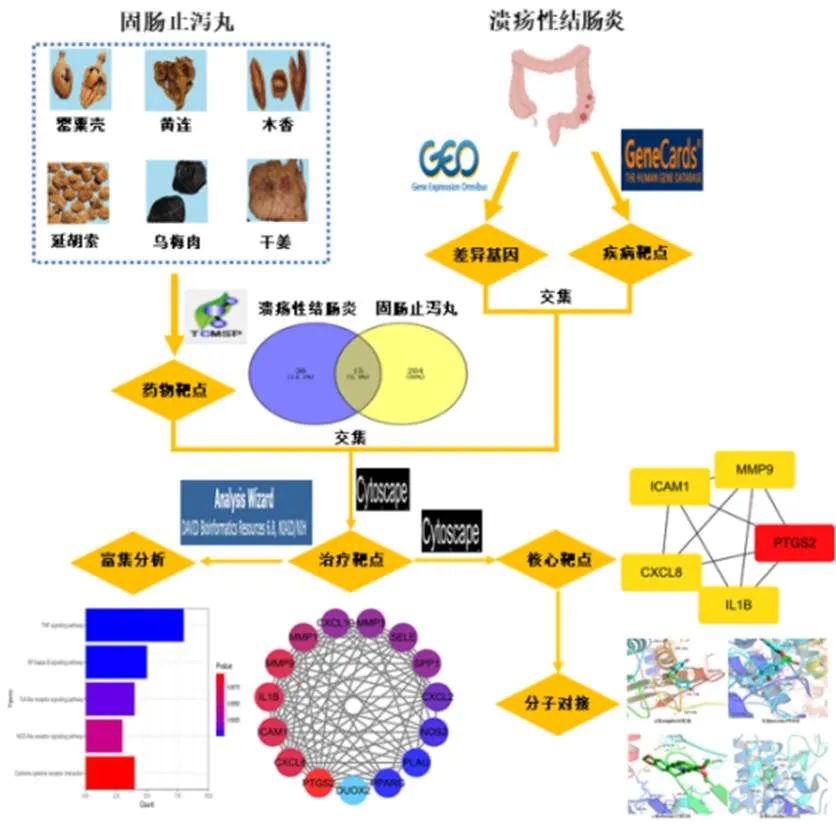
图1 本研究流程图
1.2 UC相关疾病靶点
在GEO数据库,以“ulcerative colitis”为关键词进行检索。通过筛选,获取GSE107499与GSE87466两个UC患者数据集,分别包括UC炎症组织75例与87例;正常结肠组织44例与21例。利用GEO数据库自带GEO2R分析功能,以log2(fold change)的绝对值>1.5和FDR<0.01为筛选条件获取正常组对比UC组的差异表达基因,负数代表下调,正数代表上调,通过Hiplot在线工具绘制火山图。在GeneCards数据库,以“ulcerative colitis”为关键词,“Score>10”为筛选条件,获取与UC相关基因。最后将上述三者交集作为本次疾病靶点。
1.3 固肠止泻丸活性成分及治疗靶点获取
在TCMSP数据库检索黄连、木香、乌梅肉、罂粟壳、干姜、延胡索共6位中药,以口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug likeness,DL)≥0.18为筛选条件,获取各中药的化学成分及相应靶点,利用Uniprot数据库对各靶点进行标准化处理。继而与1.2疾病靶点相互映射作为治疗靶点,剔除不含交集靶点的化学成分,最终得到固肠止泻丸治疗UC的活性成分。
1.4 PPI网络构建及核心靶点的获取
将1.3的治疗靶点导入String11.0数据平台,设置为默认参数,结果通过Cytoscape3.7.2构建治疗靶点PPI网络并计算各靶点度值(Degree)、中介中心性(Betweenness centrality)、接近中心性(Closeness centrality)。利用cytoHubba插件中最大团中心性算法(MCC)获取核心靶点,依据重要程度排序。
1.5 GO富集与KEGG信号通路富集
将1.3获取治疗靶点导入David6.8数据库,以“P-Value<0.05”为条件,筛选GO富集中的生物过程、细胞组分、分子功能以及与UC相关的KEGG信号通路。最终结果以富集图和气泡图展示。最后,利用Cytoscape绘制“活性成分-靶点-KEGG通路-疾病”多维网络。
1.6 分子对接
计算“活性成分-靶点-KEGG通路-疾病”网络各节点Degree值,筛选出排名前三位的化合物槲皮素、山奈酚以及小檗碱,这可能是固肠止泻丸治疗UC的关键成分,并与1.4中得分最高的5个核心靶点进行分子对接验证。从PDB蛋白结构数据库获取核心靶蛋白结构,利用AutoDock Tools软件处理靶蛋白与小分子配体。通过AutoDock Vina进行分子对接,利用Pymol软件实现数据可视化。
2 结果
2.1 UC疾病相关靶点
结果显示GSE107499数据集得到405个差异基因,其中上调77个,下调328个。GSE87466数据集获得468个差异基因,其中上调161个,下调307个,结果绘制火山图(图2a,2b)。在GeneCards数据库共获得368个基因。通过韦恩图将上述三者取交集,最终获取UC疾病靶点51个(图2c)。

图2 UC相关靶点结果
2.2 固肠止泻丸活性成分及靶点筛选结果
通过检索TCMSP数据库,获取固肠止泻丸各中药的主要成分及对应靶点,共得到221个药物靶点。将药物靶点与2.1中疾病靶点取交集,剔除不含交集靶点的药物成分,最终获得黄连活性成分9个,乌梅5个,干姜2个,木香3个,罂粟壳8个,延胡索30个。其中槲皮素(Quercetin)是乌梅、黄连,延胡索共有活性成分;豆甾醇(Stigmasterol)是乌梅、延胡索、木香共有活性成分;小檗碱(Berberine)、R型氢化小檗碱((R)-Canadine)、巴马汀(Palmatine)以及黄连碱(Coptisine)是黄连、延胡索共有活性成分;β-谷甾醇(beta-Sitosterol)是乌梅、干姜共有活性成分。
2.3 固肠止泻丸-UC治疗靶点PPI网络
如图3所示,将2.2获取的药物靶点与2.1获取的疾病靶点取交集,共15个靶点,并将结果上传至String11.0数据库,得到蛋白质互作网络(PPI)。在PPI网络中共有15个节点,75条边。该网络平均Degree值10.53,平均BC值0.02,平均CC值0.82。利用cytoHubba插件对15个治疗靶点进行打分,评分前五位的靶点有前列腺素内过氧化物合酶2()、白介素-1β()、基质金属酶9()、趋化因子8()、细胞间黏附分子-1()。这可能是固肠止泻丸治疗UC的核心基因。
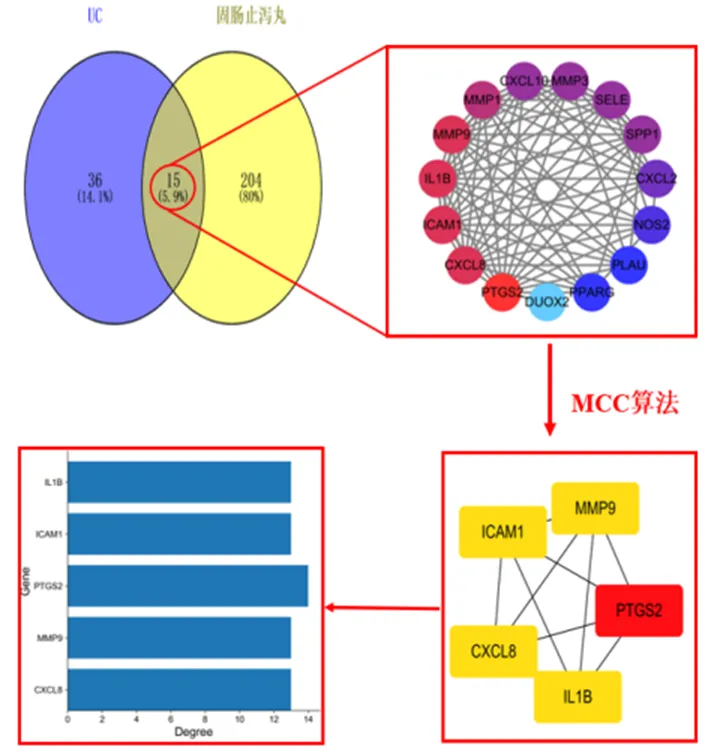
图3 固肠止泻丸-UC治疗靶点PPI网络及核心基因
2.4 GO功能及KEGG通路分析
如图4a,本次GO功能涉及炎性反应、趋化因子相互作用、对脂多糖的反应等生物学进展;涉及细胞外域空间、细胞核周等细胞组分;参与蛋白质结合、趋化因子活性等分子功能。结合参考文献,获取与UC密切相关的KEGG通路5条,如图4b所示,分别是TNF信号通路、NF-κB信号通路、Toll-like信号通路、NOD-like信号通路以及细胞因子受体相互作用。此外,如图4c所示通过Cytoscape软件构建“活性成分-靶点-KEGG通路-疾病”多维网络,该网络71个节点、124条边;其中活性成分按度值排在前三位的化合物,槲皮素、山奈酚、小檗碱,这可能是固肠止泻丸治疗UC的关键成分。
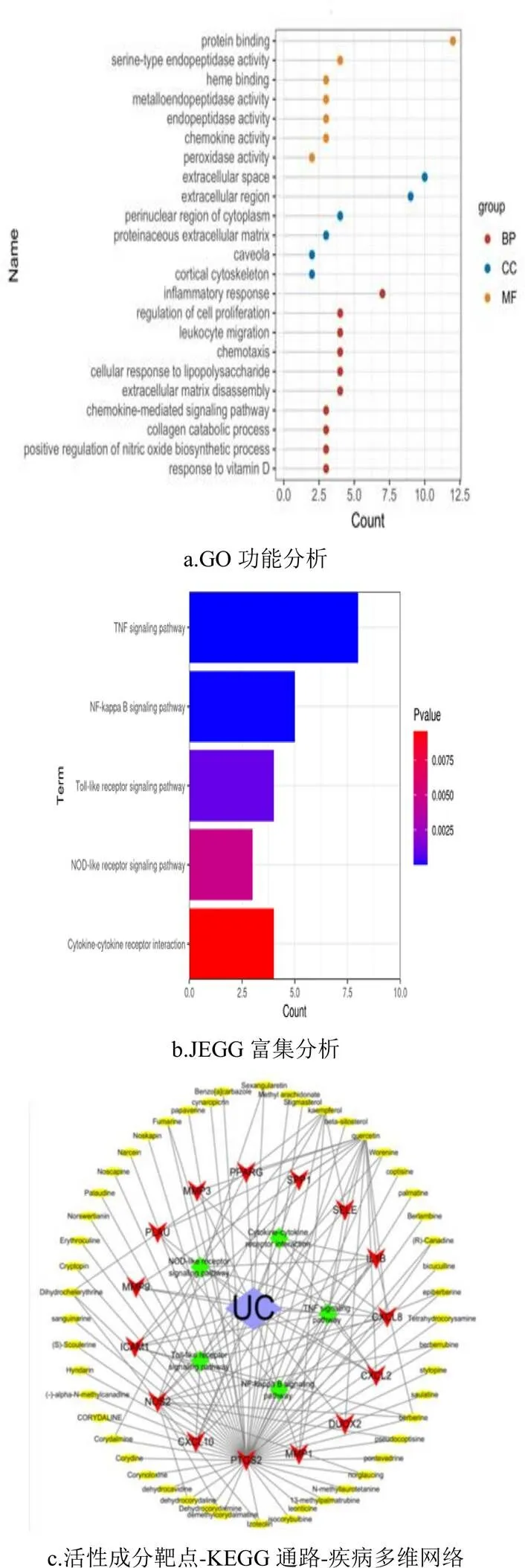
图4 富集分析以及“活性成分-靶点-KEGG通路-疾病”多维网络
2.5 分子对接结果
在RCSB数据库中检索并获取5个核心靶点的蛋白结构(PDB格式),在TCMSP数据库中获取核心活性成分槲皮素、山奈酚、小檗碱化合物结构(mol2格式)。应用AutoDock Vina 1.1.2软件进行分子对接验证。一般认为分子间结合能越低,受体与配体亲和力越高,构象越稳定。结合能(affinity,kcal/mol)小于-4.25 kcal/mol表示配体分子与受体蛋白之间有一定的结合活性;小于-5.0 kcal/mol表明配体分子与受体蛋白之间有较好的结合活性;小于-7 kcal/mol表明配体分子与受体蛋白具有强烈的结合活性。如表2所示本次研究显示核心成分与关键靶点蛋白结合活性均<-5 kcal/mol,具有良好的结合活性。如图5所示,部分结果予以可视化显示。
表2 分子对接结果
Table 2 The results of molecular docking
编号核心靶蛋白PDB编码小分子配体对接能量(kcal/mol) 1PTGS21PXX原有配体-3.5 槲皮素-5.1 山奈酚-5.8 小檗碱-5.0 2IL-1B1RWN原有配体-4.2 槲皮素-5.5 山奈酚-6.0 小檗碱-5.1 3MMP94HMA原有配体-4.4 槲皮素-7.1 山奈酚-6.6 小檗碱-5.0 4CXCL81QE6原有配体-2.3 槲皮素-5.4 山奈酚-5.4 小檗碱-6.1 5ICAM-11IAM原有配体-3.5 槲皮素-5.4 山奈酚-5.1 小檗碱-8.1
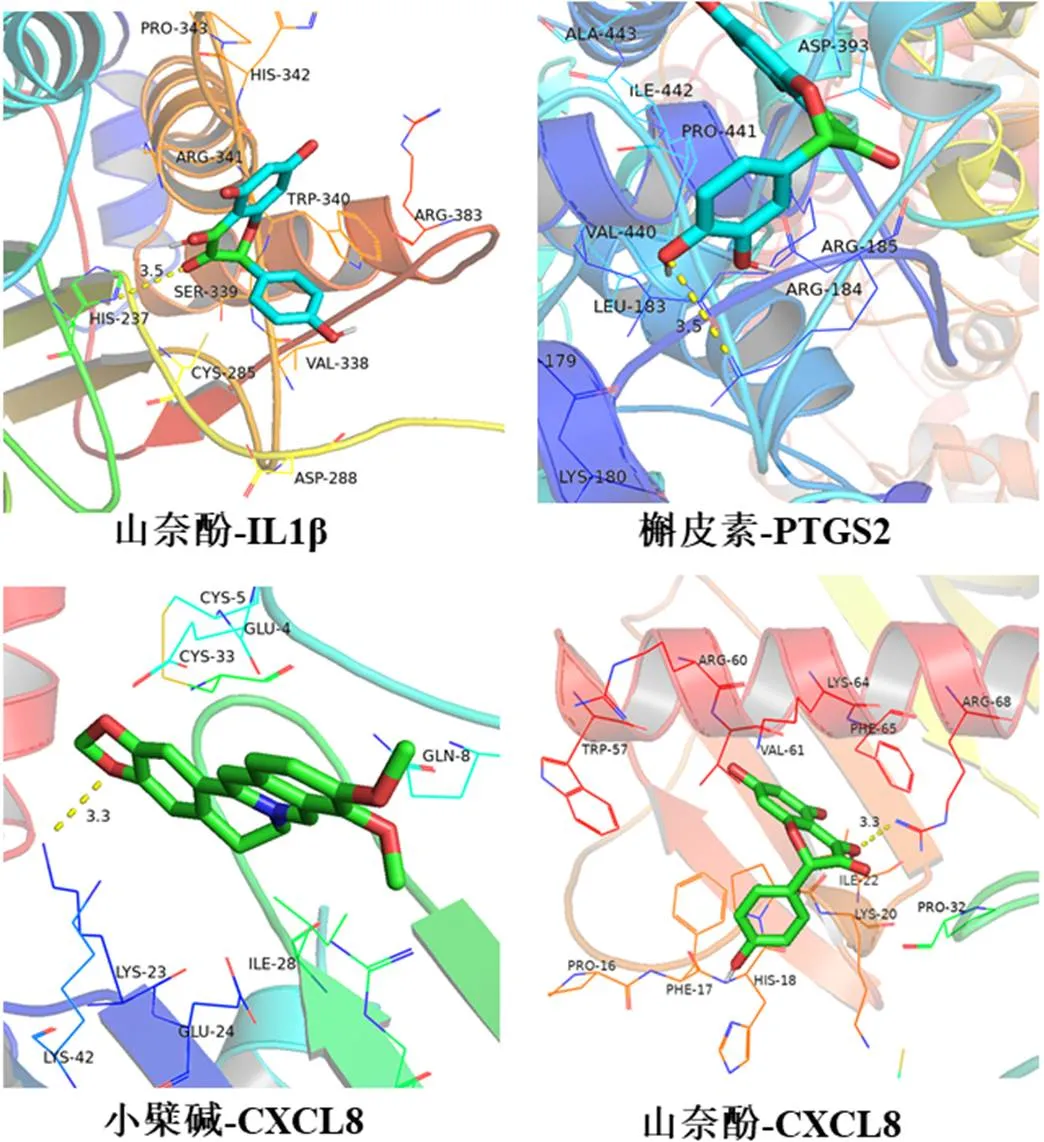
图 5 分子对接结果3D图
3 讨论
在本次研究中涉及3个核心成分,分别是槲皮素、山奈酚以及小檗碱。槲皮素是一种天然的黄酮类化合物,具有广泛的抗炎、抗氧化应激以及免疫调节药理作用。Najafzadeh M等[15]研究表明槲皮素有效降低UC模型的T淋巴细胞氧化应激水平,减轻细胞内DNA凋亡,从而实现对肠道组织的保护功能。Dicarlo M等[16]研究显示槲皮素能降低TNF-α与重组蛋白LCN-2表达,上调抗炎因子血红素加氧酶 1(HMOX1)表达,从而实现治疗UC的作用。山奈酚具有强大的抗炎、抗氧化作用。Park MY等研究证实山奈酚能减轻硫酸葡聚糖硫酸钠(DSS)诱导的UC小鼠血浆中一氧化氮(NO)、前列腺素(PGE)水平[17],提高对肠道杯状细胞保护功能,改善肠道细胞氧化应激损伤。Bian等[18]研究发现在LPS诱导的肠道血管内皮细胞的炎症模型,能显著降低炎症介质如TNF-α、ICAM-1浓度,并对TLR4/NF-κB通路具有负向调节作用。亦有研究显示山奈酚能作用于Wnt信号通路,调节Axin蛋白表达,维持肠道隐窝结构,增加肠道屏障功能[19]。小檗碱常用于腹泻、细菌性痢疾等胃肠疾病的治疗。何涛宏等[20]研究显示UC大鼠给予小檗碱,与模型组相比,炎症因子TNF-α、IL-1β水平显著降低,提高肠道紧密蛋白occludin表达,这说明小檗碱能有效抑制UC大鼠结肠炎症和缓解病理损伤。
通过对15个预测治疗靶点构建PPI网络,计算其拓扑学参数,获得5个关键基因分别是和。基因参与调控环加氧酶-2的生成,其广泛存在于肠道上皮组织,能将细胞膜中释放的花生四烯酸代谢为炎性产物前列腺素的关键酶,促进炎症反应,并影响肠道屏障功能稳定性。经典抗UC药物美沙拉嗪亦是通过抑制的活化进而发挥治疗作用[21-22]。炎症因子IL-1β在UC患者结肠组织与血清中浓度明升高;其水平与疾病严重程度呈正相关;且能激活Th17细胞信号通路,并释放干扰素γ加重肠黏膜损伤[23]。基因积极参与炎症性肠病患者的病理生理过程,能影响粘膜细胞之间的紧密连接,增加肠粘膜通透性并加重粘膜屏障功能的损害;同时刺激结肠细胞产生TNF-α,加剧肠道炎性损伤[24-25]。此外,MMP 9蛋白表达可以作为UC活动期生化指标,与病人的预后密切相关[26]。趋化因子8()基因参与白介素-8的表达,促进中性粒细胞向患处迁移。Walana等[27]研究发现应用拮抗剂G31P治疗DSS诱导的UC小鼠时,可以降低促炎因子水平,对患处起到保护作用。细胞间黏附分子-1()基因在正常结肠组织中表达极低。当结肠受到炎性损伤时,能持续激活该信号通路,同时NF-κB的活化能促进的表达,造成炎症的级联与扩散[28]。研究表明通过靶向抑制表达,有望成为新型UC治疗手段[29]。
本次KEGG分析表明预测的治疗靶点主要集中在TNF信号通路、NF-κB信号通路、Toll-like以及NOD-like等信号通路。肠道上皮细胞参与维持粘膜屏障功能与介导免疫应答。研究表明UC患者的上皮细胞凋亡明显增加,此过程与TNF信号通路密切相关[30]。通过活化T细胞,诱导产生TNF-α,并参与肠道内皮血管的水肿,肠道免疫细胞激活释放炎症因子以及促进细胞的凋亡[31]。Toll-like信号通路作为经典模式识别受体,参与细菌、病毒等感染的免疫应答过程。TLR4过度表达能促进提升促炎因子水平,导致炎症的级联与扩散[32-33]。刁凌云等[34]研究显示UC活动期患者TLR2、TLR4表达水平显著上调,且与疾病严重程度呈正相关性,作为诊断UC和预后指标具有一定的参考意义。NOD-like信号通路是一种胞内模式识别受体,能被多种内源性以及外源性刺激因子活化,进而形成NLRP3炎症小体。NLRP3炎症小体与UC的进展密切相关。不仅促进炎症因子IL1β、IL-18的表达,参与细胞焦亡。同时激活下游MAPK以及NF-κB信号通路,增加促炎因子IL-6表达同时减少抑炎因子IL-10,并诱导细胞凋亡等多种功能。NLRP3过度活化能够影响肠道菌群正常组分,UC患者肠道内益生菌含量下降,加剧肠道损伤[35]。此外,NOD-like信号通路与Toll-like信号通路,均可激活下游NF-κB通路,释放炎症因子如IL-1β及TNF-α等[36-37]。
4 小结
本研究运用网络药理学以及分子对接技术系统分析固肠止泻丸治疗UC的潜在作用机制,其中槲皮素、小檗碱、山奈酚等活性成分可能通过、、等基因靶点及TNF、NF-κB和Toll-like等信号通路发挥免疫调理、抑炎、抗氧化应激等多种作用。但鉴于网络药理学的局限性以及当前中药数据库信息尚不完整,固肠止泻丸实际干预UC结果可能存在一定偏倚。未来仍需进一步探究固肠止泻丸“多成分-多靶点-多通路”作用机制。
[1] 沈洪,唐志鹏,唐旭东,等. 消化系统常见病溃疡性结肠炎中医诊疗指南:基层医生版[J].中华中医药杂志,2019,34(9):4155-4160.
[2] 李卓原,刘剑,刘聪聪,等.中西医治疗溃疡性结肠炎的研究进展[J].中国肛肠病杂志,2020,40(12): 72-74.
[3] 杨勇,周源,赵娟,等. 固肠止泻丸干预溃疡性结肠炎模型大鼠的实验研究[J].世界最新医学信息文摘,2018,18(65): 3-5.
[4] 张小丽,范引科,姜姗姗,等. 固肠止泻丸治疗免疫及醋酸致豚鼠溃疡性结肠炎的实验研究[J].西北药学杂志,2010,25(03): 198-199.
[5] Ru J, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminformatics, 2014, 6(1): 13.
[6] Zhang W, Bojorquez-Gomez A, Velez DO, et al. A global transcriptional network connecting noncod ing mutations to changes in tumor gene expression[J]. Nat Genet, 2018, 50(4): 613-620.
[7] 罗静初.UniProt蛋白质数据库简介[J].生物信息,2019,17(3): 131-144.
[8] Barrett T, Wilhite S E, Ledoux P, et al. NCBI GEO: archive for functional genomics data sets -update[J]. Nucleic Acids Res 2013,41: D991-D995.
[9] Huang D W, Sherman B T, Lempicki R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nature Protoc,2009,4(1): 44-57.
[10] Szklarczyk D, Franceschini A, Kuhn M, et al. The STRING database in 2011: functional interaction. networks of proteins, globally integrated and scored[J]. Nucleic Acids Research, 2011,39(suppl 1):561-568.
[11] Hiplot: a community-driven bioinformatics data visualization platform[M]. Openbiox Community,2020.
[12] Burley SK, Berman HM, Bhikadiya C, et al. RCSB Protein Data Bank: biological macro molecular structures enabling research and education in fundamental biology, biomedicine, biotechnology and energy[J]. Nucleic Acids Research, 2019, 47: 464-474.
[13] Word JM, Lovell, SC, Richardson, JS, et al. Asparagine and glutamine: using hydrogen atom contacts in the choice of sidechain amide orientation[J]. J Mol Biol, 1999, 285: 1733-1745.
[14] O Trott, A J Olson. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization and multithreading[J]. Journal of Computational Chemis try, 2010: 455-461.
[15] Najafzadeh M, Reynolds PD, Baumgartner A, et al. Flavonoids inhibit the genotoxicity of hydrogen peroxide (H(2)O(2)) and of the food mutagen 2-amino-3-Methylimadazo (IQ) in lympho -cytes from patients with inflammatory bowel disease (IBD) [J]. Mutagenesis, 2009, 24(5):405-11.
[16]Dicarlo M, Teti G, Verna G, et al. Quercetin Exposure Suppresses the Inflammatory Pathway in Intestinal Organoids from Winnie Mice[J]. Int J Mol Sci, 2019, 20(22): 5771.
[17]Park MY, Ji GE, Sung MK. Dietary kaempferol suppresses inflammation of dextran sulfate sodium-induced colitis in mice [J]. Dig Dis Sci, 2012, 57(2): 355-63.
[18] Bian Y, Liu P, Zhong J, et al. Kaempferol inhibits multiple pathways involved in the secretion of inflammatory mediators from LPS‑induced rat intestinal microvascular endothelial cells Mol Med Rep, 2019, 19(3): 1958-1964.
[19] Sharma AR, Nam JS. Kaempferol stimulates WNT/β-cateninsignaling pathway to induce diffe rentiation of osteoblasts[J].J Nutr Biochem,2019,74:108228.
[20]何涛宏,陈敏,郝亮亮,等.盐酸小檗碱对溃疡性结肠炎大鼠炎症的影响[J].中国临床药理学杂志,2020,36(21): 3461-3464.
[21] Zamuner SR, Warrier N, Buret AG, et al. Cyclooxygenase 2 mediates post-inflammatory colonic secretory and barrier dysfunction[J]. Gut, 2003, 52(12): 1714-20.
[22] Wiercinska-Drapało A, Flisiak R, Prokopowicz D. Effects of ulcerative colitis activity on plasma and mucosal prostaglandin E2 concentration[J]. Prostaglandins Other Lipid Mediat, 1999, 58: 159-165.
[23] Mao L, Kitani A, Strober W, et al. The role of NLRP3 and IL-1β in the pathogenesis of inflammat ory bowel disease[J]. Front Immunol, 2018, 9(5):2566.
[24] Bai X, Bai G, Tang L, et al. Changes in MMP-2, MMP-9, inflammation, blood coagulation and intestinal mucosal permeability in patients with active ulcerative colitis[J]. Exp Ther Med, 2020, 20(1): 269-274.
[25] Neurath M. Current and emerging therapeutic targets for IBD[J].Nat Rev Gastroenterol Hepatol, 2017, 14(11): 688.
[26] Kreijne JE, van der Giessen J, Verhaar AP, et al. Fecal matrix metalloproteinase-9 measure-ment for optimizing detection of disease activity in inflammatory bowel disease[J]. J Clin Gastroen -terol, 2019, 53(5):395-397.
[27] Walana W, Ye Y, Li M, et al. IL-8 antagonist, CXCL8(3-72)K11R/G31P coupled with probiotic exhibit variably enhanced therapeutic potential in ameliorating ulcerative colitis[J]. Biomed Pharma -cother, 2018, 103: 253-261.
[28] Bendjelloul F, Rossmann P, Malý P, et al. Detection of ICAM-1 in experimentally induced colitis of ICAM-1-deficient and wild-type mice: an immunohistochemical study[J]. Histochem J., 2000, 32(12): 703-709.
[29] Reinisch W, Hung K, Hassan-Zahraee M, et al. Targeting Endothelial Ligands: ICAM-1/alicaforsen, MAdCAM-1[J]. J Crohns Colitis, 2018, 12(suppl 2): S669-S677.
[30] Seidelin JB, Nielsen OH. Epithelial apoptosis:cause or consequenceof ulcerative colitis? [J].Scand J Gastroenterol, 2009, 44 (12): 1429-1434.
[31] Zelová H, Hošek J.TNF-α signalling and inflammation: interactions between old acquain-tances[J]. Inflamm Res, 2013, 62(7): 641-51.
[32] 徐晓云,李冬斌,李彬. TLR4、NF-κB p65、IL-8 在溃疡性结肠炎中的表达[J].疑难病杂志,2012,11(3):181-183。
[33] Kordjazy N, Haj-Mirzaian A, Rohani MM. Role of toll-like receptors in inflammatory Bowel disease[J]. Pharmacol Res,2018,129:204-215.
[34] 刁凌云,皇金萍,陈洋,等. TLRs及其下游炎性因子在溃疡性结肠炎早期诊断及预后评估中的价值分析[J].川北医学院学报,2021,36(12): 1546-1551.
[35] Zhen Y, Zhang H. NLRP3 inflammasome and inflammatorybowel disease[J]. Front immunol, 2019, 10:276.
[36] 李跃文,刘志强,王博龙等. 四磨汤治疗功能性胃肠病机制的网络药理学分析[J].井冈山大学学报:自然科学版,2020,41(3): 90-95.
[37] Karimi S, Tabataba-Vakili S, Ebrahimi-Daryani N, et al. Inflammatory biomarkers response to two dosages of vitamin D supplementation in patients with ulcerative colitis: A randomized, double-blind, placebo-controlled pilot study[J]. Clin Nutr ESPEN,2020, 36(2):76-81..
MECHANISM EXPLORATION OF GUCHANG ZHIXIE PILLS ACTING ON ULCERATIVE COLITIS BASED ON NETWORK PHARMACOLOGY-MOLECULAR DOCKING TECHNOLOGY
WANG Wei-hao1, SONG Xu-jiao1,*MA Hao2
(1. School of Chemical and Biological Engineering, Yichun University, Yichun, Jiangxi 336000, China;2. School of Aesthetic Medical , Yichun University, Yichun, Jiangxi 336000, China)
To explore the pharmacodynamic material basis and underlying mechanisms of Guchang Zhixie pills in the treatment of ulcerative colitis by network pharmacology combined with molecular docking.The traditional Chinese medicine components and corresponding targets of Guchang Zhixie pills were collected in TCMSP database, and the disease targets were intersected to obtain the potentially effective components and therapeutic targets. The protein interaction network between therapeutic targets was constructed by using String database, the relevant topological parameters were calculated, and then the key genes were obtained. The therapeutic targets were introduced into David database for progressive GO enrichment and KEGG enrichment analysis. The progressive molecular docking of the core components and key genes was verified by Auto Dock1.1.2 software.50 active components were screened, quercetin, kaempferol and berberine may be the key components involved in the treatment, involving 16 therapeutic targets, including 5 key genesandThere were 30 biological processes, 6 cellular components and 7 molecular functions of GO, which are involved in biological processes such as response to inflammation, cellular components such as extracellular space and molecular functions such as chemokine activity. There were 5 KEGG pathways related to ulcerative colitis, including Toll-like receptor signal pathway, TNF signal pathway and so on. The results of molecular docking showed that the core components of Guchang Zhixie pills could regulate the above core targets.Guchang Zhixie pills regulate intestinal immune function through multi-components and multi-targets and plays a key role in anti-inflammatory and antioxidant stress, which is an important mechanism in the treatment of UC.
network pharmacology; molecular docking; Guchang Zhixie pills; ulcerative colitis; active compound
1674-8085(2022)03-0086-08
R256.3
A
10.3969/j.issn.1674-8085.2022.03.014
2021-04-23;
2022-01-20
江西省研究生创新专项项目(YC2020-S647);宜春学院博士科研启动基金项目(113-3350100050)
王惟浩(1988-),男,河北保定人,硕士生,主要从事网络药理学研究(Email:453889388@qq.com);
*马 浩(1986-),男,山东淄博人,讲师,博士,硕士生导师,主要从事临床药学及药理学研究(Email:promisingmh@163.com).
