耐碳青霉烯大肠埃希菌分子特征和同源性分析
2022-05-12黄家祥王中新潘亚萍徐元宏
黄家祥,王中新,潘亚萍,徐元宏
大肠埃希菌是引起医院和社区感染的主要病原体之一,通常作为人类和动物肠道正常菌群存在,但是在某些情况下,可引起人类肠道感染,还可侵入肠外组织引起尿路感染、腹腔感染、胆道感染、肺部感染、血流感染、脑部感染和肌肉结缔组织感染等[1]。近年来随着碳青霉烯类药物的广泛使用,耐碳青霉烯大肠埃希菌(carbapenem-resistantEscherichiaColi,CREC)已屡见不鲜。为了更好了解CREC耐药情况,预防耐药菌株院内传播,该研究收集安徽医科大学第一附属医院近5年的大肠埃希菌,从中筛选出碳青酶烯耐药的菌株,探讨CREC产碳青霉烯酶的表型、产酶基因的构成及其分子流行病学。
1 材料与方法
1.1 菌株来源收集安徽医科大学第一附属医院2015年1月-2019年12月临床标本分离并-20 ℃保存的6 092株大肠埃希菌,选取对厄他培南、亚胺培南或美罗培南耐药的菌株,转种血琼脂培养基复苏细菌,剔除重复分离株和死亡株,共71株CREC纳入本次研究。质控菌株:大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA1705、肺炎克雷伯菌ATCC BAA1706。
1.2 仪器与试剂Vitek-2 Compact微生物鉴定仪、MALDI-TOF-MS质普仪、血琼脂培养基、MH琼脂培养基(法国Bio Merieux公司),PCR扩增仪、凝胶成像系统、电泳仪(美国BIO-RAD公司),高速离心机(德国Eppendorf公司),生物安全柜(苏净安泰空气技术有限公司),亚胺培南西司他丁钠[默沙东(中国)有限公司],琼脂糖(德国Biofroxx公司),硫酸锌、酚红(中国医药集团有限公司),Taq PCR Mix 预混液(2×,含红染料)、引物、4S Red Plus核酸染料、TBE粉末、DNA分子量标准Marker(上海生工生物工程有限公司)。
1.3 细菌鉴定与药敏采用Vitek-2 Compact进行细菌鉴定,MALDI-TOF-MS质普仪进行确认。细菌药敏实验采用Vitek-2 Compact配套药敏卡AST-N334,纸片法进行复核和补充。
1.4 耐碳青酶烯酶表型实验
1.4.1改良Hodge实验 用无菌生理盐水制备0.5麦氏浓度的大肠埃希菌ATCC 25922菌悬液,将菌悬液用生理盐水按1 ∶10稀释后,无菌棉签蘸取稀释后的菌液,均匀涂布于MH琼脂平板上,自然干燥5~10 min,平板中央贴美罗培南(10 μg)纸片,用一次性无菌1 μl接种环挑取适量过夜培养的待测菌落,沿美罗培南纸片边缘,垂直方向画待测菌线,菌线长20~25 mm,空气环境中35 ℃培养18~24 h,结果判读:待测菌线与抑菌圈交界处大肠埃希菌ATCC 25922呈增强生长,判为阳性结果;无增强生长,则为阴性结果。
1.4.2mCIM实验 用10 μl接种环刮取1环血琼脂平板过夜培养的待测细菌加入含400 μl无菌水的EP管中,震荡混匀,浸入美罗培南纸片(10 μg),35 ℃温育2 h。取出纸片,挤出多余菌液,贴于均匀涂布有0.5麦氏浓度大肠埃希菌ATCC 25922菌液的MH琼脂上,35 ℃温育18~24 h,测量抑菌圈直径。结果判读:① 抑菌圈直径为6~15 mm或直径为16~18 mm但抑菌圈内有散在菌落生长,提示待测菌株产碳青霉烯酶。② 抑菌圈直径≥19 mm,提示待测菌株不产碳青霉烯酶。③ 抑菌圈直径为16~18 mm或直径为≥19 mm但抑菌圈内有散在菌落生长,提示无法判断是否存在碳青霉烯酶。
1.4.3Carba NP实验 取a、b两个无菌EP管,均加入100 μl细菌蛋白提取液,用1 μl接种环取两环血平板上培养过夜的待测菌单菌落分别加入a、b管中,涡旋震荡5~10 s,再向a管中加入A液100 μl,向b管中加入B液100 μl,35 ℃孵育2 h,每0.5 h观察记录管中颜色变化。结果判读:① a、b管均为红色或橙红色,提示未检出碳青霉烯酶。② a管红色或橙红色,b管浅橙色、黄色或深黄色,提示检出碳青霉烯酶。③ a管红色或橙红色,b管橙色,提示试验结果无效。④ a管橙色、黄色或深黄色,b管任何颜色,提示试验结果无效。
1.5 PCR扩增耐药基因参照文献设计碳青霉烯酶基因引物,并由上海生工公司合成,引物序列见表1。采用煮沸法制备扩增模板。PCR反应体系总体积为50 μl:Taq PCR Master Mix(2×,red dye)25 μl,10 μmol/L正反引物各2 μl、DNA模板1 μl、ddH2O 20 μl。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s、根据各引物退火温度退火30 s、72 ℃延伸1 min、72 ℃最后延伸10 min、39个循环。PCR产物经1.5%琼脂糖凝胶电泳后,凝胶成像系统观察结果。阳性扩增产物委托上海生工公司进行测序,使用NCBI网站的Blast程序对基因序列进行比对,以确定基因型及其亚型。

表1 PCR引物序列
1.6 ERIC-PCRERIC-1引物序列为: 5′-ATGTAAGCTCCTGGGGATTCAC-3′,ERIC-2引物序列为:5′-AAGTAAGTGACTGGGGTGAGCG-3′,由上海生工公司合成,反应条件如下:94 ℃预变性4 min,94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸1 min、72 ℃最后延伸10 min、30个循环。PCR产物经1.5%琼脂糖凝胶电泳后,凝胶成像系统观察纪录结果。结果判断:将电泳图谱条带位置相同的菌株视为同一型别。
1.7 统计学处理药敏试验结果参照CLSI 2018标准进行判读,使用WHONET 5.4软件对细菌数据进行统计分析。
2 结果
2.1 菌株基本资料5年间CREC的检出率分别为1.00%(12/1198)、1.12%(14/1247)、1.01%(13/1287)、1.22%(15/1230)、1.50%(17/1130),71株CREC主要来自尿液29株,其次为痰液15株,分泌物10株,血液5株;穿刺液、创面、腹水、引流液各2株;胆汁、脑脊液、脓液和咽拭子均为1株。病区来源以ICU和烧伤科为主,分别为8株和7株,其次为泌尿外科、门诊各5株;肝胆外科、感染科、急诊内科和康复科各4株;干部病房、神经外科、血液科和肿瘤科各3株;风湿科、呼吸科、神经内科、肾内科、胃肠外科、消化科和心脏外科各2株;产科、新生儿科、内分泌科和皮肤科各1株。
2.2 药物敏感性结果71株CREC对常见抗菌药物的耐药率普遍居高,见表2。

表2 71株CREC对常见抗菌药物的耐药率
2.3 表型试验结果71株CREC中45株MHT阳性, 67株mCIM阳性,69株Carba NP阳性,阳性率分别为63.38%、94.37%、97.18%。部分阳性结果见图1~3。

图1 部分菌株MHT试验结果阳性对照:1705即肺炎克雷伯菌ATCC BAA1705;阴性对照:1706即肺炎克雷伯菌ATCC BAA1706;21:编号21的CREC(MHT阳性)
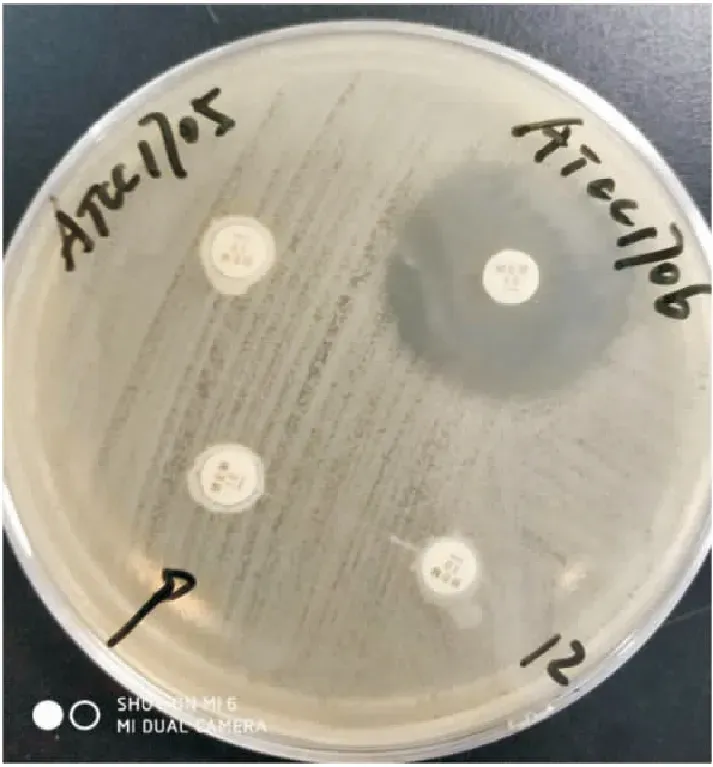
图2 部分菌株mCIM试验结果阳性对照:ATCC 1705即肺炎克雷伯菌ATCC BAA1705;阴性对照:ATCC 1706即肺炎克雷伯菌ATCC BAA1706;9、12:编号9、12的大肠埃希菌(mCIM阳性)
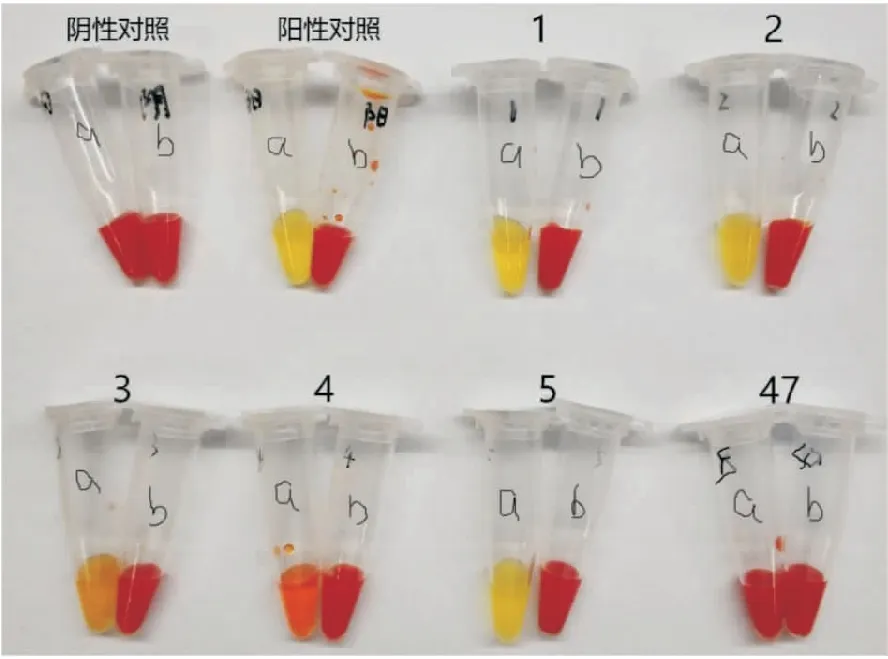
图3 部分菌株Carba NP试验结果阳性对照:肺炎克雷伯菌ATCC BAA1705;阴性对照:肺炎克雷伯菌ATCC BAA1706;1~5:Carba NP试验阳性菌株;47:Carba NP试验阴性菌株
2.4 耐药基因PCR扩增结果71株CREC共有43株检出碳青酶烯酶基因,检出率为60.56%,34株携带blaNDM中有7株为blaNDM-1,27株为blaNDM-5,9株携带blaKPC均为blaKPC-2。其余碳青酶烯酶基因blaBIC、blaIMP、blaSPM、blaAIM、blaGIM、blaDIM、blaSIM、blaGES、blaOXA-48均未检出。部分碳青酶烯酶基因电泳图谱见图4。

图4 部分blaNDM阳性电泳图谱M:DL2000 DNA Marker;1:阴性对照;2:阳性对照;3~11:blaNDM阳性菌株;12:blaNDM阴性菌株
2.5 ERIC-PCR结果71株CREC的ERIC-PCR电泳图谱产生2~8条不同的条带模式,范围从100~2 000 bp,共分为19个型别,其中A型9株,B型8株,C型7株,D型6株,E型6株,F型5株,G型5株,H型4株,I型4株,J型4株,K型3株,L型2株,M型2株,N型、O型、P型、Q型、R型、S型各1株。部分菌株ERIC-PCR电泳图谱见图5。
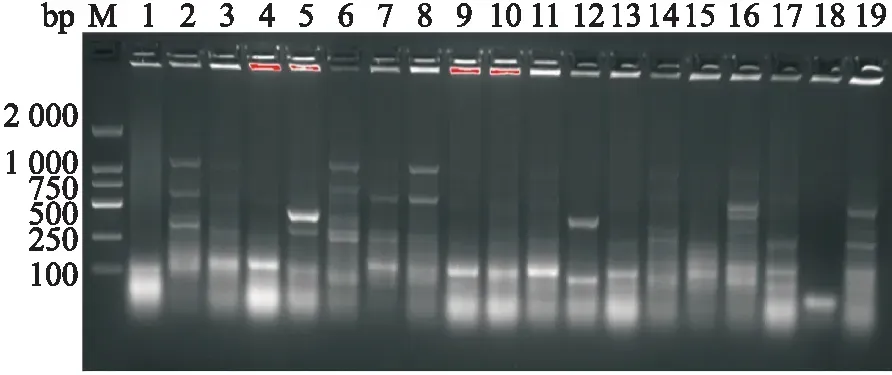
图5 部分菌株ERIC-PCR电泳图谱M:DNA Marker;2、3、6、8、11、14:B型;1、4、9、10、13、15:C型;18:A型;16:D型;19:E型;17:G型;7:K型;5:M型;12:P型
3 讨论
近年来,随着碳青霉烯类药物的广泛使用,耐碳青霉烯肠杆菌科细菌(carbapenem-resistantEnterobacteriaceae, CRE)在世界范围内越来越普遍。中国细菌耐药性监测网CHINET监测结果[6]显示大肠埃希菌对亚胺培南的耐药率由2014年的0.9%上升到2019年的2.0%。另外CRE感染往往会引起较高的死亡率,Tamma et al[7]研究发现32%的CRE血液感染患者在14 d内死亡,因此,防控CRE的产生和传播意义重大。
5年间,本院CREC的检出率基本维持在低位水平,平均为1.17%,且分离至不同年份不同科室,ICU和烧伤科来源的菌株数量略高于其他科室,可能与这两个科室的患者病情常较重,大量抗生素的使用和进行过侵袭性操作有关。本研究中,尿液标本分离的CREC高于其他样本类型,与Tian et al[8]研究结果一致,这对临床医师治疗泌尿道感染提出了严峻的挑战,由于氨基糖苷类、喹诺酮类和碳青霉烯类药物通常用于治疗泌尿系统感染,而CREC对这几类药物往往表现出较高的耐药性。
到目前为止,CLSI先后推荐了MHT、Carba NP和mCIM作为碳青霉烯酶的表型筛选实验。MHT操作简单且成本低廉,对流行广泛的KPC具有很好的检测能力,但对新德里金属-β-内酰胺酶(NDM)、粘质沙雷菌型碳青霉烯酶(SME)和苯唑西林酶(OXA)的敏感性较低[9]。Carba NP通过测量细菌提取物对亚胺培南的体外水解情况来检测碳青霉烯酶,Carba NP对大多数碳青霉烯酶具有较好的敏感性,然而,在检测相对较弱的OXA型碳青霉烯酶时存在一定的局限[10]。mCIM是2017年CLSI推荐的一种用于筛选碳青霉烯酶表型的新型试验,有研究[11]表明mCIM筛选肠杆菌科细菌产碳青霉烯酶具有较高的特异性和敏感性。本研究中,34株产NDM的菌株只有22株MHT阳性,说明MHT对NDM型碳青霉烯酶的检测能力有限。71株CREC,mCIM阳性67株,阳性率94.4%,略低于闫玲 等[12]报道的阳性率100%。Carba NP阳性69株,仅有2株阴性,虽然Carba NP具有很好的检测效能,但是所需试剂准备繁琐、保质期较短,大规模流行病学筛查远比实验室小样本检测更能体现其优势。
产NDM细菌发现之初被称为“超级细菌”,可见其耐药情况严重,NDM能够水解几乎所有的β-内酰胺类抗生素,大肠埃细菌和肺炎克雷伯菌是blaNDM的主要携带者。目前世界范围内均发现NDM阳性菌株,尤以印度次大陆、中东和巴尔干地区的流行率最高[13]。一项关于CRE在国内流行情况的研究[14]显示,25个省、直辖市中,除北京、上海和四川外,NDM是CREC最常见的碳青霉烯酶。本研究中,43株CREC检出耐碳青霉烯基因,34株(34/43,79%)携带blaNDM,9株(9/34,21%)携带blaKPC-2,提示blaNDM是本院CREC主要携带的碳青霉烯酶基因,与全国绝大多数地区相一致。
ERIC-PCR是一种可靠、快速的基因分型方法,目前已广泛应用于细菌的流行病学研究。本研究使用该技术对71株CREC之间的遗传相关性进行研究,CREC被分为A-S共19个型别,没有发现优势型别,相同型别菌株所属科室较为分散,且分离年份未见集中现象。说明本院流行的CREC基因多态性较高,以散发为主。
