人/猪SERPING1同源性比较及猪SERPING1敲除细胞系的建立
2022-05-12朱晓晗刘晓蕊杨海元戴一凡
王 蒙,朱晓晗,刘晓蕊,李 琳,王 盈,杨海元,戴一凡
遗传性血管性水肿(hereditary angiodema,HAE)是一种罕见的,以皮肤和黏膜下肿胀为特征的潜在威胁生命的疾病,常见受累部位为面部、四肢、躯干、生殖道、上呼吸道和胃肠道[1]。1888年,William Osler确定遗传性血管性水肿为常染色体显性遗传病[2],表明编码补体C1抑制剂的基因突变是HAE发病的根本原因。经典的HAE是由于编码补体C1抑制剂的基因SERPING1突变造成[3],HAE-Ⅰ型患者,突变分布整个基因序列,HAE-Ⅱ型突变主要位于SERPING1第八号外显子,第八号外显子编码补体C1抑制剂的反应中心环。补体C1抑制剂的反应中心环为C1抑制剂与靶蛋白酶的结合位点,若编码该功能域序列的SERPING1第八号外显子突变则导致补体C1抑制剂的功能缺陷。因此,笔者选择敲除对应基因序列,用于建立疾病模型。
近年来,CRISPR/Cas9基因编辑技术由于操作简便,基因编辑效率高而引起广泛关注,已成功应用于基因修饰的猪等大动物模型构建[4-6]。猪的解剖结构与生理情况都与人的极其相似,被视为研究人类疾病的理想大动物模型。该研究拟利用CRISPR/Cas9建立SERPING1敲除细胞系,为后续构建SERPING1敲除克隆猪,模拟遗传性血管性水肿疾病奠定重要前期工作。
1 材料与方法
1.1 主要材料引物和磷酸化的寡核苷酸序列(金斯瑞公司);猪胎儿成纤维细胞(南京医科大学江苏省异种移植重点实验室) ;pX330质粒(Addgene 423230)、Bbs1限制性内切酶、Quick Ligase连接酶、DH5α感受态和质粒小提中量试剂盒(北京天根生化科技公司);Basic NucleofectorTMKits和细胞转染仪(德国Lonza公司);胰酶、胎牛血清、Penn/Strep双抗、DMEM培养基和PBS缓冲液(美国Gibco公司);T7E1酶(美国New England Biolabs公司);琼脂糖凝胶回收试剂盒(德国Qiagen公司);pMD18-T载体(日本Takara公司)。
1.2 实验方法
1.2.1人/猪SERPING1氨基酸序列同源性分析 使用Clustal软件对人和猪两个物种进行SERPING1氨基酸序列比对,比较分析SERPING1在人和猪上的同源保守性。
1.2.2人/猪SERPING1蛋白二级结构和三维结构的预测 利用SOPMA软件对人/猪SERPING1蛋白进行二级结构分析,预测了人/猪SERPING1蛋白α螺旋、β转角、延伸链、无规则卷曲的比例。采用Swiss Model软件(https://www.swissmodel.expasy.org/)进行SERPING1蛋白三维建模,比较人/猪的二级和三维结构的一致性。
1.2.3SERPING1-Exon8靶点设计和pX330-Exon8载体构建 参照NCBI上猪SERPING1序列,使用CRISPR在线设计软件(http://crispr.mit.edu/)在第八号外显子上设计一对20 bp的单导向RNA(single guide RNA,sgRNA)序列,5′末端加上磷酸化修饰,由金斯瑞公司合成。设计了两对sgRNA寡核苷酸序列,SERPING1-Exon8-Oligo1 F:5′-CACCGctctgtggcccgcagtttgc-3′,SERPING1-Exon8-Oligo1 R:5′-AA ACgcaaactgcgggccacagagC-3′,SERPING1-Exon8-Oligo2 F:5′-CACCGtcccagagcacgaaaaggaa-3′,SERPING1-Exon8-Oligo2 R:5′-AAACttccttttcgtgctctgggaC-3′。
接下来进行寡核苷酸链的退火、酶切、连接(参照http://www.genome-engineering.org/crispr/)首先将每条寡核苷酸链稀释为100 μmol/L,退火形成双链:正向Oligo 1 μl,反向Oligo 1 μl,去离子水8 μl,PCR程序:37 ℃,30 min;95 ℃,5 min;-5 ℃/min,降至25 ℃;4 ℃保持。BbsⅠ线性化的pX330载体与退火双链Oligo(稀释250倍)连接,然后转化到DH5α中,挑取单克隆菌落,测序公司验证。验证成功后使用试剂盒提取质粒,并用50%甘油保留菌种。
1.2.4细胞转染和阳性单克隆细胞的筛选和鉴定 细胞培养与转染:原代猪胎儿成纤维细胞(巴马小型猪,♂)复苏后培养在含16%胎牛血清的培养基中,长至对数生长期。使用细胞计数仪(Thermo CountessIIFL)测量细胞密度约4.7×106个/ml,配制转染液,共转染1 μg pX330-Exon8-1质粒和1 μg pX330-Exon8-2质粒,使用U-023核转程序。用2 ml培养基重悬转染后的细胞,分至10 cm培养皿中。隔天换用含G418(1 mg/ml)的培养基培养,观察细胞生长状态,据此调整培养基中G418浓度。
挑取单克隆细胞:转染后的细胞经过9 d的药筛,可观察到单克隆细胞群。显微镜下在10 cm培养皿的皿底标记单克隆细胞群的位置。吸出培养基,PBS清洗2遍,在合适的克隆环中加入0.25%的胰蛋白酶消化单克隆细胞群,用Eppendorf微量移液器移入24孔板中,将克隆转移时间及编号标记在孔板盖子上。
细胞传代和冻存:观察24孔板中的细胞状态,待细胞长满后消化传至12孔板,长满冻存。
提取冻存细胞基因组:留存在24孔板的细胞长满后,消化,离心,加入NP40裂解细胞,提取基因组。
TA克隆鉴定细胞基因型:PCR扩增目的片段,反应条件95 ℃,5 min;95 ℃,30 s;56.5 ℃,30 s;72 ℃,1 min;35个循环,总延伸72 ℃,7 min;切胶回收,连接到pMD-18T载体上,转化到DH5α感受态中,涂板。每个固体培养基挑取15个单克隆菌落,送到公司测序,比对敲除细胞基因型。
1.2.5T7E1酶切检测突变 提取转染细胞的基因组,扩增目的片段,对上述PCR产物进行琼脂糖凝胶电泳并切胶回收。T7E1酶切体系:取纯化产物5 μl,10 × NEBuffer 2.0 2 μl,Nuclease-free水12 μl,在PCR仪中进行退火反应,结束后各取9.5 μl退火产物,分别加入0.5 μl T7E1酶和去离子水,去离子水作为对照,37 ℃孵育15 min,加入Proteinase K 0.5 μl失活T7E1酶,采用1%琼脂糖凝胶电泳后分析结果。
2 结果
2.1 人/猪SERPING1氨基酸序列同源性分析结果人和猪蛋白的氨基酸序列比对显示,二者SERPING1氨基酸排列顺序相似性达到65.87%,人/猪SERPING1蛋白的同源性较高。见图1。

图1 人与猪SERPING1蛋白氨基酸同源性分析
2.2 人/猪SERPING1蛋白结构比对结果利用SOPAM(蛋白质结构预测软件)对人和猪SERPING1蛋白进行二级结构分析。其中预测到人SERPING1蛋白Alpha helix占39.60%,Beta turn占4.8%,Extended strand占15.20%,Random coil占40.40%。猪SERPING1蛋白Alpha helix占39.92%,Beta turn占3.87%,Extended strand占12.01%,Random coil占44.20%。由此推算,SERPING1蛋白二级结构在人和猪上一致性较高(图2A)。蛋白三维结构显示人/猪SERPING1相似(图2B)。生物信息学分析结果表明,人(Homo sapiens)和猪(Sus scrofa)SERPING1分子具有较近的亲缘关系,序列比对和结构分析具有高度的同源性,推测SERPING1在Homo sapiens/Sus scrofa的血浆接触级联系统发挥相近的生物学功能。

图2 人与猪SERPING1蛋白质二级,三维结构分析A:人/猪蛋白质二级结构比较;B:人/猪蛋白质三维建模结果对比;蓝色:α螺旋;绿色:β转角;红色:延长链;黄色:无规则卷曲
2.3 重组打靶载体测序pX330载体上连接SERPING1基因靶点sgRNA序列。5′-ACTATCATATGCTTAC-3′为U6启动子序列(图3A)。重组载体pX330上成功插入SERPING1Exon8的靶点sgRNA序列(图3B)。
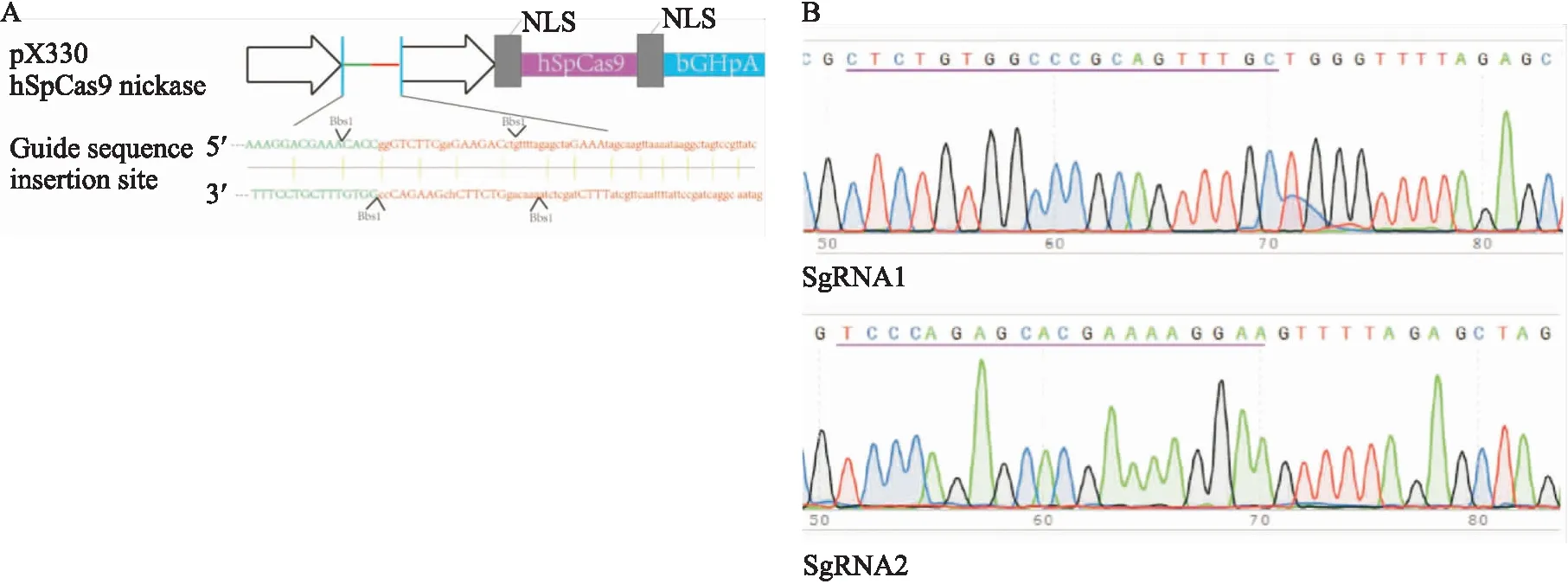
图3 重组载体的构建与测序A:Cas9骨架载体pX330图谱,Bbs1酶切位点;B:重组载体测序图
2.4SERPING1基因敲除情况的验证转染pX330-Exon8-1和pX330-Exon8-2载体的猪胎儿成纤维细胞对应的PCR产物目的条带下面有被剪切过的片段条带。验证了第八外显子靶点发生了碱基的突变。见图4。
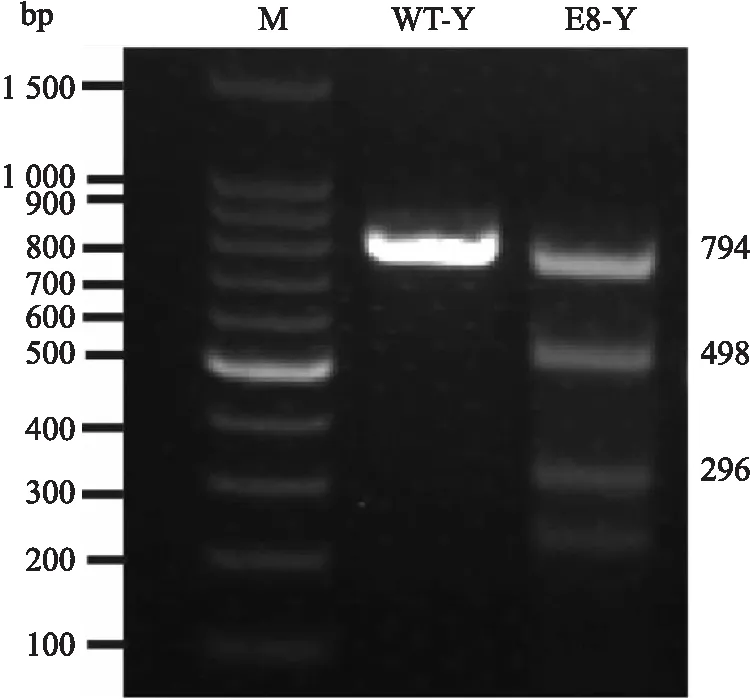
图4 两个sgRNA敲除情况验证M:100 bp marker;WT-Y:加入T7E1酶的野生型基因组;E8-Y:加T7E1酶的第八外显子敲除基因组
2.5SERPING1敲除细胞系的基因型鉴定共获得44个单克隆,进行TA克隆测序。PCR所用的引物如下,F:5′-AACTTGGGAGCAACCCAGAAA-3′,R:5′-TCACAGGGAAGGGATGGTAGA-3′。测序结果显示SERPING1基因的第八外显子靶点区域为缺失突变。其中,最常出现的突变类型为缺失29个碱基。见图5。
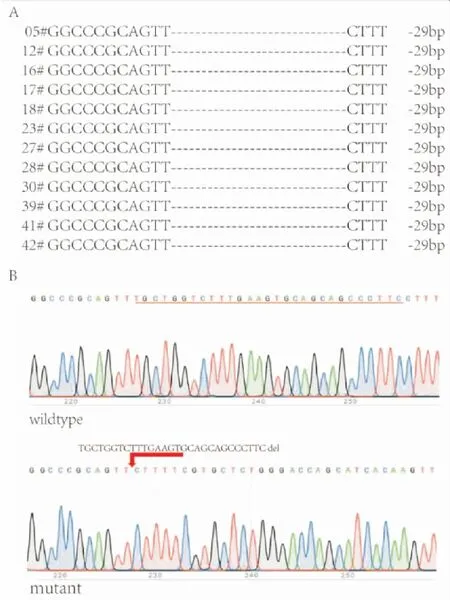
图5 单克隆细胞在目的sgRNA位点的缺失情况
3 讨论
遗传性血管性水肿是一种罕见遗传病,发病率为1/50 000至1/10 000[7],会导致水肿(肿胀)反复发作。因喉部水肿导致呼吸道梗阻患者窒息,引起广大临床工作者的重视。但目前因为其比较罕见,导致医务工作者对其认知还不透彻,易被误诊为其他疾病。并且我国目前还没有新型治疗药物,所以急需动物模型,对其发病机制有更进一步的了解并据此研制新型治疗药物缓解患者的痛苦[8]。现有的研究[9-10]显示HAE的发病机制除了与C1INH有关,第三型遗传性血管性水肿还与凝血因子FXII有关,第四型还与其他蛋白酶有关。将来有必要进一步探索不同类型的发病机制。
本研究重点关注与C1INH有关的一型和二型HAE,有关SERPING1单基因敲除的克隆鼠虽有报道[11],但无法复制人遗传性血管性水肿表型,以巴马小型猪胎儿成纤维细胞为材料,通过CRISPR/Cas9技术构建SERPING1-/-细胞系。首先通过生物信息学分析表明,猪的SERPING1蛋白无论是在氨基酸排列顺序、二级结构、三维空间上都与人具有较高的相似性,并且其生物特征更贴合人类,所以猪是构建HAE的理想模型。CRISPR/Cas9的深入研究使得该技术成为动植物基因功能研究和建立动物细胞系[12-14]主要手段,因此本实验也选择该技术作为主要研究手段。
目前已发现超过450种与补体C1抑制剂缺乏致遗传性血管性水肿相关的基因突变[15],集中于SERPING1的第八号外显子。因此,选择在第八号外显子上设计打靶载体,通过测序验证敲除的基因型,发现敲除的形式比较稳定,均为靶点附近29 bp的缺失,若用于后续模型的构建,动物的表征一致,方便分析。共挑选了44个细胞克隆,经鉴定产生了12个敲除成功的单克隆细胞系,敲除效率较高,敲除单个基因是可能的原因之一,且在这基因上同时设计两个打靶载体也有效地提高了基因编辑效率。
本研究利用CRISPR/Cas9技术成功制备了SERPING1-/-猪胎儿成纤维细胞系,为后续构建SERPING1-/-巴马小型猪遗传性血管性水肿模型,以及研究相关机制提供了重要的供体细胞。
