RAGE抑制剂FPS-ZM1对db/db小鼠抑郁的影响及机制
2022-05-12朱延东周晓燕
朱延东,李 艳,周晓燕
糖尿病伴随抑郁症是身体/精神共病的典型病例,糖尿病患者伴抑郁症的发病率是非糖尿病患者的两倍[1]。目前临床上多应用抗抑郁药和降糖药来治疗糖尿病患者的抑郁样症状,但是效果不明显且副作用大[2]。因此,寻找有效的治疗糖尿病抑郁的药物尤为重要。海马是调控情绪和认知的功能脑区,海马区炎症和神经元损伤与糖尿病抑郁发生发展密切相关[3]。晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)是糖尿病多种并发症的关键因子。海马区RAGE表达显著增加,激活其相关信号通路,损伤海马神经元突触传递,是焦虑和抑郁等精神行为异常的关键因素[4-5]。该研究通过腹腔注射RAGE抑制剂FPS-ZM1,观察其对2型糖尿病模型鼠db/db小鼠抑郁样行为,海马神经元凋亡和NOD样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性小体的影响,明确FPS-ZM1对db/db小鼠抑郁行为的影响及分子机制,能够为治疗糖尿病抑郁症状提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1主要试剂 TUNEL试剂盒购自江苏凯基生物技术股份有限公司(货号:KGA703),BCA蛋白浓度测定试剂盒(增强型)(货号:P0010S)和免疫印迹制胶试剂盒(货号:P0012A)购自上海碧云天生物技术有限公司,RAGE抗体(货号: SC-365154)购自美国Santa Cruz公司;NLRP3抗体(货号: NBP2-12446)购自美国Novus公司;白介素-1β (Interleukin-1β, IL-1β)抗体(货号: 16806-1-AP)和半胱氨酸蛋白酶-1 (cysteinyl aspartate specific proteinase-1, Caspase-1) 抗体(货号: 22915-1-AP)均购自美国Proteintech公司。其他化学试剂均购自上海国药试剂有限公司。
1.1.2实验动物 5~7 周龄2型糖尿病模型小鼠db/db及对照杂合子db/m 小鼠均购于南京大学模式动物研究所,并于徐州医科大学实验动物中心的SPF屏障系统内进行无菌饲料和无菌水喂养。小鼠适应性喂养1周后开展实验。
1.2 方法
1.2.1实验分组 6~8周龄雄性db/db小鼠24只,随机分为2型糖尿病组(db/db,不予任何处理)、糖尿病给药组[db/db+FPS,db/db小鼠腹腔注射FPS-ZM1 1.0 mg/(kg·d)]、糖尿病溶剂对照组(db/db+Oil,db/db小鼠腹腔注射同等体积的玉米油),每组8只。6~8周龄的雄性db/m小鼠8只作为正常对照。给药12周后,进行行为学检测,然后处死取脑。
1.2.2悬尾实验(tail suspension test, TST)[6]将小鼠尾部悬挂于离地面40 cm的实验杆上,2 min适应后,Any Maze软件系统摄像头追踪小鼠头部,记录4 min内小鼠不动时间。
1.2.3强迫游泳实验(forced swimming test, FST)[7]将直径45 cm、19 cm的玻璃容器内盛水,水温22~25°C,液面高度23 cm。将小鼠放入容器中适应2 min后,Any Maze软件系统摄像头追踪小鼠头部,记录 4 min内不动时间。
1.2.4海马蛋白的提取和浓度测定 1.5%的戊巴比妥(0.6 ml/g)腹腔注射麻醉小鼠,每组4只小鼠,然后迅速断头取脑,剥离出小鼠双侧海马放于EP管中。按照胞质蛋白提取试剂盒加入600 μl的匀浆液,冰上匀浆后,12 000 r/min,离心10 min,吸取上清液,即为胞质蛋白。然后使用BSA蛋白检测试剂盒进行浓度测定。根据所测各样本浓度,取相同的样本量,补充匀浆液至相同的体积。加入4 × Loading buffer,充分混匀后沸水煮10 min,使蛋白完全变性,放入-20 ℃冰箱内待用。
1.2.5海马脑片准备和TUNEL染色 将每组4只小鼠麻醉后,用4%的多聚甲醛灌注 20 min后,取脑剥离后固定,脱水透明后修剪脑块并进行石蜡包埋。脑片冠状缝切片,厚度5 μm,脱蜡至水后按照TUNEL试剂盒说明书的步骤进行染色。首先滴加proteinase K工作液37 ℃反应30 min,PBS漂洗3次,每个脑片加入50 μl标记液(TdT和dUTP混合液),室温30 min后加50 μl TUNEL反应混合液,37 ℃避光反应1 h。PBS常规漂洗3次,滴加50 μl DAB工作液反应5 min,PBS漂洗3次后复染封片。Olympus DP73正置显微镜下观察细胞形态,凋亡神经元着色较深,体积变小,细胞核皱缩或溶解,细胞质染色质分割成块状或出现点状的凋亡小体。计数小鼠海马CA3区1 mm2面积中神经元的凋亡率。
1.2.6免疫印迹法检测RAGE、NLRP3、IL-1β、Caspase-1以及Actin的表达 根据蛋白的分子量配置10%(RAGE、IL-1β及Caspase-1)和8%(NLRP3)的电泳凝胶。每孔上样10~20 μl(含蛋白量40~80 μg),常规电泳和电转。NC膜在3% BSA中封闭3 h后,浸泡在合适比例的一抗(RAGE:1 ∶3 000;NLRP3:1 ∶3 000;IL-1β:1 ∶2 000;Caspase-1:1 ∶2 000)中,4 ℃孵育过夜。次日Washing Buffer震荡洗涤5次后,荧光二抗(1 ∶3 000)室温摇床孵育1 h后,Odyssey化学发光扫描系统扫描条带。使用Image J软件进行蛋白条带的灰度值分析,计算各组目的蛋白与Actin灰度值的比值,再将各组获得的比值与对照组(db/m)相比作为各组的相对表达量。
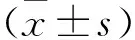
2 结果
2.1 RAGE抑制剂FPS-ZM1改善db/db小鼠抑郁样行为FPS-ZM1注射12周后,应用TST和FST检测小鼠抑郁症状。结果显示:db/db小鼠在TST和FST中的不动时间(95.25 ± 8.4,103.40 ± 7.9)显著高于db/m小鼠(57.10 ± 5.8,67.13 ± 6.6)(F=22.52、15.16 ,P<0.01);FPS-ZM1能减少db/db小鼠在TST和FST中的不动时间 (76.27 ± 7.2,82.26 ± 7.7)(F=22.52、15.16,P<0.01)。表明FPS-ZM1能改善糖尿病小鼠的抑郁样行为。见图1。
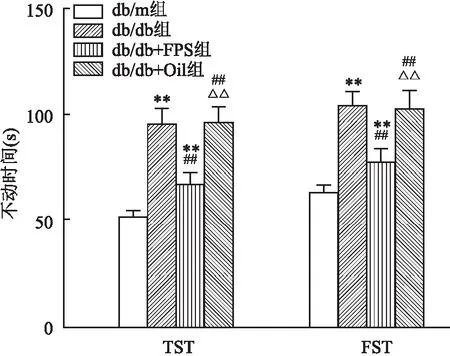
图1 FPS-ZM1改善db/db小鼠的抑郁样症状(n=8)与db/m组比较:** P<0.01;与db/db组比较:## P<0.01;与db/db+FPS组比较:△△P<0.01
2.2 RAGE抑制剂FPS-ZM1减少db/db小鼠海马神经元凋亡应用TUNEL法检测海马神经元的凋亡率,结果显示:db/db小鼠海马CA3区神经元凋亡率高于db/m组(F=80.93,P<0.01);应用FPS-ZM1后降低db/db小鼠海马区神经元的凋亡(F=80.93,P<0.01)。表明FPS-ZM1能减少高血糖引起的海马神经元凋亡。见图2。
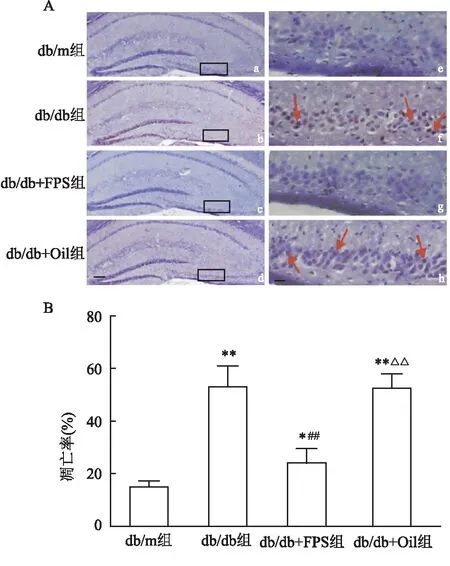
图2 FPS-ZM1减少db/db小鼠海马神经元凋亡(n=8)A:海马切片TUNEL染色的典型图片;e-h:a-d中的黑框区域放大图;a-d:×40;e-h:×400;红色箭头:凋亡细胞;B:海马CA3细胞凋亡率的统计图;与db/m组比较:*P<0.05, **P<0.01;与db/db组比较:## P<0.01;与db/db+FPS组比较:△△P<0.01
2.3 RAGE抑制剂FPS-ZM1减少db/db小鼠海马区RAGE和NLRP3的表达免疫印迹结果显示:db/db小鼠海马区RAGE的表达增加(F=24.02,P<0.01),而FPS-ZM1能够降低db/db小鼠海马区RAGE的高表达(F=24.02,P<0.01)。db/db小鼠海马区NLRP3的表达增加(F=28.14,P<0.01),而FPS-ZM1能够降低db/db小鼠海马区NLRP3的表达(F=28.14,P<0.01)。表明FPS-ZM1能下调高血糖引起的RAGE高表达以及其下游炎性小体的活化。见图3。
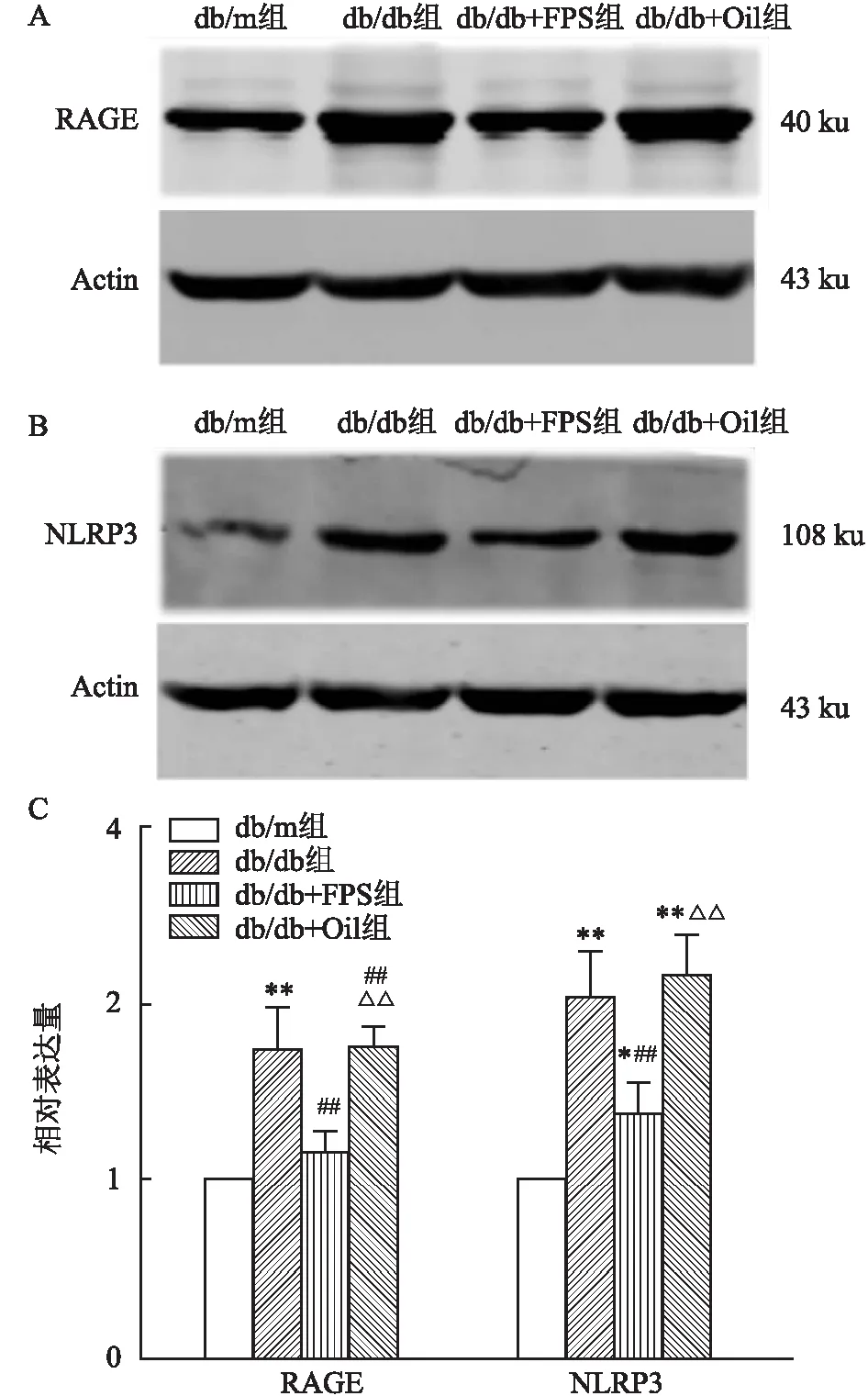
图3 FPS-ZM1抑制db/db小鼠海马中RAGE和NLRP3的水平(n=4)A、B:免疫印迹实验检测RAGE、NLRP3的表达;C:各组RAGE和NLRP3相对表达量的统计图;与db/m组比较:*P<0.05, ** P<0.01;与db/db组比较:## P<0.01;与db/db+FPS组比较:△△P<0.01
2.4 RAGE抑制剂FPS-ZM1减少db/db小鼠海马区Caspase-1和IL-1β的活化免疫印迹结果显示:db/db小鼠海马区IL-1β的表达高于db/m小鼠(F=27.06,P<0.01),而FPS-ZM1能降低高血糖引起的IL-1β高表达(F=27.06,P<0.01),而db/m组、db/db组、db/db+FPS组以及db/db+Oil组中IL-1β的前体蛋白pro-IL-1β的表达没有差异;db/db小鼠海马区Caspase-1的表达高于db/m小鼠(F=193.90,P<0.01),同样,FPS-ZM1能降低Caspase-1的高表达(F=193.90,P<0.01),而Caspase-1的前体蛋白pro-Caspase-1的表达各组间无明显差异。表明FPS-ZM1能抑制高血糖引起的NLRP3炎性小体的活化。见图4。
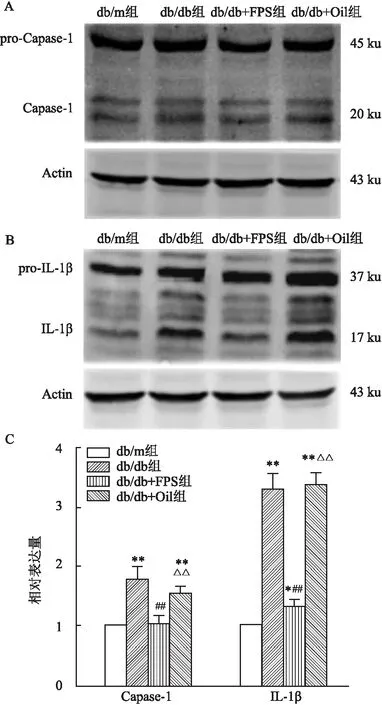
图4 FPS-ZM1降低db/db小鼠海马区Caspase-1和IL-1β的表达(n=4)A、B:免疫印迹法检测Caspase-1、IL-1β的表达水平;C:Caspase-1和IL-1β的相对表达量的统计图;与db/m组比较:*P<0.05, ** P<0.01;与db/db组比较:##P<0.01;与db/db+FPS组比较:△△P<0.01
3 讨论
糖尿病和抑郁共病会导致患者生活质量显著降低,同时也给糖尿病患者的家庭以及全社会造成严重的经济负担。目前关于糖尿病引起抑郁症状发生发展的分子机制尚未完全阐明,临床尚缺乏有效的治疗措施。因此,深入探讨糖尿病引起抑郁行为的分子机制,能够为研发治疗糖尿病抑郁的药物提供可靠治疗靶标。研究[8]显示海马CA3区是调控情绪的关键功能脑区,CA3区神经元的损伤和神经突触连接障碍是抑郁发生发展的重要原因。此外,高血糖引起的脑内炎症因子表达增加,也在糖尿病神经系统并发症以及精神行为异常中扮演着重要角色。炎症反应引起海马区小胶质细胞和星型胶质细胞的激活,介导凋亡启动子Caspase-3的活化,进而导致海马神经元损伤,引起糖尿病小鼠认知障碍、焦虑、抑郁等精神行为异常[9-10]。
NLRP3炎性小体是由NLRP3蛋白、凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)以及Caspase-1前体蛋白(Pro-caspase-1)共同组成的一个炎性复合体。该炎性小体活化后可引起Pro-caspase-1剪切活化成Caspase-1,进而使IL-1β前体也发生剪切,形成有活性的IL-1β。Caspase-1和IL-1β活化后从胞质释放到胞外,引起局部的炎症反应[11-12]。既往的研究[13]显示,高血糖可活化小鼠海马区NLRP3,导致Caspase-1和IL-1β等下游炎症介质释放增加,进而通过多种机制促进糖尿病小鼠认知障碍、行为异常和抑郁样症状。敲除NLRP3或抑制NLRP3炎性小体的活化,都能够减轻神经炎症,改善高血糖引起的行为异常和抑郁样症状。
研究[14]证实,高糖刺激引起海马区RAGE表达显著增加。RAGE作为上游信号分子,可通过激活NLRP3炎性小体和其他凋亡信号通路,引起海马神经元损伤,导致神经突触连接障碍。因此RAGE是糖尿病神经抑郁及其他神经系统并发症发生发展的关键因素。敲除RAGE,能够抑制糖尿病小鼠海马区丝裂原激活的蛋白激酶/MAP激酶(mitogen-activated protein kinase, MAPK)信号通路,改善海马神经元的长时程增强(long-term potentiation, LTP),提高糖尿病小鼠的认知功能[15]。此外应用RAGE特异性抑制剂FPS-ZM1能显著抑制高糖环境中RAGE的表达,抑制神经炎症反应,降低糖尿病小鼠海马神经元损伤,提高神经纤维的密度,改善海马依赖性的空间学习记忆能力[5]。因此RAGE与糖尿病神经系统并发症密切相关,其抑制剂FPS-ZM1能够减轻高糖刺激引起的海马神经元损伤。但是FPS-ZM1是否能够改善糖尿病抑郁,以及其减轻抑郁的分子机制仍需进一步探明。
本研究以2型糖尿病模型鼠db/db小鼠为糖尿病-抑郁共病模型,应用行为学、组化和免疫印迹实验,阐明了RAGE抑制剂FPS-ZM1改善糖尿病抑郁的分子机制:FPS-ZM1通过下调海马区RAGE的表达,减少其下游NLRP3炎性小体的活化,进而抑制高血糖引起的海马神经元凋亡,减轻糖尿病小鼠抑郁。该分子机制的阐明对研发治疗糖尿病抑郁的药物提供了可靠的理论依据。
