PTG重组腺病毒过表达载体的构建
2022-05-12王晨玺赵志聪蔡珍生张盼盼李昊翔袁国跃
王晨玺,邓 霞,赵志聪,蔡珍生,张盼盼,李 莲,李昊翔,赵 丽,王 东,杨 玲,袁国跃
PTG隶属于蛋白质磷酸酶1(protein phosphatase 1,PP1)家族,编码调节亚单位3C。PP1全酶由一个催化亚基和一个调节亚基组成[1],通过催化已经磷酸化的蛋白质分子去磷酸化而发挥作用[2]。GenBank显示,PTG在人类和小鼠中分别定位于10号及19号染色体,cDNA全长1 499 bp,编码285个氨基酸残基。PTG在小鼠多种组织器官中均有表达,参与宫颈癌、肾细胞癌和前列腺癌[3-5]等肿瘤的发生与发展,并能够在肝细胞中显著增加糖原的合成与储存[6],参与全身能量代谢调控[7]。Lu et al[8]研究发现,PTG沉默可降低空腹血糖和胰岛素水平,改善胰岛素敏感性,在糖原和脂质能量平衡中起桥梁作用。该研究旨在构建并鉴定小鼠 PTG基因重组过表达腺病毒载体,为深入研究PTG的功能及其在糖脂代谢中作用的具体机制提供实验基础。
1 材料与方法
1.1 材料
1.1.1细胞及菌株 本实验所用的HEK293T细胞系由上海交通大学附属瑞金医院内分泌科实验室同仁惠赠。
1.1.2工具酶及主要试剂 本课题组从上海吉凯基因化学技术有限公司购入质粒载体pDC315、GV314 载体体系、pCDNA3.1及BamHⅠ/AgeⅠ内切酶。本实验中所用到的其他限制性内切酶从NEB公司购买;1 kp DNA标准参照物从Fermentas公司购买;250 bp DNA标准参照物从捷瑞公司购买;In-FusionTMPCR克隆试剂盒由Clontech公司提供;Taq聚合酶由Sino Bio公司提供;dNTP购自TaKaRa公司。本实验中所用的质粒抽提试剂盒由Promega公司提供,上海捷瑞生物工程公司合成及提供本实验所用全部引物。质粒的测序工作由美季生物技术公司完成,琼脂糖凝胶DNA回收试剂盒由北京天根生化公司提供。TRIzol 购自美国Invitrogen公司,逆转录试剂盒以及荧光定量试剂盒购自诺唯赞公司。RIPA、蛋白酶抑制剂以及BCA蛋白定量试剂盒购自碧云天公司。DMEM及谷氨酰胺购自Gibco公司,胎牛血清及含有Flag标签的一抗购自Sigma公司,二抗购自Santa Cruz公司。
1.2 方法
1.2.1含有小鼠PTG基因质粒的构建 首先,从293T细胞中提取总RNA,按照反转录试剂盒说明书对总RNA进行反转录反应,得到cDNA。根据基因库中公布的小鼠PTG基因(NM_016854)全长的mRNA序列,运用Primer premier 5.0 软件设计PTG克隆引物,交由生工生物工程有限公司合成,将该引物含有的目的基因5′ 端部分序列用于PCR钓取目的基因,上游序列:5′-AGGTCGACTCTAGAGGATCCCGCCACCATGAGCTGCACCAGAATG-3′;下游序列:5′-TCCTTGTAGTCCATACCTCGATAGGAGGTCA AGTTC-3′。进行PCR扩增后得到目的基因片段,BamH Ⅰ/Age Ⅰ 酶切后,将其连接至质粒载体p CDNA3.1(-)。反应条件:5 μl 10×缓冲液,0.5 μl 100×BSA,2 μl纯化的DNA质粒(浓度为1 g/L),1 μl BamH Ⅰ(浓度为20 U/μl),1 μl AgeⅠ(浓度为20 U/μl),最后加双蒸水40.5 μl将总体系补足至50 μl。此后将按以上步骤混合得到的反应物放置于37 ℃环境中,时间为2 h。
1.2.2重组穿梭质粒pGV314-PTG的构建 将酶切后的产物交换入线性化表达载体GV314中得到重组穿梭质粒pGV314-PTG。BamH Ⅰ/Age Ⅰ 酶切载体GV314进行线性化,之后将酶切得到的产物与目的基因产物片段进行交换,反应体系如下:2 μl线性化载体DNA(浓度为100 mg/L),2 μl目的基因产物(浓度为100 mg/L),0.5 μl In-Fusion交换酶,2 μl 10×交换酶缓冲液,13.5 μl双蒸水。于25 ℃条件下反应30 min,42 ℃条件下反应15 min。转化细菌感受态细胞DH5α,随后将其转移到含有相应抗生素的LB琼脂平板上倒置培养,培养条件为 37 ℃,计时16 h。对长出的菌落用PCR法进行鉴定,将空载设置为阴性对照组,将纯化的GAPDH基因的PCR产物设置为阳性对照组。GV314载体PCR引物序列如下,上游序列为5′-AGCTTTGAGAAGAAGGTTCAGG-3′,下游序列为5′- CCTTATAGTCCTTATCATCGTC-3′。反应体系:1 μl模板,上游和下游引物(浓度为10 μmol/L)各0.4 μl,4 μl 5×Taq缓冲液,1.6 μl d NTPs(浓度为2.5 mmol/L),0.2 μl Taq聚合酶,12.4 μl双蒸水。反应条件:在94 ℃条件下预变性3 min,94 ℃条件下变性30 s,60 ℃条件下退火30 s,72 ℃条件下延长40 s,再次稳定延伸5 min,将此过程循环30次。随后将PCR后得到的产物进行琼脂糖凝胶电泳, PCR产物约为481 bp,之后进行阳性菌接种,放置于37 ℃的环境中培养16 h。随后利用甘油菌对其进行保存,并分装200 μl以待进行后续的测序和比对分析。
1.2.3腺病毒质粒同源重组及鉴定 用含有EDTA的0.25%胰酶消化处于对数生长期的HEK293T细胞,以得到细胞悬液,接种于24孔培养板中,细胞数为4×105个/孔。置于培养箱中常规培养,培养条件为37 ℃、5%CO2。待细胞的融合度达到50%~60%时,利用LipofectamineTM2000转染试剂将pGV314-PTG与辅助包装质粒pDC315共转染至HEK293T细胞中。在转染之前的2 h换液,将原先的旧培养基更换为不含血清的培养基,细胞换液2 h后开始转染。将DNA 溶液与不含血清的培养基混合均匀,二者混合液总体积为50 μl,其中DNA溶液包含5 μg穿梭质粒及5 μg辅助质粒,混合后置于室温条件下温育5 min。将上述混合后的50 μl培养基与10 μl LipofectamineTM2000混合,再次置于室温条件下温育5 min。将前述稀释后得到的DNA溶液与LipofectamineTM2000混合均匀,注意动作轻柔,避免振荡,随后放置于室温条件下温育20 min,以便形成DNA/Lipofectamine 2000TM转染复合物。在HEK293T细胞培养液中缓慢滴加前述转染复合物并将其混合均匀,随后放置于细胞培养箱中培养,培养条件为37 ℃、5%CO2。于培养箱中培养6 h后将含有转染混和物的原有旧培养基弃去,向其中加入PBS溶液2 ml,轻柔晃动,洗去残余的转染混合物后将溶液倒弃,再向其中缓慢加入5 ml含有10%血清的细胞培养基,放置于细胞培养箱中继续培养,培养条件为37 ℃、5%CO2,注意每天定期观察转染后细胞的生长状况,如果发现有培养基明显发黄的情况,需酌情向其中补加适量的新鲜培养液。最后,利用Cre/Lox P重组酶系统的作用以产生重组过表达腺病毒,并将该重组过表达腺病毒命名为Ad-PTG。成功转染之后24 h可通过荧光显微镜观察到细胞内增强型绿色荧光蛋白(EGFP)的表达情况,转染之后36 h收集细胞并用相应试剂提取总蛋白,以待后续进行Western blot检测。
1.2.4重组过表达腺病毒的包装、扩增与纯化 用PacⅠ 酶切线性化Ad-PTG质粒,并进行抽提以及乙醇沉淀回收等步骤后测定其含量与纯度,将其转染至HEK293T细胞中,放置于细胞培养箱中常规培养,培养条件为37 ℃、5%CO2,此后每日观察转染后细胞的状态及生长情况。持续观察约10~15 d,待大部分细胞出现肿胀、变圆、坏死等典型的细胞病变效应(cytopathic effect,CPE),且有约50%的细胞脱壁现象出现时,提示腺病毒包装成功。用低速离心方法收集细胞,吸取2 ml的 DMEM并将收集的细胞重悬于其中,在液氮和37 ℃水浴的条件下将此前制成的细胞悬液反复冻融4次后,于4 ℃以7 900 r/min低温离心5 min,离心后产物有明显的分层,收集离心后的病毒上清液,将其放置于-80 ℃冰箱中保存。用上述方法反复感染和收集之后,取病毒上清液再一次感染HEK293T细胞,从而可以实现数轮扩增的目的。
用Adeno-XTM病毒纯化试剂盒按照步骤将最终收集到的PBS重悬病毒上清液纯化重组过表达腺病毒,分装已纯化的重组过表达腺病毒,放置于 -70 ℃ 冰箱中保存以备后续使用。
1.2.5终点稀释法测定腺病毒滴度 对已获得的纯化重组过表达腺病毒进行滴度测定,具体采用的方法为终点稀释法,在实验开始前24 h于96孔板中接种HEK293T细胞(细胞数每孔约1×103个)。倍比稀释重组过表达腺病毒液至10-6~10-13,并用其感染HEK293T细胞,随后将细胞放入培养箱中常规培养。培养期间持续观察细胞CPE病变的情况,并对细胞CPE病变孔进行计数,计算出每一行的阳性率。用Spearman-Karber Method计算所测样本的病毒颗粒滴度,公式如下:病毒样品的滴度=10(x+0.8) (PFU/ml),其中x为10-1~10-13中所有稀释度下细胞CPE病变阳性率的总和。
1.2.6荧光定量PCR 将成功构建的Ad-PTG转染HEK293T细胞48 h后,收集细胞,并使用TRIzol试剂提取细胞总RNA, 后使用逆转录试剂盒对RNA进行逆转录反应得到相应cDNA并进行荧光定量PCR实验。用GraphPad 8.0.1分析结果。
1.2.7Western blot实验 将成功构建的Ad-PTG转染HEK293T细胞48 h后收集细胞,提取蛋白并测定其浓度。配制10%分离胶和5%浓缩胶,将之前所提取的蛋白样品及蛋白标准参照物按照实验设计的顺序依次在相应泳道上样。首先设定电压为90 V,20~25 min待样品跑至下层胶后,调整电压至120 V,继续恒定电压电泳1 h左右待样品跑至底部。将PVDF膜置于甲醇中激活约1 min,随后把PVDF膜、滤纸和电泳后的凝胶按照装配要求组装成三明治结构,固定放置于转膜装置内,并于4 ℃恒定电流120 mA转膜4 h。转膜后的PVDF膜完全浸没于5%脱脂奶粉封闭液中,在摇床上于室温条件下低速封闭1 h。封闭结束后裁剪至合适大小,浸没于一抗(1 ∶1 000)稀释液中,于4 ℃环境中摇床低速孵育过夜。一抗孵育结束后用1×TBST缓冲液洗涤,将PVDF膜浸没于二抗(1 ∶5 000)稀释液中摇床室温下孵育1 h。1×TBST缓冲液中洗涤后用ECL发光液曝光以待后续分析。
1.3 统计学处理采用SPSS 25.0及GraphPad 8.0.1统计分析软件对实验数据进行单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PCR扩增PTG目的片段酶切连接目的基因的p CDNA3.1质粒,PCR扩增并进行琼脂糖凝胶电泳(图1),结果显示:在995 bp附近处有亮带,与目的基因片段长度一致,表明带有PTG基因的p CDNA3.1 质粒构建成功。
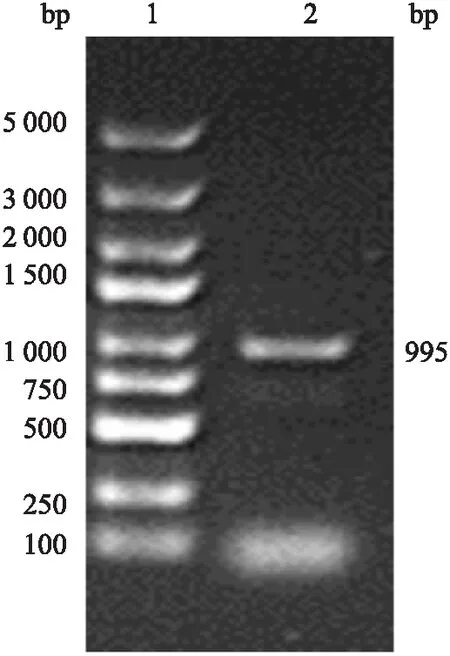
图1 PTG目的片段电泳图1:DNA标准参照物;2:PCR产物
2.2 重组穿梭质粒p GV314-PTG的PCR鉴定运用In-Fusion克隆技术得到p GV314-PTG的重组穿梭质粒,采用随机的方法从中挑选出8个阳性单克隆菌,并用菌斑PCR技术对其进行鉴定及验证(图2)。
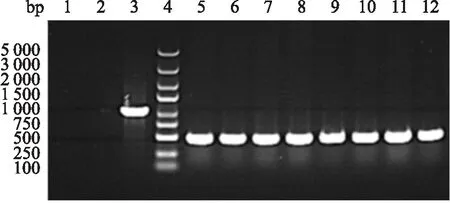
图2 PCR鉴定p GV 314-PTG重组穿梭质粒8个阳性克隆1:阴性对照(双蒸水);2:阴性对照(空载自连对照组);3:GAPDH;4:DNA标准参照物;5~12:1~8号转化子
2.3 重组质粒Ad-PTG的测序鉴定将鉴定出的阳性克隆转化子接种于LB液体培养基中,放于37 ℃培养箱常规培养12~16 h,取适量菌液送至上海生工生物工程有限公司,由其进行测序鉴定,经比对后证实与GenBank上的目标序列完全一致(图3)。

图3 部分重组穿梭质粒序列对比结果
2.4 重组质粒Ad-PTG的蛋白表达将p GV314-PTG与质粒p DC315转染HEK293T细胞,转染24 h后出现EGFP表达(图4),转染36 h后用Western blot法检测到在37 ku处有特征性条带(图5)。其大小与目的蛋白大小一致,说明重组蛋白融合表达正确。
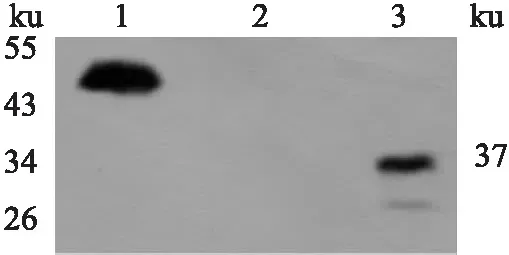
图5 蛋白质印迹鉴定重组质粒Ad-PTG转染HEK293T细胞PTG的表达1:阳性对照组;2:SURVIVIN-3FLAG-GFP蛋白表达组;3:Ad-PTG转染组
2.5 重组获得过表达腺病毒Ad-PTG及滴度测定重组过表达腺病毒质粒转染HEK293T细胞10~15 d时,细胞部分出现CPE细胞病态反应,细胞病变范围渐渐增大,部分细胞逐渐从培养皿上脱落,提示已经成功包装重组过表达腺病毒。反复感染,收集细胞并冻融数次后,收集到大量的病毒上清液,纯化重组过表达腺病毒,经终点稀释法计算得到病毒滴度值为4×1010PFU / ml。
2.6 重组过表达腺病毒上调肝细胞中PTG的表达将成功构建的Ad-PTG转染HEK293T细胞48 h后,收集细胞,荧光定量PCR和Western blot结果显示,与正常对照组相比,Ad-PTG组PTG的mRNA和蛋白表达水平显著升高(P<0.05)(图6)。
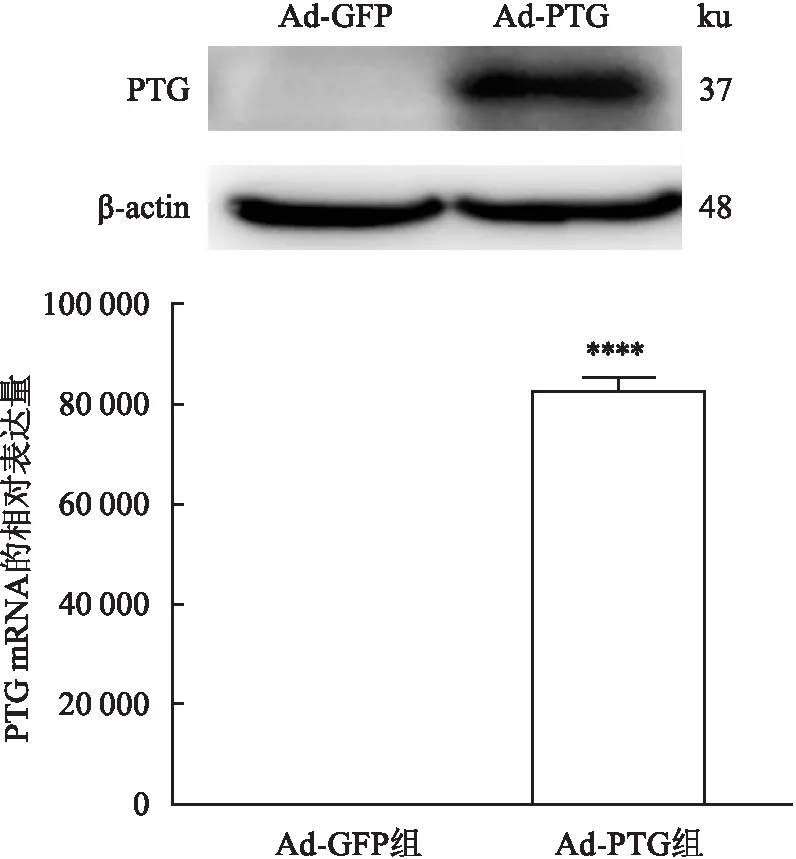
图6 PTG重组过表达腺病毒的验证与Ad-GFP组比较:****P<0.000 1
3 讨论
糖尿病是一种由多种原因引起的慢性高血糖为特征的代谢性疾病,其中90%为2型糖尿病。迄今为止,2型糖尿病已经发展成为以高血糖为主要特征的全球性公共卫生问题。肝脏胰岛素抵抗是2型糖尿病发病机制的主要环节[9],胰岛素抵抗是指细胞不能有效利用胰岛素,即施以正常剂量的胰岛素之后仅能产生低于正常生物学效应的一种异常生理状态,包括胰岛素的靶器官对胰岛素的敏感性和(或)反应性下降。胰岛素抵抗最明显的病理生理特点包括糖原分解功能、糖异生以及脂代谢环节发生紊乱,进而导致肝糖输出增多和肝脏脂肪的积聚。因此,有效地抑制肝脏葡萄糖的产生与输出以及减少肝脏脂肪的积聚,是治疗胰岛素抵抗与2型糖尿病的重要靶标之一,深入探求肝脏糖代谢与脂代谢调控的分子机制已成为当前的研究热点。
在本课题组前期进行的芯片筛选中,PTG引起了本课题组的注意。众所周知,蛋白质磷酸化在调节肝脏糖异生中起着关键作用。PP1是在真核细胞中丰富表达的一种磷酸酶,其可通过催化已经磷酸化的蛋白质分子发生去磷酸化而发挥作用[2]。在调节糖原代谢中,催化亚基PP1C通过一组糖原靶向调节亚基(G亚基)锚定于糖原颗粒,通过PP1介导的去磷酸化调节糖原代谢酶的活性[1, 10-11]。根据GenBank数据库数据显示,有7个编码G亚基的基因,PTG基因是其中的一种,编码蛋白磷酸酶1调节亚单位3C,其在糖代谢与脂代谢中发挥重要的调控作用[4]。PTG不仅可将PP1定位于糖原颗粒,还可直接与糖原合酶和磷酸化酶结合,从而实现糖原代谢的有效调控[12]。进一步研究还发现,PTG基因杂合缺失的小鼠,这些小鼠的脂肪组织、肝脏、心脏和骨骼肌中的糖原储存减少,相应的糖原合酶活性以及糖原合成率降低[7]。此外,PTG沉默小鼠可以防止高脂诱导的肝糖原积聚,降低空腹血糖和胰岛素水平,从而改善胰岛素敏感性;而哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)及胆固醇调节元件结合蛋白1(SREBP1)可作用于PTG启动子,调节PTG的转录影响糖原的代谢,而糖原的积聚可通过反馈调节SREBP1,从而影响脂肪代谢,建立了肝脏糖代谢与脂代谢之间的相互对话,调节了能量的平衡。以上研究结果表明,PTG在糖代谢与脂代谢中起着关键作用,并且对于维持糖原和脂质之间燃料底物分配的代谢平衡是必要的[8]。
为了深入地探索PTG的功能及其参与糖代谢与脂代谢中具体的作用机制,本课题组成功构建出PTG的重组过表达腺病毒载体。采用能够表达较大的外源基因片段的腺病毒穿梭载体GV314,该载体具有广泛的宿主范围,分裂以及非分裂细胞均可被其感染。且该载体还具有病毒滴度高和方便浓缩储存等优点,同时还具有较高的安全性,是将外源性基因导入宿主细胞时所采用的重要载体之一。本研究将携带腺病毒基因组与外源基因的腺病毒穿梭质粒的包装质粒共转染至HEK293T细胞,通过Cre/lox P重组酶系统得到重组过表达腺病毒,并进一步通过Western blot、荧光定量PCR以及测序等方法验证,表明PTG重组过表达腺病毒构建成功。
