Cx43调控NLRP3炎性小体参与α1-AR激活诱导的心脏急性交感应激
2022-05-12王文博李新芝司军强马克涛
王文博,荣 毅,陈 玲,李新芝,司军强,王 丽,马克涛
心力衰竭的病理进程往往伴随着交感神经系统的过度激活和血浆儿茶酚胺水平的增高。在急性交感应激时,心脏中的α1-肾上腺素受体(α1-adrenergic receptor,α1-AR)、β-肾上腺素受体(β-adrenergic receptor,β-AR)被儿茶酚胺激活,并通过NLRP3炎性小体/半胱天冬氨酸蛋白酶-1/白细胞介素18(interleukin-18,IL-18)通路(NLRP3/Caspase-1/IL-18)介导急性交感应激引起的心脏炎症[1]。而炎性小体(NACHT、LRR和PYD结构域蛋白、NLRP)作为一种大分子蛋白质复合物,可精细调节Caspase-1的激活以及促炎性细胞因子[如白介素-1β(interleukin-1β,IL-1β)和IL-18]的产生和分泌,其核心作用已被众多研究证实[2]。
缝隙连接蛋白广泛分布在人体中,这些跨膜蛋白组装形成称为间隙连接的细胞间通道[3]。缝隙连接蛋白43(connexin 43,Cx43)是心脏中连接蛋白最丰富的同工型,主要存在于心室肌细胞中,对维持由心肌细胞的协调收缩引起的正常心跳至关重要[4]。有研究[5]表明,α肾上腺素能受体激动剂苯肾上腺素(phenylephrine,PE)可增强新生大鼠心肌细胞Cx43的表达,从而导致缝隙连接电导的增强。然而,在心脏急性交感应激中,Cx43的作用目前尚未见相关报道。该研究将在心肌细胞水平,通过急性过度激活α1-AR模拟诱导心脏急性交感应激疾病模型,探讨Cx43在心脏急性交感应激中的作用。
1 材料与方法
1.1 材料H9C2大鼠心肌细胞购于中国科学院上海生命科学研究院细胞资源中心。PE购于 Sigma 公司;Cx43特异性阻断剂Gap26 购于APExBIO 公司;兔抗 NLRP3抗体、兔抗 Cx43抗体、鼠抗IL-1β抗体购于Abcam 公司;兔抗Caspase-1抗体、兔抗IL-18抗体购于Proteintech Group公司;小鼠抗 GAPDH 抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗小鼠 IgG、辣根过氧化物酶标记的山羊抗兔 IgG 均购于北京中杉金桥生物技术有限公司;其余试剂材料均为国产分析纯。
1.2 方法
1.2.1H9C2大鼠心肌细胞培养与实验分组 使用含有12%胎牛血清(fetal bovine serum,FBS)DMEM培养基,将H9C2心肌细胞置于含5%CO2、37 ℃恒温培养箱中进行培养。当细胞生长至80%时进行传代及下一步实验。首先使用50 μmol/L PE分别干预H9C2心肌细胞5、15、30、60、120 min,检测不同时间组心肌细胞NLRP3蛋白表达,确定PE干预时间。接下来实验分为4组:对照组(control组)、PE单独处理组、Gap26 干预组、Gap26单独处理组,其中PE单独处理组中PE干预浓度为50 μmol/L[6-7],Gap26干预组给予0.5 μmol/L的Gap26预处理30 min后[8],加入50 μmol/L的PE干预15 min。
1.2.2Western blot法检测H9C2大鼠心肌细胞Cx43、NLRP3、Caspase-1、IL-1β、IL-18的蛋白水平 从心肌细胞中提取蛋白样品,用10%或12%SDS聚丙烯酰胺凝胶电泳分离,转膜,室温封闭2 h(5%的脱脂奶粉或BSA)。分别加小鼠抗GAPDH抗体(1 ∶ 1 000) 、兔抗Cx43抗体(1 ∶1 000) 、兔抗NLRP3抗体(1 ∶1 000)、兔抗Caspase-1抗体(1 ∶1 000)、鼠抗IL-1β抗体(1 ∶500)、兔抗IL-18抗体(1 ∶1 000),4 ℃孵育过夜;TBST 洗膜后孵育二抗(1 ∶5 000、1 ∶10 000)2 h;洗膜后在暗室内加ECL 化学发光试剂显影,压片、曝光。使用Image J软件对目的蛋白进行灰度值分析。
1.2.3免疫荧光法检测H9C2大鼠心肌细胞Cx43的蛋白表达及定位 将H9C2大鼠心肌细胞按分组接种于小皿中,爬片,恒温培养。待爬片上心肌细胞形态良好、密度适中时,分组干预后弃培养基,预温PBS清洗3次,后用4%多聚甲醛固定15 min,PBS清洗3次;用0.2% Triton X-100将各皿细胞透化破膜3~5 min;PBS清洗3次,加5% BSA置于37 ℃温箱中封闭30 min;弃掉封闭液后,加入兔抗Cx43(1 ∶100),于湿盒中4 ℃孵育过夜;次日,37 ℃复温30 min,PBS清洗3次;避光加入FITC 标记的山羊抗兔二抗,37 ℃恒温孵育 1 h;PBS清洗3次;避光加入PI染核4 min,PBS清洗3次;抗荧光淬灭剂封片;在激光共聚焦显微镜下观察并采集图像,用Image J软件进行分析。
1.2.4qRT-PCR法检测NLRP3、Caspase-1、IL-18、IL-1β的mRNA表达 分组干预后收集各组细胞,TRIzol法提取总RNA;检测RNA的浓度, 使用反转录试剂盒得到cDNA。PCR扩增,运行实时定量PCR程序:UDG酶激活50 ℃ 2 min,95 ℃预变性2 min,95 ℃变性15 s,60 ℃延伸1min,共40个循环。根据数据计算每组Ct值,对NLRP3、Caspase-1、IL-18、IL-1β的mRNA表达水平进行分析。实验所有引物见表1。

表1 目的基因引物序列
1.2.5ELISA法检测心肌细胞培养液中细胞因子IL-1β、IL-18的表达 对照说明书配制标准样品,按照说明书中具体操作步骤进行实验。所有加样完毕后,在15~30 min内,使用酶标仪检测各组样品在450 nm/ 540 nm波长处的光密度值(optical density,OD)。以标准品线性回归曲线为参照,计算出样品450 nm/540 nm OD值对应的浓度。

2 结果
2.1 PE急性刺激心肌细胞后NLRP3表达上调Western blot 结果显示,使用PE刺激H9C2大鼠心肌细胞后,NLRP3的蛋白水平快速升高,其表达峰值在药物作用15 min时(P<0.01),随后蛋白表达开始下降,见图1。表明激动心肌细胞α1-AR可以引起心肌细胞NLRP3炎症小体的激活。

图1 激活心肌细胞α1-AR使NLRP3表达上调(n=3)A:Western blot法检测50 μmol/L PE干预H9C2大鼠心肌细胞后NLRP3的蛋白表达;B:A图的统计结果;a:control组;b-f:50 μmol/L PE干预H9C2心肌细胞5、15、30、60、120 min;与control组比较:##P<0.01
2.2 PE急性刺激心肌细胞后Cx43 蛋白表达上调Western blot结果显示,给予PE刺激后,心肌细胞Cx43蛋白表达上调(P<0.01),并且随着PE的干预呈现时间依赖性变化,在PE刺激15 min后表达开始下调,见图2。表明Cx43参与PE诱导的心肌细胞急性交感应激过程。

图2 PE对H9C2心肌细胞Cx43蛋白表达的影响(n=3)A:PE干预不同时间对H9C2心肌细胞Cx43蛋白表达的影响;B:A图的统计结果;a:control组;b-f:50 μmol/L PE干预H9C2心肌细胞5、15、30、60、120 min;与control组比较:*P<0.05,**P<0.01
2.3 PE上调的心肌细胞Cx43及NLRP3/Caspase-1/IL-18通路蛋白表达可被Gap26所逆转免疫荧光法检测结果显示Cx43主要表达在细胞膜上,与control组相比,PE刺激后心肌细胞Cx43 蛋白表达增加(P<0.01)(图3);而Gap26+PE干预组的Cx43表达均较PE单独处理组下调(P<0.01)。用Western blot法检测各处理组细胞NLRP3/Caspase-1/IL-18通路蛋白及Cx43、IL-1β的蛋白表达,结果如图4所示,与control组相比,PE单独处理组能上调NLRP3/Caspase-1/IL-18通路蛋白及Cx43、IL-1β的蛋白表达(P<0.05);与PE单独处理组相比,Gap26干预组能下调NLRP3/Caspase-1/IL-18通路蛋白及Cx43、IL-1β的表达(P<0.05)。而对于细胞因子IL-1β及IL-18,ELISA法测定结果与Western blot法检测结果一致(图5),差异均有统计学意义。

图3 H9C2心肌细胞上Cx43蛋白的表达和定位(n=3)A:Cx43在H9C2心肌细胞中的表达和定位 ×200;B:Cx43的半定量统计分析结果;a:control组;b:PE单独处理组;c:Gap26干预组;d:Gap26单独处理组;与control组比较: **P<0.01;与PE单独处理组比较:##P<0.01;Cx43:绿色;PI(碘化丙啶):红色(细胞核);Merge:合并图
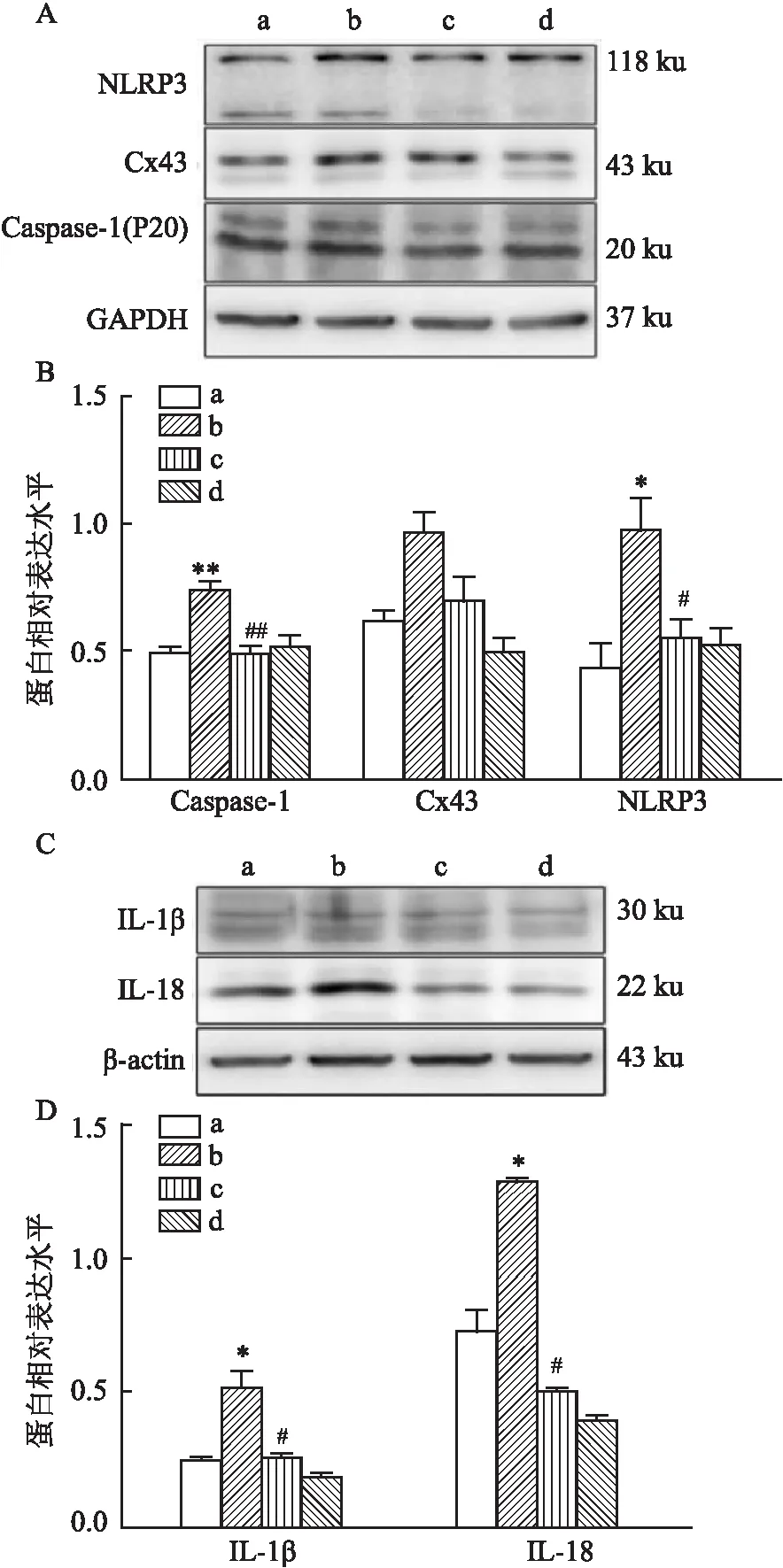
图4 PE及Gap26对H9C2心肌细胞NLRP3/Caspase-1/IL-18通路蛋白及Cx43表达的影响(n=3)A:PE上调的Cx43、NLRP3、Caspase-1蛋白表达可被Gap26不同程度逆转;B:Caspase-1、Cx43、NLRP3蛋白表达的统计学分析;C:PE上调的心肌细胞因子IL-18、IL-1β表达可被Gap26逆转;D:IL-18、IL-1β蛋白表达的统计学分析;a:control组;b:PE单独处理组;c:Gap26干预组;d:Gap26单独处理组;与control组比较:*P<0.05,**P<0.01;与PE单独处理组较: #P<0.05,##P<0.01
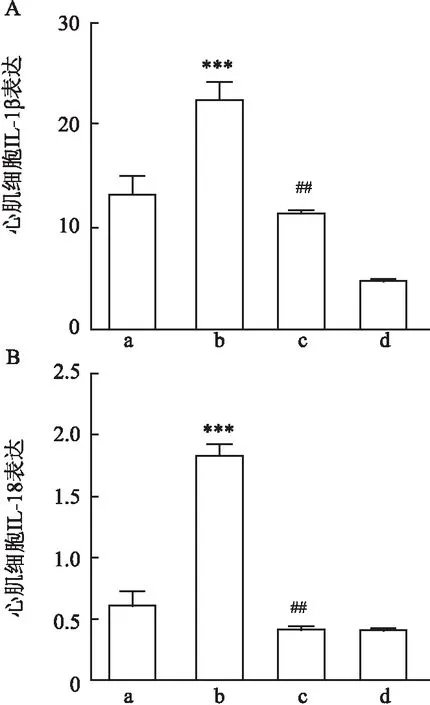
图5 PE及Gap26对H9C2心肌细胞中细胞因子IL-1β、IL-18表达的影响(n=6)A:ELISA法检测H9C2心肌细胞IL-1β的表达;B:ELISA法检测H9C2心肌细胞IL-18的表达;a:control组;b:PE单独处理组;c:Gap26干预组;d:Gap26单独处理组;与control组比较:***P<0.001;与PE单独处理组比较: ##P<0.01
2.4 Gap26 预处理抑制PE诱导的心肌细胞NLRP3、Caspase-1、IL-1 mRNA表达上调qRT-PCR检测结果显示,与 control组相比,PE单独处理组NLRP3、Caspase-1、IL-18、IL-1β mRNA水平升高(P<0.05),而给予Gap26预处理后NLRP3、Caspase-1、IL-18 mRNA水平相对于PE单独处理组降低(P<0.01);IL-1β mRNA表达水平有所下降,但差异无统计学意义。见图6。

图6 PE及Gap26对H9C2心肌细胞NLRP3、caspase-1、IL-18及IL-1β mRNA水平的影响(n=6)A:control组;b:PE单独处理组;c:Gap26干预组;d:Gap26单独处理组;与control组比较:*P<0.05,**P<0.01;与PE单独处理组比较:#P<0.05,##P<0.01
3 讨论
心力衰竭是各种心血管疾病的终末期,其发生发展过程主要与神经内分泌失调引起的心肌重塑密切相关。交感神经系统(SNS)过度激活在心血管病的进程中发挥重要作用,应激刺激引起循环儿茶酚胺浓度升高,进而过量的儿茶酚胺与心脏肾上腺素能受体结合,激活并进一步导致一系列心血管系统病理生理改变。尽管在交感应激早期,机体会表现生理性代偿,但若不加以干预,随着时间延长呈现交感持续刺激时,心脏就会出现失代偿损害:心肌纤维化、肥大等病理性重塑,而炎症因子在此过程中发挥了关键性作用。此外,促炎性刺激可诱导NLRP3和其他炎性小体成分在心肌细胞、白细胞和其他非心肌细胞驻留细胞(如成纤维细胞和内皮细胞)中表达[9-10]。本研究使用50 μmol/L PE作用于H9C2心肌细胞,通过Western blot检测不同PE干预时间下NLRP3的蛋白表达,结果显示PE可上调NLRP3表达,并且在15 min时达到最高峰,之后逐渐下降,由此证实在急性过度激活心脏α1-AR诱导的急性交感应激中,NLRP3炎性小体被激活并进一步介导心脏炎症反应。
众所周知,Cx43在心房和心室肌细胞中表达最丰富,广泛参与疾病的发展。Cx43在调节细胞生长、凋亡、微管稳定性、细胞周期、分化、增殖和细胞信号传导中起重要作用[11-12]。在实验动物水平及细胞水平模拟心肌肥大反应的相关研究中,Cx43的分布和表达变化一直是研究的主要焦点,这些变化背后的分子机制和信号通路的研究还不够深入[13-15]。在关于激活α1-AR表达心脏Cx43信号通路研究中,显示PE对乳鼠心肌细胞24 h的刺激导致Cx43蛋白和mRNA浓度依赖性升高,表明α1-AR刺激对Cx43蛋白和mRNA水平均有调节。Cx43的增加可以被PKC抑制剂BIM I或MAPK信号通路的抑制剂阻断,表明p38和p42/44参与了这一过程[16]。本研究中,给予PE干预H9C2心肌细胞,Cx43的蛋白表达上调,其峰值出现在15 min时;免疫荧光显示Cx43的表达主要分布在细胞质和细胞膜中,说明Cx43参与了α1-AR急性过度激活诱导的心脏炎症过程。而在此急性炎症过程中,Cx43及NLRP3蛋白表达均有上调,且随时间的变化趋势基本一致,故推测在心脏急性交感应激时Cx43与NLRP3之间可能存在相关性(图1~3)。故在接下来的研究中,增加了Cx43特异性抑制剂Gap26来进一步探讨Cx43与NLRP3炎性小体之间的作用关系。
在脂多糖诱导急性肾损伤的研究及另一项慢性眼病研究模型中,Cx43表达的增加与NLRP3表达直接相关,增加Cx43水平有助于炎症小体激活[17-18]。在受损的心肌细胞中NLRP3炎性小体的形成是保护性机制还是进一步损伤机制尚不清楚。本研究的主要目的是希望在急性交感应激过程与NLRP3/caspase-1/IL-18通路中寻找一个新的治疗靶点。Western blot、qRT-PCR检测发现,Cx43特异性阻断剂Gap26预处理组与单独PE干预组相比,IL-1β与NLRP3、Caspase-1及IL-18的蛋白及mRNA表达水平均下调(图4~6)。使用PE急性过度刺激H9C2心肌细胞上的α1-AR,可以引起NLRP3、Caspase-1、IL-18及IL-1β的蛋白与mRNA表达水平增加;ELISA法检测同样提示PE干预H9C2心肌细胞,可以使细胞因子IL-1β及IL-18表达上调,而使用特异性抑制剂Gap26可以下调其表达。
综上,Cx43可通过调控NLRP3炎性小体激活参与α1-AR激活诱导的心脏急性交感应激。
