重楼皂苷Ⅶ对人皮肤鳞状细胞癌裸鼠移植瘤生长的影响及作用机制
2022-05-11杨春华时洁唐凤王婧张震
杨春华,时洁,唐凤,王婧,张震
(1.恩施土家族苗族自治州中心医院,湖北 恩施 445000;2.河西学院附属张掖人民医院,甘肃 张掖 734000)
人皮肤鳞状细胞癌(Cutaneous squamous cell carcinoma,cSCC)主要发生于人体皮肤的鳞状上皮组织,是我国常见的皮肤恶性肿瘤之一[1]。尽管很少致命,但cSCC通过功能障碍、损害容貌以及由此导致的社会心理问题严重降低患者的生活质量。且cSCC多发于60岁及以上的人群中,随着老年人口的增加cSCC发病率会迅速增加[2]。因此,cSCC对医疗保健成本的影响越来越大。cSCC的一般治疗选择包括手术、放疗和化疗等。然而,cSCC的预后,特别是对于那些患有晚期疾病的患者,效果并不令人满意[3]。基于此,开发用于治疗cSCC的新颖有效的药物有重大意义。
中草药重楼有退热解毒、消肿止痛、养肝定惊等作用,在中医中已用于多种疾病治疗[4]。现代药理表明重楼的化学成分包括甾体皂苷、植物蜕皮激素、植物甾醇、类黄酮和脂肪酸酯等[5]。有研究表明,甾体皂苷是重楼发挥各种药理作用的主要生物活性成分[6]。目前,已经从重楼中分离并鉴定116种甾体皂苷。其中重楼皂苷Ⅶ(Polyphyllin Ⅶ,PP Ⅶ)有抗炎、抗癌活性,已在多种癌症类型中表现出强大的抑癌作用,如结肠癌[7]、肺癌[8]和胶质瘤等[9]。但其在cSCC中的作用及机制尚不明确,因此本研究通过构建cSCC裸鼠模型,观察PP Ⅶ对移植瘤的影响并探讨其作用机制,为cSCC新型治疗方法提供依据。
1 材料与方法
1.1 一般材料 8~10周龄无特定病原(SPF)级白变种实验室老鼠(BALB/c)雌性裸鼠购买自中国科学院上海药物研究所[SCXK(沪)2019-0001];cSCC A431细胞株购买自中国上海中科院细胞库;PP Ⅶ购买自美国 Sigma Aldrich;原位末端标记技术(TUNEL)试剂盒购买自上海博耀生物科技有限公司;Ki67、血管内皮生长因子(Vascular endothelial growth factor,VEGF)免疫组化试剂盒购买自上海谷研实业有限公司;洛斯维·帕克纪念研究所研发的培养基(RPMI)1640、胰蛋白酶购买自美国 Gibco;胎牛血清购买自以色列BI;天冬氨酸特异性蛋白酶 3(Caspase-3,66470-2-Ig)、切割后(cleaved)-Caspase-3(66520-1-Ig)、B 淋巴细胞瘤-2(Bcl-2,60178-1-Ig)、Bcl-2 相关 X 蛋白 (Bax,60267-1-Ig)、Notch1(20687-1-AP)、发状分裂相关增强字-1(Hes-1,10597-1-AP)、甘油醛-3-磷酸脱氢酶(GAPDH,60004-1-Ig)抗体购买自美国Proteintech Group公司。
1.2 方法
1.2.1 细胞培养 取出低温冻存A431细胞,置于37℃水浴条件下融化,冻存液部分溶解时取出,在无菌操作台下吸取冻存液加入适量培养基混匀后离心去上清液,加入适量添加有10% 胎牛血清的RPMI 1640完全培养基重悬细胞,于37℃、5% 二氧化碳(CO2)浓度条件下恒温培养。显微镜观察培养细胞,细胞铺满培养瓶80% ~90% 时进行传代培养。加入适量0.25% 胰蛋白酶对培养细胞进行消化处理3~5min,用完全培养基终止消化反应,重悬细胞并计数,以RPMI1640培养基稀释至1×108个/mL备用。
1.2.2 裸鼠移植瘤模型构建 25只裸鼠适应性培养 1 周后,将 100 μL A431 细胞悬液(1×108个/mL)接种于裸鼠右侧腋窝皮下,接种1周后,接种部位明显瘤状隆起视为造模成功。接种2周后,将造模成功的裸鼠随机分为对照组、PP Ⅶ0.5、1、2 mg/kg组、阳性对照氟尿嘧啶(5-FU)10 mg/kg组,每组各5只。按照组别对应分别给予腹腔注射0.5、1、2mg/kg PP Ⅶ或10 mg/kg 5-FU,对照组腹腔注射等量生理盐水,1次/d,连续注射30 d。药物剂量选择依据相关文献[10]。分别与药物注射后 5、10、15、20、25、30 d使用游标卡尺测量移植瘤最长径(L,mm)与最短径(S,mm),根据公式 V(mm3)=L×S2×π/6计算体积。30 d后处死裸鼠,取出移植瘤检测移植瘤质量。
1.2.3 TUNEL染色检测细胞凋亡 对各组移植瘤进行常规固定包埋,切片,脱蜡后使用二甲苯浸洗2次,5 min/次;使用梯度浓度乙醇(100、95、90、80、70%)依次浸洗3 min;加入适量蛋白酶K室温孵育30 min,磷酸盐缓冲液(PBS)清洗2次;按 TUNEL试剂盒说明书混合各试剂,加入50 μL TUNEL混合反应液于玻片标本上,置于湿盒中37℃反应1 h,PBS清洗3次;滤纸吸干水分,加入50 μL converter-POD于玻片标本上,置于湿盒中37℃反应30 min,PBS清洗3次;滤纸吸干水分,加入50~100 μL二氨基联苯胺(DAB),室温反应10 min,PBS清洗3次;加入苏木素复染,几秒后流水充分冲洗,脱水、透明、封片。结果判定:细胞核为棕黄色即为凋亡细胞,每切片随机取400倍显微镜视野5个,分别对凋亡细胞及总细胞进行计数,计算细胞凋亡率。细胞凋亡率=(凋亡细胞数/总细胞数)×100% 。
1.2.4 免疫组化检测Ki67、VEGF 各组移植瘤切片常规脱蜡水化,细胞通透液浸润玻片30 min,PBS清洗3次;将玻片放入0.01 mol/L柠檬酸钠缓冲液(pH6.0)中微波修复抗原,PBS清洗3次;加入3% 过氧化氢(H2O2)溶液孵育30 min以阻断内源性过氧化酶,PBS清洗3次;加入5% 血清(与二抗来源一致)置于湿盒中室温封闭20 min;滤纸吸干血清,加入50 μL适当比例稀释Ki67、VEGF一抗,4℃孵育过夜,PBS清洗5次;加入二抗室温孵育30 min~1 h,PBS清洗5次;滴加过氧化物酶标记的链霉亲和素(SP)室温孵育30 min~1 h,PBS清洗5次;滤纸吸干水分,加入50~100 μL DAB,室温反应10 min,PBS清洗3次;加入苏木素复染,几秒后流水充分冲洗,脱水、透明、封片。免疫组化结果判定:细胞内有棕黄色颗粒即为蛋白阳性表达细胞,每切片随机取400倍显微镜视野5个,分别对阳性细胞及总细胞进行计数,计算阳性细胞率。阳性细胞率=(阳性细胞数/总细胞数)×100% 。
1.2.5 蛋白免疫印迹(WB)法检测蛋白表达水平 提取各组移植瘤蛋白,按照聚氰基丙烯酸正丁酯(BCA)法使用试剂盒测定蛋白质浓度;根据测量浓度加入相应体积的待测样品于十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中,以25 mA恒定电流电泳1~2 h;将凝胶转印到聚偏二氟乙烯(PVDF)膜上,浸入封闭液中2 h,用Tris缓冲盐溶液+Tween 20(TBST)清洗膜3次,3 min/次;加入适当比例稀释的Caspase-3、Bax、Bcl-2、Notch1、Hes-1 蛋白一抗,4 ℃孵育过夜,TBST清洗膜3次;加入对应浓度二抗,室温孵育2 h,TBST清洗膜3次;避光加入ECL发光染色,使用凝胶成像仪进行成像分析。采用TotalLab2.0进行灰度分析,以GAPDH作为内参,计算蛋白的相对表达量。
1.3 统计学分析 使用SPSS 20.0统计学软件进行统计处理。计量资料以(±s)表示,2组比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 PP Ⅶ抑制cSCC移植瘤生长 药物注射30 d后,与对照组相比,随着PP Ⅶ注射剂量的增加,移植瘤逐渐变小并接近5-FU10mg/kg组水平,见图1A;PP Ⅶ1、2 mg/kg组、5-FU 10 mg/kg组移植瘤质量、体积显著低于对照组(P<0.05),见图1B、C。随着PP Ⅶ注射剂量的增加和注射时间的延长,cSCC移植瘤生长曲线越加平缓;与对照组相比,各PP Ⅶ组移植瘤生长受到不同程度的抑制,且PP Ⅶ2 mg/kg组抑制作用最明显并接近5-FU 10 mg/kg组水平,见图1C。

图1 PP Ⅶ抑制cSCC移植瘤生长
2.2 PP Ⅶ诱导cSCC移植瘤细胞凋亡 TUNEL染色结果表明,药物注射30 d后,对照组棕黄色凋亡细胞较少,随着PP Ⅶ注射剂量的增加,棕黄色凋亡细胞逐渐增多并接近5-FU 10 mg/kg组水平,见图2A;PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg组细胞凋亡率显著高于对照组(P<0.05),见图2B。

图2 PP Ⅶ诱导cSCC移植瘤细胞凋亡
2.3 蛋白印迹法检测各组移植瘤Caspase-3、Bax、Bcl-2蛋白表达水平 蛋白印迹结果显示,随着PP Ⅶ注射剂量的增加,Bax、Caspase-3蛋白表达量逐渐增加,Bcl-2蛋白表达水平逐渐降低并接近5-FU 10 mg/kg组水平,见图3A;PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg组Bax/Bcl-2值和cleaved Caspase-3/Caspase-3值显著高于对照组(P<0.05),见图3B。

图3 各组移植瘤Caspase-3、Bax、Bcl-2蛋白表达水平
2.4 免疫组化检测各组cSCC移植瘤细胞Ki67、VEGF蛋白表达情况 免疫组化结果显示,对照组有大量含有棕黄色颗粒细胞,Ki67、VEGF蛋白阳性表达率较高,随着PP Ⅶ注射剂量的增加,Ki67、VEGF蛋白阳性表达细胞数量逐渐减少并接近5-FU 10 mg/kg组水平,见图4A、C;PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg组Ki67、VEGF蛋白阳性细胞率显著低于对照组(P<0.05),见图4B、D。

图4 各组移植瘤细胞Ki67、VEGF蛋白表达情况
2.5 WB法检测各组移植瘤Notch1、Hes-1蛋白表达水平 蛋白印迹结果显示,随着PP Ⅶ注射剂量的增加,Notch1、Hes-1蛋白表达量逐渐增加,见图5A;PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg组 Notch1、Hes-1蛋白表达量显著高于对照组(P<0.05),见图5B。
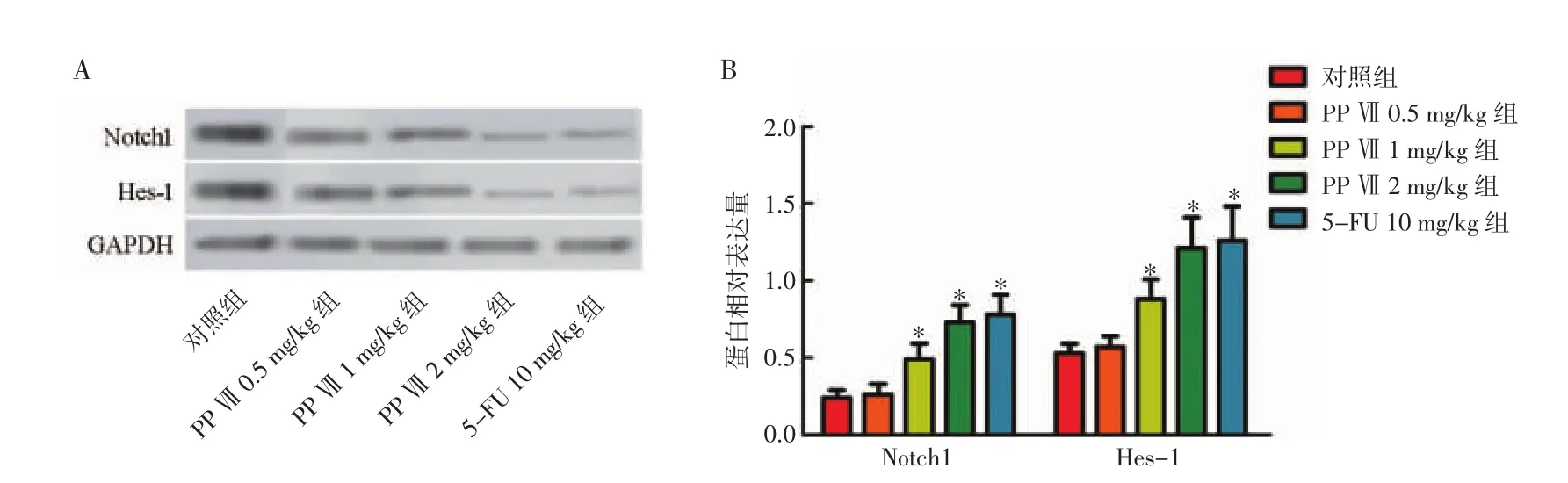
图5 各组移植瘤Notch1、Hes-1蛋白表达水平
3 讨论
作为第二大最常见的皮肤癌,cSCC是一种高度流行的恶性肿瘤,在大多数情况下,可通过手术切除来治愈。但是,约3% 的患者会发生区域淋巴结转移,显著降低患者5年生存率[11],因此探索新的治疗药物有重要意义。近年来,PP Ⅶ的抗癌作用与机制已在多种癌症研究中报道。本研究通过构建cSCC裸鼠移植瘤模型,对各组移植瘤体积、质量、生长情况进行观察比较,发现与对照组相比,PP Ⅶ各组移植瘤生长速度、质量、体积显著降低,说明使用PP Ⅶ能在一定程度上抑制cSCC移植瘤的生长,并且这种抑制作用随PP Ⅶ用药剂量增加而加强;同时,PP Ⅶ2 mg/kg组与5-FU 10 mg/kg组移植瘤大小、质量相近,表明高剂量PP Ⅶ的抑癌作用已与5-FU相当。
恶性肿瘤较强的抗凋亡能力和促增殖能力是其发生发展的关键。Zhang等[12]证明PP Ⅶ能通过触发线粒体介导的ROS生成以及激活MAPK和PTEN/p53途径诱导肝癌细胞凋亡。Lin等[13]报道PP Ⅶ通过诱导细胞周期停滞并触发凋亡,对肺癌细胞生长表现出强抑制作用。本研究通过TUNEL染色检测细胞凋亡,结果显示随着PP Ⅶ注射剂量的增加,细胞凋亡率增加,PP Ⅶ1、2 mg/kg组、5-FU 10 mg/kg组细胞凋亡率显著高于对照组,且PP Ⅶ2 mg/kg组与5-FU 10 mg/kg组细胞凋亡率差异无统计学意义。Bax、Bcl-2是调控细胞凋亡相关基因,但二者生理功能相反,Bax促凋亡,Bcl-2抗凋亡。Bax、Bcl-2蛋白水平比例能反应细胞凋亡状况,Bax/Bcl-2值越高,细胞凋亡发生率越高[14]。Caspase-3是内源性和外源性凋亡途径必须的关键蛋白,其可在上游信号分子作用下裂解生成有活性的cleaved Caspase-3,进而降解多种蛋白并在细胞凋亡过程中形态改变和DNA断裂中起到作用[15]。在本研究中WB结果显示,随着PP Ⅶ注射剂量的增加,Bax、Caspase-3蛋白表达量逐渐增加,Bcl-2蛋白表达水平逐渐降低,PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg组Bax/Bcl-2值和cleaved Caspase-3/Caspase-3值显著高于对照组,且PP Ⅶ2 mg/kg组与5-FU 10 mg/kg组Bax/Bcl-2值和cleaved Caspase-3/Caspase-3值差异无统计学意义。Ki67是一种核蛋白,可指示细胞增殖的程度。cSCC的预后与高水平的Ki67表达活性之间存在显著关联[16]。另一方面,肿瘤血管形成在肿瘤形成过程中起着重要作用,对于肿瘤的进展和实体瘤的转移扩散至关重要。VEGF被认为是肿瘤血管生成过程中最重要的血管生成调节因子之一[17]。本研究中,免疫组化结果显示,随着PP Ⅶ注射剂量的增加,Ki67、VEGF蛋白阳性表达细胞数量逐渐减少,PP Ⅶ 1、2 mg/kg组、5-FU 10 mg/kg 组Ki67、VEGF蛋白阳性细胞率显著低于对照组,且PP Ⅶ 2 mg/kg组与 5-FU 10 mg/kg组 Ki67、VEGF蛋白阳性细胞率差异无统计学意义。这些结果表明PP Ⅶ有促进cSCC细胞凋亡和抑制cSCCA细胞增殖的能力,并且作用效果随剂量增加而加强,高剂量条件下促凋亡和抗增殖效果与5-FU相当。
Notch信号传导是细胞内通讯的一种重要形式,在细胞分化、生存、增殖中起着关键作用[18]。在角质形成细胞中,其诱导分化并抑制肿瘤的发展,其在角质形成细胞中的缺失会增强对皮肤癌形成的敏感性[19]。而Notch通路激活能促进cSCC细胞凋亡和抑制cSCC细胞增殖[20]。Notch受体被配体激活后,γ-分泌酶会对Notch的胞内结构域进行切割,细胞内裂解的Notch易位至细胞核,与DNA结合蛋白RBP-J形成复合物,并激活许多靶基因的转录,包括Hes转录因子家族[21]。Hes-1在Notch1信号调控下,与相应的靶基因结合,调控基因转录进而发挥生理功能。在本研究中,随着PP Ⅶ注射剂量的增加,Notch1、Hes-1蛋白表达量逐渐增加,表明PP Ⅶ能激活Notch1/Hes-1通路,促进cSCC细胞凋亡。
综上所述,PP Ⅶ能促进cSCC细胞凋亡,抑制cSCC细胞增殖,这可能与其能激活Notch1/Hes-1信号通路有关,突出表明PP Ⅶ用于cSCC治疗的潜在价值。
