人工智能在脑血管病诊疗中的应用
2022-05-09许璟鲁伟向建平
许璟 鲁伟 向建平
脑血管病位居我国居民各种死亡原因的第一位,已成为严重危害我国居民健康和生命的主要疾病。《中国卫生健康统计年鉴(2018)》指出,2017年我国脑血管病死亡构成比超过20%[1],这意味着我国居民平均每5例死者中有1例死于脑血管病。该病的发病特点是起病突然、病情进展迅速、诊疗时间窗短、病程长、患者预后较差等。脑卒中是最常见的脑血管病之一,主要包括出血性卒中和缺血性卒中,其中出血性脑卒中包括高血压脑出血、颅内动脉瘤破裂、脑血管畸形出血、硬脑膜动静脉瘘和烟雾病出血等;缺血性脑卒中包括急性脑梗死、颈动脉和椎动脉狭窄闭塞、颅内血管狭窄、静脉窦狭窄闭塞等。基于多模态的影像学诊断是脑卒中诊疗过程中的主要检查方法。脑血管病影像检查主要包括CT、MR和数字减影血管造影(digital subtraction angiography,DSA)等影像模态,具体包括颅内无显影CT(non contrast CT,NCCT)、CT血管造影(CT angiography,CTA)、CT灌注成像(CT perfusion,CTP)、MR血管造影(MR angiography,MRA)、MR灌注成像(MR perfusion,MRP)和DSA等。随着人工智能(artificial intelligence,AI)和计算机视觉技术的快速发展,机器学习和深度学习等AI技术逐渐用于医学影像学领域[2]。以深度学习神经网络为代表的AI算法基于强大的表征学习能力,能够自动化提取影像学特征,进而为辅助诊断和决策提供参考。合理、合规地应用AI技术并将其充分与临床结合,能有效提高诊断效率和诊断精度,对缓解医疗资源紧张、区域和城乡医疗资源分配不均衡等均有重要社会意义。本文对AI在脑血管多模态影像处理、脑卒中和颅内动脉瘤等脑血管病诊疗过程中的研究进展和产业应用作一述评,同时结合脑血管病的临床需求,总结目前AI在脑血管病诊疗应用中存在的问题,并对未来的发展进行展望。
1 AI在脑血管影像处理中的应用
AI在脑血管影像处理中的应用主要包括影像的颅骨去除和血管分割等两个方面。对于脑血管影像,特别是CT模态的影像,颅骨的CT值一般都非常大,对于后续脑血管的识别、分割会有较大干扰,所以脑血管图像处理的一个关键问题就是去除颅骨。随着AI技术的兴起,颅骨去除方法经历了由传统的图像处理算法(如阈值法、区域生长方法等[3])逐渐转变为由机器学习和深度学习神经网络为主导的AI算法。在机器学习方面,像经典的支持向量机[4]、主成分分析降维方法[5]都可用于颅骨去除,但整体效果有限,AI方法在颅骨去除方面的应用主要还是在于深度学习。Kleesiek等[6]提出使用3D卷积神经网络(convolutional neural network,CNN)来提取MRI脑部区域,最优分割dice系数能够达到0.95。Chen等[7]基于3D网络和ResNet结构设计了一种VoxResNet网络,同样也是用于MRI影像的颅骨去除。
AI在脑血管影像处理中的另一个应用就是颅内血管分割。血管影像的快速准确分割是进行后续脑血管病诊断与预测的重要前提。而血管分割的时效性、准确性、覆盖度、连通性等是脑血管分割最主要的评价指标。Klimont等[8]基于预训练和2D UNet网络在NCCT上进行尝试,并将其与对应CTA影像进行比较,得到分割dice系数为0.64。Fu等[9]基于3D CNN首次设计了一个可实现头颈CTA血管分割的后处理系统,它能够自动除去骨影像,并完成头颈CTA的血管分割与重建。该研究构建了近2万份数据的CTA影像队列,该算法在分割dice系数和灵敏度上均达到0.9以上,在外部不独立测试集的准确性上也达到0.93,对CTA影像细小血管的分割均有非常高的精度。
2 AI在脑卒中诊疗过程中的应用
脑卒中的诊疗高度依赖于多模态的影像数据。AI在脑卒中诊疗中的应用主要体现在基于多模态影像数据的辅助诊断分类、病灶分割、病变血管定位和梗死进展预测等方面。脑卒中可分为出血性卒中和缺血性卒中两大类型,是颅内两种截然相反的情况。脑出血的特征是闭合颅腔内血量过多,而脑缺血的特征是血量过少而不能为某部分脑组织提供足量的氧和营养物质。以下将对目前AI在出血性卒中和缺血性卒中的应用研究进展进行梳理,并对相关的产业实践作一简单介绍。
2.1 出血性卒中的AI应用研究 出血性脑卒中是由于局部脑组织血管破裂引起的急性脑血管病,包括创伤性脑出血和自发性出血。NCCT是诊断脑部病变的最常用成像技术,具有成像速度快、扫描方便、价格相对便宜等优点。该方法可以迅速、准确地显示血肿部位、出血量、占位效应、是否破入脑室或蛛网膜下腔、周围脑组织受损等情况,是疑似卒中患者的首选影像学检查方法。目前AI在急性颅内出血(intracranial hemorrhage,ICH)中的应用主要体现在基于深度学习神经网络的出血二分类诊断、多分类出血分型诊断以及出血病灶的图像分割等。Chang等[10]提出一种基于混合2D和3D CNN网络的ICH检测网络,在大队列数据集上,其检测出血的灵敏度和特异度分别达0.971和0.975;在出血病灶分割问题上,Hssayeni等[11]提出了一种基于深度全卷积网络的ICH病灶图像分割模型,最优分割dice系数能达到0.52;此外,该模型对于硬膜下出血、硬膜外出血、脑室内出血、实质内出血和蛛网膜下腔出血(subarachnoid hemorrhage,SAH)均有较好的分割效果,见图1。
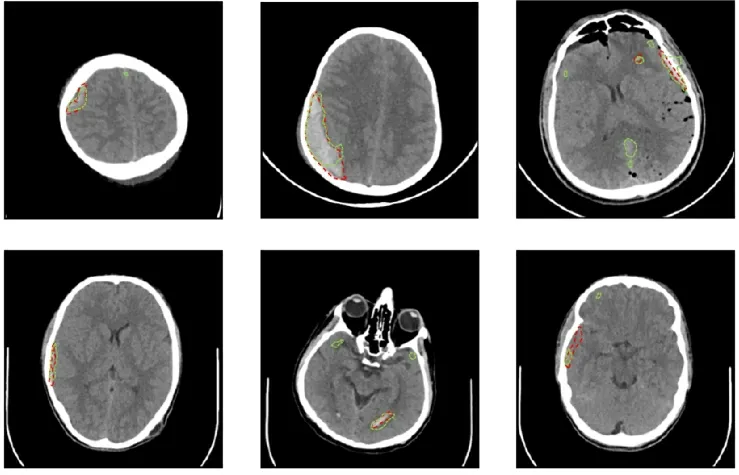
图1 人工智能在颅内出血分型病灶分割中的应用
2.2 缺血性卒中的AI应用研究 相较于出血性卒中,缺血性脑卒中是由于局部脑组织血管堵塞和供血不足引起的急性脑血管病。临床上常用的检查手段包括CT、MR,基于CT的一站式脑卒中检查的诊断流程如下:患者入院先行NCCT检查,判断是出血还是缺血,或者是其他颅内疾病;如果是出血性卒中,即按照出血治疗方式进行相应处理;如果是缺血性卒中,可先进行Alberta卒中项目早期CT评分(Alberta stroke program early CT score,ASPECTS),然后进一步通过CTA检查确定堵塞血管的位置,通过CTP检查量化评估梗死核心体积和缺血半暗区域体积。
ASPECTS是一种基于NCCT影像评估早期缺血性卒中梗死范围的定量评估方法,但其本身存在着主观性强、评估误差大等弊端。Kuang等[12]提出基于随机森林算法的自动化ASPECTS系统,通过提取ASPECTS分区区域图像特征并训练机器学习算法来判定区域是否有低密度梗死灶,最后进行汇总评分。该研究认为基于机器学习算法的早期缺血特征判读能力不弱于临床专家。在缺血梗死区域定量评估方面,Flottmann等[13]提出基于机器学习算法的无阈值方法来预测梗死区域,从体积误差上看,效果要优于传统的单一阈值化方法。Dolz等[14]提出多路径的UNet网络进行灌注参数图的梗死区域分割,以MRI影像作为金标准,以CT灌注参数图像作为多通道输入,构建多路径UNet分割网络,平均分割dice系数能达到0.635。大血管堵塞(large vessel occlusion,LVO)是指在颅内外供应脑部的动脉血管壁在发生病理性改变的基础上,在血流缓慢、血液成分改变或血黏度增加等情况下形成血栓,致使血管闭塞。CTA是脑血管成像的一种技术方法,是识别疑似急性缺血性卒中患者大血管狭窄闭塞的最常用方法。You等[15]基于CTA影像提出一种混合XGBoost机器学习和CNN深度学习方法的LVO检测模型,该模型对于LVO的检测率达到93%。在MR梗死定量评估方面,Chen等[16]设计了一种两层结构的深度卷积网络用于MRI DWI影像的梗死病灶区域分割,对于大梗死和小梗死区域的分割dice系数分别为0.83和0.61。
总而言之,目前AI在缺血性卒中诊疗中的应用主要体现在影像评估上,包括基于机器学习方法的自动化NCCT ASPECTS、基于深度学习图像分割的CTP/DWI梗死核心和半暗带定量评估以及基于深度学习检测算法的CTA LVO检测。
2.3 脑卒中诊疗与AI产品化实践 AI在脑卒中诊疗的应用除了学术界广泛研究外,在工业界产品化方面也取得了较大的进展。目前国内外主要医疗软件厂商关于脑卒中诊疗AI产品化应用相关的基本信息,见表1。ICH、ASPECTS、CTP和LVO在脑卒中临床诊断流程中的位置,见图2。从表1可以看到,目前国内外医疗软件厂商在AI脑卒中产品化方面都有着相对成熟的产品线,且各厂商的软件均能在图2找到对应工具。在相关应用上,可以看出两个技术结合的特征,第一个是传统图像算法与AI技术的结合,对于不适合直接用AI技术进行处理的问题,比如CTP的灌注参数图分析,一般会通过传统的图像处理技术来解决;第二个是传统的机器学习与当前流行的深度学习算法相结合,可以进行多元化的影像特征信息提取,以获得更为准确的预测结果。
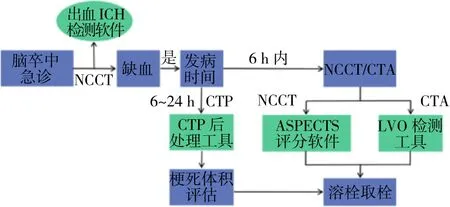
图2 脑卒中临床诊断流程
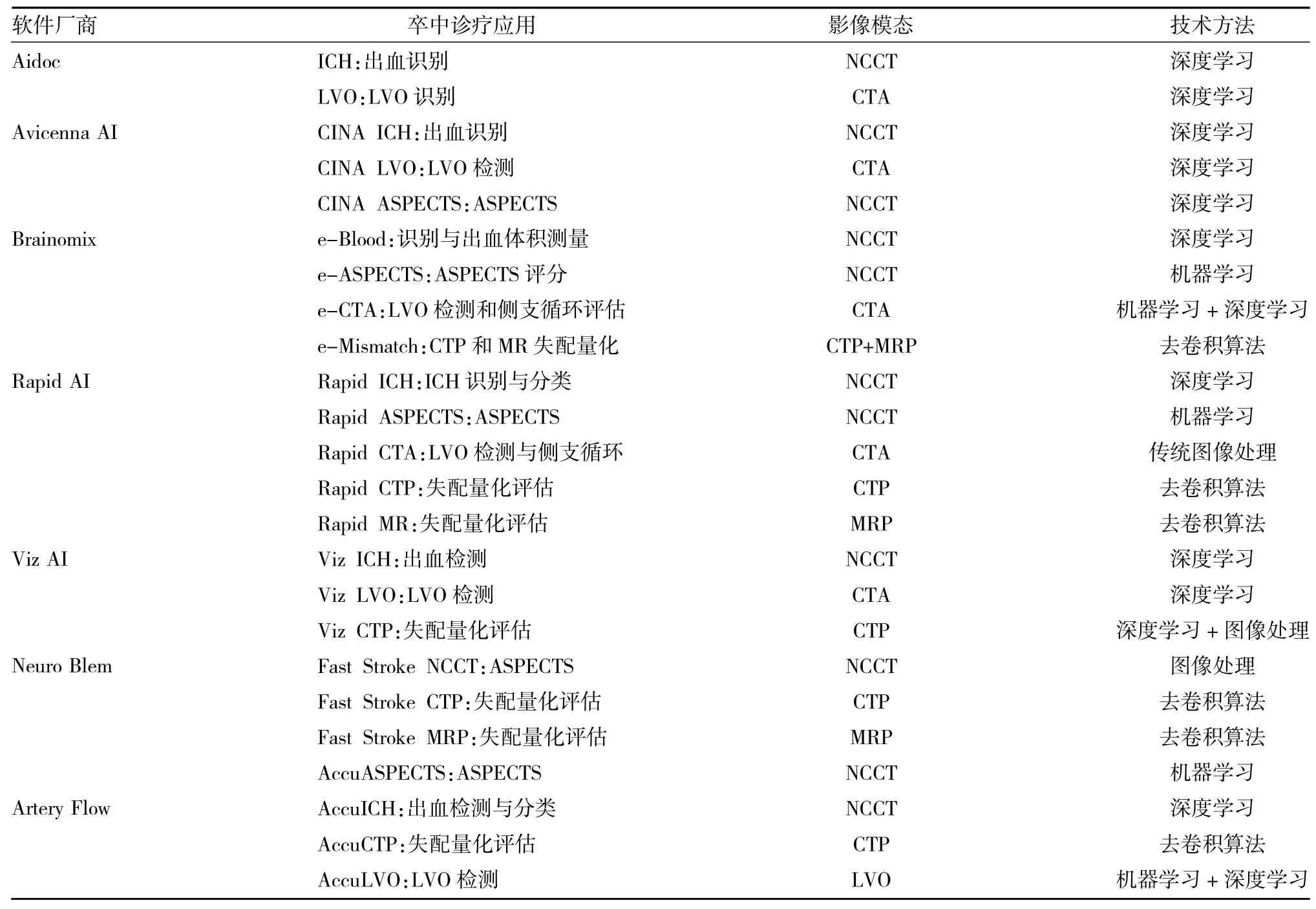
表1 脑卒中诊疗软件和主要技术
3 AI在动脉瘤诊疗中的应用
颅内动脉瘤是由于先天发育异常或后天损伤等因素导致局部的颅内动脉管壁损害,在血流动力学和其他因素的共同作用下,逐渐扩张形成的异常膨出,是最常见的脑血管病之一。它在人群中的发病率为2%~7%,任何年龄段均可发病,40~60岁是发病年龄的高峰期。颅内动脉瘤破裂所致的SAH具有极高的致残率和致死率,占所有卒中的5%~10%;而80%的SAH是由于颅内动脉瘤破裂导致的。因此,对颅内动脉瘤进行早期筛查并准确预估其是否有破裂风险至关重要。而AI在动脉瘤诊疗中的应用主要集中于自动化诊断筛查和破裂风险评估两个方面。
颅内动脉瘤的常规检查手段是颅内CTA、DSA和MRA,其中CTA作为颅内CT一站式检查方式之一,具有成像速度快、分辨率较高的特点,是临床上常用的动脉瘤检查手段。然而,也存在传统人工阅片和筛查技术效率低下、漏检率较高等问题。近年来,基于AI和深度学习技术的自动化动脉瘤筛查与检测相关研究逐渐开展起来。Park等[17]提出基于CTA的动脉瘤检测模型HeadXNet,且实验证实配备HeadXNet动脉瘤辅助诊断系统的医生诊断动脉瘤的准确率明显高于没有算法辅助的医生。Shi等[18]提出了基于CTA影像的动脉瘤检测模型DAResUNet,该模型以多个CNN结构设计进行拼接,以DSA影像作为动脉瘤诊断标签的金标准设计了多个临床对比实验,最终显示该模型的灵敏度高达0.97,在独立的外部验证集上灵敏度也有0.85,且对于<5 mm的小动脉瘤也有较高的检出率。在MR影像动脉瘤诊断方面,Ueda等[19]提出了基于MRA影像的Aneu-Dect模型,在内部和外部验证集上的灵敏度分别为0.91和0.93。
颅内动脉瘤破裂的风险评估是动脉瘤诊断的核心。目前相关研究主要集中在构建包含动脉瘤破裂终点事件的队列数据,基于各种机器学习算法进行建模预测。传统方法通常收集患者的常规临床信息和动脉瘤形态学参数信息作为特征,通过随机森林或XGBoost分类模型对动脉瘤是否有破裂风险进行预测。Jaehyuk等[20]对常规临床信息和病史进行特征重要性排序,说明了某些特征对于动脉瘤破裂风险的影响更大。Chubin等[21]采用了radiomics医学影像特征提取库提取动脉瘤形态信息,且在预测动脉瘤破裂风险上具有不错的准确性(AUC=0.883)。近年来,部分国内医学影像科研机构计算了动脉瘤的血流动力学参数信息,并与常规临床信息和动脉瘤形态学参数信息一同作为特征进行模型训练,以预测动脉瘤破裂风险。Xiang等[22]采用逻辑回归模型融合动脉瘤形态学参数和血流动力学参数信息,该模型在预测动脉瘤破裂风险方面具有较好的准确性(AUC=0.89)。
在动脉瘤临床治疗和预后评估方面,近年来也有一些基于AI的研究被逐渐提出。Bhurwani等[23]提出将深度神经网络应用于血管造影,利用治疗前、后的DSA预测动脉瘤闭塞情况。在基于造影参数来预测颅内动脉瘤介入治疗的成功率方面,该研究展现了深度神经网络的潜在应用前景。Tabaie等[24]基于机器学习模型来捕捉预测动脉瘤引起SAH患者的临床风险因素,这些因素有助于高风险患者的临床治疗决策和患者影像数据的临床价值挖掘。Paliwal等[25]比较了4种经典的监督学习机器学习算法(逻辑回归、支持向量机、K-近邻和BP神经网络)预测血流导向装置治疗动脉瘤6个月的预后结果,结果表明BP神经网络(AUC=0.967)在训练集上表现最好,支持向量机和BP神经网络在测试队列中的预测准确性为0.90。尽管该研究缺乏独立的外部验证,但应用机器学习模型来帮助临床医生在适当的动脉瘤患者中选择血流导向装置具有较高的临床价值。
4 小结与展望
本文重点梳理了近年来AI在脑血管病诊疗过程中的应用研究与产业实践进展,同时阐述了AI在脑血管影像处理、脑卒中诊疗以及颅内动脉瘤诊疗等领域中的应用进展,并结合临床实际对目前AI在脑血管病诊疗应用中存在的问题进行总结。AI可应用于脑血管病的诊断分类、病变检测定位、病灶分割和破裂风险预测等,并在多个领域取得了较大的进展,而且一些产品已经在临床中得到广泛应用,如本文提到的ASPECTS和CTP的评估。但AI在脑血管病的应用也面临着许多问题:(1)目前的AI模型还处于对数据极度依赖的发展阶段,构建稳健和泛化能力强的模型缺乏大型队列和高质量标注的数据集,这使得AI在脑血管病中的应用仍处于定制化场景,而泛化应用广度不能令人满意。(2)AI模型算法工程师缺乏与临床医生或放射科医生之间的有效协作模式,大多数由工程师训练出模型,不能满足真正的临床使用需求。(3)AI模型的可解释性问题,因为临床诊断过程一般需要明确的可解释性和决策依据。但是,随着数据的标准化和AI算法的发展,相信未来会有越来越多成熟的AI产品广泛应用于临床,覆盖脑血管病诊疗的整个流程。
