马钱子总碱纳米脂质体凝胶的制备及渗透动力学研究
2022-05-07李海平王晓慧张运良李明娟
李海平,王晓慧,谢 骥,张运良,李明娟
1.湖南邵阳中医医院药剂科,邵阳 422001;2.湖南邵阳学院药学院,邵阳 422000
马钱子为马钱科植物马钱(Strychnosnux-vomicaL.)的干燥成熟种子,具有通络散结、消肿止痛的功效[1]。其有效成分为马钱子总碱(主要为马钱子碱和士的宁)。现代医学的研究证明,马钱子有镇痛、兴奋中枢神经系统、提高免疫、抗肿瘤等作用[2],但因其安全范围窄,限制了其在临床上的使用。以脂质体为载体的药物易在角质层内形成药物储库,药物可持续地对病变细胞起到治疗作用,极大地提高治疗效果,减少全身不良反应的发生[3-5]。同时,因其与皮肤角质层的脂质有高度的生物相容性,能在皮肤局部积累,起到持续地药物释放作用[6-7]。本研究用硫酸铵主动载药技术制备马钱子纳米脂质体(total alkaloids ofStrychnosnux-vomicaL.of nanoliposome,TAS-NL)并制成马钱子总碱纳米脂质体凝胶(total alkaloids ofStrychnosnux-vomicaL.of nanoliposome gel,TAS-NL-Gel),希望强化促渗剂效能以提高载药量,并通过马钱子碱缓慢、持续地释放,起到减毒增效的作用。
1 仪器与材料
1.1 仪器
Agilent 1220 Serie高效液相色谱仪(美国安捷伦公司);78HW-1恒温磁力加热搅拌器(常州荣华仪器制造有限公司);RE-52旋转蒸发仪(上海亚荣生化仪器厂);KQ-500B-超声波清洗机(昆山市超声仪器有限公司);H1850高速离心机(湖南湘仪仪器有限公司);Zetasizer Nano ZSP纳米粒度电位仪(富瑞博国际有限公司);FEI透射电子显微镜(美国赛默飞世尔科技有限公司);ZTY 智能透皮吸收实验仪TP-2A(巩义市英峪予华仪器厂)。
1.2 试药
马钱子粉[缅甸产,原药购于邵东廉桥,经邵阳学院中药教研室李成舰教授鉴定为马钱科植物马钱(Strychnosnux-vomicaL.)的干燥成熟种子,经砂烫法炮制后去壳过40目筛];马钱子碱对照品(批号110705-202006)、士的宁对照品(批号110706-202005)均购自中国食品药品检定研究院;庚烷磺酸钠(色谱纯,批号20200928,北京奥秘佳医药科技有限公司);大豆卵磷脂[批号20200427,艾伟拓(上海)医药科技有限公司];胆固醇[批号20191015,艾伟拓(上海)医药科技有限公司];Sephadex G-50(批号20200511,上海源叶生物科技有限公司进口分装);水溶性氮酮(批号20200422,西安晋湘药用辅料有限公司);丙二醇(批号20200716,西安天正药用辅料有限公司);桉叶油(批号20200713,湖北康纯香料有限公司);其他试剂均为分析纯或色谱纯;水为超纯水。
1.3 动物
清洁级KM 小鼠,雄性,体质量为18~22 g,购自湖南斯莱克景达实验动物有限公司,生产许可证号SCXK(湘)2019-0004。
2 方法与结果
2.1 TAS-NL-Gel的制备
2.1.1 马钱子总碱的制备 TAS 浓缩液为自制,其中马钱子碱的质量浓度为(20.06±0.03)mg·mL-1、士的宁的质量浓度为(39.94±0.04)mg·mL-1。
2.1.2 TAS-NL-Gel的制备 采用硫酸铵主动载药技术[7-8]制备TAS-NL,见图1。最佳工艺参数为脂-药比10∶1、磷脂-胆固醇比6∶1、硫酸铵溶液的质量浓度0.2 mg·mL-1,乙醇的用量0.12 mL·g-1。
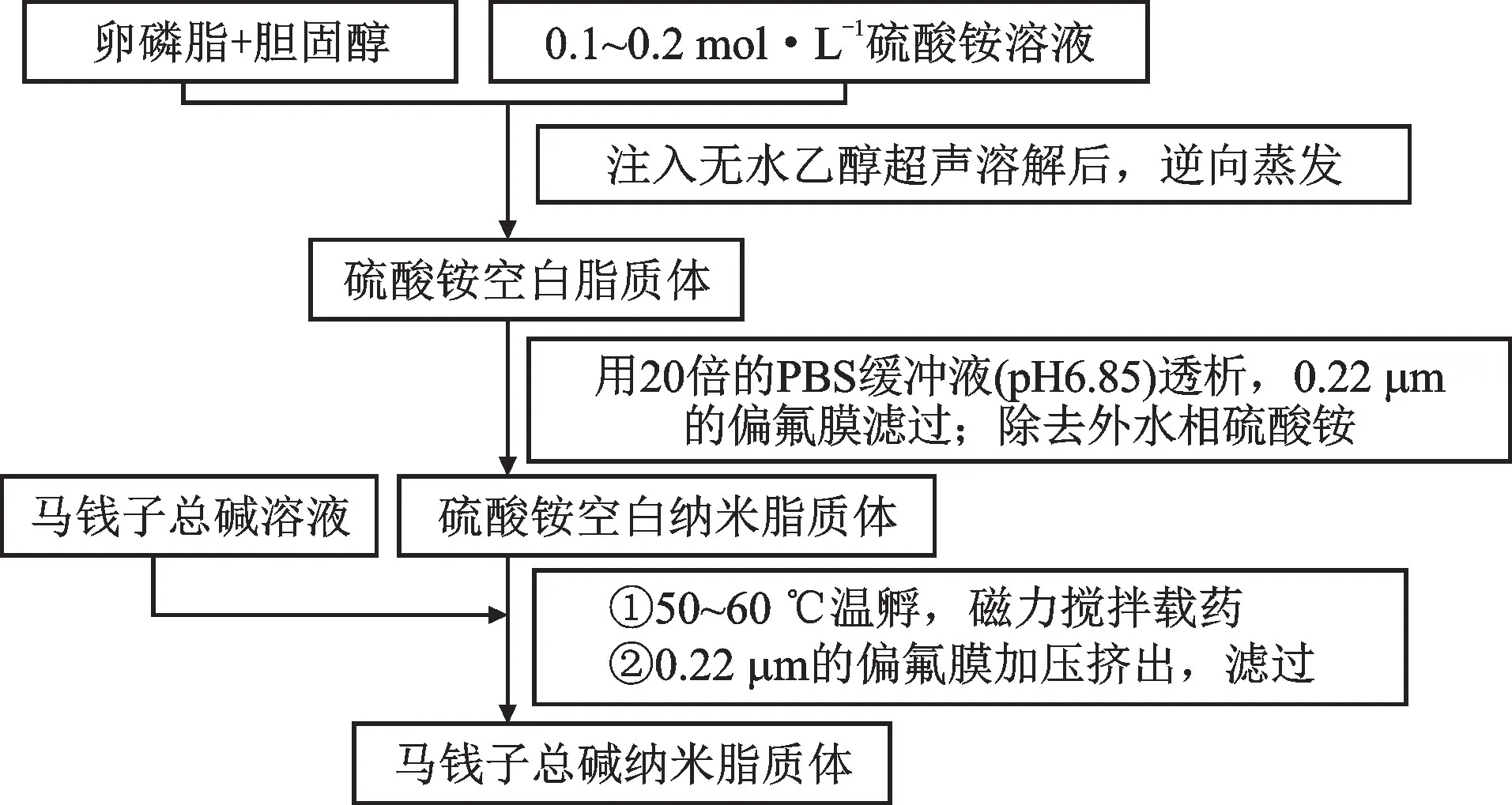
图1 脂质体制备流程Fig.1 Flow of preparation of brucine total alkali nanoliposomes
2.1.3 TAS-NL-Gel的制备 取TAS-NL(质量浓度1 mg·mL-1)10 mL,加促渗剂适量,PBS 溶液(pH 6.0~6.8)4 mL,用三乙醇胺调pH 至6.0~6.8,0.01 mol·L-1盐酸甲醇溶液加至50 g后与预先配制好的质量浓度为20 mg·mL-1的卡波姆940等量混合基质(pH 6.0~6.8)50 g 混合均匀,即得到100 g TAS-NL-Gel(马钱子碱的含量约为100μg·g-1、士的宁的含量约为200μg·g-1)。
2.1.4 TAS-Gel的制备 将2.1.3项下的TAS-NL换成TAS(质量浓度1 mg·mL-1)10 mL,即得到100 g TAS-Gel(含马钱子碱约100μg·g-1、士的宁约200μg·g-1)。
2.2 TAS-NL的质量评价
采用纳米粒度电位仪,以超纯水为分散介质测得马钱子总碱脂质体的Zeta电位为-36 m V、平均粒径为(172±6.19)nm,结果见图2。用透射电子显微镜观察并拍摄照片,见图3。由图3 可见,TAS-NL呈球形,形态完整,分界清晰。
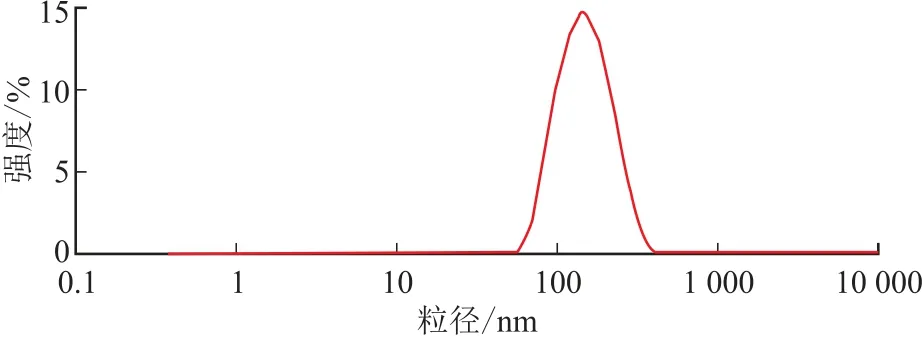
图2 脂质体粒径分布Fig.2 Size distribution of liposomes
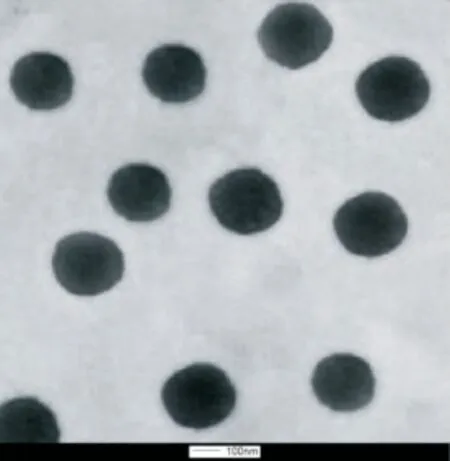
图3 脂质体扫描电镜图Fig.3 The scanning electron microscopic photograph of liposomes
2.3 方法学考察
2.3.1 色谱条件 Hypersil C18色谱柱(250 mm×4.6 mm,5μm);流动相:流动相A(79%)为0.01 mol·mL-1的庚烷磺酸钠和0.02 mol·mL-1磷酸二氢钠等量混合,然后用100 mg·mL-1的磷酸盐调pH=2.8,流动相B(21%)为乙腈;流速:1 mL·min-1;检测波长:262 nm;进样量:20μL;柱温:30℃[9]。
2.3.2 供试液的制备 精密移取TAS浓缩液适量,用0.01 mol·mL-1甲醇溶液溶解后过滤,滤液稀释至对照品溶液质量浓度范围内,262 nm 处进样20μL,记录峰面积S,折算成含量。
2.3.3 线性关系的确定 分别精密称取马钱子碱和士的宁对照品各4 mg,置于100 mL 量瓶中,加入甲醇定容,作为40μg·mL-1对照品储备液备用。分别精密移取对照品储备液1.0、2.0、3.0、4.0、5.0、6.0mL,置于10mL量瓶中,配制成质量浓度为4、8、12、16、20、24μg·mL-1的对照品溶液。以甲醇溶液为空白,于262 nm 处,进样20μL 检测。以峰面积S为纵坐标(y)、质量浓度C(mg·mL-1)为横坐标(x),绘制标准曲线,拟合后分别得马钱子碱的回归方程为y=20 663x-3 742,R2=0.999 0,士的宁的线性回归方程为y=40 073x-1 044,R2=0.999 4,质量浓度范围均为4~24μg·mL-1。
2.3.4 精密度实验 分别取对照品溶液,连续进样6次,每次20μL,记录峰面积S。计算得马钱子碱峰面积的RSD 值为0.87%(n=6),士的宁峰面积的RSD值为0.78%(n=6),表明该方法的精密度良好。
2.3.5 稳定性实验 分别在0、2、4、8、12和24 h分别进样TASS-NL-Gel供试品溶液20μL,记录峰面积S。计算得马钱子碱峰面积的RSD 值为1.21%(n=6),士的宁峰面积的RSD 值为1.13%(n=6),表明该方法的稳定性良好。
2.3.6 重复性实验 取同一批TAS-NL-Gel供试品6份,连续进样6次,每次20μL,记录峰面积S。计算得马钱子碱峰面积的RSD 值为1.12%(n=6),士的宁峰面积的RSD 值为0.93%(n=6),表明该方法的重复性良好。
2.3.7 加样回收率 分别于质量浓度为8.12 μg·mL-1的3份供试液中加入质量浓度为4μg·mL-1(低质量浓度)、8μg·mL-1(中质量浓度)、12μg·mL-1(高质量浓度)的对照品溶液,摇匀后分别进样20μL,记录峰面积S,每个样品重复测定3次,得到马钱子碱的平均回收率(n=3)为100.31%、100.56%、100.19%,平均RSD 值(n=3)为0.52%、0.48%、0.39%;士的宁的平均回收率为100.49%、99.89%、99.12%,平均RSD值(n=3)为0.24%、0.37、0.64%,表明该方法的稳定性、准确性良好。
2.3.8 凝胶的含量测定 取凝胶0.5 g,加甲醇10 mL,超声搅拌3~5 min,高速(7 200 r·min-1)离心30 min,转移至25 mL量瓶中定容。取上清液,经无水硫酸钠脱水后用0.45μm 微孔滤膜过滤。精密吸取滤液1 mL,用0.01 mg·mL-1的甲醇溶液稀释至对照品溶液质量浓度范围内,262 nm 处进样20μL,记录峰面积S,折算成含量[10]。
2.3.9 体外透皮吸收实验 采用改良的Franze扩散池,容积为6.3 mL,有效吸收面积为1 cm2。加入6 mL混合磷酸盐缓冲液(pH 6.0~6.8)作为接收液,将处理好的离体小鼠腹皮与扩散池固定好,取1 g凝胶均匀涂抹于离体小鼠腹皮上,将扩散池置于(37±0.5)℃恒温水浴槽中,在磁力搅拌器持续搅拌下,于0.5、1、2、4、8、12、24 h取出5.0 mL 接收液,同时补以同体积的空白接收液。将5.0 mL 接收液稀释至对照品溶液质量浓度范围内,以PBS溶液(pH 6.0~6.8)为空白,262 nm 处进样20μL,记录峰面积S,计算相应的药物质量浓度Cn,按以下公式计算单位面积累积释药量Q(μg·cm-2)[11]。
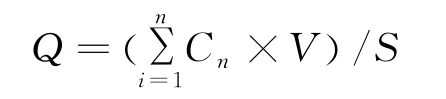
Cn为于第n个取样点测得的药物质量浓度(μg·mL-1);V为接收池的总体积(m L),S为有效扩散面积(cm2)。
2.4 TAS-NL-Gel制剂处方的优化
2.4.1 单因素分析实验 选定载药量(A)、促渗剂的品种(B)、促渗剂的用量(C)和氮酮-丙二醇-桉叶油的比例(D)4个影响因素进行单因素分析,在其他因素不变的情况下,改变任一因素,通过5个水平的变化,考察各因素对马钱子碱Q24的影响,以确定各因素的响应点。因素-水平表见表1,各因素对马钱子碱Q24的影响见图4。
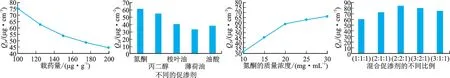
图4 各因素对Q24 的影响(单因素)Fig.4 Influence of various factors on Q24(single factor)

表1 单因素分析的因素与水平Tab.1 Factors and levels of single factor analysis
结果显示,载药量为100μg·g-1、氮酮的质量浓度为30 mg·mL-1、氮酮-丙二醇-桉叶油的比例为2∶2∶1时为最佳处方方案。载药量达到100μg·g-1(临床使用最低起效量)后,继续增大载药量,不能使Q24继续升高,表明凝胶载药具有一定的饱和性,释药具有剂量依赖性。
2.4.2 正交实验设计 结合单因素分析结果确定氮酮的质量浓度(A)、氮酮-丙二醇-桉叶油的比例(B)、载药量(C)和方差(D)为考察因素,以马钱子碱Q24为考察指标,用L9(34)正交实验设计,因素-水平表见表2,正交实验结果见表3,方差分析结果见表4。
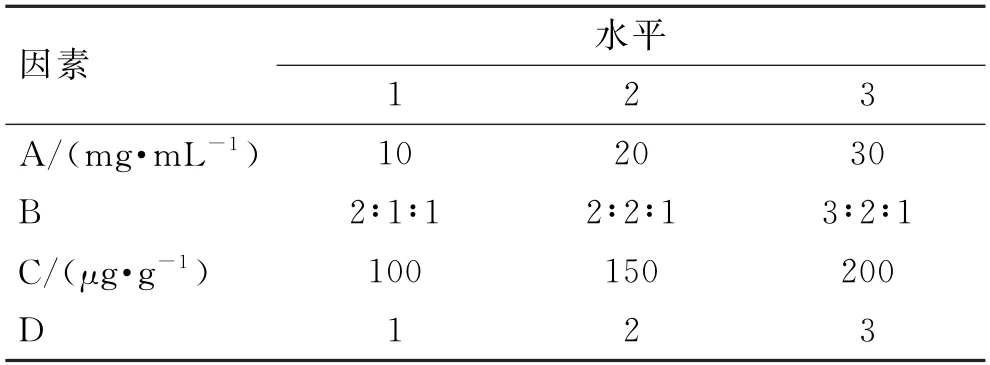
表2 正交实验设计的因素与水平Tab.2 Factors and levels of the orthogonal experimental design
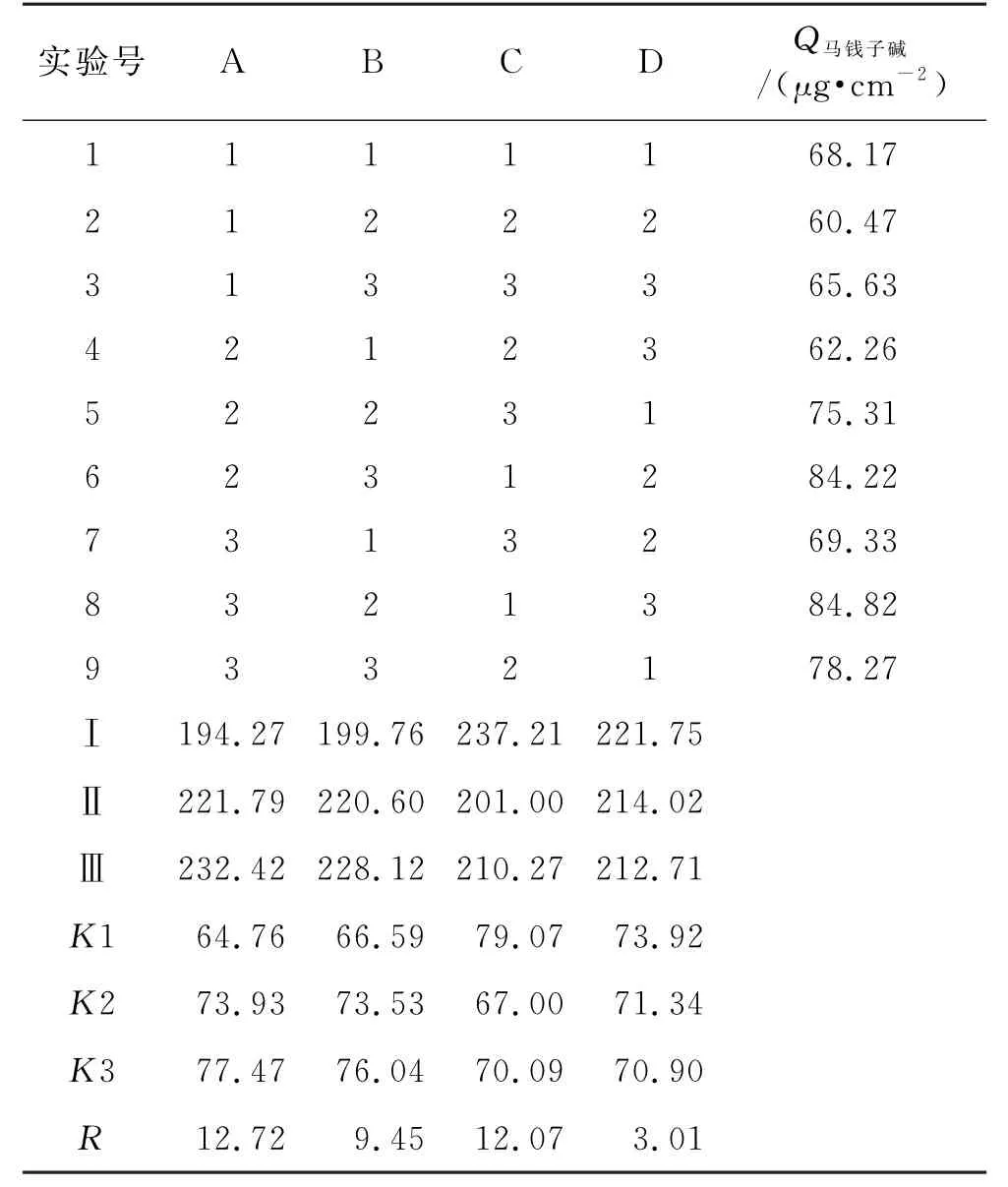
表3 正交设计实验结果Tab.3 Results of the orthogonal experimental design test
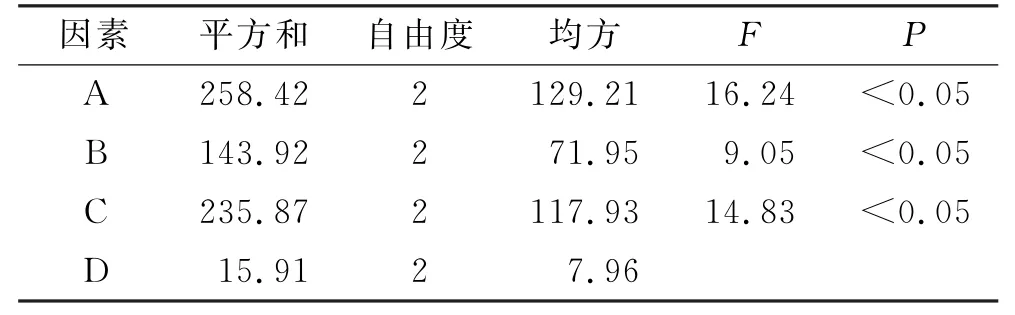
表4 正交实验方差分析结果Tab.4 Analysis of variance in orthogonal experiment
直观分析最优处方方案为A3C1B2,主、次影响因素的顺序为:C>A>B;方差分析结果与直观分析结果相符,主体间效应检验差异具有统计学意义(P<0.05)。因此,在载药量为100μg·g-1、氮酮的质量浓度为30 mg·mL-1、氮酮-丙二醇-桉叶油的比例为2∶2∶1时为最佳处方方案,与实验结果相符。
2.4.3 优化处方验证性实验 按照最优处方方案平行制备3份,Q24(马钱子碱)为(85.16±0.19)μg·cm-2,RSD值为0.19%,Q24(士的宁)为(160.56±0.35)μg·cm-2,RSD值为0.44%,表明最优处方方案稳定、可靠、质量可控。
2.5 TAS-NL-Gel体外渗透动力学考察
2.5.1 24 h单位面积累积渗透率(Q24)实验 根据2.4.2 项下的方法,选用最优处方方案分别制备TASS-NL-Gel和TASS-Gel,结果见表5。结果显示,TAS-NL-Gel中马钱子碱和士的宁的Q24均大于TAS-Gel,经F检验,差异具有统计学意义(P<0.05)。
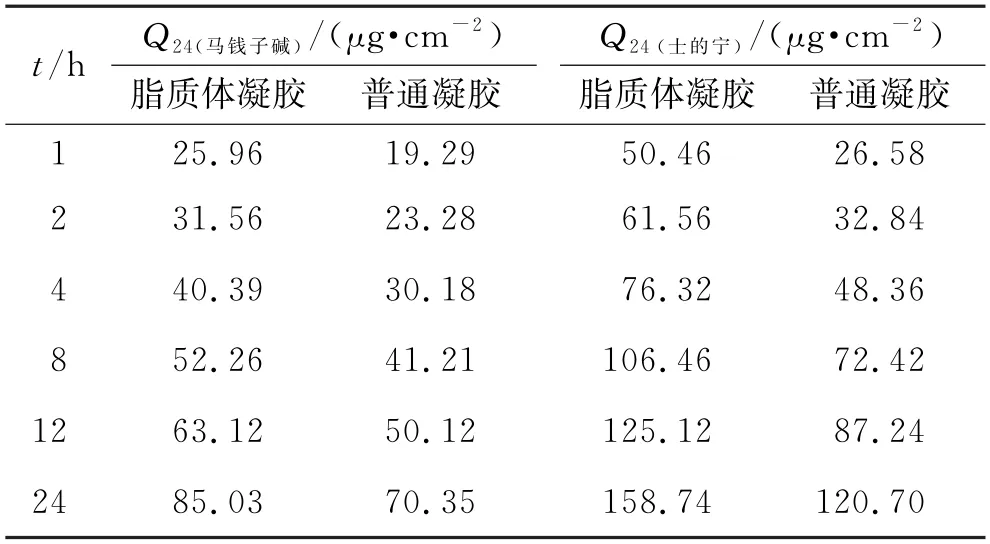
表5 ASS-NL-Gel和TASS-Gel Q24Tab.5 ASS-NL-Gel and TAS-Gel Q24
2.5.2 皮肤滞留量(Qs)实验 体外透皮吸收实验结束后,用生理盐水洗净有效皮肤表面的药物并尽量剪碎,加1 mL 甲醇,涡旋5 min,超声30 min,以5 000 r·min-1离心10 min,上清液用0.45μm微孔滤膜过滤,取滤液按照含量测定的方法,每个样品测定6次,分别记录峰面积S并计算平均Qs,最后折算成单位面积皮肤滞留率(Qs)。
Qs=VC/A,A为有效扩散面积,V为溶解样品的体积,C为测得的马钱子碱和士的宁的质量浓度。
结果显示,马钱子碱和士的宁脂质体凝胶的皮肤滞留量分别为12.50和22.35μg·cm-2,马钱子碱和士的宁普通凝胶的皮肤滞留量分别为8.04和14.67μg·cm-2,TAS-NL-Gel中马钱子碱和士的宁的Qs大于TASS-Gel,经F检验,差异有统计学意义(P<0.05)。
2.5.3 渗透动力学参数和方程拟合 将TAS-NLGel 24 h内累积释药量(Q)和时间(t)的关系与零级释放方程、Higuchi(渗透)方程,用OriginPro 9.0软件拟合,渗透动力学方程的斜率即为稳态渗透速率(Js),拟合结果见表6,渗透动力学参数见表7。
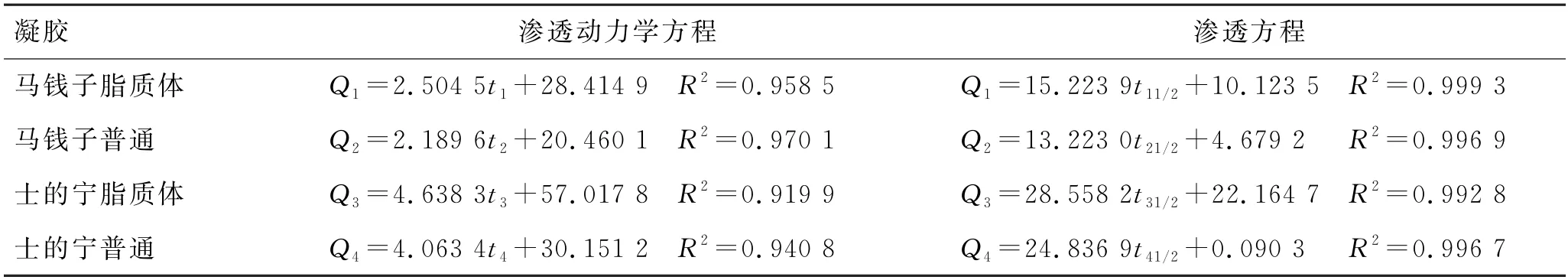
表6 渗透动力学方程拟合结果Tab.6 Fitting results of osmotic dynamics equations
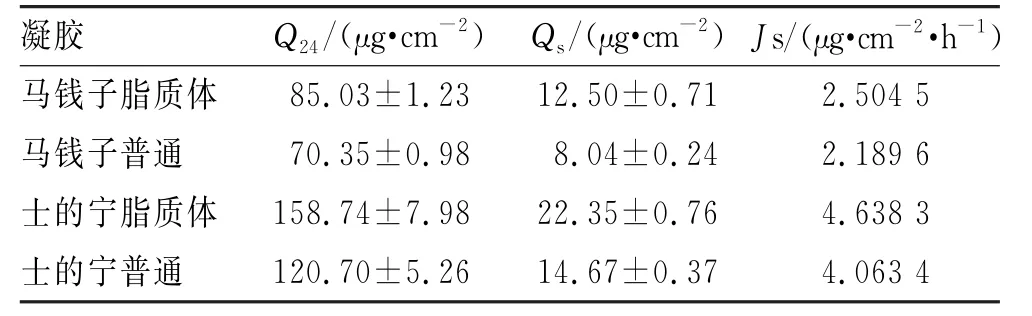
表7 渗透动力学参数Tab.7 Osmotic dynamic parameters
结果显示,TASS-NL-Gel中马钱子碱和士的宁的Js均大于TASS-Gel,经F检验,差异有统计学意义(P<0.05)。
3 讨论
本实验采用硫酸铵主动载药技术(课题组前期研究)制备了TAS-NL 并尝试制成TAS-NL-Gel,从实验结果来看,TAS-NL 的表征相对稳定;TAS-NLGel的Q24均高于TAS-Gel,提示TAS-NL有助于凝胶的透皮吸收;TAS-NL-Gel的Qs均高于TAS-Gel,提示TAS-NL-Gel在皮肤中存在储药库,这种皮肤储库效应,有利于药物持续、缓慢地释放,从而起到减毒增效的作用。
3.1 关于促渗剂
影响凝胶剂发挥作用的关键是药物是否能够按照需要顺利地透过皮肤屏障,大部分研究者常常单独使用某一种促渗剂(如氮酮)来促进药物的渗透。氮酮主要是通过降低药物向角质层间隙中脂质的相转移温度,增大分子的流动性,减小药物在角质层中的扩散阻力,从而增加药物的透过量[12],但由于氮酮的溶解性能差(脂溶性、水溶性均差)故使制成的制剂外观受到一定影响(甚至有微颗粒感),实验结果显示,氮酮的促渗效果与质量浓度呈正相关,但与丙二醇联用时会产生协同作用,最优促渗质量浓度为1~50 mg·mL-1,但当质量浓度超过40 mg·mL-1时,对皮肤的刺激性将影响制剂的长期使用[13];桉叶油的化学性质稳定,有优良的脂溶性和水溶性,自身也具有祛风除湿的作用。皮肤类脂层游离脂肪酸在适当条件下可形成层状液晶结构,桉叶油能渗透进入液晶结构中,打乱甚至破坏液晶结构,但并不影响类脂分子本身的结构,这是桉叶油促进药物经皮吸收可能的原因之一[14]。
3.2 关于载药量
凝胶的载药量主要由凝胶基质的性质决定。介质的pH 值、离子强度、药物性质等因素不同程度地影响卡波姆凝胶的载药能力[14-15]。卡波姆940 在pH 6.0~6.8时黏度适中,可使药物呈零级或近似零级释放的规律进行释放[16]。马钱子总碱为弱生物碱,相对分子质量也比较大,载药量的增大会使药物难以进入网穴,本实验试图通过强化促渗剂效能提高载药量,却止步于100μg·g-1。表明凝胶的载药具有一定的饱和性,释药具有剂量依赖性。
值得注意的是,本研究制备的TAS-NL-Gel中马钱子碱和士的宁Q24的增大可能会导致体内吸收量增加,故应密切关注血药浓度是否在治疗窗内。同时,提示需要对TAS-NL-Gel的剂量进行规范、准确地分割,以免发生中毒反应。皮肤储库效应和促渗效应会使TAS-NL-Gel体内经皮吸收呈现怎样的变化,还需进一步开展在体内经皮吸收行为的研究,探索其在体内准确的释放规律。
