山茱萸粗多糖的超声辅助提取及抗氧化活性研究
2022-05-07姚瑞祺胡家栋
姚瑞祺,胡家栋,王 锋,周 博
杨凌职业技术学院,杨凌 712100
山茱萸是我国传统中药材,是山茱萸科植物山茱萸(CornusofficinalisSieb.et Zucc.)的干燥成熟果肉,主产于陕西、河南和浙江等省[1],具有补益肝肾、涩精固脱的功效[2-3]。山茱萸多糖是山茱萸中重要的活性成分,经研究发现,其对动物免疫系统、循环系统、神经系统及泌尿系统疾病均有一定的治疗和预防作用[4-6],应用前景十分广阔。水提醇沉法是植物多糖的常用提取方法,操作安全、简单,无须大功率提取设备,在生产中应用较多[7-9],但其缺点是提取所需时间较长、多糖得率较低。超声波辅助提取是近年来常用的提取技术,可缩短提取时间、提高产品得率、降低活性物质被破坏的可能性[10-11]。本研究利用超声波辅助提取山茱萸粗多糖,并进行抗氧化活性分析,以期为山茱萸多糖的理论研究和生产应用提供参考。
1 仪器与试药
1.1 仪器
2500C 型多功能粉碎机(永康市金穗机械制造厂);JM-15D-45/80型超声波提取仪、JM-07D-28/45型超声波提取仪、JM-20D-28 型超声波提取仪、JM-16D-80型超声波提取仪、JM-16D-40 型超声波提取仪,均购自深圳市洁盟清洗设备有限公司;UV1901PCS型双光束紫外可见光分光光度计(北京普析通用仪器有限责任公司);R1002B 型旋转蒸发仪(上海申生科技有限公司);DCM-5M 型离心机(上海赫田科学仪器有限公司);BSA423S-CW 分析天平(德国赛多利斯集团)。
1.2 试药
山茱萸(产自陕西省佛坪县,经鉴定为山茱萸科植物CornusofficinalisSieb.et Zucc.的干燥成熟果肉);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(色谱纯,美国Sigma公司);DPPH·(色谱纯,美国Sigma公司);2,6-二叔丁基对甲酚(2,6-Di-tert-butyl-4-methylphenol,BHT,食品级,江苏迈达新材料股份有限公司);苯酚、浓硫酸、葡萄糖、乙醇、FeCl3、FeSO4均为分析纯,均购自国药集团化学试剂有限公司。
2 方法
2.1 实验方案
山茱萸粗多糖的制备工艺流程:山茱萸干粉→粉碎→称质量→超声辅助提取→过滤→浓缩→体积分数为95%的乙醇溶液醇沉→离心→干燥→山茱萸粗多糖。
超声辅助提取方案:分别称取50 g山茱萸干粉,按照不同的料液比加入设定温度(30~55℃)的水中,在设定的超声波频率(28、40、80、28/45、45/80 k Hz)和功率(180~360 W)条件下浸提一定时间(30~120 min)。本研究主要考察超声频率、超声功率、料液比、浸提温度、浸提时间等因素对山茱萸粗多糖提取率的影响。对照组的处理过程与上述方案一致,但不采用超声波辅助浸提。
准确称量制备好的山茱萸粗多糖,用蒸馏水溶解,配置成质量浓度为0.05~0.60 mg·mL-1的溶液,进行抗氧化活性分析(对照品为BHT)。
2.2 指标测定方法
2.2.1 山茱萸粗多糖提取率测定 以葡萄糖为对照品,采用苯酚-硫酸法[12]测定样品山茱萸粗多糖的含量,得出山茱萸粗多糖的提取率。
标准曲线的绘制[13]:分别精密吸取不同体积的葡萄糖供试液,用蒸馏水补充体积至2.0 mL,依次分别加入50 mL·L-1的苯酚和浓硫酸1.0、5.0 mL,摇匀后静置30 min,用紫外可见分光光度计于波长490 nm处测定吸光度,并绘制标准曲线,得回归方程。
样品山茱萸粗多糖含量测定:分别采用苯酚-硫酸法检测不同提取条件下的样品山茱萸粗多糖溶液,根据回归方程计算样品山茱萸粗多糖的含量。按照公式W=[(C×D)/M]×100%计算山茱萸粗多糖的提取率。其中C为样品中山茱萸粗多糖的含量;D为样品稀释倍数;M为称取的山茱萸的质量。
2.2.2 山茱萸抗氧化活性的测定方法 山茱萸抗氧化活性的测定方法有ABTS法和DPPH·法。
ABTS法[14]:取40μL样品溶液置于96孔板中,加入970μL 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]工作液,混匀,在避光条件下静置6 min,测定在734 nm 处的吸光度;以40μL乙醇溶液为对照;计算不同质量浓度样品溶液的ABTS自由基清除率,并计算半数清除质量浓度(IC50)。DPPH·法[15]:在3.0 mL 60μmol·L-1DPPH·乙醇溶液中加入20μL 样品溶液,摇匀后在25℃放置0.5 h,测定在517 nm 处的吸光度(AS);以20μL乙醇为对照(A0);计算不同质量浓度样品溶液的DPPH·自由基清除率,并计算半数清除质量浓度(IC50)。
2.3 统计学方法
应用SPSS 18.0进行数据分析,结果以平均值±标准差表示。
3 结果
3.1 葡萄糖回归方程
葡萄糖回归方程为y=0.011x-0.011,R2=0.999 4。
3.2 单因素实验研究
3.2.1 超声频率对山茱萸粗多糖提取率的影响 不同频率的超声波对山茱萸粗多糖提取率的影响见图1。由图1可见,与无超声波对照相比,在每个浸提时间点,有超声波辅助的山茱萸粗多糖提取率均大于无超声波对照。在30~105 min范围内,随着浸提时间的延长,山茱萸粗多糖的提取率均呈现上升的趋势,105 min以后,提取率增速变缓或趋于不变。

图1 频率对提取率的影响Fig.1 Effect of ultrasonic frequency on extraction yield
相关研究的结果[16-17]表明,单频超声波的频率越低,空化作用越明显,而提取率则越高。这与本实验得到的结果一致,在3个单频超声波处理组中,28 k Hz的提取率最高,之后依次为40和80 k Hz。本实验发现,在任一浸提时间点上,双频组合超声波(28/45和45/80 k Hz)的山茱萸粗多糖的提取率均优于单频超声波(28、40和80 k Hz),其中,28/45 k Hz双频组合超声波的提取率优于45/80 k Hz双频组合超声波(P<0.05),这可能与样品的共振频率相关[18-19]。28/45 k Hz双频组合超声波更接近于山茱萸粗多糖的共振频率,更容易引起共振现象,从而使山茱萸粗多糖的浸提效果更佳。
3.2.2 料液比对山茱萸粗多糖提取率的影响 不同料液比对山茱萸粗多糖提取率的影响见图2。由图2可见,在30~105 min范围内,随着浸提时间的延长,各组山茱萸粗多糖的提取率均稳步上升(P<0.05);105 min以后,增长渐趋平缓或略有下降(P>0.05)。1∶6 的料液比在105 min 时提取率达到最高,为18.25%,而此时对照仅为10.82%(P<0.05)。由此可见,超声辅助提取山茱萸多糖的效果显著。

图2 料液比对提取率的影响Fig.2 Effect of proportion of raw material and water on extraction yield
3.2.3 浸提温度对山茱萸粗多糖提取率的影响 因考虑到过高的温度可能会使山茱萸粗多糖的抗氧化活性减弱,故本实验仅考察了30~55℃的浸提温度范围。不同浸提温度对山茱萸粗多糖提取率的影响见图3。由图3可见,在105 min前,不同温度下的山茱萸粗多糖浸提率均呈现随着浸提时间的延长浸提率逐渐升高的规律。50℃为较为理想的浸提温度,在105 min时山茱萸粗多糖浸提率达到了18.68%;与45和55℃相比,差异具有统计学意义(P<0.05);与无超声对照(9.2%)相比,提取率提升了近1倍。
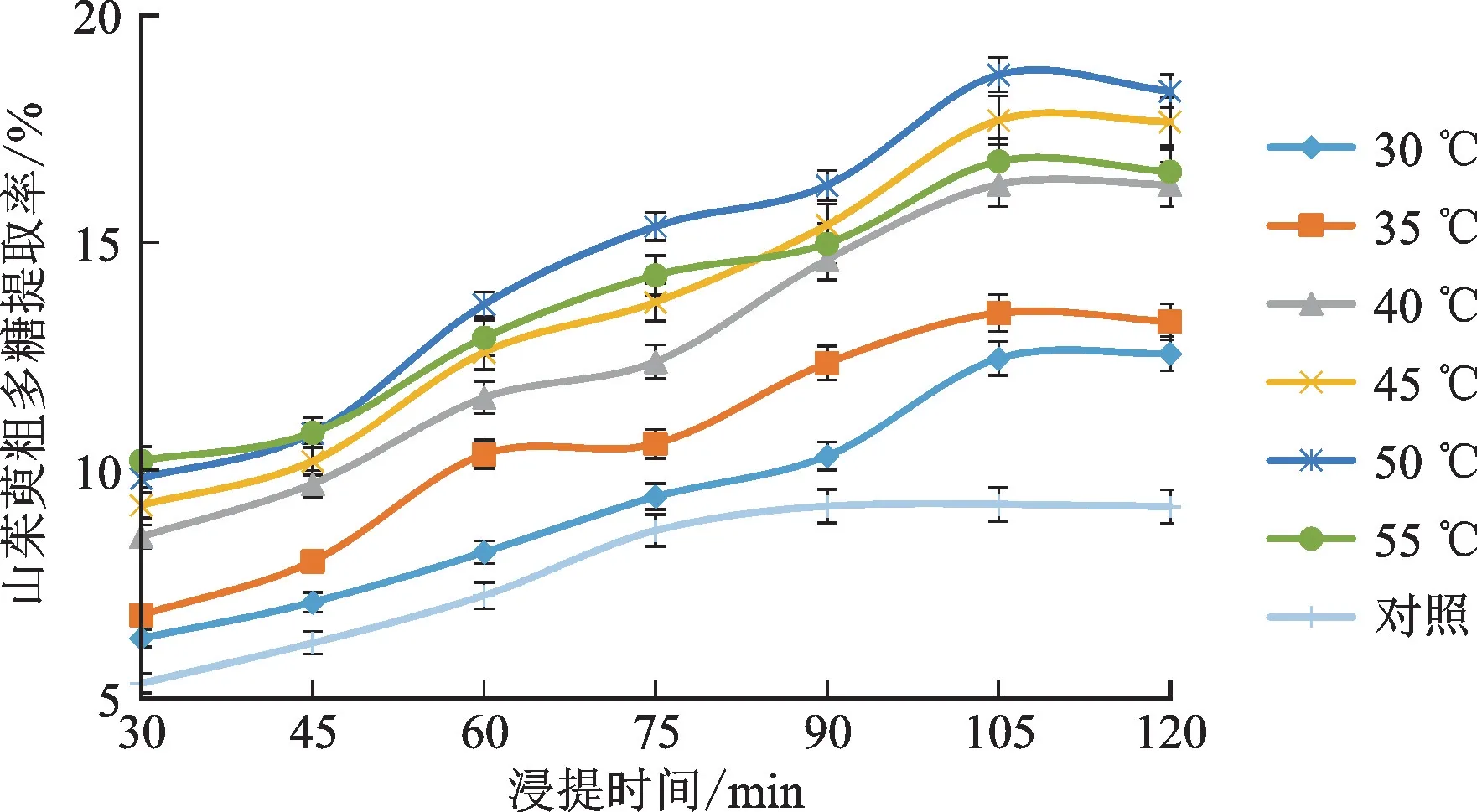
图3 温度对提取率的影响Fig.3 Effect of temperature on extraction yield
3.2.4 浸提功率对山茱萸粗多糖提取率的影响 浸提功率对山茱萸多糖提取率的影响见图4。由图4可见,在180~360 W 超声功率范围内,伴随浸提时间的延长,样品的提取率均呈现先上升后下降的趋势。在330 W 的超声功率作用105 min时,山茱萸粗多糖的提取率最大,达到18.25%;与临界的300和360 W 相比,差异均具有统计学意义(P<0.05)。在180~330 W 范围内,随着超声功率的提高,山茱萸的提取率也逐渐上升,当超声功率达到360 W 时,山茱萸粗多糖的提取率反而有所下降。这可能是由于长时间大功率的超声波作用使部分山茱萸多糖发生了降解[20]。

图4 浸提功率对提取率的影响Fig.4 Effect of power on extraction yield
3.3 正交实验设计
在单因素实验优选数据的基础上,进行正交实验设计,得出最优超声辅助浸提山茱萸粗多糖工艺。正交实验的因素与水平见表1。

表1 正交实验的因素与水平Tab.1 Factors and levers of orthogonal test
正交实验结果和极差分析结果见表2。由表2可见,影响山茱萸粗多糖提取率的因素依次为超声频率(A)>超声功率(D)>料液比(B)>浸提温度(C),最优工艺组合为A2D2B2C3,即超声频率28/45 k Hz、超声功率330 W、料液比1∶6、浸提温度55℃。在此条件下,经3次平行实验验证,发现山茱萸粗多糖的提取率为19.15%。
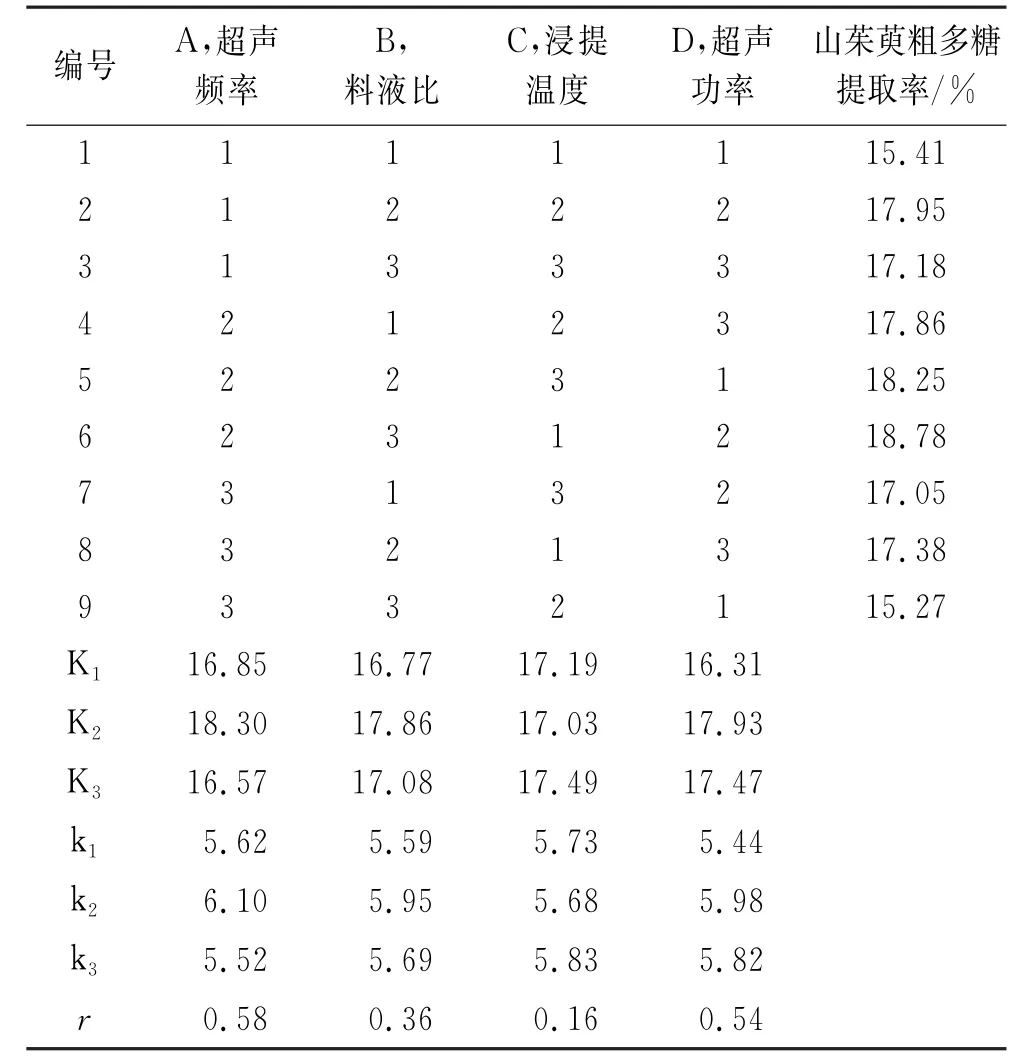
表2 正交实验结果及极差分析结果Tab.2 Results of orthogonal test and analysis of extreme difference range
方差分析结果见表3。由表3可见,超声频率、料液比、超声功率对山茱萸粗多糖提取率的影响均极为显著(P<0.01),而浸提温度则为显著(P<0.05)。

表3 正交实验方差分析结果Tab.3 Results of variance analysis of the orthogonal test
3.4 山茱萸粗多糖抗氧化活性研究
山茱萸粗多糖的抗氧化活性采用ABTS 法和DPPH·法进行检测。IC50值越小,提示清除自由基的能力越强。
BHT 是一种化学合成的抗氧化剂,具有极强的抗氧化作用,对各类自由基均有较强的清除作用,被广泛应用于食品行业,在生产中可以作为食品添加剂中的抗氧化剂使用[21]。不同质量浓度的山茱萸粗多糖和BHT 对照对ABTS及DPPH·的清除效果分别见图5和图6。
3.4.1 ABTS法 由图5可见,质量浓度在0.02~0.20 mg·mL-1范围内时,BHT 对ABTS的清除率随质量浓度的增加而呈直线上升的趋势,当质量浓度继续增大时,清除率基本保持不变,维持在90.5%。在同一质量浓度下,虽然山茱萸粗多糖的ABTS清除率低于对照BHT,但随着质量浓度的增加,其对ABTS自由基的清除率也逐渐升高,当质量浓度达到0.4 mg·mL-1时,曲线趋于平缓,清除率达到65.71%,约为对照BHT 的2/3。经曲线模拟计算,山茱萸粗多糖对ABTS的IC50值为0.26 mg·mL-1。

图5 山茱萸粗多糖和BHT对ABTS自由基的清除效果Fig.5 Scavenging effects of Cornus officinalis crude polysaccharides and BHT on ABTS free radicals
3.4.2 DPPH·法 DPPH·是一种稳定的自由基,其乙醇溶液为紫色;有自由基清除剂存在时,DPPH·的单电子被捕捉而使其乙醇溶液的颜色变浅,在517 nm 波长处吸光度会有所下降,根据下降的程度可评价实验样品的抗氧化能力。
山茱萸粗多糖和BHT 对DPPH·的清除效果见图6。由图6可见,质量浓度在0.05~0.30 mg·mL-1范围内时,BHT对DPPH·的清除率随质量浓度的增加而增大,直至达到最大清除率(95.24%);随后曲线趋于平缓,DPPH·清除率的变化不明显。山茱萸粗多糖的质量浓度在0.05~0.45 mg·mL-1范围内时,DPPH·的清除率低于BHT,但呈现了质量浓度越大清除率越高的趋势;当质量浓度超过0.45 mg·mL-1时,山茱萸粗多糖对DPPH·的清除率基本平稳,达到了最高值(95.70%),与相同质量浓度BHT的清除率接近。经曲线模拟计算,山茱萸粗多糖对DPPH·的IC50值为0.28 mg·mL-1,BHT对DPPH·的IC50值为0.16 mg·mL-1。
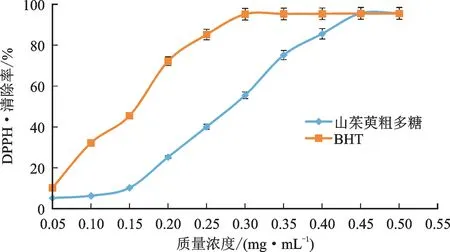
图6 山茱萸粗多糖和BHT对DPPH·的清除效果Fig.6 Scavenging effects of Cornus officinalis crude polysaccharide and BHT on DPPH·
4 结论与讨论
超声波辅助提取可用于山茱萸粗多糖的提取,影响提取率的因素主要有超声频率、料液比、浸提温度、超声功率等。与无超声波对照相比,超声辅助提取能显著提高山茱萸粗多糖的浸提率。在单因素实验条件下,双频组合超声波(28/45和45/80 k Hz)的浸提效果优于单频超声波(28、40和80 k Hz),且以28/45 k Hz为佳;超声功率以330 W 为佳。这可能是因为28/45 k Hz双频组合超声波更接近于山茱萸粗多糖的共振频率,容易引起共振现象;在330 W 功率下,超声波的能量能最大程度地作用于山茱萸,且未引起多糖的降解,对山茱萸粗多糖的浸提效果更佳。经正交实验,得出超声辅助提取山茱萸粗多糖的最优工艺为超声频率28/45 k Hz、超声功率330 W、料液比1∶6、浸提温度55℃,在此工艺条件下,山茱萸粗多糖的提取率可达19.15%。
山茱萸粗多糖对ABTS的IC50值为0.26 mg·mL-1,其清除ABTS的能力在质量浓度0~0.4 mg·mL-1范围内呈现质量浓度依赖,即质量浓度越高,清除能力越强;质量浓度在0.4 mg·mL-1以上时,清除率不再继续增大,维持在65.71%,约为对照BHT的2/3。山茱萸粗多糖对DPPH·的IC50值为0.28 mg·mL-1,其清除ABTS的能力在质量浓度为0.05~0.45 mg·mL-1范围内呈现质量浓度依赖,质量浓度越高,清除能力越强;质量浓度在0.45 mg·mL-1以上时,清除率不再继续增大,维持在95.70%,与对照BHT的最大清除率基本相同。
综上所述,超声波辅助提取能有效提高山茱萸粗多糖的提取率,本研究利用单因素和正交实验筛选出了最佳提取工艺;经超声波辅助浸提制得的山茱萸粗多糖具有较好的抗氧化活性,能有效清除ABTS 和DPPH·自由基。
