Rhopaladins类似物对宫颈癌Hela细胞增殖、凋亡的影响及其机制
2022-05-05王彦娇曾小华柯丽娜朱秀莲陈琴华李斌
王彦娇,曾小华,柯丽娜,朱秀莲,陈琴华,李斌
1 锦州医科大学国药东风总医院研究生培养基地,湖北十堰442008;2 湖北医药学院附属国药东风总医院妇产科;3 湖北医药学院药学院武当特色中药研究湖北省重点实验室
宫颈癌是女性生殖系统恶性肿瘤,好发于子宫颈外口柱状上皮与鳞状上皮交接处,全球每年宫颈癌新发病例接近53万例,每年宫颈癌的死亡人数超过25 万,而且年轻女性患者所占比例越来越多,严重影响女性的心理健康和生活状况[1]。宫颈癌常用的治疗方法包括手术、放疗和化疗等,虽取得一定的治疗效果,但对于晚期或复发宫颈癌治疗效果欠佳,研发新的宫颈癌药物是目前急需解决的问题。近年来,临床医师常采用海洋药物来控制宫颈癌,是研究和治疗此病的新思路[2]。Rhopaladins A~D 是从冲绳海洋被膜植物Rhopalaea sp 中分离出的新的双吲哚生物碱,对与宫颈癌预后相关的癌基因CerbB-2有显著的抑制作用[3-6]。本课题组前期化学合成的Rhopaladins 类似物(简称RPDPB),分子结构与Rhopaladins 类似,体外实验证实RPDPB 具有抑制宫颈癌Caski 细胞增殖并促进其凋亡的作用[7-8]。但前期实验关于RPDPB 对宫颈癌Hela 细胞的作用及可能的作用机制少有探讨。2020 年8 月—2021 年4 月,我们观察了RPDPB对宫颈Hela细胞增殖、凋亡的影响,并探讨其作用机制。
1 材料与方法
1.1 细胞株、RPDPB 及主要试剂 Hela 细胞(宫颈癌细胞,货号CL-0101),购自中国典型培养物保藏中心。RPDPB 由武当特色中药研究湖北省重点实验室提供。MEM 培养基(Procell),FBS(CellMax 赛澳美),二甲基亚砜(Mpbio 公司),0.1%胰酶(Sigma公司),细胞计数试剂盒-8(CCK-8),细胞凋亡试剂盒(rh Annexin V/FITC Kit,MultiSciences 公司),TRIzol试剂(Invitrogen 公司),PCR 引物(上海生工生物有限公司合成),mRNA 逆转录试剂盒(Fermentas公司),SYBR Green Realtime PCR Master Mix(Toyobo公司),miScript SYBR Green PCR Kit、miScript ⅡRT Kit(Qiagen 公 司),Wnt1、Wnt2b、beta Catenin 抗 体(Abcam公司),GAPDH抗体和HRP标记的山羊抗兔二抗(Antgene公司)。
1.2 Hela 细胞培养 Hela 细胞培养于10%FBS 和1%青霉素—链霉素的MEM 培养基中,置于37 ℃、含5%CO2及饱和湿度细胞培养箱中,每周换液2~3次。
1.3 Hela 细胞分组、RPDPB 的给予方法及细胞增殖抑制率测算 采用CCK-8 法。取对数生长期HeLa 细胞,按1.5×104个细胞/孔,接种于96 孔板,置于37 ℃、含5%CO2培养箱中过夜。将细胞分为实验组、对照组、空白组,实验组又分为不同剂量组,不同 剂 量 组 分 别 以3.125、6.25、12.5、25、50、100 μmol/L RPDPB 干预,对照组只加DMSO 培养液,空白组加入不含细胞的MEM 培养液,每组均设6 个复孔。分别于24、48、72 h 后终止培养,各孔均加入110 μL 的CCK-8 试剂混合液,混匀,继续培养1 h,酶标仪检测450 nm 处的吸光度(OD)值。计算细胞增殖抑制率,细胞活力(%)=(实验组OD值-空白组OD 值)/(对照组OD 值-空白组OD 值)×100%,细胞增殖抑制率(%)=1-细胞活力(%)。48 h IC50值为17.63 μmol/L,相同方法检测RPDPB对肝细胞(LO2)的毒性,48 hIC50为95.20 μmol/L,故选取后续实验药物浓度为12.5、50、100 μmol/L,药物作用时间为48 h。
1.4 Hela 细胞分组、RPDPB 的给予方法及细胞凋亡率测算 采用AnnexinV-FITC/PI 双染法。取对数生长期细胞,按1.0×106个细胞/mL,接种于6 孔板,置于培养箱中过夜,待细胞贴壁后,将细胞分为实验组和对照组,实验组又分为不同剂量组,不同剂量组分别以12.5、25、50 μmol/L RPDPB 混合液刺激,对照组不予处理,均设3 个复孔。培养48 h 后,收集上清和细胞,PBS洗2次,弃上清,Binding Buffer液重悬细胞,Annexin V-FITC和PI液染色,室温避光反应5 min,1 h 内流式细胞仪检测细胞凋亡。流式细胞技术检测早期凋亡细胞群:Annexin-V(+),PI(-);晚期凋亡细胞群或坏死细胞群:Annexin-V(+),PI(+);机械损伤细胞群:Annexin-V(-),PI(+);正常细胞群:Annexin-V(-),PI(-)。计算细胞凋亡率,早期凋亡率(%)=早期凋亡细胞数/总细胞数×100%,晚期细胞凋亡率(%)=晚期凋亡细胞数/总细胞数×100%。
1.5 Hela 细胞分组、RPDPB 的给予方法及人乳头瘤病毒18 E6(HPV18 E6)、人乳头瘤病毒18 E7(HPV18 E)7、WNT2B、β-catenin mRNA 和miR-145 RNA 检测 采用实时定量PCR 法。实验分组及各组干预方法与“1.4”相同。TRIzol法提取总RNA,逆转录后再PCR 扩增。依据说明书操作,GAPDH mRNA、WNT2B mRNA、β-catenin mRNA 反应条件为95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,40 个循环。 E6、E7 mRNA 反应条件:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火10 s,72 ℃延伸15 s,40 个循环。U6 和miR-145 RNA 反应条件:95 ℃预变性15 m,94 ℃变性15 s,55 ℃退火30 s,70 ℃延伸30 s,40 个循环。数据分析采用2-ΔΔCt法,实验重复3次,每次设置3个复孔。GAPDH 引物序 列:F-AATGGGCAGCCGTTAGGAAA,R-GCGCCCAATACGACCAAATC;HPV18 E6 引物序列:FCTGCAATGTTTCAGGACCCA,R-TCATGTATAGTTGTTTGCAGCTCTGT;HPV 18 E7 引物序列:F-GAGGAGGAGGATGAAATAGATGGT,R-CACTTGCAACAAAACGTTACAATATTG;wnt2b 引 物 序 列:FAAACCCTGAAGAGCCCAAGCAATG,R-AGAAAGAGTGAAAGGAGACAGCAGTG;β-catenin引物序列:F-TCTGAGGACAAGCCACAAGATTACAAG,R-TCAGCAGTCTCATTCCAAGCCATTG;U6 引物序列:FGTGCTCGCTTCGGCAGCACATAT;miR-145-5p 引物序列:F-GTCCAGTTTTCCCAGGAATCCCT。
1.6 Hela 细胞分组、RPDPB 的给予方法及WNT2B、β-catenin 蛋白检测 采用Western blot 法。实验分组及各组干预方法与“1.4”相同。加入裂解液、蛋白酶抑制剂及磷酸酶抑制剂裂解细胞,抽提蛋白,BCA 法定量,上样,SDS-PAGE 凝胶电泳,电泳结束将蛋白湿转至0.45 μm 的PVDF 膜上,结束后用5%的脱脂牛奶封闭1 h,一抗4 ℃孵育过夜,TBST洗膜3 次,加入二抗室孵育2 h,TBST 洗膜3 次,每次10 min,ECL 法曝光显色。用Image Pro Plus6.0软件进行灰度值分析。
1.7 统计学方法 采用SPSS23.0 统计软件。符合正态分布的计量资料以-x±s表示,比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组不同时点细胞增殖抑制率 细胞增殖抑制率见表1。由表1可知,与对照组比较,实验组增殖抑制率增加,且呈时间和剂量依赖性(P均<0.05)。

表1 两组不同时点OD值和细胞增殖抑制率(%)
2.2 各组早期细胞凋亡率、晚期细胞凋亡率 早期细胞凋亡率、晚期细胞凋亡率见表2。由表2 可知,与对照组比较,实验组早期细胞凋亡率和晚期细胞凋亡率增加,且呈剂量依赖性(P均<0.05)。
表2 两组早期细胞凋亡率、晚期细胞凋亡率(%,±s)
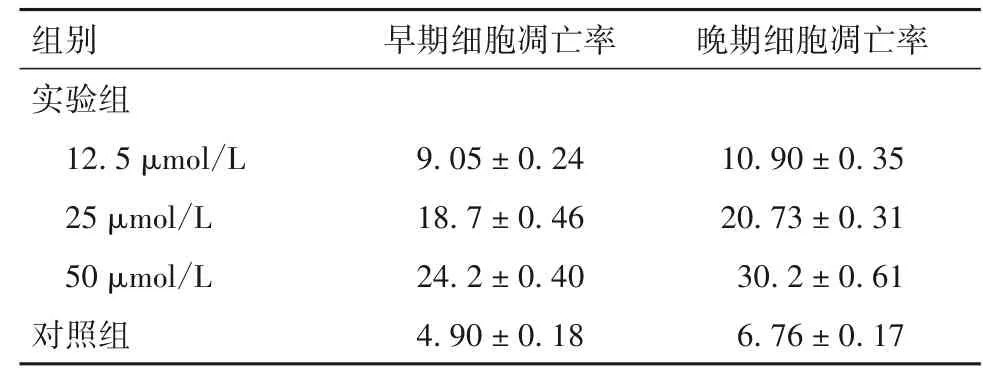
表2 两组早期细胞凋亡率、晚期细胞凋亡率(%,±s)
组别实验组12.5 μmol/L 25 μmol/L 50 μmol/L对照组早期细胞凋亡率9.05±0.24 18.7±0.46 24.2±0.40 4.90±0.18晚期细胞凋亡率10.90±0.35 20.73±0.31 30.2±0.61 6.76±0.17
2.3 两 组 细 胞HPV18 E6 mRNA 、HPV18 E7 mRNA、miR-145 RNA、WNT2B mRNA、β-catenin mRNA 相对表达量比较 细胞HPV18 E6 mRNA、HPV18 E7 mRNA、miR-145 RNA、WNT2B mRNA、β-catenin mRNA 相对表达量见表3。由表3 可知,与对照组比较,实验组HPV18 E6 mRNA、HPV18 E7 mRNA 、WNT2B mRNA 、β -catenin mRNA 相对表达量降低,miR-145 RNA 相对表达量升高,且呈剂量依赖性(P均<0.05)。
表3 两组细胞HPV18 E6 mRNA、HPV18 E7 mRNA、miR-145 RNA、WNT2B mRNA、β-catenin mRNA相对表达量(±s)

表3 两组细胞HPV18 E6 mRNA、HPV18 E7 mRNA、miR-145 RNA、WNT2B mRNA、β-catenin mRNA相对表达量(±s)
组别实验组12.5 μmol/L 25 μmol/L 50 μmol/L对照组HPV18 E6 mRNA 0.79±0.10 0.52±0.04 0.26±0.15 1.04±0.03 HPV18 E7 mRNA 0.78±0.04 0.54±0.10 0.30±0.06 1.23±0.22 miR-145 RNA 1.37±0.08 1.99±0.17 2.73±0.33 1.00±0.09 WNT2B mRNA 0.72±0.08 0.45±0.10 0.24±0.05 1.01±0.16 β-catenin mRNA 0.86±0.05 0.52±0.10 0.31±0.02 1.00±0.01
2.4 两组细胞WNT2B、β-catenin 蛋白相对表达量比较 细胞WNT2B、β-catenin 蛋白相对表达量见表4。由表4 可知,与对照组比较,实验组WNT2B、β-catenin 蛋白相对表达量降低,且呈剂量依赖性(P均<0.05)。
表4 两组细胞WNT2B、β-catenin蛋白相对表达量(±s)
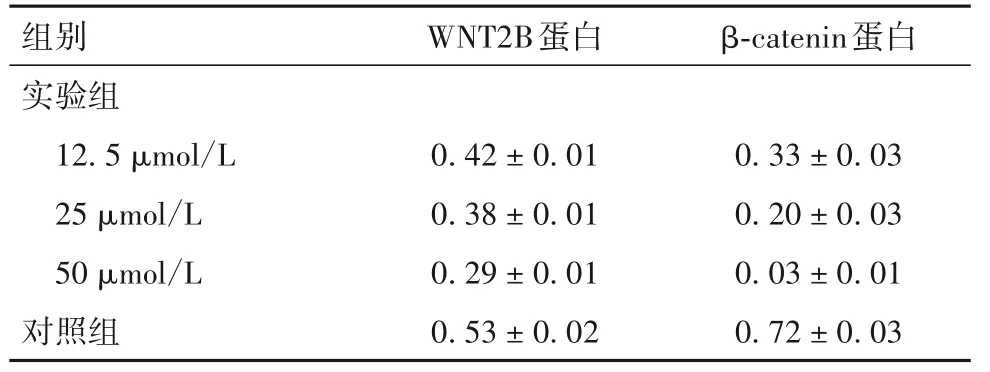
表4 两组细胞WNT2B、β-catenin蛋白相对表达量(±s)
组别实验组12.5 μmol/L 25 μmol/L 50 μmol/L对照组WNT2B蛋白0.42±0.01 0.38±0.01 0.29±0.01 0.53±0.02 β-catenin蛋白0.33±0.03 0.20±0.03 0.03±0.01 0.72±0.03
3 讨论
宫颈癌是好发于子宫颈外口柱状上皮与鳞状上皮交接处的女性生殖系统恶性肿瘤,主要以宫颈接触性出血阳性或不规则阴道流血阳性、阴道排液为主,不同年龄段患者阴道流血表现略有差异,早期患者往往无自觉症状,多在体检时发现。宫颈癌是全世界威胁女性健康最常见的恶性肿瘤,疾病进展是制约其疗效、影响预后的重要因素之一。宫颈癌临床上主要以手术治疗和放疗为主,化疗为辅。对于晚期患者和复发转移的患者来说,主要以全身化疗为主,但因为多种因素影响,目前临床上患者的化疗不太理想。
近年来,海洋生物碱治疗宫颈癌的研究逐渐成为热点,海洋生物碱具有抗病毒、抗炎及抗肿瘤等作用[9],其中RPDPB 是通过化学合成的海洋生物碱吡咯烷酮类衍生物,同样具有抗肿瘤作用。前期实验发现,RPDPB 中部分化合物显著抑制宫颈癌和肝癌细胞增殖[10]。体外研究证实,RPDPB 具有抑制宫颈癌Caski 细胞增殖并促进其凋亡的作用。本研究发现,与对照组比较,实验组宫颈癌Hela 细胞增殖率增加,呈时间及剂量依懒性,细胞凋亡率上升,呈剂量依懒性,提示RPDPB可以抑制宫颈癌Hela细胞增殖,并促进其凋亡的作用。
持续性高危型HPV 感染是导致宫颈癌的必然原因,其中HPV16、18 导致了超过75%的子宫颈癌病例[11]。MALLA 等[12]和PAL 等[13]发现,E6 和E7 癌蛋白是驱动宫颈癌进展的生物标志物,其分别通过干扰p53 和pRb 来影响致病进程(癌细胞增殖、细胞凋亡、转移和耐药性,早期癌基因介导的信号通路)。最新研究[12]发现,针对E6 和E7 的靶向治疗已被证明在集中去除异常繁殖的恶性细胞方面非常有效。宫颈癌的靶向治疗药物的研究成为治疗宫颈癌的重点。前期实验发现,RPDPB 可抑制宫颈癌Caski 细胞增殖,并促进细胞凋亡,机制可能与E6/E7 的表达下降有关[8-9]。本研究显示,与对照组比较,实验组E6/E7 mRNA相对表达量下降,且呈剂量依赖性,这提示RPDPB 可能通过抑制E6/E7 表达,进而抑制宫颈癌HeLa细胞增殖,促进细胞凋亡。MICHAEL 等[14]首次发现,miR-145 在结直肠肿瘤中表达上调。miR-145 是一种肿瘤抑制因子,可以抑制各种癌症,如前列腺癌、胃癌、子宫内膜癌和膀胱癌[15-18]。研究[19]表明,宫颈癌细胞中miR-145 与E6/E7 表达呈负相关,HPV E6/E7 低表达时miR-145 高表达,宫颈癌细胞的生长与进展明显受抑[20]。过表达的miR-145 可抑制宫颈癌细胞的活力、迁移和侵袭[21]。而且miR-145 高表达时,宫颈癌患者的生存时间越长和预后情况越好[22]。本研究发现,实验组miR-145 RNA 相对表达量升高,且呈剂量依赖性。此与LU 等[19]和SHI 等[20]研究结果一致,提示RPDPB 可能通过抑制E6、E7 mRNA 表达,进而上调miR-145 RNA 表达,达到调控Hela 细胞生长的目的。另有研究[18,23-24]发现,miR-145-Wnt/β-catenin 信号通路在膀胱癌、大肠癌及乳腺癌的进展中均发挥了重要作用。研究证实,Wnt2b 是miR-145 的靶基因。在宫颈癌中,当miR-145 相对高表达时,导致其下游靶向基因Wnt2b 表达下降,同时遏制β-catenin表达,最终使Wnt/β-catenin 通路失活,抑制宫颈癌细胞增殖、促进凋亡、抑制迁移和侵袭[25]。WANG等[26]发现,E6/E7 癌蛋白直接或间接与β-catenin 相互作用,激活Wnt/β-catenin 信号通路,最终促进宫颈癌发生。而且β-catenin 表达量越高,肿瘤的恶性程度越高,迁移和侵袭能力越强,患者预后越差[27]。本研究发现,与对照组比较,实验组WNT2B、β-catenin 蛋白相对表达量降低,且呈剂量依赖性。此结果与Li等[25]研究结果相同。
总之,RPDPB可抑制宫颈癌Hela细胞增殖,并诱导细胞凋亡,呈时间和剂量依懒性,最佳抑制时间为48 h,最佳抑制浓度为17.63 μmol/L,作用机制可能是其通过下调HPVE6/E7 mRNA表达,导致miR-145 RNA 表达上调,进而抑制下游WNT2B/β-catenin 通路中WNT2B、β-catenin mRNA和蛋白表达。
