子宫内膜癌组织中miR-128-3p、Notch1 mRNA、BMI1 mRNA的表达变化及其意义
2022-05-05吴晓蕊靳荣卢慧
吴晓蕊,靳荣,卢慧
天津市第五中心医院妇产科,天津300450
子宫内膜癌是起源于子宫内膜上皮的恶性肿瘤,为女性生殖系统常见恶性肿瘤,全球发病率为10.8/10 万,约41.7 万例[1]。早期子宫内膜癌的肿瘤局限于子宫体,手术切除病灶可取得较好预后,但对于晚期子宫内膜癌,术后转移复发几率高,尽管近年靶向和免疫治疗显著进步,但患者生存率仍不能令人满意[2]。肿瘤是多因素、多基因变异参与的过程,非编码RNA 是一类不编码蛋白质的RNA,参与调节细胞增殖、分化、侵袭、迁移、凋亡等行为,在子宫内膜癌发生发展中发挥重要调控作用[3-4]。微小RNA-128-3p(miRNA-128-3p)是 一 种 高 度 保 守的miRNA,其参与宫颈癌、结直肠癌等多种恶性肿瘤进展[5-6]。缺口受体1(Notch1)是一种配体激活的转录因子,能与同源配体相互作用而改变蛋白构象,激活下游特定靶基因表达,在细胞发育、分化、增殖、凋亡等过程中发挥调节作用[7]。B 细胞特异性莫洛尼鼠白血病病毒整合位点1(BMI1)是多梳抑制复合物1复合体的一个组分,能通过修饰染色质,参与细胞增殖、凋亡、侵袭、迁移等调控[8]。研究报道,Notch1和BMI1在子宫内膜癌中高表达,与癌细胞恶性行为相关[9-10]。2014 年10 月—2018 年10 月,我们观察了子宫内膜癌组织中miR-128-3p 及Notch1、BMI1 mRNA的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择2014 年10 月—2018 年10 月天津市第五中心医院收治的子宫内膜癌患者50例,年龄35~76(50.25±5.66)岁;组织学分型:子宫内膜样癌(EEC)124 例,非子宫内膜样癌(NEEC)26例;分化程度:低分化59 例,中高分化91 例;国际妇产科联盟(FIGO)分期[11]:Ⅰ~Ⅱ期91 例,Ⅲ~Ⅳ期59 例;血管侵犯:有36 例,无114 例;淋巴结转移:有60 例,无90 例。纳入标准:①经术后病理检查确诊为子宫内膜癌;②入院前未接受任何放疗、化疗、免疫治疗、激素治疗等;③病理资料和随访资料完整者。排除标准:①合并其他部位肿瘤者;②非原发性性子宫内膜癌者;③严重心、肝、肾等脏器疾病者;④全身感染性疾病者;⑤合并其他严重妇科疾病者。手术留取子宫内膜癌及其癌旁(距离癌组织>5 cm)组织各150 例份,新鲜组织获取后立即分装于冻存管中置放入液氮保存。本研究经医院伦理委员会批准,且患者及家属均知情同意。
1.2 子宫内膜癌组织中miR-128-3p 及Notch1、BMI1 mRNA 检测 取出液氮冻存组织,加入TRIzol(上海捷瑞生物工程有限公司,货号:GK3006)裂解提取组织总RNA,核酸蛋白测定仪(德国艾本德,型号:BioPhotometer plus)测定总DNA 浓度及纯度,使OD260/OD280为1.8~2.0,Takara 试剂盒反转录合成cDNA,使用qRT-PCR 仪(美国伯乐公司,型号:S1000)和试剂盒(北京宝日医生物技术有限公司,货号:639506)进行qRT-PCR 扩增。miR-128-3p 上游引 物:5′-GGAATTCAACCAACTGTCAATAACTGGAG-3′,下游引物:5′-CGGGATCCAATTTGTCATCCAAATCTACTTTGG-3′;内 参U6 上 游 引 物:5′-TGAACGCCGAGGGTGAGTGTCG-3′,下游引物:5′-CGGAACGTGACGTGTGGCGTACG-3′;Notch1 上游引物:5′-CGTGTGAACCCGTAGGCGCC-3′,下游引物:5′-GGCCAACGTGTGCAAGCGACGGC-3′;内参GAPDH 上 游 引 物:5′-GCGATAAGTGCTGAGCTGCTC-3′,下游引物:5′-GTTGACGCGAACTGACGTGT-3′;BMI1 上游引物:5′-CTGGTTGCCCATTGACAGC-3′,下 游 引 物:5′-CAGAAAATGAATGCGAGCCA-3′;内参GAPDH 上游引物:5′-TGCACCACCA ACTGCTTAGC-3′,下游引物:5′-GGCATGGACTGTGGTCATGAG-3′。反 应 体 积 共20 μL:10 μL 2×All-in-One qPCR Mix;2 μL上游、下游引物;2 μL cDNA 模板;4 μL 经DEPC 处理水。反应条件:95 ℃预变性10 min 1 次;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s,循环40次。反应结束后得到各反 应 管Ct,构 建 溶解 曲线,采 用2-ΔΔCt法 计算 组织中miR-128-3p及Notch1、BMI1 mRNA相对表达量。
1.3 随访方法 通过门诊或电话方式随访3 年,随访至2021 年10 月,随访内容包括妇科盆腔检查、阴道B 超、胸部X 线检查,必要时进行CT 或MRI检查,统计术后3年累积生存率。
1.4 统计学方法 采用SPSS26.0 统计软件。计数资料比较采用χ2检验;符合正态分布的计量资料以±s表示,组间比较采用t检验;Pearson 相关分析法分析子宫内膜癌组织中miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达的相关性;K-M 法绘制不同miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达子宫内膜癌患者生存曲线,组间生存率比较采用Log-rank检验;多因素Cox 回归分析法分析子宫内膜癌患者死亡影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜癌及其癌旁组织中miR-128-3p、Notch1 mRNA、BMI1 mRNA 相对表达量比较 子宫内 膜 癌 组 织 中 miR-128-3p、Notch1 mRNA、BMI1 mRNA 相对表达量分别为0.66±0.22、2.79±0.43、1.25 ± 0.26,癌旁组织分别为1.00 ± 0.21、2.02±0.37、0.76±0.28,两者比较,P均<0.05。
2.2 子 宫 内 膜 癌 组 织 中 miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达的相关性 子宫内膜 癌 组 织 中 miR-128-3p 与 Notch1 mRNA、BMI1 mRNA 表达均呈负相关(r分别为-0.744、-0.733,P均<0.05),Notch1 mRNA 与BMI1 mRNA表达呈正相关(r=0.803,P<0.05)。
2.3 miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达与子宫内膜癌临床病理特征的关系 结果见表1,由 表 1 可 知 ,miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达与子宫内膜癌分化程度、FIGO 分期、血管侵犯、淋巴结转移有关(P均<0.05)。
表1 miR-128-3p、Notch1 mRNA、BMI1 mRNA表达与子宫内膜癌临床病理特征的关系(±s)

表1 miR-128-3p、Notch1 mRNA、BMI1 mRNA表达与子宫内膜癌临床病理特征的关系(±s)
临床病理特征年龄≥50岁<50岁组织学分型EEC NEEC分化程度低分化中高分化FIGO分期Ⅰ~Ⅱ期Ⅲ~Ⅳ期血管侵犯有 无淋巴结转移是 否n 86 64 124 26 59 91 91 59 36 114 60 90 miR-128-3p 0.66±0.21 0.67±0.24 0.68±0.21 0.59±0.26 0.51±0.20 0.70±0.23 0.71±0.22 0.45±0.20 0.52±0.21 0.69±0.22 0.48±0.19 0.72±0.22 Notch1 mRNA 2.82±0.41 2.75±0.46 2.79±0.42 2.78±0.49 2.99±0.43 2.72±0.42 2.69±0.41 2.95±0.42 3.05±0.43 2.74±0.42 2.96±0.41 2.67±0.41 BMI1 mRNA 1.27±0.25 1.23±0.26 1.25±0.26 1.27±0.25 1.41±0.26 1.21±0.24 1.19±0.24 1.59±0.25 1.46±0.24 1.21±0.25 1.65±0.24 1.19±0.24
2.4 miR-128-3p、Notch1 mRNA、BMI1 mRNA 表达与子宫内膜癌患者预后的关系 根据miR-128-3p、Notch1 mRNA、BMI1 mRNA 相对表达量将150 例子宫内膜癌患者分为高低表达者,miR-128-3p≥0.66、0.66 者术后3 年累积生存率分别为80.56%(58/72)、57.69%(45/78),两 者 比 较,P<0.05;Notch1 mRNA≥2.79、<2.79 者术后3 年累积生存率分别为60.00%(45/75)、77.33%(58/75),两者比较,P<0.05;BMI1 mRNA≥1.25、<1.25 者术后3 年累积生存率分别为55.84%(43/77)、82.19%(60/73),两者比较,P<0.05。
2.5 子宫内膜癌患者死亡影响因素的多因素Cox回归分析结果 随访3~36个月,中位随访27个月,死亡47 例,存活103 例。死亡者年龄≥50 岁29 例(61.70%)、EEC 40 例(85.11%)、低 分 化25 例(53.19%)、FIGO 分期Ⅲ~Ⅳ期42 例(89.36%)、血管 侵 犯21 例(44.68%)、淋 巴 结 转 移41 例(87.23%)、miR-128-3p≥0.66 9 例(19.15%)、Notch1 mRNA≥2.79 38 例(80.85%)、BMI1 mRNA≥1.25 40 例(85.11%),存 活 者 年 龄≥50 岁57 例(55.34%)、EEC 84 例(81.55%)、低 分 化34 例(33.01%)、FIGO 分期Ⅲ~Ⅳ期17 例(16.50%)、血管 侵 犯15 例(14.56%)、淋 巴 结 转 移19 例(18.45%)、miR-128-3p≥0.66 63 例(61.17%)、Notch1 mRNA≥2.79 37 例(35.92%)、BMI1 mRNA≥1.25 37 例(35.92%),两者低分化比例、FIGO 分期Ⅲ~Ⅳ期比例、血管侵犯比例、淋巴结转移比例、miR-128-3p≥0.66 比例、Notch1 mRNA≥2.79 比例、BMI1 mRNA≥1.25 比例比较,P均<0.05。以随访时间为时间变量,年龄(≥50岁=1,<50岁=0)、分化程度(低分化=1,中高分化=0)、FIGO分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、血管侵犯(有=1,无=0)、淋巴结转移(有=1,无=0)、miR-128-3p(≥0.66=1,<0.66=0)、Notch1 mRNA(≥2.79=1,<2.79=0)、BMI1 mRNA(≥1.25=1,<1.25=0)为自变量,是否死亡(是=1,否=0)为因变量,多因素Cox 回归分析显示,FIGO 分期Ⅲ~Ⅳ期、淋 巴 结 转 移、Notch1 mRNA≥2.79、BMI1 mRNA≥1.25为子宫内膜癌患者死亡独立风险因素,miR-128-3p≥0.66 为独立保护因素(P<0.05),详见表2。
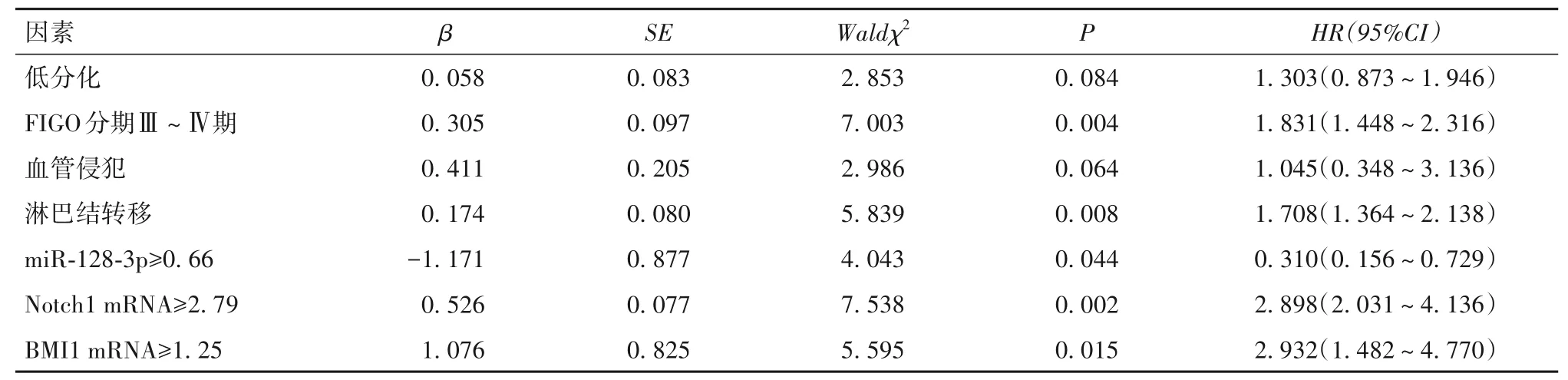
表2 子宫内膜癌患者死亡影响因素的多因素Cox回归分析结果
3 讨论
子宫内膜癌是常见的女性生殖系统恶性肿瘤,通常发生于绝经后,临床症状以不规则阴道流血、排液为主,其相关危险因素包括持续雌激素暴露、初潮早、未育、绝经延迟、代谢异常、携带子宫内膜癌遗传易感基因等,近年来由于低运动量和高脂高热饮食生活方式的影响,子宫内膜癌发病率呈年轻化和上升趋势,严重影响女性生理和心理健康[12-14]。目前,子宫内膜癌的治疗仍以手术为主,放疗和化疗为辅,对于早期子宫内膜癌一般预后较好,但仍有部分患者可能存在癌灶转移,同时对于晚期存在宫外转移患者,即使进行多学科协作治疗也难获得良好预后,因此亟需阐明子宫内膜癌发病机制,寻找评估预后指标对改善患者预后具有重要意义。
miRNA 是约22 个核苷酸组成的非编码RNA,能在3′-非翻译区与靶基因的mRNA结合,导致靶基因转录后沉默,从而调控靶基因表达,在肿瘤发生发展中发挥致癌或抑癌作用[15]。研究[16-17]表明,子宫内膜癌发生发展过程中存在多种miRNA 的异常表达,对子宫内膜癌细胞增殖、迁移、浸润等生物学行为产生影响。miR-326能靶向抑制B细胞淋巴瘤/白血病-2 表达,抑制子宫内膜癌细胞增殖和促进凋亡[16]。miR-501 能靶向抑制同源框D10 表达,促进子宫内膜癌细胞增殖和转移[17]。miR-128-3p是新近发现的一种miRNA,其在多种恶性肿瘤中异常表达。杨吉鹏等[18]发现,miR-128-3p 在胶质母细胞瘤中低表达,能靶向抑制同源框A5 抑制胶质母细胞瘤细胞增殖、侵袭及抗凋亡能力。BAI 等[19]认为,miR-128-3p在结直肠癌中高表达,能通过抑制叉头框O4 激活JAK 激酶/信号转导和转录活化因子3和转化生长因子β/SMAD 信号调节上皮间质转化,促进结直肠癌细胞增殖、迁移、侵袭。上述研究提示,miR-128-3p 在不同恶性肿瘤中发挥致癌或抑癌基因作用。本研究显示,与癌旁组织比较,子宫内膜癌组织中miR-128-3p 表达降低,并且与子宫内膜癌分化程度、FIGO 分期、血管侵犯、淋巴结转移有关,提示miR-128-3p 在子宫内膜癌中发挥抑癌基因作用。文献[20]报道,上调miR-128-3p 表达能抑制子宫内膜癌细胞增殖、迁移和侵袭的能力。本研究还显示,miR-128-3p 高表达者术后3 年累积生存率明显升高,生存时间明显延长,提示miR-128-3p 低表达与子宫内膜癌患者预后不良相关;miR-128-3p 高表达是子宫内膜癌患者死亡的独立保护因素,说明miR-128-3p可作为判断预后的分子标志物。
既往研究认为肿瘤的发生原癌基因激活和抑癌基因失活有关,近年研究认为信号转导途径异常,导致细胞接受异常增殖、分化信号是肿瘤发生发展的关键因素[21]。Notch1 作为一种配体激活的转录因子,能将胞外信号转化为核内基因表达,进而调控细胞表面受体和核转录,其信号通路是一条进化保守的细胞间相互作用机制,在细胞发育、增殖、分化、凋亡中发挥重要作用,能通过激活核因子-κB、磷脂酰肌醇-3-激酶/蛋白激酶B/雷帕霉素靶蛋白等多条信号通路促进肿瘤细胞增殖、分化、迁移、上皮—间质转化等行为[22-23]。本研究显示,与癌旁组织比较,子宫内膜癌组织中Notch1 mRNA 表达升高,并且与子宫内膜癌分化程度、FIGO 分期、血管侵犯、淋巴结转移有关,提示Notch1 在子宫内膜癌中发挥致癌基因作用,其机制可能与Notch1 可激活多条肿瘤相关信号通路促进子宫内膜癌恶性进展有关。牛丽佳等[24]认为,Notch1 能诱导子宫内膜癌细胞上皮—间质转化,促进子宫内膜癌细胞增殖、迁移、侵袭。本研究还显示,Notch1 mRNA 高表达者术后3 年累积生存率明显降低,生存时间明显缩短,提示Notch1 mRNA高表达与子宫内膜癌患者预后不良相关;Notch1 mRNA高表达是子宫内膜癌患者死亡的独立风险因素,说明Notch1 mRNA 可作为判断预后的分子标志物。
多梳基因家族是重要的表观遗传修饰基因,与细胞增殖和细胞周期密切相关,在肿瘤发生发展中发挥关键作用,BMI1是首个被鉴定的多梳基因家族功能基因,作为一种原癌基因,BMI1 能通过调控WNT/β-连环蛋白、Notch、磷脂酰肌醇-3 激酶/蛋白激酶B、c-Jun 氨基端激酶等信号通路参与恶性肿瘤发生发展[25-27]。本研究显示,与癌旁组织比较,子宫内膜癌组织中BMI1 mRNA表达升高,并且与子宫内膜癌分化程度、FIGO 分期、血管侵犯、淋巴结转移有关,提示BMI1 在子宫内膜癌中发挥致癌基因作用,其机制可能与BMI1能调节多种肿瘤信号通路有关。研究[28-29]报道,BMI1能增加磷酸化蛋白激酶B水平,促进子宫内膜癌细胞增殖、分化、迁移等行为,沉默BMI1表达能发挥相反作用,同时能提升子宫内膜癌细胞的化疗敏感性,促进癌细胞凋亡。本研究还显示,BMI1 mRNA 高表达者术后3 年累积生存率明显降低,生存时间明显缩短,提示BMI1 mRNA 高表达与子宫内膜癌患者预后不良相关;BMI1 mRNA 高表达是子宫内膜癌患者死亡的独立风险因素,说明BMI1 mRNA亦可作为判断预后的分子标志物。
本研究还发现,子宫内膜癌组织中miR-128-3p与Notch1 mRNA、BMI1 mRNA 表达呈负相关,Notch1 mRNA 与BMI1 mRNA 表达呈正相关,说明三者可能共同参与子宫内膜癌进展,考虑与miR-128-3p与Notch1、BMI1 的3′-非翻译区存在互补结合位有关。顾晓荔等[30]的研究指出,miR-128-3p 能靶向抑制Notch1 表达抑制子宫内膜癌细胞增殖,促进细胞凋 亡。YANG 等[31]发现,miR-128-3p 能 靶 向抑 制BMI1 表达抑制视网膜母细胞瘤细胞活力、迁移、侵袭。同时研究[32]指出,BMI1 抑制剂能影响Notch 信号通路蛋白的表达和活性。但关于miR-128-3p 是否能靶向下调Notch1、BMI1 参与子宫内膜癌进展有待进一步细胞研究证实。
总之,子宫内膜癌组织中miR-128-3p 低表达,Notch1、BMI1 mRNA高表达,均与分化程度、FIGO分期、血管侵犯、淋巴结转移有关,是子宫内膜癌患者死亡的独立影响因素,可能成为子宫内膜癌患者预后评估生物标志物。
