骨髓间充质干细胞来源外泌体对成年大鼠子宫内膜细胞铁死亡的改善作用及其机制
2022-05-05陈美婷肖邦朱怡卿刘梦黄金凤王芳
陈美婷,肖邦,朱怡卿,刘梦,黄金凤,王芳
海军军医大学医学遗传学教研室,上海200433
宫腔粘连(IUA)指女性子宫腔或者宫颈管发生部分或完全闭塞,进而引起月经异常、周期性腹痛、复发性流产及不育等的一种综合病症[1]。据统计,90%的IUA 与宫内手术对子宫内膜的损伤有关。铁死亡是一种区别于细胞凋亡、坏死、自噬性死亡的细胞程序性死亡方式,其在创伤性损伤诱发的继发性损伤过程中发挥重要作用[2-4]。在体内外脑出血模型中存在神经元铁死亡现象,采用铁死亡抑制剂能有效地减轻脑出血性损伤[5-7]。外泌体是一种能被大多数细胞分泌的具有脂质双层膜结构的微小膜泡,其中含有的信号分子传递给其他细胞从而改变靶细胞的功能。最近有研究发现,脐带间充质干细胞来源的外泌体通过靶向TGFβ/SMAD2 信号通路促进伤口的愈合。然而,间充质干细胞来源的外泌体(BMSCs-Exo)在子宫内膜损伤诱导的细胞铁死亡中的作用及机制还有待研究。2021 年3—11 月,我们观察了BMSCs-Exo对子宫内膜细胞铁死亡的改善作用,并探讨其可能机制,旨在为IUA的防治提供潜在治疗靶点。
1 材料与方法
1.1 实验动物 断乳雌性SD 乳鼠(50~60 g)5 只、成年雌性SD 大鼠(200~220 g)90 只,购自上海斯莱克实验动物有限责任公司,并饲养于海军军医大学实验动物中心SPF级动物屏障设施。动物所进行的实验方案经海军军医大学伦理委员会批准。
1.2 主要仪器及试剂 主要仪器:超净工作台、CO2培养箱、透射电子显微镜、流式细胞仪、高速低温离心机、恒温干燥箱、电泳仪、垂直电泳槽、分光光度计等。主要试剂:ficoll 密度梯度离心液、低糖DMEM 基础培养基、胎牛血清、细胞培养用双抗、丙二醛(MDA)含量检测试剂盒、Fe2+检测试剂盒、细胞或组织提取液GSH 检测试剂盒、小鼠GAPDH 单抗、小鼠HNE单抗、小鼠GPX4单抗、HRP标记兔抗小鼠二抗、预染蛋白maker。
1.3 乳鼠骨髓间充质干细胞分离、鉴定及外泌体提取 ①骨髓间充质干细胞分离、鉴定:参照文献[8]报道方法分离乳鼠骨髓间充质干细胞。应用颈椎脱臼的方法处死乳鼠,75%酒精浸泡2 min 充分消毒,然后用手术剪分离双侧股骨,并且把股骨上的肌肉组织剔除干净。然后用冰预冷的含100 U/mL 肝素钠的低糖DMEM 基础培养基冲洗骨髓腔三次,收集骨髓腔里面的细胞。接着将冲洗收集到的骨髓细胞悬液 与ficoll 梯 度 液 按1∶3 比 例 混 合,300 g 离 心20 min,收集白颜色细胞团,转移至一个新的离心管,然后用含10%胎牛血清的低糖DMEM 培养基洗涤细胞两次。接着用低糖DMEM 完全培养基(含体积比10%胎牛血清、100 U/mL双抗)重悬细胞,然后置于细胞培养箱培养(培养条件为5%CO2、37 ℃)。培养3 d 后,紧密黏附细胞培养皿的细胞即为P0 代BMSCs。BMSCs 传代培养至P3 代,细胞生长到每孔面积80%~90%的汇合程度时,弃去培养基,然后用2.5%胰蛋白酶消化贴壁的细胞,2 000 r/min 离心10 min,倒掉上清,用冰预冷PBS 重悬洗涤两遍细胞沉淀,最后用含5 μL 异硫氰酸荧光素(FITC)标记的CD90、CD29 和CD34、CD45 抗体孵育缓冲液重悬细胞,37 ℃避光孵育30 min,采用流式细胞仪对BMSCs 的表面阳性标记CD90、CD29 和阴性标记CD34、CD45 进行鉴定。结果显示,间充质干细胞表面标记CD29 和CD90 在我们分离培养的骨髓间充质干细胞表面高水平表达,分别为99.54%±0.22%和98.10% ± 0.11%,而几乎不表达CD34(0.05% ±0.03%)和CD45(3.13% ± 0.52%)。②BMSCs-Exo提取:参照文献[9]方法,以超速离心法从乳鼠骨髓间充质干细胞条件培养基(CM)中分离外泌体。主要包含以下几个步骤:a.300 g离心CM 10 min,去除中的死细胞或细胞碎片。b.20 000 g离心30 min,去除大的微泡。c.转移上述步骤离心后得到的上层清液至新的试管里面,应用0.8 μm的Poretics PCTE 滤膜过滤,接着超高速离心(110 000 g 离心2 h),浓缩过滤样品。d.浓缩后的样品用PBS 重悬,离心(100 000 g,时间1 h)。e.用50~100 μL 的PBS 重悬外泌体颗粒,保储在-80°C,用于后续实验。
1.4 成年大鼠分组、子宫内膜损伤模型制备及BMSCs-Exo 注射方法 每天下午14点~18点对大鼠进行阴道涂片分析,确定动物的动情周期。选择具有4 个连续动情周期的雌性SD 大鼠进入下一步实验。取60只大鼠,并分为治疗组和损伤组,各30例,两组均制备子宫内膜损伤模型,制备过程:腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉大鼠,在腹中线靠后1/3处按顺序依次切开皮肤、肌肉、腹膜,暴露子宫。在子宫中、远端连接处的下1/3 处切开子宫壁1.0 cm切口,然后用2 mm刮勺刮取子宫内膜,直至子宫壁变得粗糙及子宫内膜明显肿胀,用可吸收缝线缝合切口。治疗组尾静脉注射BMSCs-Exo(800 μg/200 g),损伤组静脉注射等量生理盐水。术后连续肌肉注射青霉素5 d,每天注射1 次,防止术后感染。另取30只成年大鼠作对照(对照组),不制备子宫内膜损伤模型,只静脉注射等量生理盐水。手术4周后,安乐死处死大鼠,收集子宫内膜组织样本用于后续实验。
1.5 实验大鼠子宫内膜细胞线粒体形态结构观察及子宫内膜组织Fe2+、MDA、GSH、GSSG 检测 ①子宫内膜细胞线粒体外膜、线粒体脊形态:采用透射电子显微镜(TEM)观察子宫内膜细胞线粒体外膜、线粒体脊。收取子宫内膜组织样本,用电镜专用固定液进行固定,锇酸固定,酒精脱水,甲基丙烯酸甲酯或环氧树脂包埋,切片,染色,用透射电子显微镜观察子宫内膜细胞线粒体外膜、线粒体脊。②子宫内膜组织Fe2+、MDA、GSH、GSSG:采用活体组织二价铁离子测定试剂盒、丙二醛(MDA)检测试剂盒、还原型谷胱甘肽(GSH)含量测定试剂盒、氧化型谷胱甘肽(GSSG)检测试剂盒分别检测各组子宫内膜组织Fe2+、MDA、GSH、GSSG。a.Fe2+:取1 g 子宫内膜组织,按照质量体积比1∶9 加入9 倍体积的生理盐水,然后运用组织研磨仪研磨制作成组织匀浆液,离心(2 000 r/min,10 min),收集上清,用于后续检测。每个样品加入铁还原剂混匀,室温孵育30 min。然后在每个样品加入铁探针100 μL,用移液器轻轻混匀,室温孵育60 min,整个孵育过程注意在避光的条件下进行,使用分光光度计在593 nm 处测量吸光度值。b.MDA:取500 μL 匀浆液,加入1.5 mL 的50%冰醋酸,水浴煮沸20 min,反应液PH 调至7.0,加入2 mL 溶液后煮沸5 min,测定540 nm 处吸光度值。c.GSH、GSSG:取0.5 g 子宫内膜组织,加入3 mL 冰冷的6%的偏磷酸(含1 mmol/L EDTA,pH2.8),冰浴研磨,匀浆液以20 000 g 速度,在4 ℃条件下离心15 min,取上清液测定GSH和GSSG的含量。GSH含量测定如下:200 μL 提取液加1.2 mL 反应液包含400 μL 反 应 液1(110 mmol/L Na2HPO4·7H20,40 mmol/L NaH2PO4·H2O,15 mmol/L EDTA,0.3 mmol/L 5,5'-二硫代双,0.04%BSA)、320 μL 反应 液2(1 mmol/L EDTA,50 mmol/L 咪 唑 溶 液,0.02%BSA)、400 μL 反应液3(5%Na2HPO4,pH 7.5的溶液稀释50 倍)、80 μL NADPH(9.0 mmol/L),测定OD412 下的吸光度值。GSSG 含量测定如下:200 μL 提取液加入1 mL 的2-2 乙烯嘧啶(稀释50倍),25 ℃水浴1 h,测定OD412 下的吸光度值。每个样本测三个复孔,最后计算每组的平均值。以对照组为参照,计算损伤组或治疗组与对照组之间的比值。
1.6 实验大鼠子宫内膜组织谷胱甘肽过氧化酶4(GPX4)、4-羟基壬烯醛(4-HNE)检测 采用蛋白印迹法。取子宫内膜组织,剪成1 mm3小块,用含1 mmol苯甲基磺酰氟(PMSF)的RIPA裂解液裂解各个组的子宫内膜组织,提取组织总蛋白。蛋白变性处理:蛋白提取液与5×loading buffer 按照1∶4 的体积比进行混合均匀,然后煮沸15 min。电泳:压缩胶电压设定为60 V,时间30 min,分离胶电压和时间 为120 V、60 min。转 膜:电 压120 V,时 间120 min 转移至PVDF 膜。封闭:封闭液(5%脱脂牛奶)孵育过夜。一抗孵育:抗4HNE 一抗(1∶2 000)、抗GPX4 一抗(1∶1 000),孵育(4 ℃,过夜)。二抗孵育:抗体稀释液(5%脱脂奶粉)与HRP 标记的二抗按1∶10 000 体积比稀释,然后室温孵育,时间为60 min。 Kodak Gel Logic 4000 R 成 像 系 统(Carestream,美国)扫描拍照,并进行条带的光密度扫描分析,计算每组动物的光密度平均值,GAPDH作为内参对照。
1.7 统计学方法 采用SPSS17.0 统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠子宫内膜细胞线粒体外膜、线粒体脊比较 各组大鼠子宫内膜细胞线粒体外膜、线粒体脊比较见图1。由图1 可知,对照组线粒体双层膜结构完整、线粒体脊清晰可见;损伤组子宫内膜组织中线粒体出现浓缩、膜增厚、脊减小或消失及外膜破裂等细胞铁死亡的特征;治疗组线粒体双层膜结构恢复、线粒体脊增多、线粒体大小正常。
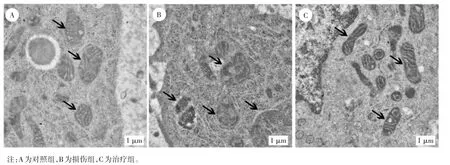
图1 各组大鼠子宫内膜细胞线粒体外膜、线粒体脊形态(TEM下)
2.2 治疗组、损伤组大鼠子宫内膜组织Fe2+、MDA、GSH、GSSG 表达比较 大鼠子宫内膜组织Fe2+、MDA、GSH、GSSG表达比较见表1。
表1 治疗组、损伤组大鼠子宫内膜组织Fe2+、MDA、GSH、GSSG表达比较(%,±s)

表1 治疗组、损伤组大鼠子宫内膜组织Fe2+、MDA、GSH、GSSG表达比较(%,±s)
注:与对照组比较,*P<0.05;与损伤组比较,△P<0.05。
组别治疗组损伤组n 30 30 MDA 108± 5△170±20*Fe2+104± 2△158±12*GSH 96±16△53± 6*GSSG 89± 3△167±21*
2.3 各组大鼠子宫内膜组织GPX4、4HNE 表达比较 各组大鼠子宫内膜组织GPX4、4HNE 表达比较见表2。
表2 各组大鼠子宫内膜组织GPX4、4HNE表达比较(±s)
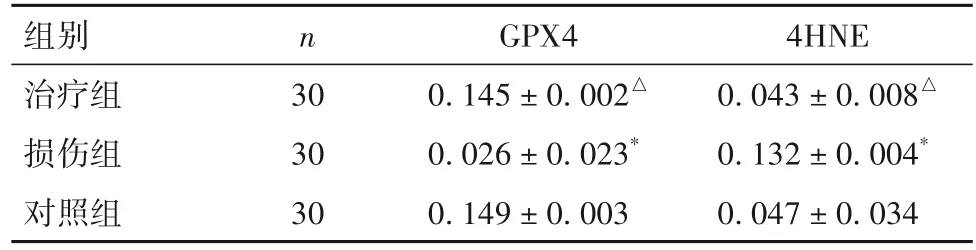
表2 各组大鼠子宫内膜组织GPX4、4HNE表达比较(±s)
注:与对照组比较,*P<0.05;与损伤组比较,△P<0.05。
组别治疗组损伤组对照组n 30 30 30 GPX4 0.145±0.002△0.026±0.023*0.149±0.003 4HNE 0.043±0.008△0.132±0.004*0.047±0.034
3 讨论
子宫内膜损伤是引起IUA 的最重要原因,90%的IUA 与宫内手术引起的子宫内膜损伤有关。目前认为,子宫内膜损伤后细胞功能严重受损,腺体减少或者缺乏活性,同时损伤后出血导致的间质内局部微环境诱发的继发性损伤使子宫内膜不能完全修复,最终导致IUA 形成。因此,子宫内膜损伤后如何有效地控制继发性损伤,促进残存细胞的存活,对于保护子宫内膜细胞功能从而促进子宫内膜损伤修复至关重要。铁死亡是细胞膜上高表达的不饱和脂肪酸在二价铁离子或酯氧合酶的催化下发生脂质过氧化而诱导的一种细胞程序性死亡方式,其主要的形态学特征是线粒体膜增厚、皱缩,线粒体脊减少或者消失,线粒体外膜破裂,细胞膜保持完整,细胞核正常,染色体无凝聚,细胞发生聚集[10]。已有研究数据表明,铁死亡在诸多疾病的的发生发展过程中扮演着及其重要的角色,包括神经退行性疾病、癌症、缺血再灌注损伤、脑卒中以及创伤性损伤等[11-12]。然而,铁死亡在子宫内膜损伤不完全修复过程中的作用还不甚明了。
外泌体是一种能被大多数细胞分泌的包含有许多特殊调控小分子的脂质双层膜结构微小囊泡,其通过介导信号分子传递给其他细胞从而改变其他细胞的功能。越来越多的研究证实,外泌体在很多生理病理过程中(如免疫中抗原呈递、肿瘤的生长与迁移、组织损伤的修复等)起重要的作用。在缺血再灌注的早期阶段,BMSCs-Exo 通过miR-199a-5p靶向免疫球蛋白结合蛋白抑制内质网应激,从而减少肾脏缺血再灌注损伤。然而,间充质干细胞来源的外泌体在子宫内膜损伤诱导的细胞铁死亡中的作用及机制还有待研究。本研究显示,损伤4周后,大鼠子宫内膜组织中细胞发生线粒体皱缩、线粒体嵴减少或消失,同时铁死亡相关指标二价铁离子、MDA、GSSG发生显著上调,GSH 发生显著下调。这提示机械损伤导致出血引起子宫内膜组织铁超载从而诱导大鼠子宫内膜组织细胞发生铁死亡。另外我们的数据也显示,BMSCs-Exo处理可以抑制损伤诱导的二价铁离子、MDA、GSSG上调及GSH下调,这表明BMSCs-Exo可以抑制损伤诱导的大鼠子宫内膜细胞铁死亡。
目前已有研究数据表明,铁死亡可以被不同的条件因素(例如缺血再灌注损伤、创伤性损伤、神经退行性疾病、癌症等)或者小分子激活剂所诱导,同时,不同的条件因素引发细胞铁死亡的上游信号通路不同,但是不同的上游信号最终都是通过直接或间接影响谷胱甘肽合成从而抑制GPX4 的活性,后者的活性降低导致细胞抗氧化能力降低,ROS 堆积,细胞内脂质活性氧生成与降解平衡失调,引起细胞膜脂质过氧化,从而导致细胞死亡[13-14]。本研究中发现,机械损伤诱导大鼠子宫内膜组织中GSH、GPX4 发生显著性下调,而BMSCs-Exo 可以显著地抑制损伤下调GSH、GPX4 表达的作用。上述结果提示,BMSCs-Exo 可能通过恢复损伤的子宫内膜组织中GPX4 的表达,进而提高细胞的抗氧化能力,降低细胞内活性氧的堆积,从而减轻细胞膜过氧化,进而抑制子宫内膜细胞铁死亡。4HNE 为脂质过氧化产物,其还可以通过与蛋白结合形成稳定状态的脂质过氧化终产物,被HNE 修饰后,被氧化的蛋白质会在结构发生进一步的改变从而影响其功能[15]。越来越多的研究证据表明,增加脂质过氧化产物会破坏细胞内钙稳态,导致线粒体损伤[16]。细胞的存活和功能发挥都依赖细胞内能量代谢的正常进行。而线粒体作为细胞能量的供给站,其结构完整性和功能的丧失导致细胞死亡的重要因素,其也是铁死亡的一个重要标志。本实验中,我们发现BMSCs-Exo 可以显著地下调损伤诱导的大鼠子宫内膜组织中4HNE 表达,促进损伤导致的线粒体外膜结构、线粒体脊破坏恢复。因此,我们猜测BMSCs-Exo 可能通过下调4HNE 的表达来维持细胞线粒体的完整性,从而维持线粒体内正常的生理生化反应及能量代谢过程,进而抑制细胞铁死亡。因此,基于以上实验数据,我们推断,BMSCs-Exo 抑制损伤诱导的大鼠子宫内膜细胞铁死亡的一种机制可能是:上调GPX4 的表达,提高细胞的抗氧化能力,同时下调4HNE 的表达进而维持细胞线粒体的结构完整和正常功能的发挥,从而来抑制细胞铁死亡的发生。
总之,BMSCs-Exo 对成年大鼠子宫内膜细胞铁死亡有改善作用,其可能机制是通过上调子宫内膜组织中GPX4表达以及下调4HNE的表达来实现。
