寻常型银屑病复发机制的研究进展
2022-05-05李园园毛鹤曹毅林金陶茂灿
李园园 毛鹤 曹毅 林金 陶茂灿
银屑病是一种多因子免疫介导的炎症性疾病,具有慢性复发-缓解往复的过程,全球发病率约2%~3%[1]。银屑病病情顽固,易反复发作,在经治疗消退的原皮损基础上会出现新的病变,若缺乏有效的治疗,皮疹反复可引起患者抑郁,甚至自杀[2]。寻常型银屑病是银屑病最常见的类型,见于90%以上的临床银屑病患者,皮损反复发作是其显著的临床特征和治疗难点,一旦停止治疗,皮损可快速复发,其中复发部位90%出现在原皮损部位[3]。传统免疫抑制剂治疗药物包括环孢素 A、甲氨蝶呤(methotrexate,MTX)、维甲酸、阿普斯特等,均存在一定不良反应[4];而新型治疗生物制剂价格昂贵,临床应用存在一定的局限性,存在一定的耐药性[5],且在传统免疫抑制剂和生物制剂治疗后,大部分患者皮疹仍反复发生。
尽管银屑病复发机制仍尚不明确,但大量研究结果表明组织驻留记忆T细胞(tissue-resident memory T cells,TRM)在银屑病的发病、病程进展,尤其是皮损复发中发挥重要作用:皮肤TRM是记忆性T细胞中的重要亚群,且在外周组织中能够长期存活和低迁移[6];皮肤 TRM分为 CD8+和 CD4+两个亚群,CD8+TRM大部分分布于表皮,CD4+TRM主要分布于真皮[7];研究发现,银屑病皮损处含有大量的CD8+TRM,且CD8+TRM是IL-17A的主要来源[8]。本文就TRM在银屑病复发中的作用和调节机制的研究进展作一综述。
1 寻常型银屑病复发与CD8+TRM的关系
TRM是记忆性T细胞中的重要亚群。当外源抗原进入皮肤时,抗原被树突状细胞识别后呈递给原始T细胞,后者被激活后,部分增殖并分化为效应性T细胞而迁移至炎症部位或B细胞区域,部分分化成记忆性T细胞的前体而发挥免疫记忆的功能。根据效应功能、迁移能力和表面受体差异,目前记忆性T细胞可进一步分类为中枢记忆性T细胞(central memory T cells,TCM)、效应记忆性T 细胞(effector memory T cells,TEM)以及TRM等亚群[9]。TRM不表达CD62L或CCR7,却持续表达 CD69、CD103、CD49a和CD44等受体,表现为具有在外周组织中长期存活及低迁徙的独有特性,且具备与TCM或TEM细胞不同的独特转录谱[6]。TRM一旦驻留在外周组织就不会因感染等刺激而再回到循环中[10]。
Boyman等[11]首次提出TRM在银屑病发病中的作用,其研究团队发现将银屑病患者的非皮损区外观正常的皮肤移植到免疫缺陷小鼠上时,会出现完全的银屑病病变。目前大量研究结果表明,TRM生物学特性对于银屑病复发至关重要,而目前银屑病治疗方法包括窄谱UVB、维甲酸、MTX、TNF-α及IL-12/23生物制剂,均无法消除TRM,因此这为患者在原皮损处恢复银屑病炎症反馈回路提供了一种潜在的机制[12]。在银屑病中,表皮层的CD8+TRM表达皮肤淋巴抗原(cutaneous lymphocyte antigen,CLA)、细胞趋化因子受体 6(Chemokine receptor6,CCR6)、CD103 和 IL-23R抗原,并在体外刺激过程中产生IL-17A[2]。CD69、CD103是人类和小鼠皮肤CD8+TRM最重要的特征表面标志物,对TRM在皮肤驻留和长期生存发挥重要作用,且是大部分表皮TRM共同表达的两种分子[13]。CD69抑制鞘氨醇-磷酸受体1型在细胞表面的表达和功能,从而阻断TRM进入外周血和淋巴结。CD103是一种αβ7整合素α链,与角质细胞表达的E-粘连蛋白结合。CD69和CD103的表达决定了皮肤CD8+TRM在皮肤组织中长期生存和低迁徙特性。研究证实,在银屑病患者皮损和非皮损区中,均含有大量CD8+TRM,可持续产生IL-17,促进银屑病复发。Kurihara等[14]取银屑病患者皮损组织进行活检,发现表皮中表达CD103的CD8+TRM的数量与表皮厚度相关,提示CD8+TRM在银屑病皮损形成中起到重要作用。Vo等[15]采用免疫荧光方法检测了银屑病患者非皮损区、皮损区和健康人群皮肤的TRM表型特征,发现与健康人群皮肤相比,表达CD103的CD8+TRM在银屑病患者非皮损和皮损区均大量表达。此外,在病程较长的银屑病患者中,皮损处的IL-17A往往高表达。TRM长期存活,且具有抗凋亡能力。TRM在皮损全部缓解后,仍可分泌IL-17A,且相关治疗仅能抑制其活性[16]。
因此,目前认为寻常型银屑病复发主要与表达CD103、CD69的CD8+TRM密切相关。TRM的发现给临床上治疗银屑病、减少皮损复发提供了潜在机制。对于TRM相关活性调控机制的研究及长期存活特性的阻断均有望成为银屑病复发防治的新干预靶点。
2 转化生长因子(transformation growth factor-β,TGF-β)信号调控皮肤CD8+TRM分化形成及长期生存
TGF-β是一组可调节细胞生长和分化的细胞因子,包含 TGF-β1、TGF-β2、TGF-β3 3 个亚型,其中TGF-β1表达最广泛、含量最多。TGF-β超家族成员通过由Ⅱ型和Ⅰ型受体组成的受体复合物发出信号。TGF-β信号从其膜受体至胞核的细胞内信号转导由多种Smad分子介导或调节。Smad蛋白家族的9个成员可分为 3 类:(1)受体调节型 Smad,由 Smads、Smad1、Smad2、Smad3、Smad5、Smad8 及 Smad9 组成,这一类受体可被直接磷酸化发挥作用;(2)共同调节型Smads,即Smad4,主要通过与受体调节型Smads结合参与信号转导;(3)抑制性 Smad,由 Smad6和 Smad7构成,这一类Smad与第一类结构相似,主要的功能是抑制受体调节型Smad的磷酸化。研究者采用转基因小鼠模型进行实验,结果发现,使用Smad3抑制剂局部治疗可阻断TGF-β信号转导,并可大量降低TGF-β1、IL-6、IL-23以及IL-17A水平,引起T淋巴细胞和巨噬细胞的浸润减少[17]。而Hu等[18]研究发现TGF-β可通过一种不需要下游信号中间体Sma和mad相关蛋白(Smad4)的信号通路来促进肺组织记忆T细胞的发育。
早在20年前,Kilshaw等[19]的体外研究结果已证实TGF-β信号可明显促进活化的T细胞CD103的表达。Mani等[20]的研究结果表明初始稳态CD8+T细胞分化成TRM需要TGF-β。在皮肤组织中,TGF-β在TRM分化形成和生存中发挥着重要作用。Nath等[21]基因组学研究结果发现TRM信号的很大一部分可以归因于TGF-β信号,TGF-β在建立TRM的驻留特异性转录谱方面具有广泛的分布,这在不同组织的TRM中均可检测到,因而其研究团队进一步提出,构成型TGF-β信号通路可能与它们在组织部位的长期存在有关。Hirai等[22-23]研究结果表明在淋巴结的抗原诱导扩增后,CD8+效应T细胞分化形成CD8+TRM,且其在表皮长期生存需要TGF-β的持续参与。
研究表明皮肤中的TGF-β激活是CD8+TRM产生和持续生存所必需的条件,可影响细胞的长期生存[20,23-24]。TGF-β 以非共价的形式与潜伏相关肽(latencyassociated peptide,LAP)结合,不具有生物活性。整合素 αvβ6和 αvβ8与 LAP 中的 RGD(Arg-Gly-Asp)结合,介导LAP与TGF-β的分离,使TGF-β获得生物活性。角质细胞表达的整合素αvβ6和αvβ8激活TGF-β亦是表皮CD8+TRM发育和生存所必需的条件[25]。
3 皮肤TGF-β信号与CD8+TRM内转录因子
CD8+T细胞在感染过程中的命运取决于多种转录因子的综合活性。然而,控制TRM分化和稳态的分子信号目前尚未完全了解。目前TRM在皮肤感染和肿瘤形成的调控转录因子主要包括 Eomes、T-bet、Hobit、Blimp-1 和 Runt相关转录因子 3(Runt-related transcription factor 3,Runx3)。T-box 转录因子,包括T-bet和Eomes是CD8+T细胞的重要调节因子,在T淋巴细胞分化和记忆表型中发挥协同和冗余的作用。T-bet在效应T细胞和TEM上高表达,当效应T细胞进展为TEM时,Eomes高表达,并在维持长期记忆中至关重要。然而,TRM分化需要在T-bet表达受限的情况下关闭Eomes。T-bet通过与TGF-β信号下游的Smad3竞争结合整合素-αE启动子来抑制CD103的表达[25]。Mohammed等[25]发现在小肠、肝和肺组织中,TGF-β信号在CD103、CD69表达、CD8+TRM存活、T-bet和Eomes下调中起重要作用。
Mackay等[26]发现转录因子Blimp-1可以协同的方式与Hobit联合促进CD8+TRM的形成。Blimp-1在TRM内表达上调,与相关的转录因子Hobit可一起介导TRM的发育。在CD8+T细胞谱系中,Hobit是以TRM特异性的方式表达,且TRM Hobit的表达依赖于低表达的T-bet和IL-15。Milner等[27]通过计算和整合小鼠体内RNA干扰筛选,发现转录因子Runx3是TRM分化和稳态的关键调控因子。TGF-β信号诱导Runx3的表达,而Runx3在CD103的表达上发挥重要作用。Wang等[28]研究结果发现Runx3可能在TRM中作用于Hobit和Blimp-1的上游。
4 小结及展望
目前关于TGF-β信号与CD8+TRM在皮肤上的关系研究,主要集中在病毒或疫苗诱导TRM表达CD69和CD103等重要标志物及该细胞的抗感染哨兵功能上。
综上所述,TGF-β信号可能在寻常型银屑病的复发中起到重要作用。本研究团队提出研究假说(图1):银屑病角质细胞表达整合素αvβ6和αvβ8可激活TGF-β,TGF-β信号可通过调控银屑病患者皮损的CD8+TRM内转录因子 [抑制T-bet、Eomes,上调Runx3和(或)Hobit-Blimp-1],促进 CD8+TRM 的分化形成及生存,持续分泌IL-17,在寻常型银屑病的复发中发挥重要作用。这个假说有待笔者进一步研究探讨,基于TGF-β对银屑病患者皮肤CD8+TRM相关活性调控作用,TGF-β有望成为银屑病复发防治的新干预靶点。
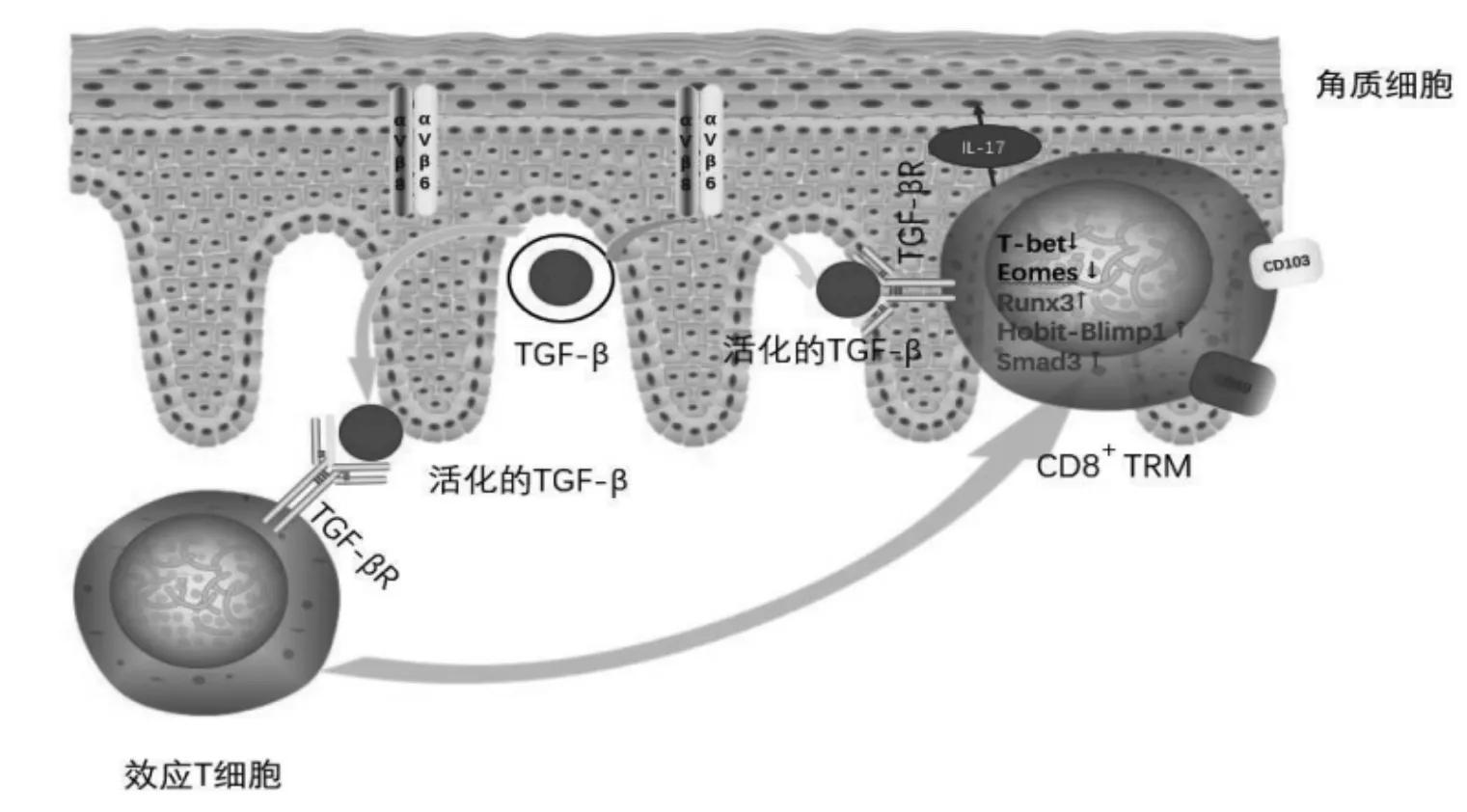
图1 TGF-β信号介导CD8+TRM分化形成和生存干预银屑病复发机制假说图
