circ_0041795靶向miR-361-3p对高糖诱导的人肾小管上皮细胞损伤的影响
2022-04-26柳越王岩高艳超魏冰
柳越 王岩 高艳超 魏冰
糖尿病肾病(DN)是主要的糖尿病微血管疾病之一,可影响糖尿病患者的长期生存率,更是终末期肾脏疾病的主要原因[1]。肾小管细胞损伤是DN的主要特征之一,研究认为高血糖通过多种机制促进活性氧产生,加重氧化应激反应,诱导肾小管上皮细胞凋亡增加,从而导致肾小管损伤[2]。因此,寻找有效抑制肾小管上皮细胞损伤的策略迫在眉睫。环状RNA(circRNA)是一类具有共价闭合环的非编码RNA,其通过与特定的微小RNA(miRNA)结合,减轻miRNA对靶mRNA的抑制作用,参与急性肾损伤、肾细胞癌、DN等多种肾脏疾病的进展[3-5]。研究报道circ_0041795在高糖诱导的人视网膜色素上皮细胞中表达上调,沉默circ_0041795可抑制高糖诱导的炎性反应和细胞凋亡,促进细胞增殖,是治疗糖尿病视网膜病变的潜在靶点[6]。然而circ_0041795在DN进展中的作用并不清楚。靶基因预测显示miR-361-3p是circ_0041795的潜在靶点。有研究报道在高糖诱导的人脐静脉细胞损伤中miR-361-3p表达降低,过表达miR-361-3p可抑制高糖诱导的血管内皮损伤,是糖尿病内皮损伤治疗靶点[7]。本研究探讨circ_0041795对高糖诱导的人肾小管上皮细胞损伤的影响,并通过miR-361-3p分析其可能的作用机制。
1 材料与方法
1.1 细胞与试剂 人肾皮质近曲小管上皮细胞HK-2购于中国科学院上海细胞库;DMEM培养液、胎牛血清、青链霉素双抗购于武汉普诺赛生命科技公司;cDNA第一链合成试剂盒、miRNA荧光定量检测试剂盒购于北京天根生化科技公司;Power SYBR green master mix购于美国ABI公司;miRNA反转录试剂盒、细胞计数试剂盒(CCK-8)、双荧光素酶活性测定试剂盒购于北京百奥莱博科技公司;膜联蛋白V-异硫氰酸荧光素(Annexin-V-FITC)/碘化丙啶(PI)凋亡检测试剂盒购于上海凯基生物公司;兔源Cleaved-caspase3抗体、兔源磷酸甘油醛脱氢酶(GAPDH)抗体、羊抗兔IgG二抗购自美国CST公司;超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒、乳酸脱氢酶(LDH)活性检测试剂盒购于北京索莱宝生物科技公司。
1.2 方法
1.2.1 细胞培养、转染和分组:①HK-2细胞在DMEM培养液中培养,该培养基添加10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素,培养箱条件为在37℃、含5%CO2。将对数期HK-2细胞铺6孔板,当细胞生长至约60%汇合时,利用Lipofectamine 2000分别转染si-circ_0041795、si-NC、miR-361-3p mimics、miR-NC、anti-miR-361-3p、si-circ_0041795+anti-miR-361-3p至HK-2细胞,收集转染48 h细胞进行后续实验。②实验分组:正常糖(NG)组:用含有5.5 mmol/L葡萄糖DMEM培养液孵育HK-2细胞;高糖(HG)组:用含30.0 mmol/L葡萄糖的DMEM培养液孵育HK-2细胞[8];HG+si-NC组、HG+si-circ_0041795组、HG+miR-NC组、HG+miR-361-3p组、HG+anti-miR-361-3p组、HG+si-circ_0041795+anti-miR-361-3p组:用含30.0 mmol/L葡萄糖的DMEM培养液分别孵育转染si-NC、转染si-circ_0041795、转染miR-NC、转染miR-361-3p mimics、转染anti-miR-361-3p、转染si-circ_0041795+anti-miR-361-3p的HK-2细胞。培养48 h后,收集细胞进行功能分析。
1.2.2 实时定量PCR(RT-qPCR)检测circ_0041795和miR-361-3p表达:Trizol法提取各组HK-2细胞的总RNA。为检测circ_0041795表达,利用cDNA第一链合成试剂盒将1 μg总RNA转化为cDNA,利用Power SYBR green master mix进行RT-qPCR。为检测miR-361-3p,采用miRNA反转录试剂盒合成cDNA,再用miRNA荧光定量检测试剂盒进行RT-qPCR。GAPDH和U6分别作为circRNA和miRNA的内源性对照。2-△△Ct法计算circ_0041795和miR-361-3p表达量。circ_0041795上游引物5’-CCAAGGAGTG TGCC CC TTTT-3’,下游引物5’-AGTCATGGTAAACCAGCCGAT-3’;GAPDH上游引物5’-GGTGGTC TCCTCTGACTTCAA-3’,下游引物5’-GTTGCTGTAGCCAAATTCGTTGT-3’;miR-361-3p上游引物5’-ACACTCCAGCTGGGTCCCCCAGGTGTGATTC-3’,下游引物5’-CTCAACT GG TGTCGTGGAGTCGGCAATTCAGTTGAGAAATCAGA-3’;U6上游引物5’-CTCGCTTCGG CAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。
1.2.3 CCK-8法检测细胞存活率:将转染HK-2或未转染细胞以2×103个/孔的密度接种在96孔板中,根据不同实验进行细胞处理。将10 μl的CCK-8溶液添加到每个孔中,然后在37℃下孵育2 h,酶标仪读取450 nm处的吸光度(A)以表示细胞活力。存活率(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.4 流式细胞术检测细胞凋亡:用胰蛋白酶消化1×106个HK-2细胞,用预冷的PBS洗涤2次。将细胞重悬在500 μl结合缓冲液中,加入5 μl PI和5 μl AnnexinV-FITC在暗室染色20 min。流式细胞仪收集荧光信号,FlowJo 8.7.1软件分析细胞凋亡率。
1.2.5 蛋白印迹法检测Cleaved-caspase3蛋白表达:全蛋白提取试剂盒分离各组HK-2细胞总蛋白。定量后,将适量蛋白与等体积2×上样缓冲液混合均匀,煮沸3 min使其变性。取30 μg蛋白样品经SDS-PAGE分离后,转移蛋白到聚偏二氟乙烯膜。室温环境下将膜在5%牛血清蛋白中封闭2 h,然后用一抗(Cleaved-caspase3和GAPDH抗体1∶1 000稀释)4℃孵育过夜。室温环境下用相应的二抗(1∶2 000稀释)孵育膜1 h。按照化学发光试剂盒说明书进行显色反应,凝胶成像系统分析Cleaved-caspase3蛋白表达水平。
1.2.6 试剂盒检测SOD活性、MDA含量以及LDH释放:HK-2细胞处理完毕后,分别收集细胞培养液上清、细胞沉淀至新的离心管中。采用LDH检测试剂盒检测细胞培养液上清中LDH水平。向细胞沉淀中加入提取液,超声破碎细胞,收集上清液,采用SOD活性检测试剂盒、MDA含量测定试剂盒检测细胞内SOD活性和MDA含量。
1.2.7 双荧光素酶报告实验:合成含有miR-361-3p预测位点序列的circ_0041795野生型(wt)序列片段或突变型(mut)序列片段,将上述片段插入到psiCHECK-2载体,构建重组质粒wt-circ_0041795、mut-circ_0041795。利用Lipofectamine 2000将上述重组质粒分别与miR-361-3p mimics、miR-NC转染HK-2细胞,培养48 h后用双荧光素酶活性测定试剂盒测定各组细胞的相对荧光素酶活性。

2 结果
2.1 沉默circ_0041795或过表达miR-361-3p对高糖诱导的HK-2损伤的影响 与NG组比较,HG组HK-2细胞circ_0041795表达量、Cleaved-caspase3蛋白表达量、凋亡率显著升高(P<0.05),细胞存活率、miR-361-3p表达量显著降低(P<0.05);与HG组、HG+si-NC组比较,HG+si-circ_0041795组HK-2细胞circ_0041795表达量、Cleaved-caspase3蛋白表达量、凋亡率显著降低(P<0.05),细胞存活率、miR-361-3p表达量显著升高(P<0.05);与HG组、HG+miR-NC组比较,HG+miR-361-3p组HK-2细胞Cleaved-caspase3蛋白表达量、凋亡率显著降低(P<0.05),细胞存活率、miR-361-3p表达量显著升高(P<0.05)。见图1,表1。

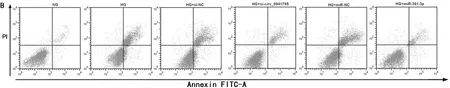
图1 沉默circ_0041795或过表达miR-361-3p对HK-2凋亡的影响;A 沉默circ_0041795或过表达miR-361-3p对HK-2中Cleaved-caspase3蛋白表达的影响;B 沉默circ_0041795或过表达miR-361-3p均可抑制高糖诱导的HK-2凋亡
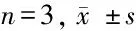
表1 沉默circ_0041795或过表达miR-361-3p对HK-2细胞活性和凋亡的影响
2.2 沉默circ_0041795或过表达miR-361-3p对高糖诱导的HK-2氧化应激的影响 与NG组比较,HG组HK-2细胞MDA含量、LDH释放量显著升高(P<0.05),SOD活性显著降低(P<0.05);与HG组、HG+si-NC组比较,HG+si-circ_0041795组HK-2细胞MDA含量、LDH释放量显著降低(P<0.05),SOD活性显著升高(P<0.05);与HG组、HG+miR-NC组比较,HG+miR-361-3p组HK-2细胞MDA含量、LDH释放量显著降低(P<0.05),SOD活性显著升高(P<0.05)。见表2。
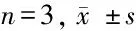
表2 沉默circ_0041795或过表达miR-361-3p对HK-2氧化应激的影响
2.3 circ_0041795靶向miR-361-3p Circular RNA Interactome预测显示circ_0041795与miR-361-3p序列间存在特异性结合位点。双荧光素酶胞实验显示,与miR-NC和wt-circ_0041795共转染比较,miR-361-3p mimics和wt-circ_0041795共转染后HK-2细胞的相对荧光素酶活性显著下降(P<0.05);与miR-NC和mut-circ_0041795共转染比较,miR-361-3p mimics和mut-circ_0041795共转染后HK-2细胞的相对荧光素酶活性无显著变化(P>0.05)。见图2,表3。

图2 circ_0041795和miR-361-3p的互补序列
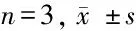
表3 双荧光素酶报告实验
2.4 抑制miR-361-3p可逆转沉默circ_0041795对高糖诱导的HK-2损伤的影响 与HG组比较,HG+si-circ_0041795组HK-2细胞存活率、miR-361-3p表达量显著升高(P<0.05),凋亡率、Cleaved-caspase3蛋白表达量显著降低(P<0.05);与HG组比较,HG+ anti-miR-361-3p组HK-2细胞存活率、miR-361-3p表达量显著降低(P<0.05),凋亡率、Cleaved-caspase3蛋白表达量显著升高(P<0.05);与HG+si-circ_0041795组比较,HG+ si-circ_0041795+anti-miR-361-3p组HK-2细胞存活率、miR-361-3p表达量显著降低(P<0.05),凋亡率、Cleaved-caspase3蛋白表达量显著升高(P<0.05)。见图3,表4。

图3 抑制miR-361-3p可逆转沉默circ_0041795对HK-2凋亡的影响
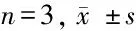
表4 抑制miR-361-3p可逆转沉默circ_0041795对高糖诱导的HK-2损伤的影响
2.5 抑制miR-361-3p可逆转沉默circ_0041795对高糖诱导的HK-2氧化应激的影响 与HG组比较,HG+si-circ_0041795组HK-2细胞MDA含量、SOD活性显著升高(P<0.05),LDH释放量显著降低(P<0.05);与HG组比较,HG+anti-miR-361-3p组HK-2细胞MDA含量、SOD活性显著降低(P<0.05),LDH释放量显著升高(P<0.05);与HG+si-circ_0041795组比较,HG+si-circ_0041795+anti-miR-361-3p组HK-2细胞MDA含量、SOD活性显著降低(P<0.05),LDH释放量显著升高(P<0.05)。见表5。
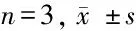
表5 抑制miR-361-3p可逆转沉默circ_0041795对高糖诱导的HK-2氧化应激的影响
3 讨论
研究证实circRNA参与DN进展的多个生物学过程。circ_15698在DN小鼠和小鼠系膜细胞中高表达,其通过与miR-185相互作用增加转化生长因子-β1蛋白水平,促进纤维化相关蛋白合成[9]。circRNA低密度脂蛋白受体相关蛋白6(circLRP6)调节高糖诱导的系膜细胞增殖、氧化应激、细胞外基质(ECM)积累和炎性反应[10]。circ_0003928通过靶向miR-151-3p并上调Anxa2促进糖诱导的肾小管上皮细胞凋亡和炎性反应[11]。上述表明circRNA可能是DN治疗的潜在治疗靶标。本研究发现高糖刺激后HK-2细胞circ_0041795表达量显著增加,提示circ_0041795高表达可能有助于DN进展。功能分析表明,沉默circ_0041795表达可抑制高糖诱导的细胞凋亡,提高细胞存活率,抑制Cleaved-caspase3蛋白表达。持续高血糖可增加活性氧的产生,当超过机体内源性抗氧化能力时,导致MDA产生、细胞损伤以及LDH释放[12]。SOD是DN大鼠重要的抗氧化防御系统,与健康大鼠比较DN大鼠中SOD表达显著减少[13]。因此,MDA、LDH和SOD是DN中氧化应激损伤的生物标志物。本研究中高糖刺激导致HK-2细胞、SOD活性降低,凋亡率、MDA水平、LDH释放增加,表明高血糖促进氧化应激、加重肾小管上皮细胞损伤。沉默circ_0041795可增加HK-2细胞活力,抑制氧化应激和细胞凋亡,这与前期报道沉默circ_0041795可减轻高糖诱导的视网膜色素上皮细胞损伤[6]一致。因此,靶向circ_0041795可能是治疗DN小管上皮损伤的重要策略。
迄今为止,circRNA的最典型的调控方式是miRNA分子海绵作用。最近研究证实一些circRNA在DN中表达失调,并通过miRNA调控DN进展,如circ_0080425在DN小鼠和高糖诱导的系膜细胞中上调,circ_0080425通过竞争性结合miR-24-3p促进系膜细胞增殖和纤维化,促进DN进展[14]。本研究中通过双荧光素酶报告实验证实miR-361-3p是circ_0041795的下游靶点。目前已在宫颈癌、非小细胞肺癌、阿尔茨海默病(AD)、糖尿病血管并发症中发现了异常表达的miR-361-3p[15-17,7]。研究报道AD细胞模型中miR-361-3p下调,过表达miR-361-3p可抑制β-淀粉样蛋白诱导的细胞凋亡、氧化应激和炎性反应,抑制AD进展[18]。本研究探讨miR-361-3p在DN进展中的作用,结果表明miR-361-3p在高糖诱导的HK-2细胞中表达下调,这与其在高糖诱导的血管内皮细胞损伤中的下调[7]相一致。功能分析证实,miR-361-3p过表达可抑制高糖诱导的HK-2细胞凋亡和LDH释放,提高细胞存活率、SOD活力,降低MDA水平和Cleaved-caspase3蛋白表达量。沉默circ_0041795后高糖诱导HK-2中miR-361-3p表达显著升高,且过表达miR-361-3p与沉默circ_0041795对高糖诱导HK-2细胞损伤的保护作用一致,提示circ_0041795可能靶向miR-361-3p调控高糖诱导HK-2细胞损伤。此外,本研究显示抑制circ_0041795表达则加剧高糖诱导HK-2细胞损伤,并逆转沉默circ_0041795对高糖诱导HK-2细胞凋亡和氧化应激损伤的影响,这进一步证实沉默circ_0041795对高糖诱导HK-2细胞损伤的保护作用是通过靶向上调miR-361-3p表达实现的。
综上所述,沉默circ_0041795可通过抑制氧化应激和细胞凋亡来抵抗高糖诱导的人肾小管上皮细胞损伤,其机制与靶向上调miR-361-3p表达有关,这些发现为治疗DN提供了新的潜在有效靶点。
