miR-30a-5p调控HDAC9对心肌细胞氧化应激损伤保护作用的机制研究
2022-04-26余敏崔跃黎鹏飞谢丹陈芬
余敏 崔跃 黎鹏飞 谢丹 陈芬
心肌组织在短时间内供血或供养不足容易引起心血管疾病的发生,如中风、急性心肌梗死和缺血性心脏病等[1,2]。心肌缺血再灌注损伤可以促进心肌细胞凋亡、炎性反应和氧化应激损伤[3,4],这也是急性心肌梗死患者病死率较高的原因[5]。miRNA在心血管疾病中异常表达,可以参与细胞的增殖、凋亡、氧化应激等生物学过程,进而参与心血管疾病的发生发展[6,7]。研究发现,抑制NPHP3-AS1通过调控下调miR305p减缓缺氧复氧诱导的心肌细胞细胞凋亡,促进心肌细胞的增殖[8]。组蛋白去乙酰化酶9(HDAC9)在缺氧/复氧诱导的神经细胞中表达水平升高,抑制HDAC9表达可以减缓缺氧复氧诱导引起的神经细胞凋亡和炎性损伤[9]。通过生物信息学网预测miR-30a-5p和HDAC9可能存在结合互补位点,但笔者发现miR-30a-5p是否调控HDAC9对缺氧复氧诱导的心肌细胞氧化应激损伤尚不明确,本研究通过建立缺氧复氧心肌细胞H9c2模型,探讨miR-30a-5p通过调控HDAC9对缺氧复氧诱导的心肌细胞凋亡和氧化应激的影响。报告如下。
1 材料与方法
1.1 细胞与试剂 大鼠心肌细胞H9c2购自中国科学院上海细胞库;10%胎牛血清、DMEM培养基购自美国Gibco公司;LipofectamineTM2000转染试剂盒、Trizol试剂盒购自美国Invitrogen公司;miR-NC、miR-30a-5p、si-NC、si-HDAC9、pcDNA和HDAC9序列和引物均购自上海吉玛制药公司;反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;凋亡试剂盒、BCA试剂盒、ECL试剂盒、双荧光素酶报告基因检测试剂盒购自北京索莱宝公司;HDAC9抗体、Bax抗体、Bcl-2抗体和GAPDH抗体购自美国Abcam公司;超氧化物歧化酶(SOD)、丙二醛(MDA)和乳酸脱氢酶(LDH)检测试剂盒购自南京建成生物研究所。
1.2 细胞培养与分组 心肌细胞H9c2复苏后,在含有10%胎牛血清的DMEM培养基内,置于培养箱内温度为37℃、饱和湿度为5% CO2条件下常规培养细胞传代。取对数生长期的心肌细胞H9c2,将细胞分组:对照组(Control组):正常条件培养心肌细胞H9c2;缺氧复氧组(H/R组):在培养箱内设置95% N2、5% CO2进行缺氧条件培养12 h,倒掉培养液,然后在培养箱为37℃、20% O2、5% CO2继续培养4 h,建立心肌细胞H9c2的缺氧复氧模型。按照LipofectamineTM2000转染试剂盒说明书的操作步骤将miR-NC、miR-30a-5p、si-NC、si-HDAC9、miR-30a-5p+pcDNA、miR-30a-5p+HDAC9转染至心肌细胞H9c2内,6 h后进行缺氧复氧处理,分别记为H/R+miR-NC组、H/R+miR-30a-5p组、H/R+si-NC组、H/R+si-HDAC9组、H/R+miR-30a-5p+pcDNA组、H/R+miR-30a-5p+HDAC9组,继续培养48 h进行后续实验。
1.3 qRT-PCR检测miR-30a-5p和HDAC9 mRNA表达 收集各组生长对数期的心肌细胞H9c2,加入Trizol试剂提取各组细胞的总RNA,在分光光度计先检测细胞浓度和纯度,然后按照反转录试剂盒说明书步骤严格进行逆转录合成cDNA,以cDNA为模板按照荧光定量试剂盒说明书操作步骤,miR-30a-5p、HDAC9 mRNA分别以U6、GAPDH作为内参进行PCR扩增,通过2-△△Ct法检测miR-30a-5p和HDAC9 mRNA表达。
1.4 Western blot检测HDAC9、Bax和Bcl-2蛋白表达 收集各组心肌细胞H9c2,加入蛋白裂解液用于提取细胞的总蛋白,采用BCA试剂盒检测蛋白的浓度,沸水变性处理细胞。取35 μg蛋白样品上样凝胶电泳处理,结束后转膜,用脱脂奶粉封闭处理,将膜转移至一抗溶液内,4℃过夜孵育,加入相应二抗溶液,室温孵育,按照ECL试剂盒说明书,显影曝光,通过Quantity One软件分析蛋白条带灰度值,以GAPDH为内参,计算目的蛋白的表达。
1.5 流式细胞术检测细胞凋亡 收集各组心肌细胞H9c2,3 000 r/min离心5 min,离心后在培养内调整细胞浓度为1×106/ml。在各组细胞内加入500 μl结合缓冲液重悬细胞,然后继续加入5 μl Annexin V-FITC和5 μl PI,严格按照凋亡试剂盒说明书,避光反应10 min后,在流式细胞仪上检测细胞凋亡率。
1.6 ELISA检测SOD活性、MDA含量和LDH含量 取各组心肌细胞H9c2,离心后上清液,用于检测SOD活性、MDA含量和LDH含量。具体操作步骤严格按照SOD、MDA和LDH检测试剂盒进行。
1.7 双荧光素酶报告基因检测miR-30a-5p和HDAC9靶向关系 通过Star Base预测显示miR-30a-5p和HDAC9存在结合位点,然后构建HDAC9 3’UTR的野生型载体(HDAC9 3’UTR-wt)和突变型载体(HDAC9 3’UTR-mut)。取对数生长期的心肌细胞H9c2,按照LipofectamineTM2000转染试剂盒说明书将HDAC9 3’UTR-wt和HDAC9 3’UTR-mut分别于miR-NC或miR-30a-5p转染至心肌细胞H9c2。最后按照双荧光素酶报告基因检测试剂盒的说明书检测荧光素酶活性。

2 结果
2.1 miR-30a-5p和HDAC9在缺氧复氧诱导心肌细胞H9c2中的表达 与Control组比较,H/R组的心肌细胞中miR-30a-5p表达显著降低(P<0.05),HDAC9 mRNA和蛋白表达水平显著增加(P<0.05)。见表1,图1。
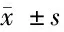
表1 miR-30a-5p和HDAC9在缺氧复氧诱导心肌细胞H9c2中的表达

图1 HDAC9在缺氧复氧诱导心肌细胞H9c2中的表达
2.2 过表达miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡和氧化应激的影响 与Control组比较,H/R组的心肌细胞中miR-30a-5p表达、Bcl-2蛋白表达和SOD活性均显著降低(P<0.05),而细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著增加(P<0.05);与H/R+miR-NC组比较,H/R+miR-30a-5p组的心肌细胞中miR-30a-5p表达、Bcl-2蛋白表达和SOD活性均显著增加(P<0.05),而细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著降低(P<0.05)。见图2,表2。

图2 过表达miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡的影响;A 细胞凋亡率;B Bax和Bcl-2蛋白表达
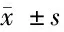
表2 过表达miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡和氧化应激的影响
2.3 miR-30a-5p调控HDAC9的表达 与miR-NC组比较,miR-30a-5p组中HDAC9 3’UTR-wt荧光素酶活性显著降低(P<0.05),而HDAC9 3’UTR-mut荧光素酶活性没有任何变化(P>0.05)。与anti-miR-N组比较,anti-miR-30a-5p组中miR-30a-5p表达显著降低(P<0.05)。与miR-NC组比较,miR-30a-5p组中HDAC9蛋白表达显著降低(P<0.05);与anti-miR-N组比较,anti-miR-30a-5p组中HDAC9蛋白表达显著增加(P<0.05)。见图3,表3、4。

图3 miR-30a-5p调控HDAC9的表达;A miR-30a-5p和HDAC9存在结合位点;B miR-30a-5p调控HDAC9的表达
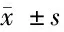
表3 双荧光素酶报告实验和anti-miR-30a-5p的转染效率
2.4 干扰HDAC9对缺氧复氧诱导心肌细胞H9c2凋亡、氧化应激的影响 与Control组比较,H/R组的心肌细胞中HDAC9蛋白表达、细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著增加,差异有统计学意义(P<0.05);而Bcl-2蛋白表达和SOD活性均显著降低,差异有统计学意义(P<0.05);与H/R+si-NC组比较,H/R+si-HDAC9组的心肌细胞中HDAC9蛋白表达、细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著降低,差异有统计学意义(P<0.05);而Bcl-2蛋白表达和SOD活性均显著增加,差异有统计学意义(P<0.05)。见图4,表5。
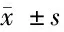
表5 干扰HDAC9对缺氧复氧诱导心肌细胞H9c2凋亡、氧化应激的影响

图4 干扰HDAC9对缺氧复氧诱导心肌细胞H9c2凋亡的影响;A 细胞凋亡率;B HDAC9、Bax和Bcl-2蛋白表达
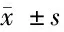
表4 miR-30a-5p调控HDAC9的表达
2.5 过表达HDAC9逆转了miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡和氧化应激的影响 与H/R+miR-NC组比较,H/R+miR-30a-5p组的心肌细胞中HDAC9蛋白表达、细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著降低(P<0.05),差异均有统计学意义;而Bcl-2蛋白表达和SOD活性均显著增加(P<0.05);与H/R+miR-30a-5p+pcDNA组比较,H/R+miR-30a-5p+HDAC9组的心肌细胞中HDAC9蛋白表达、细胞凋亡率、Bax蛋白表达、MDA含量和LDH含量均显著增加(P<0.05);而Bcl-2蛋白表达和SOD活性均显著降低(P<0.05)。见图5,表6。
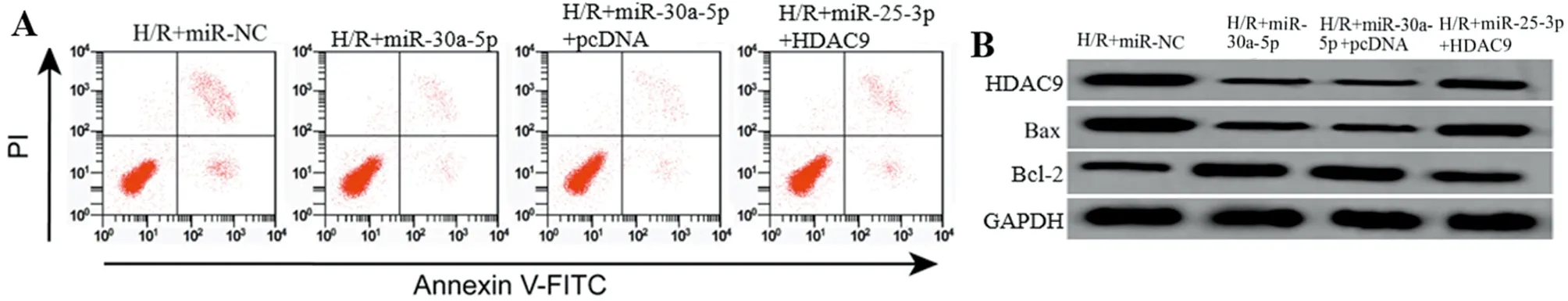
图5 过表达HDAC9逆转了miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡的影响;A 细胞凋亡率;B HDAC9、Bax和Bcl-2蛋白表达
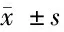
表6 过表达HDAC9逆转了miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡和氧化应激的影响
3 讨论
微小RNA(miRNA)在心血管疾病中研究作用已经获得大量研究的认可,而且miRNA在心肌细胞凋亡和氧化应激等研究过程中也备受关注[10],其中miR-143、miR-519d-3p和miR-27a-3p等已被证明[11-13]。Liu等[14]研究结果显示,缺氧复氧诱导心肌细胞后,miRNA-15b表达显著增加,过表达miRNA-15b明显促进缺氧复氧诱导的心肌细胞的凋亡,这与本研究结果相反。Yang等[15]研究结果显示,miR-22在缺氧复氧诱导的心肌细胞中低表达,miR-22通过调控CBP/AP-1途径减缓缺氧复氧诱导的心肌细胞凋亡和炎性损伤,进而起到保护心脏的作用。在急性心肌梗死构建的缺氧模型中发现,miR-483-5p在缺氧诱导人心肌细胞中表达上调,过表达miR-483-5p明显促进了缺氧诱导的心肌细胞凋亡和氧化应激,这与本研究结果相反[16]。miR-499-5p在缺氧复氧诱导的心肌细胞中表达下调,过表达miR-499-5p明显抑制缺氧复氧诱导的心肌细胞凋亡和氧化应激[17],这与本研究结果相似。miR-30a-5p报道参与可肾脏损伤、心肌缺血和再灌注损伤模型[18,19]。本研究结果显示,通过建立缺氧复氧诱导心肌细胞H9c2模型,缺氧处理后明显降低心肌细胞明显促进心肌细胞的凋亡和氧化应激水平,以及上调Bax蛋白表达,下调Bcl-2的表达;进一步研究结果显示,miR-30a-5p在缺氧复氧诱导的心肌细胞H9c2中低表达,过表达miR-30a-5p明显抑制心肌细胞H9c2的凋亡和氧化应激水平,以及下调Bax蛋白表达,上调Bcl-2的表达,这说miR-30a-5p参与了缺氧复氧诱导心肌细胞H9c的氧化应激损伤的作用。
HDAC9是HDACs家族成员的转录因子之一,位于7号染色体q21.1位置上,与酵母HAD-I样酶具有高度的同源性,主要存在细胞核和细胞质中[20,21]。HDAC9在多种癌症中发挥着重要作用,且在动脉粥样硬化和冠状动脉中高表达[22,23]。研究结果显示,HDAC9在缺血再灌注损伤模型中高表达,与缺血性脑卒中密切相关[24]。Shi等[25]研究发现,HDAC9在大鼠脑缺血/再灌注表达上调,转染慢病毒HDAC9降低了脑部中风的风险;沉默HDAC9明显抑制了OGD诱导的炎性反应和凋亡。本研究结果显示,HDAC9 mRNA和蛋白表达在缺氧复氧诱导的心肌细胞H9c2中高表达,干扰HDAC9明显抑制心肌细胞H9c2的凋亡和氧化应激水平,以及下调Bax蛋白表达,上调Bcl-2的表达;通过生物信息学网站和双荧光素酶实验结果证实,miR-30a-5p可以靶向调控HDAC9表达,过表达HDAC9逆转了miR-30a-5p对缺氧复氧诱导心肌细胞H9c2凋亡和氧化应激的作用,这说明miR-30a-5p通过靶向调控HDAC9抑制缺氧复氧诱导的心肌细胞H9c2凋亡和氧化应激水平,对心肌细胞发挥保护作用。
综上所述,过表达miR-30a-5p可以减缓缺氧复氧诱导的心肌细胞的凋亡和氧化应激水平,其作用机制可能与HDAC9有关,起到保护心肌细胞的作用。
