糖尿病诱导血管平滑肌表型转化机制的研究进展
2022-04-26姜格格综述伟审校
姜格格综述,李 伟审校
0 引 言
糖尿病是一种以高血糖为主要特征的慢性代谢性疾病。调查数据显示,2019年我国糖尿病患病人数为1.16亿人,2040年可能增加到1.51亿人[1]。根据WHO(1999年)的糖尿病病因学分型体系,糖尿病可分为4种类型,即1型糖尿病(Type 1 diabetic mellitus,T1DM)、2型糖尿病(Type 2 diabetic mellitus,T2DM)、特殊类型糖尿病和妊娠期糖尿病。T1DM、T2DM和妊娠期糖尿病是临床常见类型,其中T2DM更易引起血管并发症。在被确诊为糖尿病时,半数以上的患者伴有血管并发症[2],成为糖尿病患者致死和致残的主要病因,给个人和社会带来沉重负担。研究发现,血管平滑肌细胞(vascular smooth muscle cell, VSMC)的表型转化在糖尿病血管并发症中起着关键作用[3],其发生机制十分复杂,涉及代谢、氧化应激和遗传等多个领域。因此,阐明糖尿病血管平滑肌表型转化的发生机制具有十分重要的临床意义,将有助于早期防治糖尿病血管并发症。
1 血管平滑肌细胞及表型转化
动脉具有内膜、中膜和外膜成熟的血管壁结构,其中中膜主要由血管平滑肌细胞构成,负责调节血管直径及张力,以维持全身血流分布及血压。VSMC在正常生理状态下主要表现为收缩表型,呈纺锤样均匀排列,表达大量分化标记物如:平滑肌肌动蛋白α、钙蛋白、平滑肌肌球蛋白重链等,含有丰富的肌纤维,而细胞合成活性、增殖活性和迁移能力较低。在血管受损或疾病状态下,VSMC可由收缩型变为合成型,称为“表型转化”。合成表型的VSMC分化标记物表达明显下降,呈菱形杂乱排列,肌纤维骤缩,增殖和迁移能力显著增强并合成和分泌大量细胞外基质,导致血管收缩和管腔狭窄。VSMC异常增殖和迁移造成的表型转化在心脑血管疾病中起着关键作用[4],是动脉粥样硬化、高血压、心衰、脑梗死和血管动脉瘤等疾病的重要病理过程之一。糖尿病患者的VSMC增殖、黏附和迁移能力显著提高,高血糖状态激活VSMC的致动脉粥样硬化活性,加速动脉粥样硬化过程和动脉成型术后再狭窄,使其在斑块进展和不稳定性中扮演重要角色。
2 糖尿病中血管平滑肌细胞表型转化机制
2.1 高血糖正常血糖状态下VSMC处于稳定状态,合成型和收缩型呈动态平衡。然而在高血糖状态下,VSMC的表型由收缩型转变为合成型,具体表现为增殖、迁移能力增强、细胞外基质分泌增多[5]。研究显示,T2DM患者对心血管疾病的易感性增加,表明VSMC可能存在病理性“糖尿病表型”。尽管随后对血糖进行控制,但一些患者的血管并发症仍会继续进展,这一现象称为“代谢记忆”[6]。糖尿病患者的外周循环中炎症标记物水平升高,炎症因子刺激VSMC去分化、增殖和迁移并诱导其进一步分泌促炎介质,导致各种促炎细胞因子表达增加,通过核因子-κB(nuclear factor-κB ,NF-κB)途径促进高糖状态下VSMC发生表型转化[7]。此外,在高糖状态下干扰素调节因子-1(interferon regulatory factor-1,IRF-1,)上调细胞周期蛋白E/CDK2,激活ROS/ERK1/2通路,促进VSMC增殖[8]。
2.2氧化应激在心血管系统中,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)主要在VSMC中表达。已有研究表明,T2DM心血管功能受损部分归因于心血管组织中iNOS的异常过表达,iNOS中一氧化氮的释放增加是糖尿病血管并发症发生的原因之一[9]。高血糖通过激活蛋白激酶C、STAT3/Pim-1信号通路[10],促使p38 MAPK /JNK/ERK磷酸化,提高超氧化物歧化酶和丙二醛水平,促使活性氧(reactive oxygen species,ROS)大量产生,引起VSMC过度增殖和迁移[11],导致VSMC表型转化,加速血管钙化、衰老。除此之外,还可通过促使多功能蛋白聚糖大量产生,调节线粒体膜电位或线粒体功能,显著增加乳酸脱氢酶活性以及丙二醛含量,刺激VSMC 氧化应激[12],激 活 通 路 如Ras/Raf/MEK/MAPK、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶途径,介导ROS的产生。此外,在VSMC中,蛋白激酶C调节血管收缩、信号转导、生长速率和DNA合成或细胞周期进程。持续高血糖刺激通过提高甘油二脂的含量活化蛋白激酶C,抑制VSMC中一氧化氮的产生,增加纤溶酶原激活物抑制剂-Ⅰ的表达和NF-κB的活性,进而提高还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶活性,促进大鼠主动脉平滑肌细胞的增殖,导致VSMC发生表型转化[13]。
2.3晚期糖基化终末产物(advanced glycation end products, AGEs)AGEs是通过蛋白质、脂质和核酸的非酶糖化和氧化产生的,可改变组织的结构、功能和机械特性,从而使组织变硬,促进VSMC异常增殖,加速糖尿病血管疾病的发生。AGEs主要通过其受体(receptor for advanced glycation end, RAGE)发挥相关生物学作用。在糖尿病动物模型的VSMC中发现RAGE的水平升高,炎症标记物表达增加,VSMC迁移率增加,抗RAGE抗体可减轻这些病理变化。AGEs还可通过刺激NF-κB激活MAPK、ERK1/2信号通路促进VSMC发生表型转化[14]。此外,血清AGEs水平已被证明是T2DM患者冠状动脉粥样硬化严重程度的生物标志物[15]。
2.4高胰岛素血症在中国糖尿病人群中,T2DM患者占比约90%。T2DM的病因由前期的β细胞功能障碍逐渐变为后期的胰岛素抵抗。研究表明,胰岛素抵抗可能是当前中国人群中糖尿病流行的主要原因[16]。由于体内胰岛素平衡遭到破坏,胰岛素抵抗最终会发展为高胰岛素血症。胰岛素对VSMC的生物学效应主要由胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)介导,IGF-1与其受体高亲和力结合,进而激活增殖信号,通过MAPK信号转导通路增加VSMC的趋化性,诱导其发生表型转化[17]。胰岛素也通过激活NF-κB信号通路操纵其发生表型转化。还有研究发现在胰岛素存在的情况下,糖尿病来源细胞的迁移能力始终高于非糖尿病来源的细胞,在注射外源性胰岛素的患者中,其血管并发症的易感性可能高于其他患者。因此调控IGF-1受体活性是改善胰岛素敏感性的靶点,可能在防治血管并发症中发挥重要作用。
2.5表观遗传表观遗传是指在DNA序列没有发生改变的情况下,基因功能发生了可遗传的变化,并最终导致了表型变化,通常是通过DNA甲基化、翻译后组蛋白修饰和基于核糖核酸的机制(包括微小核糖核酸)发生的。近年来越来越多的研究发现,VSMC表型转化的过程与表观遗传密切相关。在糖尿病动物和细胞模型中都发现了表观遗传的证据,并可通过高糖诱发。
2.5.1DNA甲基化和组蛋白修饰DNA甲基化通常发生在CG二核苷酸重复序列(CpG岛),其在糖尿病中的重要性已经通过研究全基因组和特定基因组甲基化模式得到证实,在糖尿病患者脂肪组织中存在整体DNA甲基化差异[18]。有研究表明VSMC仅仅几次复制就可以引起显著的基因组低甲基化[19],血管细胞外基质的损伤也能引起VSMC分化基因的局部甲基化促进去分化表型改变。在体内,组蛋白可进行多种动态修饰,包括乙酰化、甲基化、磷酸化、SUMO化和泛素化。这些修饰可被一系列蛋白质家族调节,如组蛋白乙酰化酶和去乙酰化酶等。有证据表明糖尿病风险和组蛋白去乙酰化醇3之间存在遗传关联[20]。此外,糖尿病小鼠VSMC炎症因子启动子处组蛋白H3赖氨酸9(histone H3 lysine 9,H3K9)三甲基化的表达下调,可能是造成糖尿病“代谢记忆”和血管平滑肌细胞炎症因子表达增多的机制之一[21]。
2.5.2微小核糖核酸(microRNAs)microRNAs是一类包含17~25个核苷酸的非编码单链RNA分子, 它们的功能主要是通过不完全的核苷酸互补性与靶的3′-UTR结合,对靶信使核糖核酸的翻译发挥负调节作用。miR-145在VSMC表型转化中发挥了关键作用,降低miR-145会增加其靶基因Krüppel样因子4(kruppel-like factor 4,Klf4)的表达。Klf4的增加,会减少心肌素含量,诱导VSMC增殖和迁移[22];miR-21是VSMC增殖和分化的关键调节因子,它在动脉平滑肌细胞中的过度表达促进了VSMC标志基因的表达和纺锤形细胞的形成。研究发现miR-21可以通过下调磷酸酶及张力蛋白同源物和上调Bcl-2的表达而抑制VSMC凋亡。重要的是,在T2DM患者中,miR-21的血浆水平低于非糖尿病患者。已经有实验开始探究miR-21作为糖尿病大血管并发症生物标志物的效用;miR-133a在VSMC中调节IGF-1受体的表达,当糖尿病患者IGF-1受体的表达受损时,VSMC容易凋亡,这可能是动脉粥样硬化主动脉VSMC中miR-133a水平低的结果[23];miR-24作为VSMC病理的调控因子,靶向参与高糖诱导细胞增殖和迁移的基因。miR-24在高糖培养的VSMC中表达缺失,将miR-24转染到VSMC中可显著上调miR-24的表达,抑制NF-κB p65易位和NF-κB DNA结合活性进而抑制高糖诱导的NF-κB激活并抑制高糖诱导的VSMC的增殖和迁移[24]。
一些数据显示T2DM血管重塑性增强,PI3K/AKT/mTOR下调,MEK/ERK通路上调,miR-126表达增加,VSMC迁移和增殖能力增加。在T2DM VSMC中,miR-126过表达通过下调PI3K/AKT轴使非T2DM VSMC具有“糖尿病”表型。miR-126还通过激活MEK/ERK通路在T2DM VSMC代谢记忆中发挥关键作用[25]。此外,有研究显示血浆中miR-126的变化是在糖尿病患者症状出现之前观察到的[26],提示其作为糖尿病患者血管并发症早期干预靶点的效力;在db/db小鼠的VSMC中,miR-125b水平上调,并可靶向下调Suv39h1(一种组蛋白甲基转移酶,介导H3K9三甲基化)。前面已经提到H3K9甲基化与糖尿病血管功能障碍的代谢记忆有关,因此靶向miR-504可能使削弱代谢记忆新疗法[27]。除上述分子外,还有一些microRNAs不断被发现,例如在db/db小鼠中,miR-9通过靶向KLF5抑制VSMC的增殖和迁移[28];上调miR-125a可通过靶向戊二酰辅酶,调控甲戊酸信号通路,阻断高糖诱导的VSMC增殖和迁移[29]。 随着体外和体内miRNAs检测技术如定量PCRs、微阵列和高通量深度测序的改进,这些miRNAs中的大多数很容易在血浆和尿液中检测到[30]。通过各种信号通路的交互作用,在VSMC中,这些技术可以为糖尿病血管并发症和VSMC增殖等异常血管过程提供治疗靶点,见图1。因此理解特定的miRNAs如何影响糖尿病VSMC机制并定制细胞靶向给药策略以实践于临床具有巨大现实意义。
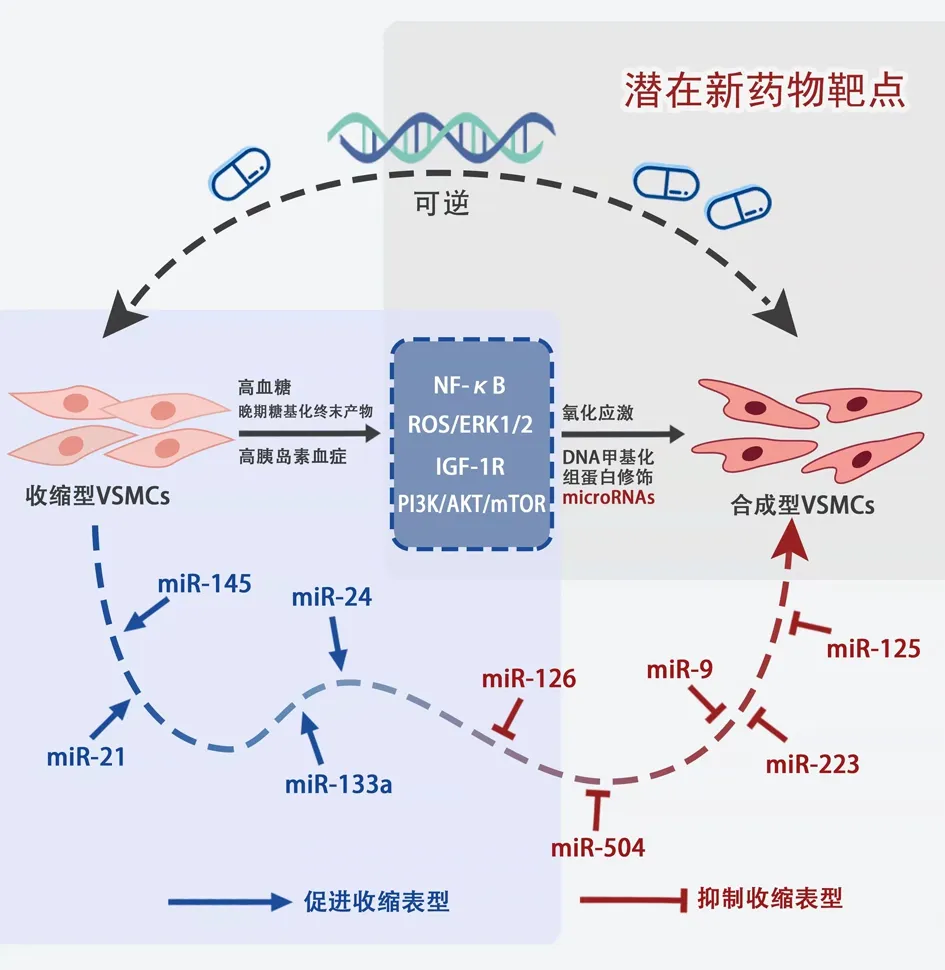
图 1 糖尿病诱导平滑肌表型转化机制图
3 靶向药物
VSMC作为血管壁中膜的主要结构,其表型转化在糖尿病血管并发症的发生发展中起着重要作用。将糖尿病中的VSMC作为修复表型的目标,有望有效地“消除”代谢记忆,改善糖尿病患者血管并发症。总结以上对VSMC表型转化机制的阐述,可以发现表观遗传机制的一个重要特点是:可逆,因此通过逆转表观遗传标记,“重置”异常VSMC表型成为可能[31]。
近年来越来越多的研究显示表观遗传学与糖尿病的发生发展密切相关,表观遗传学的研究将为糖尿病的防治和精准治疗提供一个新的思路。目前,各种表观遗传学药物正在不同程度上开发和研制,如DNA甲基化抑制剂(如白藜芦醇、四环素等),miRNA(外泌体)及组蛋白调节剂(曲古菌素 A、伏立诺他、丙戊酸、阿托伐他汀等)。但目前还没有任何研究表明是否表观遗传药物可以逆转VSMC病理表型。因此,在今后工作中我们可以着重从表观遗传学的DNA甲基化、组蛋白修饰以及miRNA等方面进行干预,逆转VSMC表型转化,从基因层面“重置”异常VSMC表型。除表观遗传药物外,目前还有一些在研的针对VSMC血管重塑的药物也有很大的应用前景。血管周围脂肪组织包含脂肪细胞、脂肪前细胞、免疫细胞(T细胞、B细胞等和间质血管碎片、内皮细胞、巨噬细胞、成纤维细胞、单核细胞等),可以通过释放血管调节因子、细胞因子、脂肪因子来调控VSMC的生长,从而影响血管重塑[32]。他汀类药物是3-羟基-3-甲基戊二酰辅酶a还原酶的抑制剂,广泛应用于血脂异常,除在上述基因层面通过组蛋白修饰影响疾病的发展,还有研究显示其在调节VSMC表型中的应用潜力。研究发现给药12周的辛伐他汀(1、5、10、20、50、100 μmol/L)可减弱年龄诱导的大鼠主动脉平滑肌细胞增殖[33],并阻断NF-κB和MAPK的激活。血小板上的P2Y12受体长期以来一直是抗血小板药物的主要靶点,抑制VSMC的迁移和增殖。目前,P2Y12抑制剂(替格瑞洛,其次是氯吡格雷)是急性冠脉综合征和经皮冠状动脉介入患者的首选药物之一。P2Y12受体在VSMC上高度表达,特别是在人颈动脉斑块中,其激活可增强动脉收缩。二磷酸腺苷与VSMC中的P2Y12受体结合,促进VSMC的迁移,从而导致新内膜增生[34]。但是很少有研究评估P2Y12在VSMC的发育、表型或可塑性中的作用,还需要大量体内体外实验证明其在糖尿病血管并发症中的应用潜力。
4 结 语
通过以上叙述不难发现细胞和非细胞成分之间的复杂相互作用可以通过多种分子机制影响糖尿病患者VSMC的表型和功能,导致血管并发症的发生发展,严重影响患者的生活质量和长期生存率,逆转VSMC表型在糖尿病血管并发症治疗中显现出巨大的临床价值。目前许多靶向药物已被证明可以调节心血管系统的疾病,但这些药物是否可以调节VSMC的表型,去除表观遗传标记从而治疗糖尿病血管并发症还不清楚,仍需要大量基础、临床实验加以证实。以VSMC表型转化为靶点治疗糖尿病血管并发症是一种新的挑战,也是新的机遇。随着研究的深入,相信其可以为糖尿病血管并发症提供更好的防治策略。
