汉黄芩苷调控细胞因子信号转导抑制因子1对肝纤维化的作用
2022-04-26刘国芳袁思雨李嘉豪张丽君王国凯
刘国芳,袁思雨,李嘉豪,张丽君,王国凯,方 玲
0 引 言
肝纤维化是由各种致病因子所致肝内结缔组织异常增生的病理过程,是一种可逆的创伤修复反应[1]。其特征是细胞外基质(extracellular matrix,ECM)的过度生成与沉积,而活化的肝星状细胞(hepatic stellate cells,HSCs)被认为是产生ECM的主要效应细胞[2-3]。因此,抑制 HSC 活化能有效缓解和减轻纤维化。课题组前期研究证实通过抑制血小板衍生生长因子-BB(platelet derived growth factor-BB,PDGF-BB)诱导的HSC活化,可降低细胞活力和减少ECM生成[4-5]。近来有研究显示,肝纤维化过程中,细胞因子信号转导抑制因子(suppressor of cytokine signaling 1,SOCS1)过度激活,而沉默或敲除SOCS1基因可抑制HSC细胞增殖,减少胶原沉积,从而缓解肝纤维化[6-8]。然而,目前临床治疗肝纤维化的药物非常有限,寻找有效预防和治疗的药物迫在眉睫。汉黄芩苷(wogonoside)是从黄芩中分离提取的一种黄酮类化合物,具有抗肿瘤、抗炎、抗血管生成等多种药理作用[9-10]。研究发现,在脂多糖/d-半乳糖胺诱导的小鼠急性肝损伤模型中,腹腔注射汉黄芩苷后,血清中丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和肝丙二醛(malondialdehyde,MDA)含量均有所下降[11]。此外,在CCl4诱导的大鼠肝纤维化中,汉黄芩苷明显改善了肝脂肪变性、胶原沉积和纤维化瘢痕面积。不仅如此,汉黄芩苷显著抑制炎症细胞因子的表达,如肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6和白细胞介素-10[12]。提示汉黄芩苷具有一定的抗肝纤维化作用,但其作用机制尚需进一步探讨。本研究建立小鼠肝纤维化模型,探讨汉黄芩苷对肝损伤和纤维化的药理作用,并采用PDGF-BB诱导HSC活化,进一步探索汉黄芩苷对HSC活化和增殖作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株和动物大鼠肝星状细胞株(HSC-T6)购自中国科学院上海细胞库;清洁级C57BL/6雄性小鼠(n=30),体重18~22 g,购自安徽中医药大学实验动物中心,实验动物许可证号:SCXK2019-0002。饲养温度20~26 ℃,湿度40%~70%,光照12 h/d,按清洁级标准适应性饲养5 d。
1.1.2药品与试剂汉黄芩苷购于成都瑞芬思生物科技有限公司,有效成分>98%;重组小鼠血小板衍生生长因子(PDGF-BB)购于英国PEPROTECH公司;ALT、AST和HYP检测试剂盒购于江苏南京建成生物工程研究所;BCA蛋白检测试剂盒购于上海碧云天生物技术公司;胎牛血清购于杭州四季青公司;DMEM高糖培养基购于美国Hyclone公司; MTT和DMSO购于美国Sigma公司;PVDF膜和超高敏的化学发光底物购于美国 MilliProe公司;小鼠β-actin抗体购于英国PEPROTECH公司;SOCS1抗体购于成都正能生物技术有限责任公司;α-SMA抗体购于上海复申生物科技有限公司;转化生长因子β1R(Transforming growth factor,TGF-β1R)、血小板衍生生长因子-βR(platelet derived growth factor-βR,PDGF-βR)、fibronectin、COL1α1、CyclinD1和CDK4抗体购于美国Abcam公司;PCNA抗体购于武汉Elabscience公司;山羊抗兔、山羊抗小鼠二抗购于北京中杉金桥生物技术有限公司;SOCS1基因的干扰性siRNA序列和阴性对照(NC)购于上海阮拓生物技术公司;LipofectamineTM2000购于美国Invitrogen公司。
1.1.3主要仪器MK3型酶标仪(荷兰雷勃公司);细胞恒温培养箱(美国Thermo公司);细胞培养超净工作台(江苏苏州安泰空气技术有限公司);XSZ型倒置显微镜(宁波永新光学股份有限公司);水平离心机(美国Beckman公司);公司电子分析天平(上海精天天平仪器厂);超速离心机(美国Beckman公司);共聚焦显微镜(日本OLYMPUS公司);Western blot设备(美国Bio-rad 公司)。
1.2方法
1.2.1 HSC-T6细胞的培养采用含10% 胎牛血清的 DMEM 培养液,在37 ℃、5% CO2及饱和湿度条件下培养,细胞为贴壁生长,待细胞稳定生长融合达到70%~80% 密度时用0.25% 胰酶消化液消化传代或按浓度接种培养瓶、培养板。实验细胞均处于对数生长期。
1.2.2肝纤维化模型的建立小鼠适应性饲养1周后,随后,将小鼠按随机数字表法分为5组,包括正常组、模型组和汉黄芩苷组(10、20和40 mg/kg),每组6只。模型组和汉黄芩苷处理组均腹腔注射10% CCl4橄榄油溶液(10 mL/kg),每周2次,连续8周,建立肝纤维化模型。同时,正常组腹腔注射相同剂量的橄榄油。自造模第4周起开始给药,各给药组分别给予相应的药物,持续4周。正常组和模型组每天给予相同剂量的等渗盐水;至实验结束,每周称重1次。最后一次给药后,禁止饮食,但不限制饮水。24 h后,小鼠进行称重,眼球取血。处死后,取出肝,编号并拍照,将肝分为两部分,其中一部分用4%多聚甲醛固定,然后进行石蜡包埋;另一部分直接保存在-80 ℃的冰箱中。
1.2.3血清学指标检测小鼠眼球血4 ℃、离心半径40 cm、3000 r/min离心15 min,取血清。检测血清中AST、ALT和HYP含量。
1.2.4肝组织HE染色取小鼠肝组织块,常规固定,包埋,切片,脱蜡水洗2 min后苏木精染色5 min,1%盐酸乙醇分色30 s,自来水浸泡 15 min,置伊红液中 2 min,常规脱水,透明,封固。显微镜观察并照相。采集所需图像。
1.2.5肝组织免疫组化检测切片脱蜡,置于枸橼酸钠缓冲液中(含0.05% Tween 20,PH=6.0),在高压锅内加压直至煮沸后进行抗原修复。切片滴加过氧化氢与甲醇的混合液封闭过氧化物酶,经1% trition10-x破膜10 min,于室温滴入山羊血清溶液封闭2 h,而后分别滴加一抗(α-SMA,1:100;COL1α1,1: 100;fibronectin,1:100),将切片组织置湿盒中4 ℃过夜,次日室温孵育二抗,DAB显色,用苏木精复染,乙醇脱水,二甲苯漂洗后封片。显微镜观察并照相。采集所需图像。
1.2.6MTT测定细胞增殖试验取对数生长期的HSC-T6细胞制成单细胞悬液,以5×103的细胞密度接种到96孔培养板。分组如下:正常组、PDGF-BB组和汉黄芩苷组(5、10、20、40、60、80、160、320 μmol/L)。待细胞完全贴壁后,使用基础培养基培饥饿HSC-T6细胞12 h。随后,汉黄芩苷处理组的细胞被替换成不同浓度的汉黄芩苷2 h后,除正常组外,其余各组再加入刺激因子PDGF-BB(10 ng/mL)继续培养48 h。每孔加20 μL 5 mg/mL MTT,避光继续培养4 h后,终止培养。5 mL注射器小心吸尽各孔液体,加入150 μL DMSO溶解细胞内结晶,室温振荡溶解10 min后,于490 nm 波长处测吸光度A值。实验筛选汉黄芩苷浓度为40、60和80 μmol/L用于后续体外实验。
1.2.7Western blot检测使用含PMSF的RIPA 细胞裂解液提取小鼠肝组织和HSC-T6细胞的总蛋白。BCA蛋白检测试剂盒检测蛋白浓度。总蛋白通过SDS-PAGE电泳分离。电泳后,将蛋白转移到PVDF膜上,室温5%脱脂牛奶孵育2 h后,将膜与相应的一抗稀释液(β-actin,1∶1000;α-SMA,1∶500;COL1α1,1∶500;fibronectin,1∶500;PDGF-βR,1∶500;TGF-β1R,1∶500;CDK4,1∶1000;CyclinD1,1∶1000;PCNA,1∶1000;SOCS1,1∶500)在4 ℃下孵育过夜。第2天,用TBST洗涤后,二抗(1∶10000)孵育1 h。使用ECL化学发光试剂盒显影,并通过ImageJ软件进行灰度值分析。
1.2.8qRT-PCR技术检测Trizol试剂提取细胞和肝组织总RNA,凝胶电泳判断有无降解。根据逆转录试剂盒将总 RNA 逆转录成 cDNA,通过Piko-real 96系统(95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环)和SYBR-Green扩增cDNA。引物序列如下:β-actin正向: CCCATCTATGAGGGTTACGC,反向: TTTAATGTCACGCACGTTC; SOCS1正向: CCTTCGACTGCCTCTTCGAG,反向: AGTCACGGAGTACCGGGTTA; α-SMA正向: 5′-CAATGGCTCCGGGCTCTGTA-3′,反向: 5′-CTCTGCTCTGCGCTTCGTC-3′; COL1α1正向: 5′- ACCTCAGGGTATTGCTGAC-3′,反向: 5′-GACCAGGGGCCTCTTTCT-3′; Fibronectin 正向: 5′-ACCTTGACTGCCCAGTGGACAGCG-3′,反向: 5′-GCTCACTCTTCTGATTGTTCTTCAG-3′。
1.2.9免疫荧光检测α-SMA和COL1α1的表达将正常组、PDGF-BB组、PDGF-BB +汉黄芩苷 40 μmol/L 组、PDGF-BB +汉黄芩苷60 μmol/L组、PDGF-BB +汉黄芩苷80 μmol/L组细胞用预冷的4%多聚甲醛固定15 min,PBS洗3次。免疫荧光阻断液在37 ℃下孵育30 min。一抗α-SMA(1∶200)和COL1α1(1:200)4 ℃ 孵育过夜。然后将细胞与荧光二抗在室温下孵育1 h,PBS清洗3次。共聚焦显微镜观察各组荧光强度。
1.2.10SOCS1 siRNA转染取对数生长期的HSC-T6细胞接种于6孔板,将细胞分为空白对照组、阴性对照组、SOCS1 siRNA1组、SOCS1 siRNA2组、SOCS1 siRNA3组。取2个EP管,加入Opti-MEM培养基溶液。分别在两管溶液中加入LipofectamineTM2000和siRNA SOCS1静置5 min。然后将两管溶液混匀,静置20 min以便形成复合物,再加入到HSC-T6细胞中,继续培养48 h。之后,qRT-PCR和Western blot来确定基因敲除率。

2 结 果
2.1 汉黄芩苷减轻CCl4诱导小鼠肝损伤与正常组相比,模型组小鼠体重增长缓慢(P<0.05),肝重比增高(P<0.05),而汉黄芩苷组较模型组体重增长较快(P<0.05);40 mg/kg汉黄芩苷组肝重比明显低于模型组(P<0.05)。见图1。HE染色显示,模型组小鼠肝小叶排列紊乱,大量炎性细胞浸润,空泡增多;而汉黄芩苷高剂量组(40 mg/kg)中肝小叶排列较规则,炎性细胞以及空泡明显减少。见图2。与正常组比较,模型组小鼠血清中ALT、AST和HYP水平增加(P<0.05);汉黄芩苷组(P<0.05),见表1。

a:小鼠每周体重变化(g);b:小鼠肝重比

a:正常组;b:模型组;c-e:分别为10、20、40 mg/kg汉黄芩苷组

表 1 小鼠血清HYP、AST、ALT的水平
2.2汉黄芩苷缓解CCl4诱导小鼠肝纤维化免疫组化的结果显示,模型组α-SMA、COL1α1和fibronectin在肝纤维化瘢痕周围大量表达,在汉黄芩苷组(40 mg/kg)中表达显著降低。见图3。Western blot结果进一步证实,汉黄芩苷组α-SMA、COL1α1和fibronectin蛋白显著低于模型组(P<0.05)。见图4。与此同时,汉黄芩苷组的纤维化细胞因子PDGF-βR和TGF-β1R蛋白水平显著降低(P<0.05)。见图5。
2.3汉黄芩苷抑制 PDGF-BB诱导的HSC-T6 细胞增殖Western blot结果表明,相较于正常组,PDGF-BB组CDK4和CyclinD1的蛋白含量增高(P<0.05);而与PDGF-BB组相比较,汉黄芩苷组CDK4的含量显著降低(P<0.05)。PDGF-BB组的PCNA蛋白含量较正常组略有增高,但差异无统计学意义(P>0.05)。但与PDGF-BB组比较,汉黄芩苷组(80 μmol/L)PCNA的蛋白表达显著降低(P<0.05),见图6。

图 3 镜下观察各组小鼠免疫组化α-SMA、COL1α1和fibronectin表达(免疫组化染色 ×50)
1:正常组;2:模型组;3-5:分别为10、20、40 mg/kg汉黄芩苷组

1:正常组;2:模型组;3-5:分别为10、20、40 mg/kg汉黄芩苷组
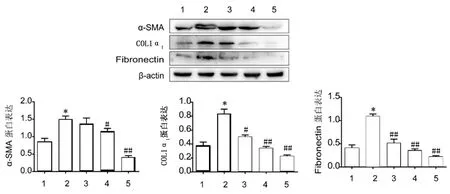
2.4汉黄芩苷减少PDGF-BB诱导的HSC-T6细胞中ECM合成免疫荧光结果显示,α-SMA和 COL1α1荧光强度在PDGF-BB组HSC-T6细胞中较强,而汉黄芩苷组荧光强度显著降低。见图7。Western blot结果同样证实,与正常组相比,PDGF-BB组α-SMA、COL1α1和fibronectin蛋白含量明显增高(P<0.05)。与模型组比较,汉黄芩苷(60 和80 μmol/L)组α-SMA、COL1α1和fibronectin的蛋白含量显著下降(P<0.05),见图8。

1:正常组;2:PDGF-BB组;3:40 μmol/L汉黄芩苷组;4:60 μmol/L汉黄芩苷组;5:80 μmol/L汉黄芩苷组

a:α-SMA;b:COL1α1

1:正常组;2:PDGF-BB组;3-5:分别为40、60、80 μmol/L汉黄芩苷组
2.5汉黄芩苷增加纤维化肝组织和活化HSC-T6细胞中SOCS1表达与正常组相比,模型组小鼠肝组织中SOCS1基因和蛋白水平表达明显降低(P<0.05)。与模型组相比,汉黄芩苷给药组可显著升高SOCS1 基因以及蛋白水平表达(P<0.05),见图9。同样,SOCS1在PDGF-BB诱导的活化的HSC-T6中高表达。较PDGF-BB组,汉黄芩苷显著提高SOCS1基因以及蛋白水平(P<0.05)。见图10。上述结果提示,SOCS1可能参与汉黄芩苷抗肝纤维化过程,并有待进一步研究。

a:小鼠肝组织中SOCS1 mRNA水平;b:Western blot检测小鼠肝组织中SOCS1蛋白水平

a:HSC-T6细胞中SOCS1 mRNA水平;b:Western blot检测HSC-T6细胞中SOCS1蛋白水平
2.6沉默SOCS1拮抗汉黄芩苷的抗肝纤维化作用合成靶向SOCS1 siRNA 1、siRNA 2和siRNA 3,转染HSC-T6细胞48 h。qRT-PCR以及Western blot结果显示siRNA 2和siRNA 3均能明显下调SOCS1的基因和蛋白表达(P<0.05),其中siRNA 2的靶向效率达到0.286,见图11。相较于正常组,SOCS1蛋白含量在PDGF-BB组降低(P<0.05)。加入汉黄芩苷(60 μmol/L)后SOCS1蛋白含量明显增加(P<0.05)。与汉黄芩苷组比较,SOCS1 siRNA 2组SOCS1蛋白水平降低(P<0.05),见图12。同时,与PDGF-BB组相比,汉黄芩苷组对α-SMA、COL1α1和fibronectin 基因水平有明显抑制作用(P<0.05)。而加入SOCS1 siRNA 2后,α-SMA、COL1α1和fibronectin 基因水平升高(P<0.05),见表2。

a:SOCS1 siRNA 1、siRNA 2和siRNA 3转染HSC-T6细胞后SOCS1 mRNA水平;b:Western blot检测SOCS1 siRNA 1、siRNA 2和siRNA 3转染HSC-T6细胞后SOCS1蛋白水平

1:正常组;2:PDGF-BB组;3:汉黄芩苷组;5:SOCS1 siRNA 2组

表 2 各组促纤维化因子的转录水平比较
3 讨 论
肝纤维化是各种慢性肝病发展的共同病理特征,也是慢性肝病进展的转折点。各种肝损伤因素刺激,氧化应激、炎症因子、细胞因子的相互作用等激活HSC,活化的HSC是肝纤维化过程中ECM的主要来源,也是肝纤维化发生的中心环节。肝脏受损时,HSC对多种细胞因子产生应答,激活后的HSC形态类似于肌纤维母细胞,增殖活性和胶原合成能力明显增加,表达大量α-SMA、COL1α1及fibronectin,增加ECM的合成和分泌,减少其降解,ECM合成和降解失衡,使过多的ECM在肝组织中沉积,形成纤维化。迄今,我们和其他实验室的研究均表明,抑制HSC活化,能有效降低ECM蓄积,进而减轻纤维化[4-5, 13-14]。
随着中医药事业的不断发展,研究发现,多种中药成分均可抑制HSC细胞的活化减轻肝纤维化[15-17]。汉黄芩苷是从传统中药黄芩中分离得到的一种具有生物活性的黄酮类化合物,已被证明可以缓解肝疾病,例如非酒精性脂肪肝、脂多糖/d-半乳糖胺诱导的急性肝损伤以及CCl4诱导的肝纤维化[11-12, 18]。汉黄芩苷通过抗炎、稳定MMPs/TIMPs平衡、减少HSC激活和ECM生成来发挥肝脏保护作用。与先前的研究一致,本研究发现在CCl4诱导的小鼠肝纤维化中,汉黄芩苷显著减轻了肝细胞变性、炎性细胞浸润、纤维瘢痕和胶原沉积;且汉黄芩苷高剂量组(40 mg/kg)疗效优于汉黄芩苷低剂量组(10 mg/kg)和汉黄芩苷(20 mg/kg)中剂量组。在体外实验中,发现汉黄芩苷剂量依赖性地抑制HSC的活力,且可抑制CyclinD1、CDK4、PCNA蛋白的表达,推测汉黄芩苷抑制了HSC的增殖,减少ECM的合成,从而减轻肝纤维化。
本研究中,汉黄芩苷不仅可减少纤维化小鼠肝组织中ECM表达,PDGF-βR和TGF-β1R蛋白水平也显著降低。其中PDGF一种刺激结缔组织等组织细胞增殖的肽类调节因子,具有促进有丝分裂、分化、趋化和血管生成的作用[19]。作为重要的促纤维化生长因子和有丝分裂原,PDGF可激活细胞内多条信号通路[20]。研究显示PDGF诱导HSC-T6细胞增殖,激活PI3K/Akt/mTOR和NF-κB信号通路,加重肝纤维化的发展[21]。此外,相关研究发现抑制PDGF诱导人肾小球细胞活化,调节负反馈蛋白SOCS1的表达,可以间接抑制JAK/STAT通路,影响炎性信号的传导,进而更好地控制系膜增生性肾小球肾炎[22]。本研究发现,应用PDGF刺激HSC-T6细胞,细胞过度增殖和胶原合成增加,该过程中SOCS1的基因和蛋白水平均显著下降;而给予汉黄芩苷,SOCS1的表达逐渐升高。进一步应用siRNA沉默SOCS1,发现SOCS1水平的降低,从而抑制汉黄芩苷的抗肝纤维化作用。推测汉黄芩苷可能通过增加SOCS1水平,从而发挥抗肝纤维化作用。
综上所述,本研究表明,汉黄芩苷可减轻CCl4诱导的小鼠肝纤维化以及抑制PDGF-BB诱导的HSC-T6细胞的活化,这一过程与上调SOCS1的表达有关。提示汉黄芩苷可能是治疗肝纤维化的潜在药物。然而,汉黄芩苷是否通过其他细胞因子或下游信号通路途径减轻肝纤维化,尚需进一步研究。
