小鼠嗜酸粒细胞性慢性鼻-鼻窦炎模型的建立
2022-04-26卫红齐徐夏媛刘志勇莫江伟邢洪瑜曹忠胜
卫红齐,陈 伟,徐夏媛,刘志勇,莫江伟,邢洪瑜,曹忠胜
0 引 言
嗜酸粒细胞性慢性鼻-鼻窦炎(eosinophilic chronic rhinosinusitis, ECRS)作为慢性鼻-鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyps, CRSwNP)的一个亚型,是一种高度异质性鼻腔鼻窦黏膜慢性炎性疾病,近年发病率有上升趋势,严重影响患者生活质量[1]。研究发现,ECRS除鼻-鼻窦黏膜组织中有大量嗜酸性粒细胞(eosinophil,EOS)浸润以外,通常伴有广泛息肉形成,且以2型T辅助细胞(type-2 T helper cell,Th2)反应为主,虽对糖皮质激素治疗敏感,然在停用糖皮质激素后难以维持长期疗效,即使手术治疗,黏膜炎症也难以控制,且术后复发率较高[2-3]。因此,探究ECRS发病机制并寻求好的治疗方案具有重要临床意义,故建立一个理想动物模型进行相关研究倍受关注。而目前截止投稿国内有关ECRS动物模型的建立方法未见报道。本研究采用普通抗原卵清蛋白(ovalbumin,OVA)联合超抗原金黄色葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)来建立小鼠ECRS实验模型。
1 材料与方法
1.1 实验动物和主要试剂SPF级雌性BALB/c小鼠24只 ,4~6周龄,体重20~30g,购自上海千全生物科技有限公司,常规方法饲养于我院实验中心SPF级动物房内,动物实验许可证号:SYXK(苏)2016-0050。适应性饲养2周,温度22~24℃,湿度50%,正常饮食。
OVA(编号:A5503-10G)购自美国Sigma公司,SEB(编号:BT202)购自美国Toxin Technology 公司,氢氧化铝粉剂(编号:77161)购自美国Thermo公司,小鼠 IFN-γ(编号:EK280/3-96)、IL-4(编号:EK204/2-96)、IL-5(编号:EK205-96)、IL-17A(编号:EK217/2-96)细胞因子特异性ELISA试剂盒购自杭州联科生物科技有限公司。免疫组化试剂:一抗为抗嗜酸性粒细胞阳离子蛋白(Eosinophil cationic protein,ECP)兔单克隆抗体(编号:ab207429),二抗为生物素结合的山羊抗兔lgG(编号:ab205718),均购自英国Abcam公司。
1.2ECRS模型的建立方法将24只BALB/c雌性小鼠随机分为4组,分别为:磷酸缓冲盐溶液(phosphate-buffered saline,PBS)组、SEB组、OVA组及SEB+OVA组,每组6只。建模方法参照Kim等[4]所采用的方法并进行适当改变。用腹腔注射OVA以及鼻腔滴入OVA使小鼠致敏,后通过鼻腔滴入SEB以及OVA的方法诱导小鼠ECRS。PBS组:第0天(d0)和第5天(d5)经腹腔注射0.2 mL PBS溶液;从d12开始,连续7d每天予40 μL PBS溶液滴鼻;从d19至d102共12周,每周3次予40 μL PBS溶液滴鼻。SEB组小鼠前46天与PBS组小鼠处理方法相同,从d47开始连续8周用10 ng SEB,每周一次鼻腔滴注。OVA及SEB+OVA两组小鼠:d0和d5腹腔注射0.2 mL含25 μg OVA及2mg氢氧化铝的混悬液(PBS稀释);从d12开始,连续7天每天予40 μL 3%OVA溶液滴鼻;从d19至d102共12周,每周3次予40 μL 3%OVA溶液滴鼻。SEB+OVA组从d47开始除了鼻腔滴注3%OVA溶液以外,连续8周给予10 ng SEB,每周一次滴鼻。每天观察动物饮食、精神状况以及鼻部症状。在d103获取标本进行检测分析。
1.3ECRS模型检测
1.3.1 细胞因子表达水平小鼠用7%水合氯醛(0.05 mL/10 g)腹腔注射麻醉后固定,仰卧头低位进行鼻腔灌洗(头低位防止灌洗液流入下呼吸道)。一侧鼻腔以5滴/min(平均一滴约0.05 mL) 的速度缓慢滴入等渗盐水,同时在对侧鼻腔用低负压持续抽吸收集鼻腔灌洗液(nasal lavage fluid, NLF)(此法有60%~80%回收率)。共收集NLF约2 mL,室温静止沉淀30 min,4 ℃离心10 min,4000 r/min,离心半径6 cm,取其上清液-70 ℃保存待测。所有上清液标本收集完毕后,用ELISA,按照试剂盒操作步骤检测NLF中的IFN-γ、IL-4、IL-5及IL-17A的浓度。
1.3.2组织病理学观察NLF收集完后,颈椎脱臼法处死小鼠,去除头部皮肤及皮下软组织,断头后整体放福尔马林固定48h后用10% EDTA脱钙液脱钙5周,每3天更换一次脱钙液。后经脱水、包埋制作蜡块, 切片(片厚4μm)后用HE染色,在光镜下观察各组小鼠鼻-鼻窦黏膜组织病理学改变。主要观察鼻-鼻窦有无息肉样病变以及黏膜组织中EOS浸润情况,并在高倍视野(400倍)下对息肉样病变以及EOS进行计数。息肉样病变定义为有明显的黏膜隆起伴EOS浸润。观察结果用息肉样病变计数/只以及EOS计数/HPF来表示。
1.3.3免疫组化染色用免疫组织化学染色检测鼻-鼻窦黏膜组织中ECP表达水平。4μm厚切片在二甲苯中脱蜡后用乙醇水化,PBS冲洗3次,用1%的正常山羊血清封闭切片,然后滴加一抗,为抗ECP兔单克隆抗体,在4℃的加湿环境下过夜。切片用PBS冲洗3次,然后滴加二抗,为生物素结合的山羊抗兔lgG(1∶1200),在室温下孵育90 min。随后,切片在室温下与生物素标记的辣根过氧化物酶复合物(avidin-biotinylated horseradish peroxidase complex, ABC)孵育60min,PBS冲洗,用二氨基联苯胺(diaminobenzidine,DAB)显色处理。最后,切片用苏木素衬染,中性树胶封片,光镜下观察。每张切片均由两名未知动物分组的病理科医师独立观察并分析。
结果判定:ECP主要表达于EOS的细胞核内,以细胞核染成棕黄色和(或)棕褐色为阳性细胞。每只小鼠取染色良好切片3张,每张切片于400倍视野下任意取不相重叠的黏膜组织5处进行观测,对表达ECP的阳性细胞均数进行统计分析。

2 结 果
2.1 细胞因子水平OVA组、SEB+OVA组IL-4和IL-5浓度显著高于PBS组、SEB组(P<0.05);SEB+OVA组IL-5表达水平较OVA组显著升高(P<0.05)。见表1。

表 1 小鼠NLF中IFN-γ、IL-4、IL-5和IL-17A浓度比较
2.2鼻-鼻窦黏膜组织病理学改变
2.2.1 EOS浸润PBS组小鼠鼻-鼻窦黏膜上皮完整,未见明显炎性细胞浸润;SEB组小鼠鼻-鼻窦黏膜内及黏膜下可见散在炎性细胞浸润;OVA组小鼠鼻-鼻窦黏膜水肿增厚伴有EOS浸润;SEB+OVA组小鼠鼻-鼻窦黏膜组织中见大量炎性细胞浸润,尤以EOS及淋巴细胞最显著。见图1。OVA组EOS计数[(35.56±5.24)/HPF]显著高于PBS组[(0.56±0.29)/HPF]、SEB组[(1.83±0.64)/HPF)](P<0.05);SEB+OVA组EOS计数[(77.80±10.29)/HPF]显著高于PBS组、SEB组及OVA组(P<0.05)。
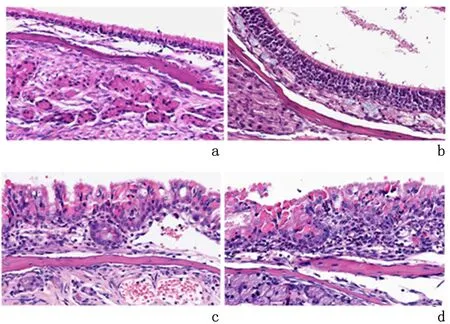
a:PBS组; b:SEB组; c:OVA组; d:SEB+OVA组图示SEB+OVA组见大量EOS浸润图 1 鼻-鼻窦黏膜组织中EOS浸润(HE ×400)Figure 1 Eosinophilic infiltration were observed in the sinonasal mucosa(HE ×400)
2.2.2息肉样病变PBS组、SEB组及OVA组鼻-鼻窦黏膜均未见息肉样病变。SEB+OVA组每只小鼠鼻-鼻窦黏膜均可见息肉样病变,个数1至4,共观察到14个息肉样病变;息肉样病变的组织病理主要表现为黏膜肿胀隆起(细胞间隙水肿)伴EOS浸润,见图2。SEB+OVA组息肉样病变计数[(2.33±0.94)个/只]较其他组(0±0)明显升高(P<0.05)。

图示鼻-鼻窦黏膜肿胀隆起伴EOS浸润
2.3鼻-鼻窦黏膜组织中ECP表达免疫组化染色显示,OVA组、SEB+OVA组鼻-鼻窦黏膜组织中均有较强表达ECP的阳性信号,表达ECP阳性细胞数[(16.53±4.82)/HPF、(34.60±7.25)/HPF)]显著多于PBS组[(0.49±0.18)/HPF]、SEB组[(0.74±0.26)/HPF],差异具有统计学意义(P<0.05),且SEB+OVA组表达ECP的阳性细胞数多于OVA组(P<0.05)。见图3。

a:PBS组; b:SEB组; c:OVA组; d:SEB+OVA组
3 讨 论
2011年,Kim等[4]首次报道使用低剂量的SEB在小鼠变应性鼻-鼻窦炎基础上成功诱导鼻息肉样病变伴EOS浸润,与ECRS病理改变相似。之后该学者在该模型基础上进行拓展研究[5]。本实验参照Kim报道的方法,根据预实验的研究进行适当改变,即在OVA致敏的基础上适当增加鼻腔滴入SEB剂量,成功诱导ECRS,研究结果基本一致。
Th2反应是ECRS重要免疫学特征。OVA组及SEB+OVA组Th2细胞因子(IL-4和IL-5)高表达,且SEB+OVA组IL-5表达水平较OVA组更高,表明OVA作为普通抗原可诱导鼻-鼻窦黏膜Th2型免疫反应,OVA联合SEB诱导Th2反应更强烈。IL-5是促进EOS在气道黏膜粘附、募集和脱颗粒的关键细胞因子[6-7]。IL-5的高表达可能在OVA联合SEB诱导ECRS过程中起重要作用。
ECRS主要病理特征:一是组织中大量EOS浸润;二是鼻腔和(或)鼻窦有息肉样病变。SEB+OVA组小鼠鼻-鼻窦黏膜组织中有大量EOS浸润,且可见息肉样病变,按照EPOS2020[8]提出的每HPF≥10个EOS作为ECRS诊断标准,EOS计数远多于此标准所规定的计数。虽然OVA组也有明显EOS浸润,但EOS计数明显少于SEB+OVA组,且未见息肉样病变,因此单纯滴入OVA可诱导变应性鼻-鼻窦炎,但炎症的程度还不足以诱导息肉样病变。小鼠鼻腔单纯滴入SEB鼻-鼻窦黏膜组织形态学改变不显著,具体原因值得探究。SEB作为超抗原在CRSwNP发生发展中的作用已得到证实。Braga等[9]单独使用SEB可成功诱导兔ECRS。本研究前期结果也显示,单独向兔上颌窦腔注入高浓度SEB可诱导急性上颌窦炎[10]。本实验单独使用SEB不能诱导鼻-鼻窦黏膜炎性改变的可能与诱导方式以及动物种类不同有关。国外有学者通过小鼠哮喘模型研究发现,SEB增强气道高反应以及变应性炎症反应需要在OVA致敏的小鼠体内[11]。
ECP主要来源于活化的EOS脱颗粒。研究发现,鼻腔分泌物中ECP表达水平与EOS计数存在显著相关性,鼻腔分泌物中ECP升高可能源于EOS脱颗粒水平上调[12-13]。本实验中,SEB+OVA组鼻-鼻窦黏膜组织中ECP表达水平显著升高,可能与EOS大量表达有关。ECP可通过损伤鼻-鼻窦黏膜上皮细胞膜导致细胞坏死脱落,且与多种细胞因子、趋化因子和黏附分子等相互作用,在鼻部慢性炎性疾病发展中起重要作用[14]。
本实验结果与Kim等[4]研究结果比较,鼻-鼻窦黏膜组织病理学改变虽然相似,但本研究在诱导ECRS过程中使用的SEB剂量是10ng,而Kim使用的剂量是5ng。本实验选择10ng的原因:①在前期的预实验中我们按照SEB 5ng进行诱导,小鼠鼻-鼻窦黏膜组织病理学观察未见明显息肉样病变;②近几年,有国外学者尝试用SEB 10ng而非5ng来诱导ECRS进行相关研究[15-16]。本研究使用SEB 5ng不能诱导小鼠鼻息肉样病变的可能原因:① 小鼠鼻孔太小,SEB滴入过程中未能全部进入小鼠鼻腔鼻窦;② 小鼠体位放置不当,滴入的SEB很快从前鼻孔溢出或流至鼻咽部。上述因素导致SEB在鼻腔鼻窦停留时间太短,实际有效剂量不足。我们推测,如果每次5ng SEB全部进入鼻腔鼻窦发挥作用,剂量可能足以诱导ECRS,通过后续研究进一步证实。
OVA联合SEB诱导小鼠ECRS,该模型在免疫学上呈现Th2型免疫反应,在组织病理学上表现为嗜酸性炎症反应,与人类ECRS具有相似性。然而,该模型也有一些局限性[4-5]。首先,小鼠鼻腔鼻窦气动窦结构空间相对较小,进行影像学评估相对困难。第二,小鼠嗅区黏膜上皮占据鼻腔黏膜上皮大部分区域,与人类存在一定差异。第三,小鼠鼻息肉样病变的外观形态与人鼻息肉外观形态差异明显。最后,该模型是由抗原及细菌毒素驱动的,所以它不能代表所有ECRS的诱导因素。所以,将动物实验数据转化并用于探索人类疾病也需慎重考虑,故对ECRS最佳动物模型探索仍存在挑战。
