长链非编码RNA00467通过调控巨噬细胞极化促进肺腺癌细胞增殖
2022-04-26汪向海周莹莹
汪向海,周莹莹
0 引 言
肺腺癌是肺癌最常见的类型,尽管肺腺癌在诊断和治疗方面取得了很大进展,肺腺癌的预后仍然很差[1-2]。因此,迫切需要进一步研究肺腺癌进展的潜在生物学机制。肿瘤相关巨噬细胞(Tumor-associated macrophages,TAM)是肿瘤微环境中一类重要的免疫细胞,与肿瘤血管生成与患者不良预后密切相关[3]。TAM可根据环境刺激及其激活状态极化为两种表型,即M1和M2。一般来说,M1型巨噬细胞的特征是分泌促炎细胞因子以清除肿瘤细胞,而M2型巨噬细胞可以表达高水平的抗炎细胞因子促进肿瘤细胞进展,如IL-10和精氨酸酶-1(Arginase-1,Arg-1)[4]。此外,TAM主要被认为是参与肿瘤血管生成和肿瘤进展的极化M2表型,与患者的不良预后密切相关[5]。然而,到目前为止,肺腺癌中TAM极化的分子机制仍大部分未知。
众所周知,长链非编码RNA(Long non-coding RNA,lncRNA)参与RNA稳定性、剪切加工、表观遗传调节和基因转录,在细胞生物学过程中发挥重要作用[6-8]。最近的一项研究表明LncRNA与肿瘤发生在内的若干病理过程密切相关[9]。此外,发现lncRNA通过调节微环境中的TAM极化参与疾病进展[10-11]。Zhou等[12]发现lncRNA NIFK-AS1通过靶向miR-146a抑制巨噬细胞极化从而抑制子宫内膜癌细胞增殖、迁移和侵袭,提示lncRNA NIFK-AS1通过调节TAM极化从而介导子宫内膜癌进展。Huang等[13]发现lncRNA-MALAT1通过靶向TAM分泌的FGF2促进甲状腺癌细胞的增殖、迁移和侵袭。本团队既往研究发现linc00467在肺腺癌中表达上调,并与肺腺癌的的增殖、侵袭和迁移密切相关[14]。然而,对其影响TAM极化在肺腺癌中的作用机制知之甚少。在本研究中,我们验证了肺腺癌细胞通过linc00467诱导巨噬细胞极化,进而促进肺腺癌的增殖。
1 材料与方法
1.1 实验材料人单核细胞系 THP-1 细胞、人正常上皮细胞系(16HBE)、肺腺癌细胞系(A549)购自中国科学院生物化学与细胞生物学研究所。将THP-1 细胞、A549细胞在添加了10%的胎牛血清(FBS)的RPMI-1640培养基(Gibco Company,Grand Island,NY)中进行培养。TRI Reagent BD购于美国invitrogen公司;PrimeScriptTMRT reagent和SYBR Premix Ex TaqTM购于日本Takara公司;Quantstudio 3.0实时荧光定量PCR仪购于美国Applied biosystems公司;低温高速离心机购于美国Thermo Fisher Scientific公司;Realtime PCR引物由南京擎科生物科技公司合成。Accuri C6流式细胞仪购于美国Becton Dickinson公司。慢病毒(linc00467-shRNA和对照-shRNA)由上海吉玛基因设计和合成。
1.2方法
1.2.1 PMA 诱导 THP-1 细胞PMA 溶解于 DMSO 中,稀释成剂量为 0.1 μg/mL,按照 2 mL 细胞悬液含 4×105个THP-1 细胞,添加 20 μL PMA(100 ng /mL),PMA 与细胞悬液混匀后,按照每孔2 mL 细胞悬液的量种于6 孔板中,诱导 48 h。
1.2.2酶联免疫吸附(ELISA)测定在96孔板细胞生长至数量为2×105个之后,使用ELISA 实验检测IL-10与IL-12水平。首先使用标准品绘制标准曲线。各组细胞培养 48 h后取上清液,按照双抗夹心法实验步骤进行IL-10与 IL-12 浓度检测。
1.2.3RT-PCR检测CD68和linc00467在细胞中的表达水平以RNA逆转录的cDNA为模板,以GAPDH为内参,利用CD68、linc00467和GAPDH特异性引物,根据Takara的SYBR Green试剂盒说明书进行RT-PCR检测。CD68上游引物为 5′-GTCCACCTCGACCTGCTCT-3′,CD68下游引物为 5′-CACTGGGGCAGGAGAAACT-3′;Linc00467上游引物为TGAGTCCAAACCGGATA,Linc00467下游引物为CACCAAGGTTCAGCAGATCCGC,GAPDH上游引物为GGAGCGAGATCCCTCCAAAAT,GAPDH下游引物为GGCTGTTGTCATACTTCTCATGG。实时定量PCR反应体系:SYBR© Premix Ex Taq 10 μL,ROX Reference Dye II 0.4 μL,上游引物0.4 μL,下游引物为0.4 μL,ddH2O 6.8 μL,cDNA 2 μL。反应条件:95 ℃,30 s;95 ℃,5 s;60 ℃,34 s;95 ℃,15 s;60 ℃, 1 min;95 ℃,15 s。实时定量PCR 检测 linc00467 的表达,得出CT值后,以GAPDH为内参,通过2-ΔCT法计算出目的基因的mRNA相对水平。
1.2.4共培养实验巨噬细胞与A549细胞的共培养实验使用 Transwell 小室完成。对照组:巨噬细胞以1×105个/孔的密度加入24孔 Transwell 板上室,16HBE细胞以同样密度加入下室。实验组:巨噬细胞以1×105个/孔的密度加入24孔 Transwell 板上室,A549细胞以同样密度加入下室,共培养 3 d。
1.2.5细胞免疫荧光染色各组巨噬细胞种植于细胞爬片,使用4%多聚甲醛固定后,CD86一抗4 ℃孵育过夜。随后使用 Alexa Fluor 568 标记的二抗室温染色 1 h。使用同样的方法标记巨噬细胞表面CD206。最后使用倒置荧光显微镜观察拍照。
1.2.6慢病毒shRNA转染细胞慢病毒(linc00467-shRNA和control-shRNA)由上海吉玛基因设计和合成。插入慢病毒载体的靶向linc00467(5′-GCTGGCAAATATGAAGGTA-3′)的片段用作有敲降linc00467功能的linc00467-shRNA,插入慢病毒载体的非靶向片段(5′-TTCTCCGAACGTGTCACGT-3′)用作无敲降功能的control-shRNA。
1.2.7流式细胞术使用流式细胞术检测巨噬细胞的表型转化。各组细胞使用 APC 标记的CD206 抗体进行染色。染色完成后每组取约 1×105个细胞重悬于100 μL 流式缓冲液中,使用 Accuri C6 流式细胞仪进行检测。
1.2.8MTT法 测定细胞增殖能力Transwell 上室A549细胞贴壁培养 48 h 后,使用MTT方法检测A549细胞增殖。细胞消化后充分重悬,细胞计数后铺96孔板,每孔铺3000个细胞,设置6个复孔。将MTT溶于PBS配置浓度为5 mg/mL MTT反应液,超净台内避光用0.22 μm滤器过滤。6 h后每孔中加入20 μL MTT,孵育4 h后,弃上清,加入150 μL DMSO/孔。震荡15 min,按照相应时间检测490 nm波长处的吸光度。
2 结 果
2.1 PMA 诱导 THP-1 细胞分化为MO型巨噬细胞待THP-1细胞生长状态良好,见图1。用100 ng/mL PMA 刺激 48 h。使用倒置显微镜观察,THP-1 细胞由悬浮状态转变为贴壁状态,透光度降低,见图2。RT-PCR检测巨噬细胞特异性标志分子CD68的mRNA水平,与对照组(0.41±0.15)相比,发现贴壁细胞 CD68mRNA水平明显增加(1.95±0.49),差异有统计学意义(P<0.01),说明 THP-1 细胞被成功诱导分化为MO型巨噬细胞。
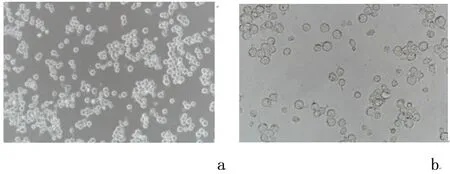
a:THP-1 细胞( ×200); b:THP-1 细胞( ×400)
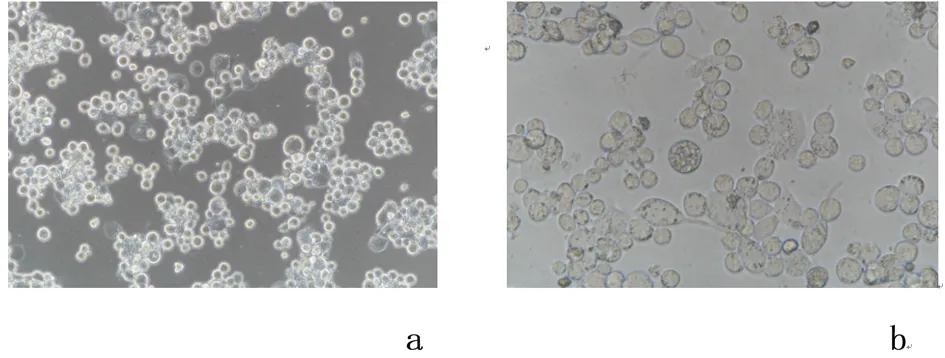
a:M0 型巨噬细胞( ×200);b:M0 型巨噬细胞( ×400)
2.2肺腺癌细胞影响巨噬细胞极化A549细胞与巨噬细胞共培养中,CD206 阳性巨噬细胞数量明显多于对照组,而CD86 阳性细胞数量降低,表明肺腺癌细胞可影响巨噬细胞极化,实验组中更多的巨噬细胞转变为M2型巨噬细胞,见图3。ELISA 实验检测促炎细胞因子IL-12和抗炎细胞因子IL-10的表达情况,与对照组(16.28±2.11)相比,肺腺癌细胞组中巨噬细胞IL-12的表达水平(8.27±1.06)下降(P<0.01)。与对照组(7.91±1.85)相比,肺腺癌细胞组中巨噬细胞IL-10的表达水平(12.86±2.17)上升(P<0.01),提示巨噬细胞向M2型巨噬细胞方向分化。
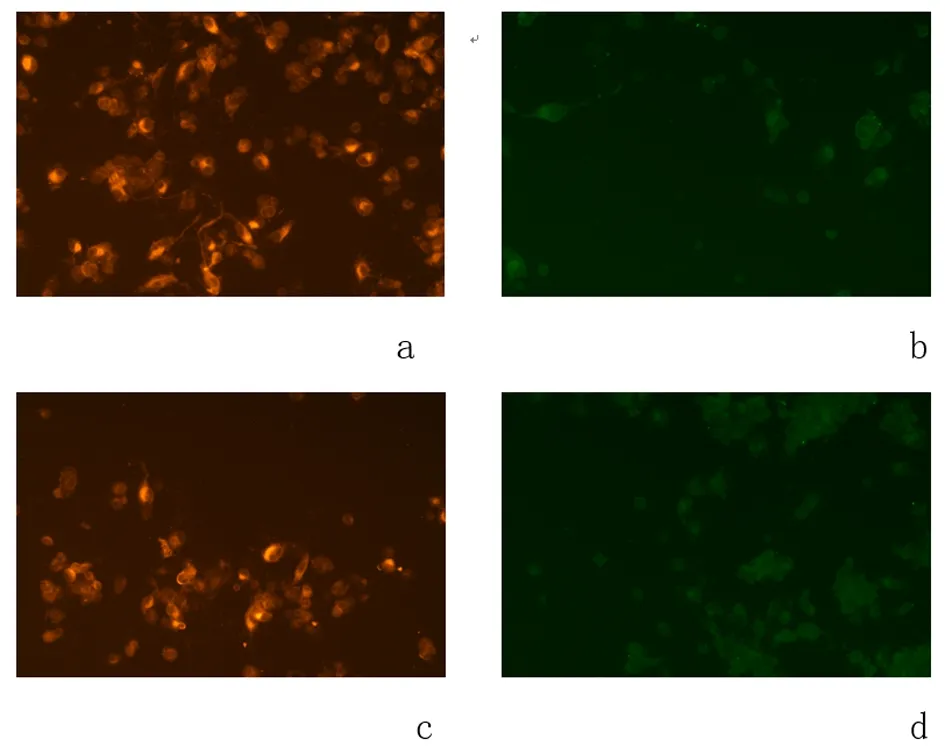
a; A549细胞与巨噬细胞共培养组CD206阳性巨噬细胞;b:A549细胞与巨噬细胞共培养组CD86阳性巨噬细胞;c:对照组CD206阳性巨噬细胞 ;d:对照组CD86阳性巨噬细胞
2.3肺腺癌细胞对巨噬细胞中linc00467表达的影响与对照组(0.42±0.19)相比,A549细胞与巨噬细胞共培养组中巨噬细胞linc00467的表达水平(1.87±0.41)增加(P<0.01),提示肺腺癌细胞诱导巨噬细胞极化可能与linc00467有关。
2.4linc00467影响巨噬细胞极化相对于对照组,实验组中巨噬细胞CD206 阳性细胞明显减少,见图4。
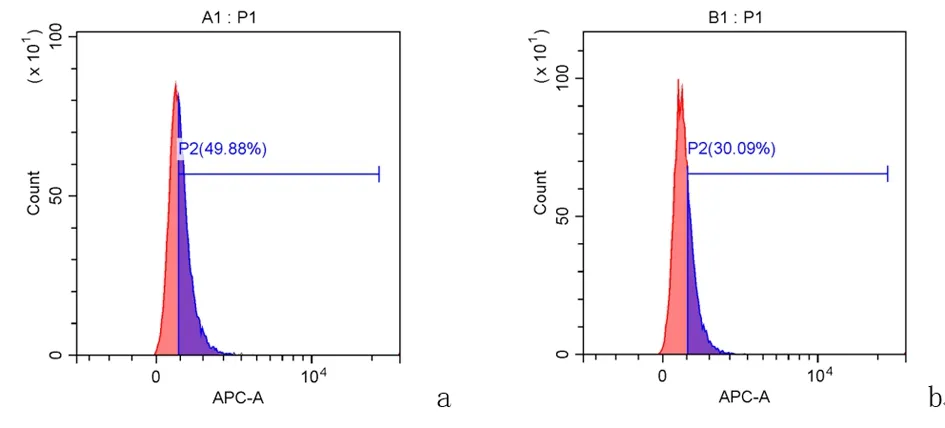
a:对照组;b:实验组
2.5MTT法检测细胞增殖巨噬细胞转染慢病毒shRNA后与A549细胞共培养。实验结果表明,与对照组相比,转染shRNA-linc00467的巨噬细胞组,A549细胞增殖能力显著降低(P<0.01),见图5。
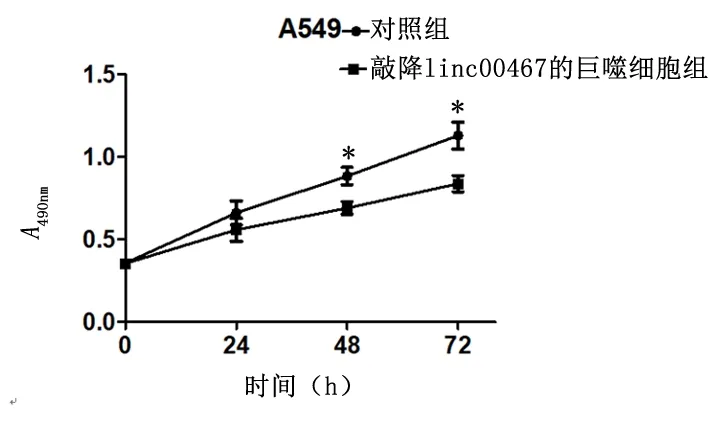
*P<0.01
3 讨 论
本课题组前期研究证明linc00467作为一种致癌因子,驱动肺腺癌细胞的增殖、迁移和侵袭,并提示患者预后不良[14]。肿瘤相关巨噬细胞极化是调控肿瘤进展过程中的一个重要细胞生物学过程,然而,目前对linc00467在肿瘤相关巨噬细胞极化中的作用知之甚少。在这项研究中,我们发现linc00467可以促进巨噬细胞极化调控肺腺癌细胞增殖。
肿瘤微环境对于肿瘤的发展与转移有重要作用,肿瘤细胞通过多种方式改变周围环境从而有利于自身发展[15-16]。M1型巨噬细胞诱导炎症反应消除肿瘤细胞,而M2型巨噬细胞拮抗炎症反应促进肿瘤进展[17-18]。M2巨噬细胞,如TAM,是免疫逃逸的关键协调器,针对TAM的治疗对于抗肿瘤治疗具有关键作用[19-20]。lncRNA是肿瘤细胞影响周围微环境的重要方式之一,近期有研究发现了lncRNA与巨噬细胞的相互作用影响食管癌细胞的侵袭和转移[17],因此,我们探讨了LncRNA介导的TAM在肺腺癌中的作用,TME中的巨噬细胞极化对于免疫反应和肿瘤的进一步发展至关重要。
肿瘤细胞中linc00467的上调导致肿瘤细胞进展[12],表明linc00467在促进癌症发展中的有着相关作用。本团队既往研究发现linc00467是肺腺癌增殖和侵袭的关键 lncRNA。然而,linc00467在巨噬细胞中的作用尚不清楚。在本研究中,我们首次发现linc00467在THP-1分化的巨噬细胞中表达增强。通过PMA刺激成功诱导THP-1细胞分化为巨噬细胞,接着进行共培养实验、免疫荧光染色和ELISA 实验验证了巨噬细胞会在肺腺癌细胞作用下发生极化,转变为M2型巨噬细胞。测定共培养体系中巨噬细胞内linc00467的含量,结果表明实验组中linc00467表达水平与对照组有显著差别。于是本研究对A549细胞进行linc00467敲降实验,证明了在A549细胞中敲低linc00467水平会抑制巨噬细胞向M2表型转化。为了验证巨噬细胞极化之后对A549细胞功能的影响,在巨噬细胞中敲降linc00467表达后与A549细胞进行共培养,结果表明实验组的A549细胞增殖能力显著降低,展示了巨噬细胞极化在促进肺腺癌进展起着关键作用。
总之, Linc00467通过促进巨噬细胞向M2型极化影响肺腺癌细胞增殖,linc00467可能是促进巨噬细胞向M2型极化和肺腺癌细胞进展中的直接靶点,这项研究为更有效的肺腺癌治疗提供了潜在的研究基础。巨噬细胞极化是一个复杂的过程,今后需要寻找更多的相关调节因子来详细揭示巨噬细胞极化的调节机制。
