2型猪链球菌cps2D基因敲除株的构建及其基本生物学特性的研究
2022-04-25刘旭苗王悄悄王怡雯汪春晖潘秀珍曹祥荣
刘旭苗,王悄悄,林 苗,倪 华,郑 峰,王怡雯,汪春晖,潘秀珍,曹祥荣
猪链球菌(Streptococcussuis,S.suis)属球菌科、链球菌属、革兰氏阳性兼性厌氧菌[1-2]。它是一种重要的人兽共患病病原菌,不仅能够感染猪,严重危害猪养殖业的发展,还能够通过伤口或猪产品感染人[3],从而引起人患脑膜炎、败血症等重要的疾病,严重者可因链球菌中毒性休克综合征致多脏器衰竭而死亡[4],威胁相关从业人员的健康。在1998年和2005年,我国江苏省和四川省分别暴发大规模的S.suis2感染猪和人的疫情,两次感染人群中分别有14例和38例死亡,病死率高达62%~81%[5-7]。在S.suis不同血清型中,2型猪链球菌(Streptococcussuisserotype 2,S.suis2)致病力最强,临床检出率最高[8]。
荚膜多糖(capsular polysaccharides,CPS)是S.suis中公认的重要毒力因子[9],由荚膜多糖基因簇cps编码,其中包含用以编码糖基转移酶、CPS聚合酶及CPS合成调控相关蛋白的基因[10]。近期有研究显示,细菌酪氨酸激酶/磷酸酶信号系统在多个细菌中广泛参与CPS的合成调节、细胞分裂、基因转录和蛋白质翻译等多个原核细胞重要生命过程[11]。实验室前期对S.suis2中国强毒株05ZYH33cps基因簇分析发现,SSU05_0565、SSU05_0566 和SSU05_0567 3个基因分别编码跨膜蛋白Cps2B、酪氨酸激酶Cps2C和酪氨酸磷酸酶Cps2D[12-15],组成酪氨酸激酶/磷酸酶信号系统,并针对酪氨酸激酶/磷酸酶信号系统开展了相关研究。
本文采用同源重组的原理构建2型猪链球菌荚膜多糖基因簇中cps2D基因敲除株(Δcps2D),对比野毒株与敲除株的基本生物学特性差异,包括细菌生长特性、溶血活性、革兰染色、细菌链长、荚膜形态等,初步探讨该基因对于细菌基本生物学功能的影响。
1 材料与方法
1.1 菌株、质粒及引物S.suis2中国强毒株05ZYH33分离自2005年四川资阳中毒性休克症病人[12],实验室保存;E.coilDH5α购自日本TaKaRa公司;pSET2质粒由Daisuke Takamatsu教授惠赠[16];实验所用引物由苏州金唯智公司合成,引物序列见表1。

表1 实验所用引物Tab.1 Primers used in this study
①:The underlined sequences are homologous recombination sequences.
1.2 主要试剂与仪器 高保真酶PrimeSTAR Max Premix、PCR产物回收试剂盒、In-Fusion Snap Assembly Master Mix购自日本TaKaRa公司;质粒提取试剂盒购自美国OMEGA公司;TSA、TSB培养基购自美国BD公司;哥伦比亚血平板购自芜湖欧克生物公司;恒温培养振荡器(ZWY-211C)购自上海智城分析仪器制造有限公司。
1.3 敲除质粒pUC19::cps2D的构建及验证 首先设计扩增引物L1/L2、R1/R2、Spc1/Spc2(表1),两端含有载体或相邻片段的同源序列。使用高保真酶,以05ZYH33菌株基因组DNA为模板,分别以L1/L2、R1/R2为引物扩增cps2D基因上、下游同源臂L片段及R片段,以pSET2质粒为模板,Spc1/Spc2为引物扩增spcR抗性基因即S片段。使用In-Fusion Snap Assembly Master Mix无缝克隆试剂盒将L、S、R与线性的pUC19载体相连,构建重组载体,转化E.coilDH5α感受态,涂布在AmpR和SpcR双抗性平板上筛选,挑取阳性克隆组合PCR验证,验证正确的重组质粒作为敲除质粒命名为pUC19::cps2D。
1.4 敲除菌株Δcps2D的构建 据Smith等[17]方法,制备05ZYH33感受态细胞。将5 μL敲除质粒(2 μg)与50 μL 05ZYH33感受态混合,冰浴10 min。电转仪参数为2 000 Ω、25 μF,电转结束后加入950 μL预热的复苏液(每100 mL含TSB粉末3 g,酵母提取物2 g,蔗糖10.269 g),37 ℃、160 r/min振荡培养2 h,涂布在含SpcR抗性平板上。挑取单克隆菌株,Check In 1/ Check In 2为引物(表1)进行PCR扩增,初步筛选cps2D候选敲除株。
1.5 敲除菌株Δcps2D的组合PCR及RT-PCR验证 在cps2D基因上游同源臂L和下游同源臂R的外侧设计引物命名为Check Out 1/Check Out 2(表1)。提取cps2D候选敲除株和05ZYH33的基因组DNA以及总RNA,将总RNA用DNase I消化后反转录为cDNA,分别以DNA、RNA、cDNA为模板,以Check In 1/ Check In 2、Spc1/Spc2为引物进行PCR扩增,从转录水平验证cps2D候选敲除株,将正确的cps2D基因敲除株命名为Δcps2D,40%终浓度的甘油-80 ℃保存备用。
1.6 生长曲线测定 将05ZYH33及Δcps2D甘油菌进行活化,在哥伦比亚血平板上划线纯化,生长48 h后挑取3个单菌接种在500 μL TSB培养基中,37 ℃、200 r/min过夜振荡培养,使用TSB将菌液浓度调至OD600值为0.4,1∶50的比例重新转接于1.5 mL TSB(加入10%FBS),每间隔1 h测量菌液OD600值(每个菌测量3次)至12 h。使用Graphpad Prism 8.0软件绘制生长曲线。
1.7 菌落形态及溶血活性观察 将05ZYH33及Δcps2D甘油菌进行活化,在哥伦比亚血平板上划线纯化,生长48 h后挑取单菌接种在TSB培养基中过夜培养。将菌液进行梯度浓度稀释,取10-6稀释倍数的菌液200 μL涂布在哥伦比亚血平板上,37 ℃培养48 h,观察菌落形态、大小以及溶血环大小。
1.8 革兰染色及细菌链长统计 将05ZYH33及Δcps2D甘油菌进行活化,在哥伦比亚血平板上划线纯化,生长48 h后挑取单菌接种在TSB培养基中过夜培养。次日按1∶50的比例转接,37 ℃静置培养,将两个菌液样本OD600值调整在0.6,进行革兰染色后置于显微镜下观察拍照。每个菌株随机选择100条细菌链进行链长统计,SPSS软件分析两组数据是否符合正态分布,t检验做统计数据分析。
1.9 透射电子显微镜观察 将05ZYH33及Δcps2D甘油菌进行活化,在哥伦比亚血平板上划线纯化,生长48 h后挑取单菌接种在TSB培养基中过夜培养。次日按1∶50的比例转接,37 ℃静置培养12 h。3 000 r/min离心15 min收集菌体,1×PBS洗涤菌体两次,弃去PBS,用2.5%戊二醛重悬菌体,4 ℃过夜固定。固定后用1×PBS漂洗2次,每次10 min。于1%锇酸中固定2 h后使用丙酮梯度脱水,环氧树脂618包埋切片,快速用水化的醋酸双氧铀/柠檬酸铅进行染色,最后使用JEM-1010透射电镜于100 kV加速电压下观察。使用Imagej软件统计细菌细胞的荚膜厚度,SPSS 25.0软件分析两组数据是否符合正态分布,t检验做统计数据分析。
2 结 果
2.1 敲除株Δcps2D的构建及验证 高保真酶PCR分别扩增出L片段(1 030 bp)、R片段(1 030 bp)和S片段(1 130 bp),片段大小均与预期相符(图 1A)。对重组载体进行组合PCR鉴定(图 1B),结果证明敲除质粒构建成功,命名为pUC19::cps2D。敲除质粒pUC19::cps2D电转至05ZYH33感受态细胞中后,使用Check In 1/ Check In 2引物对阳性克隆进行验证,Check In引物扩增阴性的菌株作为疑似敲除株。共筛选69个克隆,得到26个疑似敲除株,对疑似敲除株进行组合PCR验证,各组引物均能扩增出与预期大小相符的条带(图 1C)。RT-PCR验证结果显示,Δcps2D用Check In引物不能扩增出条带,而Spc1/Spc2则能扩增出条带,与05ZYH33相反,其他引物组合扩增出的片段都与预期相符(图 1D)。表明在DNA和RNA水平上该基因都已经敲除成功,Δcps2D敲除株构建成功。
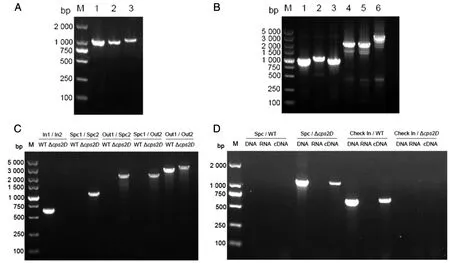
A:M. DNA marker;1. L片段;2. R片段;3. S片段;B:M. DNA marker;1. L1/L2;2. R1/R2;3. Spc1/Spc2; 4. L1/Spc2;5. Spc1/R2;6. L1/R2;C:Combined PCR verification of knockout strain Δcps2D;D:RT-PCR verification of gene knockout Δcps2D图1 基因敲除株Δcps2D的构建及验证Fig.1 Construction and verification of the knockout strain Δcps2D
2.2 生长曲线绘制 分别将OD600值为0.4的05ZYH33菌株和Δcps2D敲除株菌液接种到新鲜TSB培养基中震荡培养,每间隔1 h测定OD600值。使用Graphpad Prism 8.0软件绘制生长曲线(图2),从图中能看到野毒株与敲除株的生长的各个阶段,对数期菌体密度迅速增加,进入平台期后逐渐趋于稳定,且略有下降的趋势。在对数期内,野毒株的菌体密度始终高于敲除株,监测至12 h时野毒株已经进入平台期,OD600趋于稳定,而敲除株生长相对缓慢。实验独立重复3次,每组设3个平行重复。
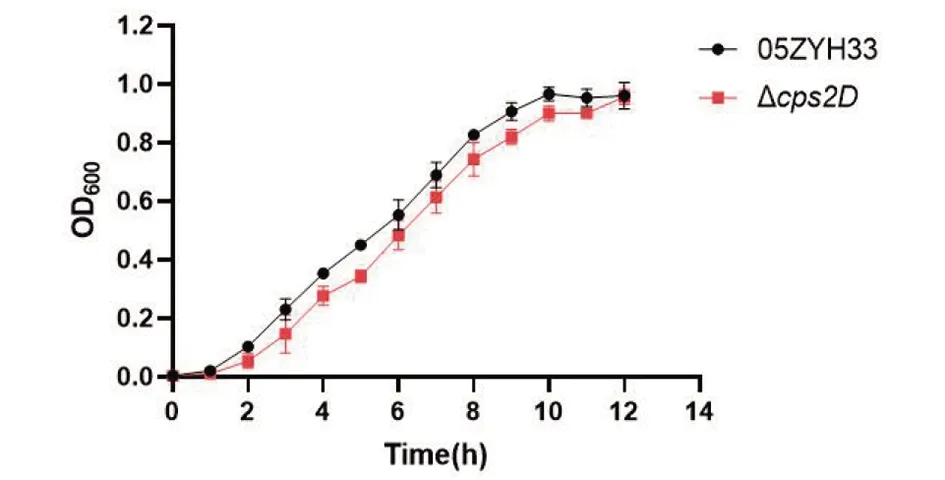
图2 05ZYH33和Δcps2D生长曲线Fig.2 Growth curve of 05ZYH33 and Δcps2D
2.3 革兰染色观察及细菌链长统计 分别制作05ZYH33菌株和Δcps2D敲除株革兰染色涂片,在油镜下随机选取视野观察细菌形状及链长。油镜下显示细菌菌体呈紫色,为革兰阳性菌,细菌呈球形,多个菌形成长短不一的链状(图3A、B),每个菌株随机选取100条链统计每链细胞数,野毒株平均每链细胞数为(7.90±3.186)个,敲除株平均每链细胞数为(5.32±1.969)个。以上结果说明,cps2D缺失导致细菌链长显著变短(图3C)。
2.4 细菌形态及溶血活性观察 将05ZYH33与Δcps2D菌液分别梯度稀释后涂布在哥伦比亚血平板上,观察其菌落形态以及溶血情况。野毒株与敲除株均能在平板上形成圆形或椭圆形,灰白色(由中间向四周颜色逐渐变浅),光滑湿润的菌落;经分析,05ZYH33与Δcps2D菌落周围菌发生了溶血,形成β溶血环,溶血环直径大小无显著差异。
2.5 透射电子显微镜观察 利用透射电子显微镜,观察细菌的表面荚膜结构。野毒株荚膜结构非常典型,位于细胞壁外侧,质地均匀,电子密度高,且细胞壁薄而清晰(图4A)。敲除株细胞壁外只有极少荚膜成分,电子密度低,在视野中呈透明状,且敲除菌株细胞壁不明显(图4B)。荚膜厚度统计结果显示,05ZYH33荚膜厚度为(0.05±0.007)μm,Δcps2D荚膜厚度为(0.02±0.001)μm,野毒株与敲除株荚膜厚度均有差异(图4C)。
3 讨 论
S.suis2的荚膜多糖(CPS)是目前广泛认可的重要毒力因子,在侵入和感染宿主细胞的过程中具有非常重要的作用,能够保护自身不受宿主免疫系统的攻击[9]。有研究报道,细菌酪氨酸激酶/磷酸酶信号系统对于荚膜的合成有非常重要的调控作用,例如在肺炎链球菌中酪氨酸磷酸化信号系统调控细胞分裂位点处CPS合成,该系统基因突变会导致细胞分裂缺陷[18]。无乳链球菌中的酪氨酸激酶可参与调节荚膜多糖合成与细菌的粘附能力[19]。实验室前期针对于S.suis2中国强毒株05ZYH33cps基因簇中的酪氨酸激酶/磷酸酶组分开展了相关研究。研究发现,Cps2C为S.suis2中的酪氨酸激酶,且能够发生自磷酸化;其编码基因敲除后细菌的荚膜变薄,毒力也明显下降[15]。Cps2B是由cps2B基因编码的跨膜蛋白,其C末端结构域为酪氨酸激酶的激活结构域,是Cps2C正常发挥激酶活性所必需的[14]。cps2B基因敲除后细菌成链能力下降,荚膜结构及致病力丧失,在人和猪仔全血中生存力下降[13]。实验室也针对低分子量酪氨酸磷酸酶(SS-PTP)开展了原核表达以及基因敲除等相关研究[14]。
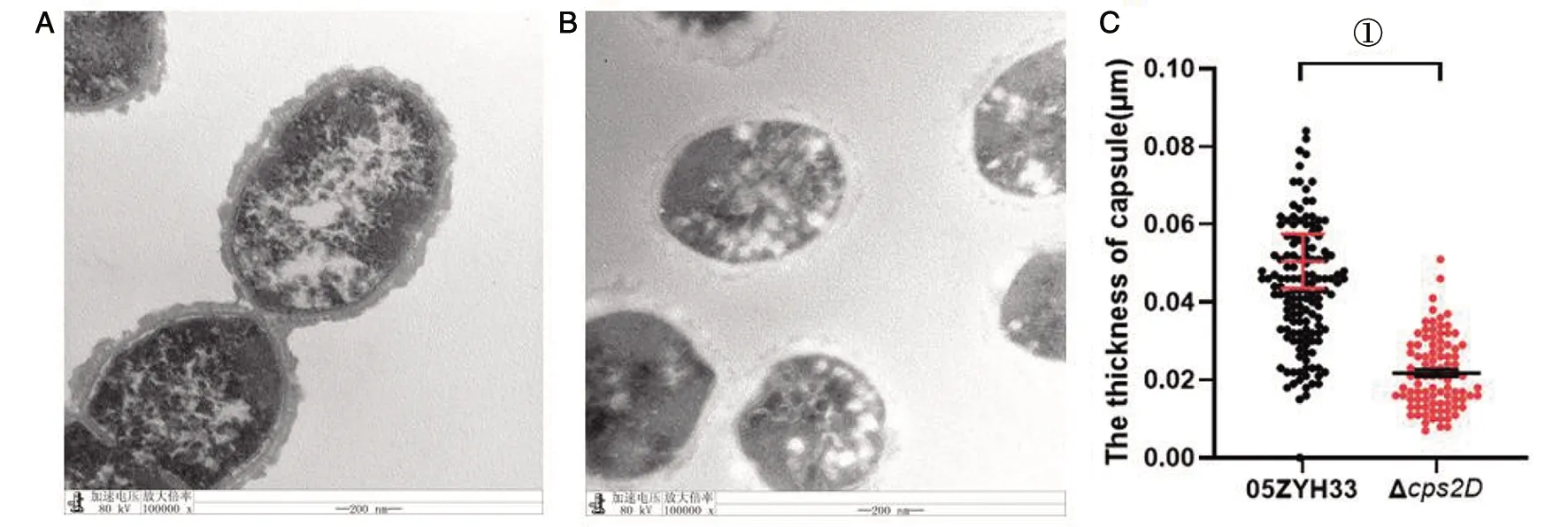
A:05ZYH33透射电子显微镜;B:Δcps2D透射电子显微镜;C:05ZYH33与Δcps2D荚膜厚度统计;①P<0.01图4 05ZYH33与Δcps2D透射电子显微镜观察及荚膜厚度统计Fig.4 Transmission electron microscopy observation and capsule thickness statistics of 05ZYH33 and Δcps2D
在实验室前期工作的基础上,本文基于同源重组的原理构建cps2D基因敲除株。设计两端为cps2D上下游同源臂,中间为spcR抗性基因的重组质粒,电转化05ZYH33使其进入细胞内发生同源重组,将cps2D替换为spcR抗性基因以实现该基因的敲除。组合PCR验证、RT-PCR验证结果证明在DNA以及RNA水平上cps2D基因均已缺失,基因敲除株Δcps2D构建成功。对05ZYH33及Δcps2D进行基本生物学特性的研究,包括生长曲线测定、革兰染色观察及细菌链长统计、菌落形态及溶血活性观察、透射电镜观察等。研究结果显示,敲除菌株Δcps2D的生长变缓,每链细胞数显著减少,而菌落形态以及溶血活性没有发生显著变化。从透射电镜的结果来看,敲除株细胞壁外电子密度低,荚膜成分明显减少,荚膜结构稀疏,且细胞壁也不够清晰。证明cps2D对于CPS的正常合成具有非常重要的作用。而其他生物学特性的改变,究其原因可能也与荚膜的变化密切相关。在肺炎链球菌中有报道显示,酪氨酸激酶能够通过影响分裂位点处CPS的组装以及染色体的分离,来影响细胞分裂和细胞周期,该激酶缺失后会导致细胞分裂异常[18]。本研究中cps2D基因敲除后,细菌的生长状态发生变化,生长速率减缓,因此推测Δcps2D生长缓慢可能与其荚膜结构的变化有关。有文献报道,链球菌的细胞链长度受到肽聚糖、脂磷壁酸和细胞壁锚定蛋白等因素的影响[20]。Δcps2D的链长显著变短,每链细胞数减少,05ZYH33每链细胞数主要集中于5~10个细胞这一区间,最长能达到18个细胞的,而Δcps2D的每链细胞数主要集中于0~5个细胞这一区间,且没有超过15个细胞的长链。因此,我们推测Δcps2D链长变短也是由于荚膜以及细胞壁的变化所导致的。课题组正在开展回补株的构建、小鼠毒力实验以及cps2D下游调控基因的相关研究,以期进一步揭示cps2D在荚膜合成调控过程中的分子机制。本研究成功构建cps2D的基因敲除株,研究了cps2D的基本生物学特性,cps2D敲除菌株作为重要的实验材料,能够为后续进一步研究酪氨酸磷酸酶组分对于荚膜合成的影响及其作用机制奠定基础。
利益冲突:无
引用本文格式:刘旭苗,王悄悄,林苗,等. 2型猪链球菌cps2D基因敲除株的构建及其基本生物学特性的研究[J].中国人兽共患病学报,2022,38(4):285-290. DOI:10.3969/j.issn.1002-2694.2022.00.043
