弓形虫ROP16蛋白在人白血病细胞THP-1表达及对其细胞增殖与凋亡的影响
2022-04-25党甜甜潘亚菲杨宁爱苏雅静赵志军
陈 梅,贾 伟,党甜甜,潘亚菲,杨宁爱,苏雅静,赵志军
刚地弓形虫(Toxoplasmagondii)是一种原生动物寄生虫,专性寄生于几乎所有有核细胞,可引起人兽共患寄生虫病[1]。该寄生虫在全球范围内分布,其中间宿主广泛且无特异性,被认为是世界上最成功的寄生虫。弓形虫入侵宿主的过程中分泌的弓形虫棒状体蛋白(ROP16)对于在宿主细胞内入侵和复制起着及其重要的作用[2]。研究发现,ROP16是一种重要的毒力决定因子,入侵宿主细胞后主要定位于宿主细胞核内[3-4],影响宿主细胞的信号转导和转录激活因子(STAT)信号通路,干扰宿主细胞内信号通路传导,影响宿主细胞的增殖、分化和凋亡等功能[5-7]。近年来,弓形虫ROP16蛋白与宿主细胞相互作用的研究逐渐成为热点,但大多数研究以体内动物模型和体外细胞实验为基础,深入挖掘弓形虫的致病效应,目的是更好地防治弓形虫病。对于弓形虫ROP16蛋白杀伤肿瘤细胞的生物探索尚少,目前关于ROP16诱导肿瘤细胞凋亡的研究仅有少数,如ROP16蛋白可诱导肝癌细胞 HepG2、小鼠脑神经细胞、人神经母细胞瘤SH-SY5Y 细胞发生凋亡[8-10],而关于急性单核细胞白血病细胞的研究极少。所以,本研究利用弓形虫II型(Me49)ROP16蛋白对人急性单核细胞白血病细胞株THP-1生物学行为影响和分子机制进行研究。旨在为开发靶向、低毒、可控的寄生虫抗肿瘤生物治疗提供候选分子及相应的理论和实验依据。
1 材料与方法
1.1 材料 弓形虫Ⅱ型Me49虫株为本实验室保存;THP-1细胞购于上海名劲生物科技有限公司,起始来源 ATCC、荧光标记的ROP16过表达慢病毒及其对照组购自汉恒生物公司;胎牛血清与RPMI-1640 培养液购自BI公司;青链霉素购于北京索莱宝公司。嘌呤霉素购于Sigma公司,Trizol试剂购于美国Invitrogen公司, Real-time PCR 试剂盒、反转录试剂盒购于大连 TaKaRa 生物工程公司。His-tag抗体购自Abcam公司;兔抗人Bax、Bcl-2、Caspase-3抗体购于ABclonal公司;兔抗人β-actin购自CST公司;HPR 标记山羊抗兔 IgG(IgG-HRP)购自Proteintech公司,CY3标记的羊抗鼠IgG(H+L)购于ABclonal公司;Real Time PCR 所用引物均由上海生工有限公司合成。
1.2 方 法
1.2.1 细胞培养 将THP-1细胞从液氮中取出后并迅速置于37 ℃温浴锅中复苏,使用含10%FBS的1640 培养液吹打悬浮细胞,于37 ℃、5% CO2恒温培养箱中培养,每2 d进行换液,待细胞生长至90%左右时进行传代,细胞传代3次后用于后续实验。
1.2.2 ROP16过表达稳转细胞系构建 将处于对数生长期且未分化的THP-1悬浮细胞按5×105/孔接种于96孔板,采用半数接种法,每孔滴加100 L细胞悬液,设置ROP16过表达组、空载体组和空白对照组,按照使用说明书向96孔板中加入过表达慢病毒(overExp-ROP16)及其空载组慢病毒(overExp-NC),加入慢病毒体积计算公式为:慢病毒体积=MOI×细胞数目/病毒滴度,在预实验中确定过表达 overExp-ROP16 慢病毒最佳 MOI 值为70,overExp-NC空载体慢病毒最佳 MOI 值为 60,放于37 ℃、5% CO2培养箱中培养,4 h后补加完全培养液100 μL,每孔补足为200 μL,48 h后离心更换新鲜培养基。感染72 h后观察细胞荧光表达情况;确定慢病毒转染成功后,用含嘌呤霉素(浓度为1 μg/mL)的1640完全培养基筛选细胞,每2 d对细胞进行换液,约1周后,至空载体组和过表达组无细胞死亡。获取稳定表达 ROP16的THP-1细胞株进行后续实验。
1.2.3 PCR检测rop16基因在THP-1细胞中的表达 提取各组细胞DNA,以DNA为模板,反应体系为(20 μL): DNA 1 L, 上、下游引物各1 μL,Taq PCR Master Mix 10 μL,无酶水补足。反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,共32个循环;72 ℃ 10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定。
1.2.4 细胞免疫荧光检测ROP16蛋白在THP-1细胞中的定位 待各组细胞达到对数生长期后,离心吹打成细胞悬液,使用六孔板进行细胞爬片,滴加细胞悬液在玻片上,置于37 ℃、5% CO2培养箱中培养,24 h后观察结果。爬片成功后的细胞滴加1 mL 4%多聚甲醛固定15 min,吸弃固定液,PBS洗3遍,每次5 min;固定后的细胞加入0.5% TritonX-100透膜5 min,PBS洗3遍,再用2% BSA 室温封闭1 h, PBS洗3遍,加入稀释好的His-tag抗体(1∶200) 4 ℃过夜,PBS洗3遍,再加入CY3标记的山羊抗小鼠IgG(H+L) (1∶800) 室温避光孵育1 h,用PBS避光洗3遍;再用DAPI室温避光复染10 min,PBS避光清洗3次,用抗淬灭剂封片,使用相应激发光,激光共焦显微镜下观察荧光拍照。
1.2.5 CCK-8检测ROP16蛋白对THP-1细胞的增殖 向96孔板中加入处在对数期的各组细胞(包括空白组、空载体组、过表达组细胞),每孔接种3×105个。每组设置3个复孔,计数好的细胞悬液向96孔板中加入100 μL/孔,并置于37 ℃、5% CO2恒温湿培养箱培养,分别于0、24、48、72 h时向每孔中加入10 μL的CCK-8溶液,在继续培养2.5 h后用酶标仪测出各孔在不同时间450 nm处的OD值,依据检测的OD值进行细胞增殖统计分析。
1.2.6 流式细胞术检测细胞凋亡 取对数生长期的稳转细胞调整细胞密度后制成单细胞悬液,同时设定空白组与空载组,离心,弃上清;用预冷的 PBS 洗涤沉淀后离心,弃上清,用 500 μL 1×Binding Buffer重悬细胞后加入5 μL Annexin Ⅴ-APC和 10 μL 7-AAD 轻柔涡旋混匀,室温避光孵育10 min 后上机进行检测。
1.2.7 蛋白免疫印迹 Western blot检测各组细胞中ROP16蛋白的表达以及凋亡相关蛋白表达情况。将各组细胞传代培养并达到对数生长期后,提取各组细胞全蛋白,BCA试剂盒检测蛋白浓度。以20 μg/孔上样量进行SDS-PAGE电泳,到目的蛋白分开后将凝胶上的蛋白转至PVDF膜上,5% BSA封闭2 h,TBST洗3遍后,根据不同分子量的蛋白分别加入鼠抗人His-tag抗体(1∶1 000)、兔抗人Bcl-2、Bax、Caspase-3(1∶5 000)抗体以及β-actin抗体(1∶5 000)置于4 ℃过夜,加入相应种属的二抗室温孵育1.5 h,洗膜3遍后进行ECL显色液显影,凝胶成像系统观察结果。
1.2.8 Real time PCR检测Bcl-2、Bax、Caspase-3 mRNA表达水平 采用Trizol法提取空白对照组THP-1细胞、空载体组、过表达组中总RNA,并检测各组细胞RNA的浓度及纯度,TaKaRa反转录试剂盒合成cDNA,通过 SYBR Green 荧光定量PCR测定不同细胞中Bcl-2、Bax、Caspase-3 mRNA水平表达情况。以GAPDH作为内参基因,相对定量使用的方法是2-ΔΔCt。所用引物见表1。

表1 引物序列Tab.1 Primer sequences
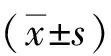
2 结 果
2.1 过表达ROP16慢病毒转染结果 将包装成功的overExp-ROP16 慢病毒和 overExp-NC组慢病毒分别转染THP-1细胞72 h后荧光显微镜观察细胞绿色荧光表达强烈,待细胞生长到一定数量使用含嘌呤霉素1640 完全培养基筛选细胞,待1周后,使用荧光显微镜观察发现实验组视野中90%以上细胞均发出绿色荧光(图1),表明过表达 ROP16细胞株与空载细胞株构建成功。
A、B、C:细胞形态(透射光,×200);a、b、c: GFP表达(荧光,×200)图1 慢病毒转染THP-1细胞筛选后荧光表达情况Fig.1 Fluorescence expression of lentivirus transduced THP-1 cells after screening
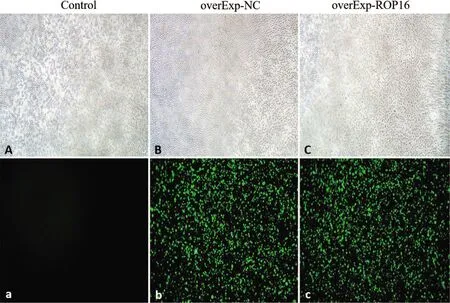
2.2 THP-1细胞中ROP16过表达鉴定 构建的稳转细胞通过PCR电泳鉴定出过表达组细胞中rop16基因的表达(图2A),Western blot检测过表达组ROP16蛋白水平较空载体组与空白对照组高表达(t值分别为18.92和18.53,P<0.05)(图2B)。
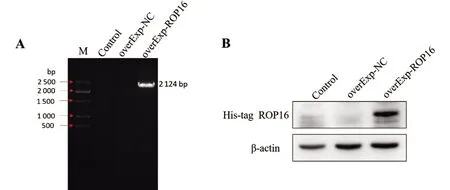
图2 PCR与Western blot检测 ROP16在THP-1细胞中的表达Fig.2 Expression of ROP16 in THP-1 cells, detected by PCR and western blotting
2.3 ROP16蛋白在THP-1细胞中的定位 为了验证ROP16蛋白在THP-1细胞中的表达位置,进行了细胞免疫荧光试验。我们用 DAPI 试剂标记细胞核(蓝色荧光),His-tag抗体标记ROP16(红色荧光),过表达阴性对照组与空白细胞组作对照。在共聚焦显微镜下,ROP16蛋白聚集在THP-1细胞核中,说明ROP16蛋白在THP-1细胞中表达,且定位于细胞核(图3)。
图3 免疫荧光检测ROP16蛋白在THP-1细胞中的定位(×600)Fig.3 Localization of ROP16 protein in THP-1 cells, detected by immunofluorescence (×600)
2.4 ROP16 对THP-1细胞增殖及凋亡的影响 ROP16转染THP-1细胞后通过CCK-8检测细胞的增殖情况,CCK-8的结果提示ROP16使THP-1细胞的增殖能力明显降低,从24 h开始差异具有统计学意义(t=3.75、7.49、4.75,P<0.05)(图4)。流式细胞术检测到ROP16对THP-1细胞的凋亡率较对照组明显增加,差异具有统计学意义(t=29.80,P<0.01),图5。
2.5 ROP16对THP-1细胞凋亡相关因子Bcl-2、Bax、Caspase-3 mRNA表达水平的影响 以THP-1正常细胞组为对照,空载体组Bcl-2、Bax、Caspase-3表达水平无显著变化(t值分别为0.92、0.66、1.80,P均>0.05);过表达组Bax、Caspase-3 mRNA均呈高表达(t=3.85、28.92,P<0.05),而Bcl-2低表达(t=19.17,P<0.01)(图6)。表明ROP16蛋白可使THP-1细胞中Bax、Caspase-3基因表达上调,而使Bcl-2表达下调。

①P<0.05;②P<0.01 vs Control group or overExp-NC group;ns P>0.05 vs Control group图4 CCK-8检测ROP16对THP-1细胞的增殖影响Fig.4 CCK-8 was used to detect the effect of ROP16 on the proliferation of THP-1 cells
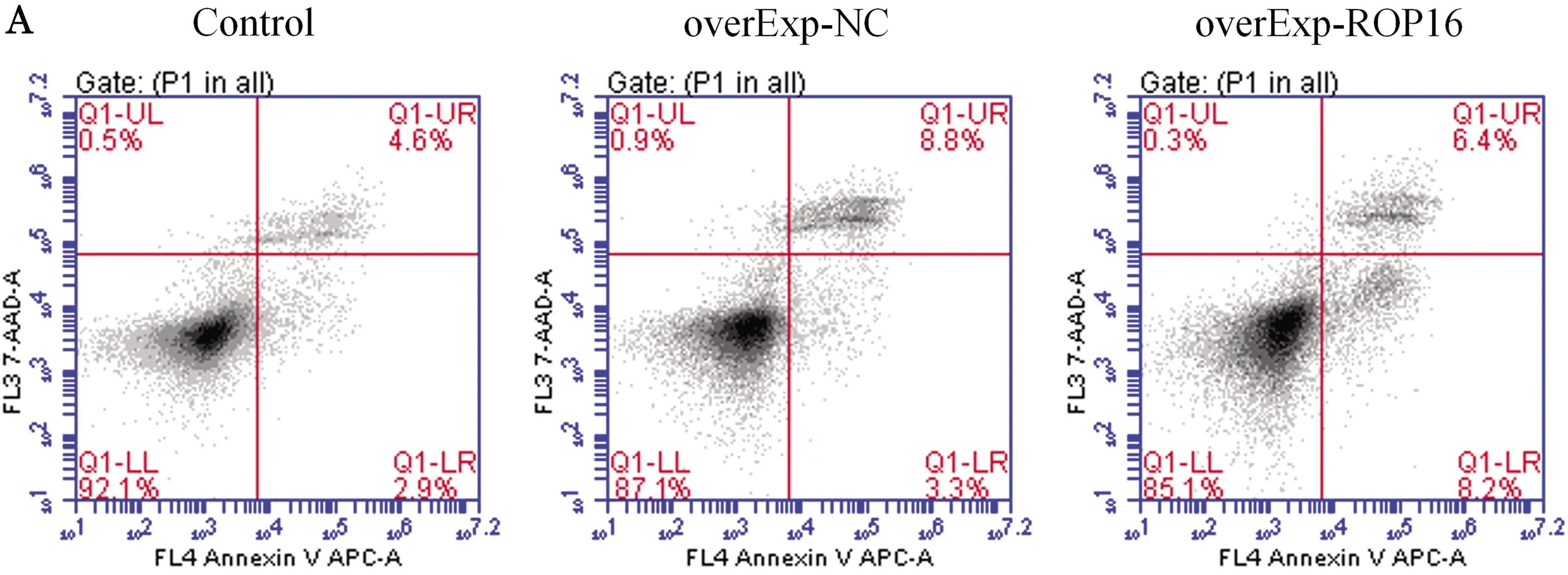
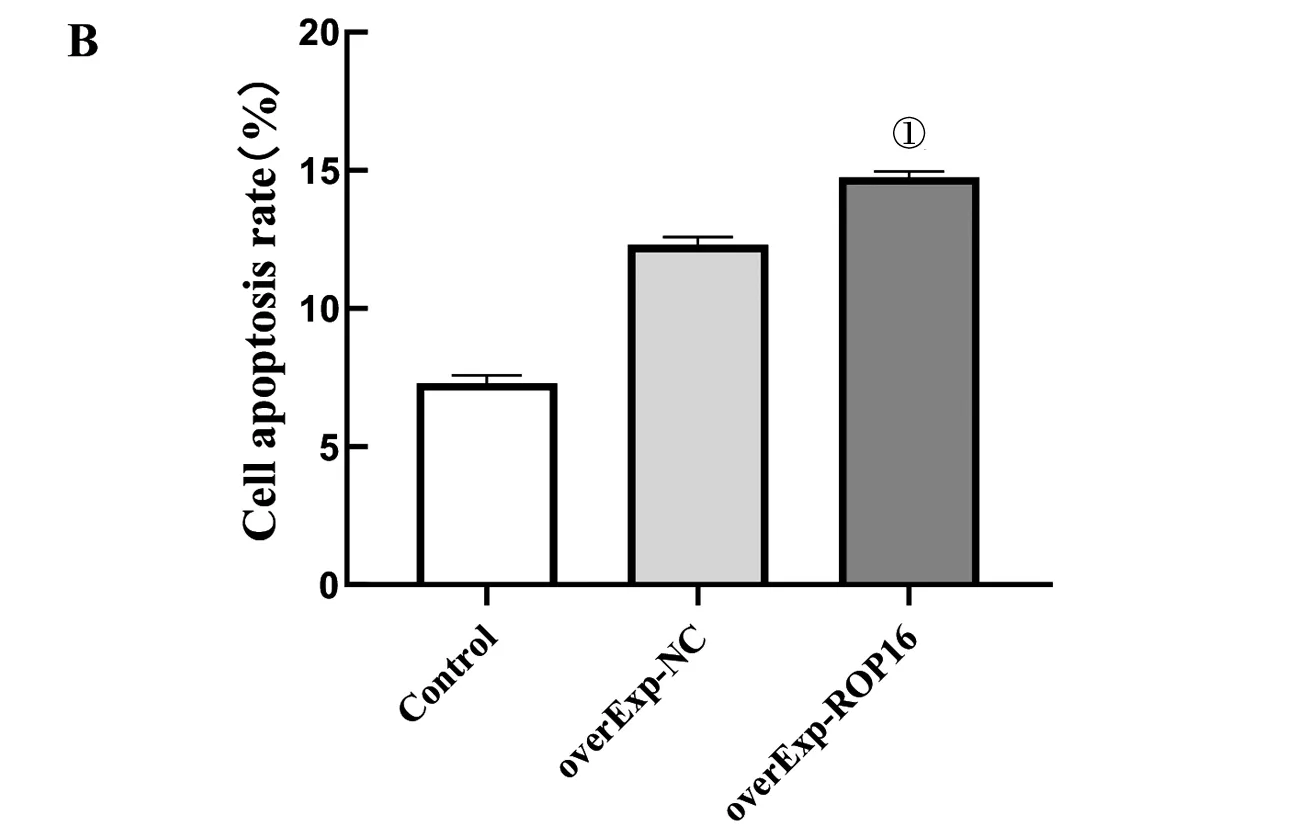
A:流式检测ROP16对THP-1细胞凋亡的影响;B:THP-1细胞凋亡的半定量分析 ①P<0.01 vs Control group or overExp-NC group图5 流式细胞术检测ROP16对THP-1细胞的凋亡影响Fig.5 Effect of ROP16 on THP-1 apoptosis, detected by flow cytometry

A:Bax; B:Caspase-3; C:Bel-20 mRNA ①P<0.05;②P<0.01 vs Control group or overExp-NC group; ns P>0.05 vs Control group图6 qPCR检测ROP16对THP-1细胞Bax、Caspase-3、Bcl-2 mRNA表达水平的影响Fig.6 qPCR detection of the effects of ROP16 on the expression of Bax, Caspase-3 and Bcl-2 mRNA in THP-1 cells
2.6 ROP16蛋白对THP-1细胞凋亡相关蛋白Bax、Caspase-3、Bcl-2的影响 ROP16基因过表达载体转染THP-1细胞后的稳转细胞株进行Western blot检测,THP-1细胞组(对照组)与过表达阴性组相比Bax、Caspase-3、Bcl-2表达差异无统计学意义(t值分别为0.21、1.62、1.57,P>0.05),过表达组与对照组相比,Bax、Cleaved-Caspase-3蛋白高表达(t=33.90、52.48,P均<0.01), Bcl-2、Pro-Caspase-3蛋白呈低表达(t=52.69、23.32,P均<0.01),见图7。

①P<0.01 vs Control group or over Exp-NC group图7 Western blot 检测ROP16蛋白对THP-1细胞凋亡相关蛋白的影响Fig.7 Effects of ROP16 protein on apoptosis-associated proteins in THP-1 cells, detected by western blotting
3 讨 论
寄生虫抗肿瘤逐渐成为生物治疗研究的热点,而利用寄生虫虫体蛋白进行抗肿瘤研究更是未来发展的方向,用虫体蛋白靶向治疗肿瘤具有高效、低毒又避免了全虫所带来的毒性。弓形虫ROP16是棒状体分泌的一类具有丝氨酸-苏氨酸激酶活性蛋白,在弓形虫速殖子、缓殖子以及子孢子中均有表达,是弓形虫在宿主细胞侵袭前后分泌的重要的特异性效应分子之一[11]。本研究团队前期工作发现,弓形虫ROP16蛋白具有调节肺癌肿瘤细胞系A549 生物表型的作用[12-13]。我们在研究弓形虫与宿主的免疫调控机制过程中也发现,刚地弓形虫速殖子裂解液能够抑制乳腺癌细胞系MDA231和肺癌细胞系A549 细胞的增殖,并且诱导MDA231和A549细胞凋亡,提示弓形虫速殖子在体外具有显著的抗肿瘤活性,进一步研究分析发现,速殖子裂解液中包含的关键分子是ROP16蛋白,提示弓形虫ROP16蛋白可能与抗肿瘤关系密切。
ROP16蛋白是弓形虫侵入宿主细胞时分泌且释放到胞质溶胶中,并通过核易位序列迅速转移到宿主细胞核内发挥作用[14]。Saeij等[7]发现 ROP16可在10 min内从棒状体分泌到宿主细胞核,影响宿主细胞的信号转导和转录激活因子(STAT)信号通路,并直接使STAT3和STAT6发生磷酸化,干扰宿主细胞内信号通路传导,调控宿主细胞白细胞介素-12(IL-12)的产生,影响宿主细胞的增殖、分化与凋亡等功能。弓形虫根据虫株的毒力水平可分为Ⅰ型、Ⅱ型和Ⅲ型。与Ⅰ型虫株相比,Ⅱ型虫株的感染导致巨噬细胞中 IL-12 P40 产生上调,而Ⅰ型和Ⅲ型虫株则会下调 IL-12的表达[7]。本课题组前期研究发现[13],在 A549 细胞中,弓形虫Ⅰ型RH株 ROP16 蛋白具有激活 p-STAT3/6作用,且能使 ARG1 mRNA 的表达上调,IL-12 mRNA 的表达下调,而弓形虫Ⅱ型ME49 虫株ROP16蛋白则无激活 p-STAT3/6 作用,但能使 IL-12 mRNA 和 iNOS mRNA 的表达上调。iNOS可催化合成 NO,已有文献报道NO具有抗肿瘤的作用[15]。因此,本研究采用弓形虫Ⅱ型(ME49 虫株)ROP16 蛋白对白血病细胞THP-1进行研究,通过构建过表达ROP16慢病毒载体,转染THP-1细胞后可观察到强荧光信号,Western blot与免疫荧光结果显示ROP16蛋白在THP-1细胞中稳定表达且定位于细胞核,为后续对细胞功能研究提供基础。
细胞凋亡是由于内外环境变化以及在基因与信号通路调控下所引起的细胞程序性死亡过程。肿瘤细胞对化疗药物诱导凋亡的敏感性受线粒体中 Bcl-2/Bax 蛋白的比例控制[16]。 Bax与相关蛋白的促凋亡活性因与抗凋亡蛋白Bcl-2形成复合物而受到抑制。当培养的细胞收到死亡信号时,Bax移动到线粒体和其他膜位点并引发线粒体功能转变,包括细胞色素c向周围细胞质的释放、跨膜电位的丧失和线粒体通透性转变,导致细胞凋亡。Caspase-3是线粒体细胞凋亡过程中的重要执行者,其过表达可加速细胞凋亡进程[17],当细胞受到外界刺激改变了Bcl-2蛋白家族对凋亡的调控,引发Caspase-3激活,最终促发细胞凋亡[18]。本研究探讨弓形虫ROP16蛋白对白血病细胞株THP-1的增殖、凋亡作用及其机制中,CCK-8结果显示,与对照组相比,过表达ROP16组能够明显抑制THP-1细胞的增殖,流式检测诱导THP-1细胞凋亡。qPCR与Western blot实验分别从转录与翻译水平解释ROP16蛋白能上调促凋亡蛋白Bax、C-Caspase-3的表达,下调抗凋亡蛋白Bcl-2,从而调控线粒体凋亡途径诱导THP-1细胞凋亡。综上所述,弓形虫Ⅱ型(Me49株)ROP16蛋白能在THP-1细胞中表达并通过入核抑制THP-1细胞增殖并诱导其凋亡,其作用机制可能通过上调促凋亡蛋白Bax、Caspase-3和抗凋亡蛋白Bcl-2的水平降低而引起的,此项研究对未来利用寄生虫虫体蛋白治疗血液肿瘤(非实体瘤)提供理想生物治疗候选分子奠定基础。
利益冲突:无
引用本文格式:陈梅,贾伟,党甜甜,等. 弓形虫ROP16蛋白在人白血病细胞THP-1表达及对其细胞增殖与凋亡的影响[J].中国人兽共患病学报,2022,38(4):277-284. DOI:10.3969/j.issn.1002-2694.2022.00.041
