高效液相色谱-电感耦合等离子体质谱法测定海产品中5种硒形态的含量
2022-04-24朱羽庄梅光明杨盈悦顾捷孟春英
朱羽庄,梅光明,杨盈悦,顾捷,孟春英
(1.浙江海洋大学 食品与药学学院,舟山 316022;2.浙江省海洋水产研究所水产品加工与质量安全研究室,舟山 316021;3.浙江省海水增养殖重点实验室,舟山 316021)
硒是生物体必需的一种微量元素,它具有增强免疫力、抗癌、抗氧化和代谢重金属等作用[1]。人体缺硒引发的疾病主要包括营养不良、大骨节病、克山病和心机系统疾病等[2]。硒元素在地球上分别以无机硒和有机硒存在,无机硒包括硒单质、亚硒酸盐(Se4+)和硒酸盐(Se6+);有机硒为硒元素的结合态,主要有甲基硒代半胱氨酸(Me-Se-Cys)、硒代蛋氨酸(Se-Met)和硒代乙硫氨酸(Se-Et)等。硒元素的功能与硒含量、硒赋存形态均相关[3],如无机硒不易被人体消化吸收、摄入过量会对人体造成毒性[4];生物体必需的硒元素主要以有机形态存在,研究发现硒代蛋氨酸、甲基硒代半胱氨酸等有机硒具有维持中枢神经、抗炎症、抗氧化和抗肿瘤的功能[5]。由于富集作用,作为排放终端的海水中硒含量可达陆源土壤中的2倍多[6],其通过海洋生物的体内吸收和蓄积转化进一步形成了结合态的有机硒[7]。因此,海产品消费可以作为一种补硒食品的重要来源。掌握各种常见海产品中硒含量及形态分布特征能够更科学地指导居民进行补硒,为消费人群提供合理的膳食建议。
目前分析硒形态的方法主要有高效液相色谱-原子荧光光谱法[8]、柱前衍生-反相高效液相色谱法[9]、高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)等[10]。其 中,HPLC-ICP-MS 由于结合了液相色谱法的化合物高效分离特性和电感耦合等离子体质谱法(ICP-MS)在元素分析上的高准确度优势,目前已成为测定硒形态的主要方法。我国对于食品中硒元素测定的相关研究和方法有很多,但主要集中在乳品[11]、茶叶[12]、大豆[13]、谷物[14]等方面,关于海产品中的硒形态研究报告较少,已有报道多采用原子荧光光谱法检测,缺少HPLC-ICP-MS在海产品中硒测定的应用。如文献[15]采用1.5 mol·L-1氢氧化钾作为提取液,用离子色谱-氢化物发生-原子荧光光谱法测定了海产品中亚硒酸盐、硒酸盐、硒代蛋氨酸和硒代乙硫氨酸等4种硒形态的含量,检出限为0.30~1.72μg·L-1;文献[16]以50%(体积分数)盐酸溶液作为提取液,采用氢化物发生-原子荧光光谱法测定海产品中总有机硒和无机硒的含量。但上述方法存在检出限高和可检测有机硒种类较少的缺点。本工作采用定性定量效果更佳的HPLC-ICP-MS测定海产品中亚硒酸盐、硒酸盐、硒代蛋氨酸、硒代乙硫氨酸和甲基硒代半胱氨酸等5种硒形态的含量,为今后研究海产品中硒形态分布特征提供定性与定量依据,以便更科学地评价各类海产品富硒营养价值,为居民通过食用海产品进行补硒提供科学膳食指导建议。
1 试验部分
1.1 仪器与试剂
Agilent 7900型电感耦合等离子体质谱仪;Agilent 1260型高效液相色谱仪;VORTEX-5型旋涡混合器;GVS-2L 型超声波清洗机;JXN-30 型高速冷冻离心机;Scientz-10N 型冷冻干燥机;Millipore Milli-Q Advantage A10型超纯水系统;HT211B型全温摇床。
单标准储备溶液:取适量的亚硒酸盐、硒酸盐、硒代蛋氨酸、硒代乙硫氨酸和甲基硒代半胱氨酸的标准物质,用水分别溶解并定容至10 mL 容量瓶中,配制成质量浓度依次为100,100,150,170,7.648 mg·L-1(均以硒计)的单标准储备溶液,于4 ℃冷藏避光贮存。
混合标准储备溶液:1.0 mg·L-1(以硒计),取适量的亚硒酸盐、硒酸盐、硒代蛋氨酸、硒代乙硫氨酸和甲基硒代半胱氨酸的单标准储备溶液,用水定容至10 mL容量瓶中,配制成质量浓度为1.0 mg·L-1(均以硒计)的混合标准储备溶液,于4 ℃冷藏避光贮存。
调谐液:内含1.0μg·L-1铈、钴、锂、铊、钇的混合溶液。
亚硒酸盐标准溶液(1 000 g·L-1);硒酸盐标准溶液(1 000 g·L-1);甲基硒代半胱氨酸标准品纯度大于98%;硒代蛋氨酸标准品和硒代乙硫氨酸标准品纯度均大于99%;大虾粉标准物质(GBW 10050);木瓜蛋白酶,800 U·mg-1;一水合柠檬酸和氨水均为优级纯;硝酸为分析纯;试验用水为超纯水。
小黄鱼、带鱼、花蛤和口虾蛄均购于某菜场,按照GB/T 30891-2014《水产品抽样规范》[17]处理后,取可食组织于-45 ℃冷冻干燥并研磨粉碎后作为待测样品。
1.2 仪器工作条件
1.2.1 微波消解条件
设定微波消解程序如下:0~5 min时,升温至140 ℃,加热功率1 000 W;5~15 min时,升温至200 ℃,加热功率1000W,保持20min;35~50 min时,不加热,降温至室温。
1.2.2 色谱条件
Agilent ZORBAX SB-AQ 色谱柱(250 mm×4.6 mm,5μm);进样量20μL;流动相10 mmol·L-1的柠檬酸溶液(用氨水将酸度调至pH 4.75),等度洗脱;流量0.6 mL·min-1。
1.2.3 ICP-MS条件
射频功率1 550 W;射频电压1.90 V;蠕动泵转速0.1 r·min-1(用于测定总硒),0.5 r·min-1(用于测定各硒形态);采样深度10.00 mm;补偿气流量0.40 L·min-1,载气流量0.80 L·min-1,氦气流量0或5.0 mL·min-1;雾化室温度-5 ℃;重复次数6次;积分时间0.1 s(用于测定总硒),0.3 s(用于测定各硒形态);监测离子数78Se。
1.3 试验方法
1.3.1 总硒测定的前处理
称取0.2 g(精确至0.000 1 g)制备好的冻干海产品置于微波消解罐中,加入5.0 mL 硝酸和2.0 mL 30%(质量分数)过氧化氢溶液,振荡后加盖放置过夜,次日按照1.2.1节设定程序进行微波消解。消解完毕后,在150 ℃电热板上加热赶酸至无黄烟产生,冷却至室温后用水定容至50 mL,得到待测液。采用大虾粉标准物质GBW 10050 作为质控样对结果进行质量控制,同时进行试剂空白试验。
1.3.2 总硒含量的测定
使用调谐液对ICP-MS的各项参数进行调节,使各项仪器性能达到最佳状态。总硒含量测定时采用在线添加500μg·L-189Y 作为内标溶液进行仪器响应信号校正。将1.3.1节前处理得到的待测液按照1.2.3节ICP-MS条件进行测定。
1.3.3 硒形态测定的前处理
称取0.2 g(精确至0.000 1 g)制备好的冻干海产品置于50 mL离心管中,加入30 mg木瓜蛋白酶(800 U·mg-1)和20 mL水(预先用氨水将酸度调至pH 8.0),以转速3 000 r·min-1涡旋3 min后置于恒温摇床中,在50 ℃、180 r·min-1的条件下振摇12 h,再以转速3 000 r·min-1涡旋3 min,在4 ℃、8 000 r·min-1的条件下离心10 min。将上清液用0.22μm 滤膜过滤,得到待测液。
1.3.4 硒形态含量的测定
将1.3.3节得到的待测液按照1.2.2节色谱条件分离后,采用时间分辨分析(TRA)采集模式,按照1.2.3节ICP-MS条件进行测定。
2 结果与讨论
2.1 流动相及色谱柱的选择
液相色谱中流动相的组分和酸度对化合物形态分离起着重要的作用,当流动相的酸度发生变化时,目标物的溶液离子状态也会随之发生变化[18],最终会影响色谱分离效果。硒形态的洗脱体系通常分为柠檬酸体系(5~20mmol·L-1,pH4.0~6.0)[8,16,19]、碳酸氢钠体系(20 mmol·L-1,pH 12.0~13.0)[15]和磷酸氢二铵体系(30~40 mmol·L-1,pH 5.0~6.0)[20-22]。文献[11,15]在水相中添加乙腈的梯度洗脱方式以提高分离效果和增大峰响应强度,但考虑到有机相的添加会造成锥体结碳和锥孔损坏,ICP-MS的维护成本增加并造成计数误差,只选用缓冲盐溶液作为前端色谱分离的洗脱流动相,将对后端ICP-MS测定更加具有吸引力。通过优化,试验选择10 mmol·L-1柠檬酸溶液(氨水将酸度调至pH 4.75)作为流动相。
硒形态分析常用的色谱分离柱为Hamilton PRP-X100柱(250 mm×4.1 mm,10μm)[19,23-24]。试验发现在10 mmol·L-1柠檬酸溶液(氨水将酸度调至pH 4.75)、流量0.6 mL·min-1的相同洗脱条件下,与Hamilton PRP-X100柱相比,采用Agilent ZORBAX SB-AQ(250 mm×4.6 mm,5μm)作为分离柱时,5 种不同硒形态色谱分离效果更好。采用Hamilton PRP-X100柱时,分离时间更长,全部目标物需要16.5 min完成分离,硒代乙硫氨酸峰形不够尖锐,硒代蛋氨酸峰响应强度很低,如图1(a)所示。采用Agilent ZORBAX SB-AQ 柱(250 mm×4.6 mm,5μm)时,5 种硒形态均能在11 min内有效分离,出峰顺序依次为硒酸盐、亚硒酸盐、甲基硒代半胱氨酸、硒代蛋氨酸、硒代乙硫氨酸,出峰时间快,信号响应强度以及峰形均良好,如图1(b)所示。
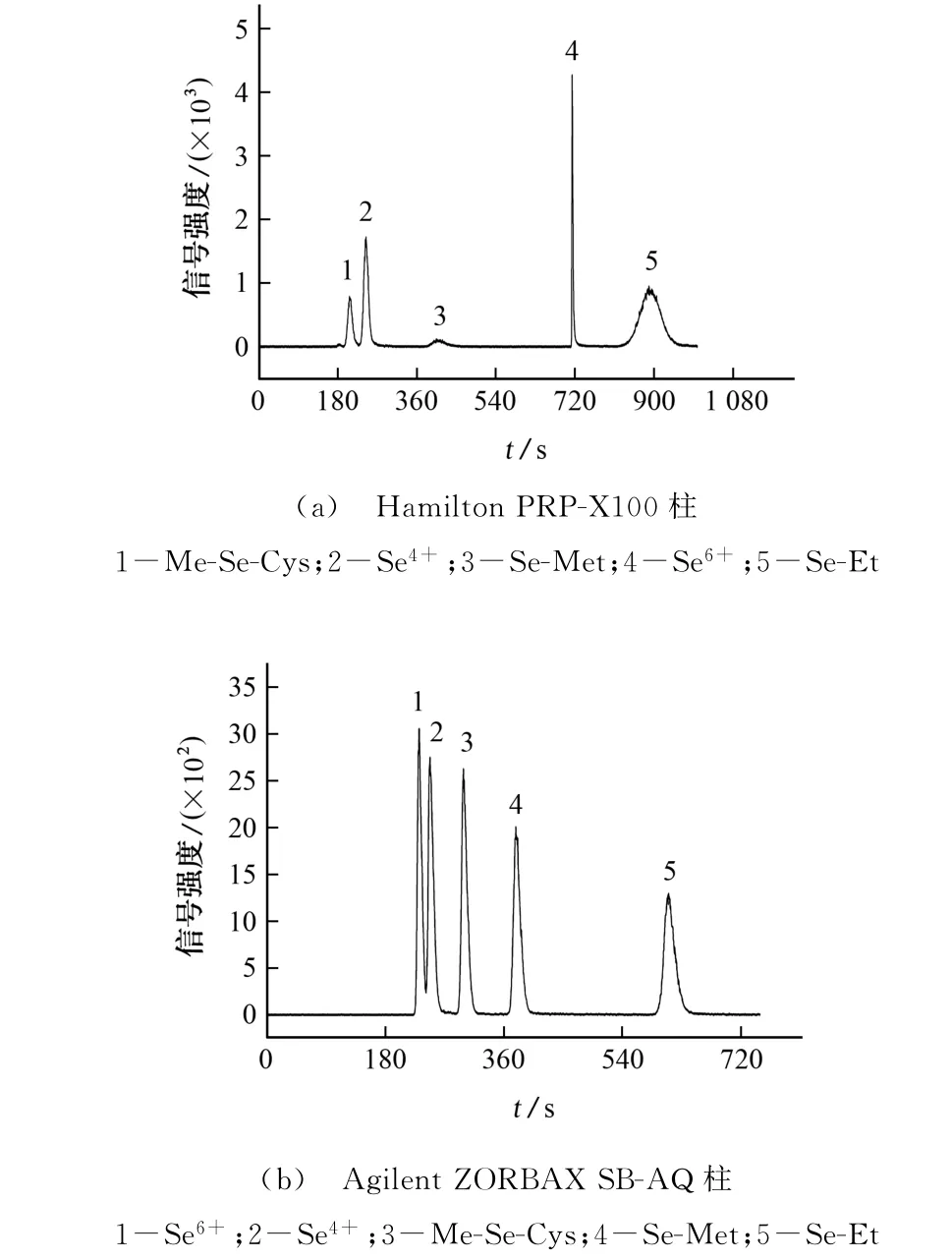
图1 5种硒形态混合标准溶液的色谱图Fig.1 Chromatograms of the mixed standard solution of selenium in 5 species
综上所述,试验选择10 mmol·L-1的柠檬酸溶液(氨水将酸度调至pH 4.75)作为流动相、Agilent ZORBAX SB-AQ 柱(250 mm×4.6 mm,5μm)作为分离柱和洗脱流量为0.6 mL·min-1的色谱分离条件,能取得较好的色谱分离效果。
2.2 前处理条件的优化
2.2.1 前处理酶
文献[16,22]报道生物样本中的硒主要以硒代蛋氨酸等有机硒形态存在,且与多肽、蛋白质等大分子结合在一起,因此硒形态测定前处理一般采用酶解法使有机硒游离。目前常用的酶有XIV 蛋白酶[19]、胃蛋白酶[25]和木瓜蛋白酶[26]等。
试验以质控样大虾粉标准物质GBW 10050(总硒认定值为5.10 mg·kg-1)作为测试样品,在各自的酶活性最适温度和酸度范围内,比较了胃蛋白酶、胰蛋白酶、碱性蛋白酶、XIV 蛋白酶、木瓜蛋白酶等5种常见蛋白酶对硒形态的提取效果。测定结果也表明大虾粉中的硒主要以硒代蛋氨酸的形态存在,如图2所示。因此,后续试验以大虾粉中硒代蛋氨酸(以硒计)的提取率作为前处理条件优化指标,筛选提取液的酸度、提取温度和时间、蛋白酶用量等参数,其中硒代蛋氨酸提取率以硒代蛋氨酸含量(以硒计)除以总硒含量来计算。
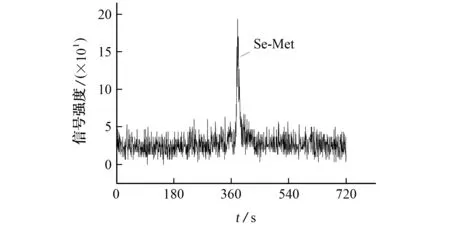
图2 大虾粉标准物质GBW 10050中硒形态的色谱图Fig.2 Chromatogram of selenium specie in reference material GBW 10050 of prawn powder
大虾粉标准物质GBW 10050总硒测定的平均值为(4.97±0.14)mg·kg-1,与认定值基本一致。不同蛋白酶的提取效果见表1。
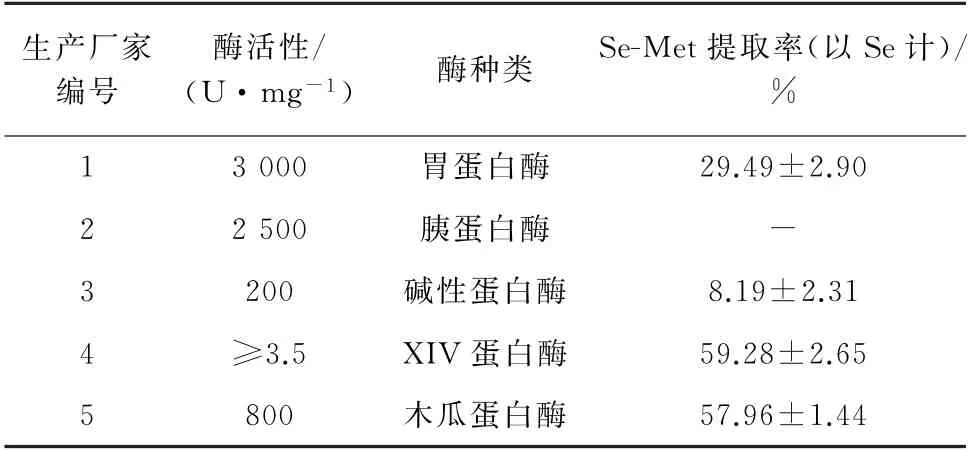
表1 前处理酶对硒代蛋氨酸提取率的影响Tab.1 Effect of pretreatment enzyme on extraction ratio of Se-Met
由表1可知,在蛋白酶用量相同的情况下,硒代蛋氨酸提取率按从大到小顺序排列为XIV 蛋白酶、木瓜蛋白酶、胃蛋白酶、碱性蛋白酶,而胰蛋白酶对硒形态没有提取效果。由于XIV 蛋白酶价格远远高于木瓜蛋白酶,而两者对硒代蛋氨酸提取率相差不大,因此试验选用木瓜蛋白酶进行样品前处理。
2.2.2 提取液的酸度
所选用的木瓜蛋白酶在pH 6.0~8.0条件下具有最佳酶活力。在样品中加入蛋白酶和用氨水调节pH 分别为5.0,6.0,7.0,8.0,9.0,10.0的水,探究不同酸度的提取液对硒代蛋氨酸提取率的影响,如图3所示。

图3 提取液酸度对Se-Met提取率的影响Fig.3 Effect of acidity of extract on extraction ratio of Se-Met
由图3可知,提取液的酸度在pH 6.0~9.0内时,硒代蛋氨酸的提取率较高,在pH 8.0时硒代蛋氨酸的提取率最高。因此,试验选用pH 8.0的木瓜蛋白酶解液作为提取液。
2.2.3 提取温度
木瓜蛋白酶的酶活力有效温度为40~60℃,因此在30,35,40,45,50,55,60℃等7个温度下,考察了提取温度对硒代蛋氨酸提取率的影响,结果见表2。

表2 提取温度对硒代蛋氨酸提取率的影响Tab.2 Effect of extraction temperature on extraction ratio of Se-Met
由表2可知,在酶活力有效温度范围内,40~50 ℃时硒代蛋氨酸的提取率呈现随温度上升不断增加的趋势,但50 ℃之后,硒代蛋氨酸的提取率逐渐减低,60 ℃时硒代蛋氨酸的提取率几乎与30~35 ℃的提取率一致。因此,试验选取50 ℃作为最佳的提取温度。
2.2.4 提取时间
试验考察了不同提取时间(2,4,6,8,10,12,14 h)对硒代蛋氨酸提取率的影响,结果如图4所示。
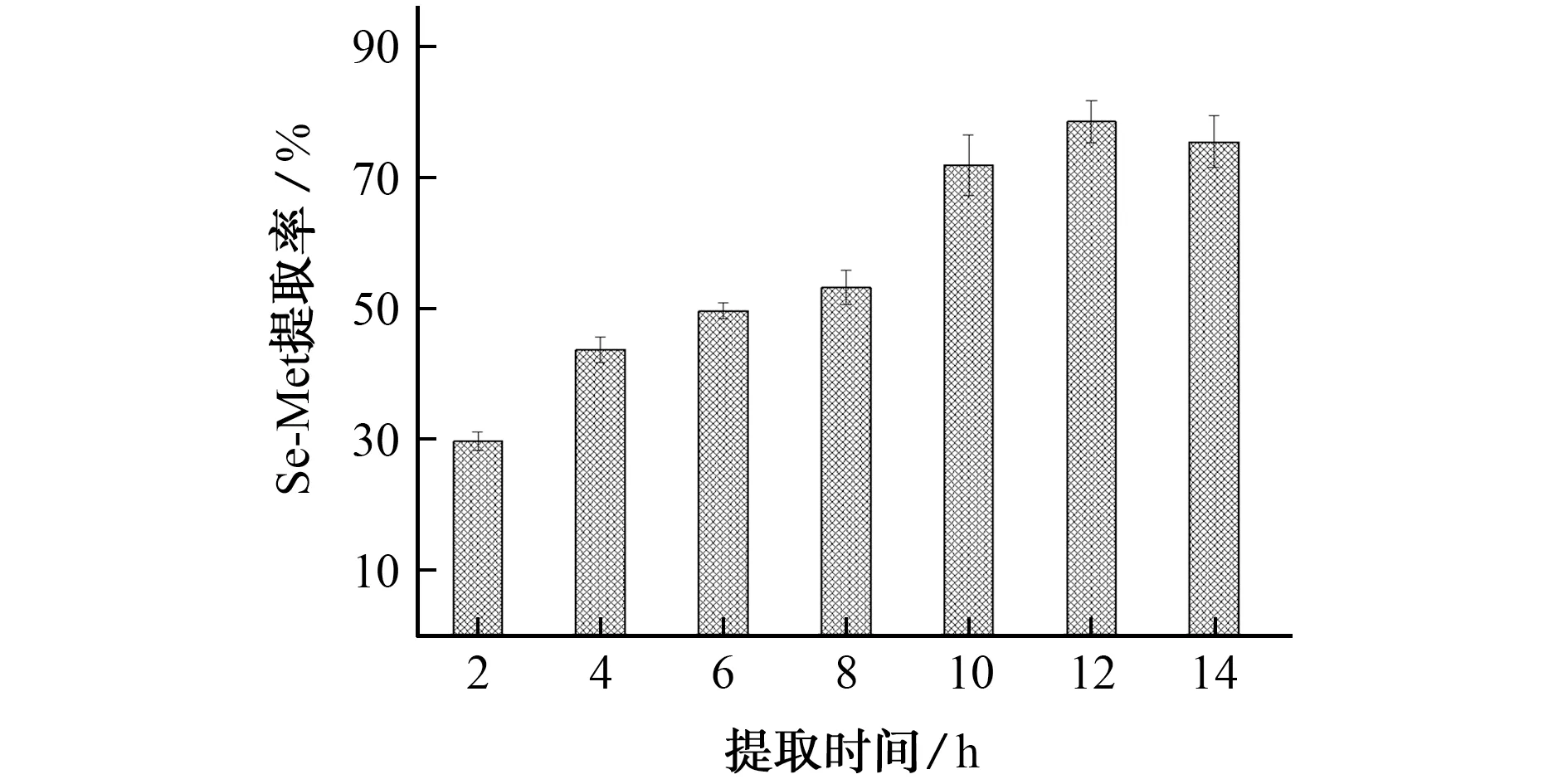
图4 提取时间对硒代蛋氨酸提取率的影响Fig.4 Effect of extraction time on extraction ratio of Se-Met
结果表明,随着提取时间的延长,硒代蛋氨酸提取率不断增加,9 h后的提取率增加幅度加剧,但在10 h以后提取率增幅趋于平缓,14 h以后提取率开始有所下降,可能是由于提取时间过长导致硒形态发生转变。因此,试验选用12 h为提取时间。
2.2.5 蛋白酶用量
试验考察了不同的蛋白酶用量(10,20,30,40,50 mg)对硒代蛋氨酸提取率的影响,结果见图5。
由图5可知:在10~30 mg的蛋白酶用量下,硒代蛋氨酸的提取率随着蛋白酶用量的增加呈现不断上升的趋势;而继续加大蛋白酶用量(40~50 mg),提取率反而有所下降。大虾粉取样量在0.2 g时,添加30 mg的木瓜蛋白酶酶解后,观察到样品得到充分酶解,形成透明澄清溶液。因此,试验选用30 mg作为木瓜蛋白酶的最佳用量。

图5 蛋白酶用量对硒代蛋氨酸提取率的影响Fig.5 Effect of the amount of protease on extraction ratio of Se-Met
2.3 标准曲线、检出限及测定下限
取适量的混合标准储备溶液,用水逐级稀释,配制成质量浓度分别为0,5,10,20,50,100,200,300,400,500μg·L-1的混合标准溶液系列。按照仪器工作条件进行测定,以硒形态的质量浓度为横坐标,其对应的78Se质谱信号值(CPS计数)为纵坐标,绘制标准曲线。结果表明,硒酸盐、亚硒酸盐、甲基硒代半胱氨酸、硒代蛋氨酸和硒代乙硫氨酸在500μg·L-1内均呈较好的线性关系,相关系数均大于0.999 7,其线性回归方程和相关系数见表3。
以3倍信噪比(S/N)的响应强度下的目标物质量浓度作为方法的检出限(3S/N),以10倍信噪比且回收率大于70.0%时的目标物质量浓度作为方法的测定下限(10S/N),结果见表3。

表3 线性参数、检出限和测定下限Tab.3 Linearity parameters,detection limits and lower limits of determination
2.4 精密度和回收试验
以小黄鱼为本底样品进行3个不同浓度水平的加标回收试验,每个浓度水平平行测定6次,连续测定6 d,计算回收率和测定值的相对标准偏差(RSD),结果见表4。
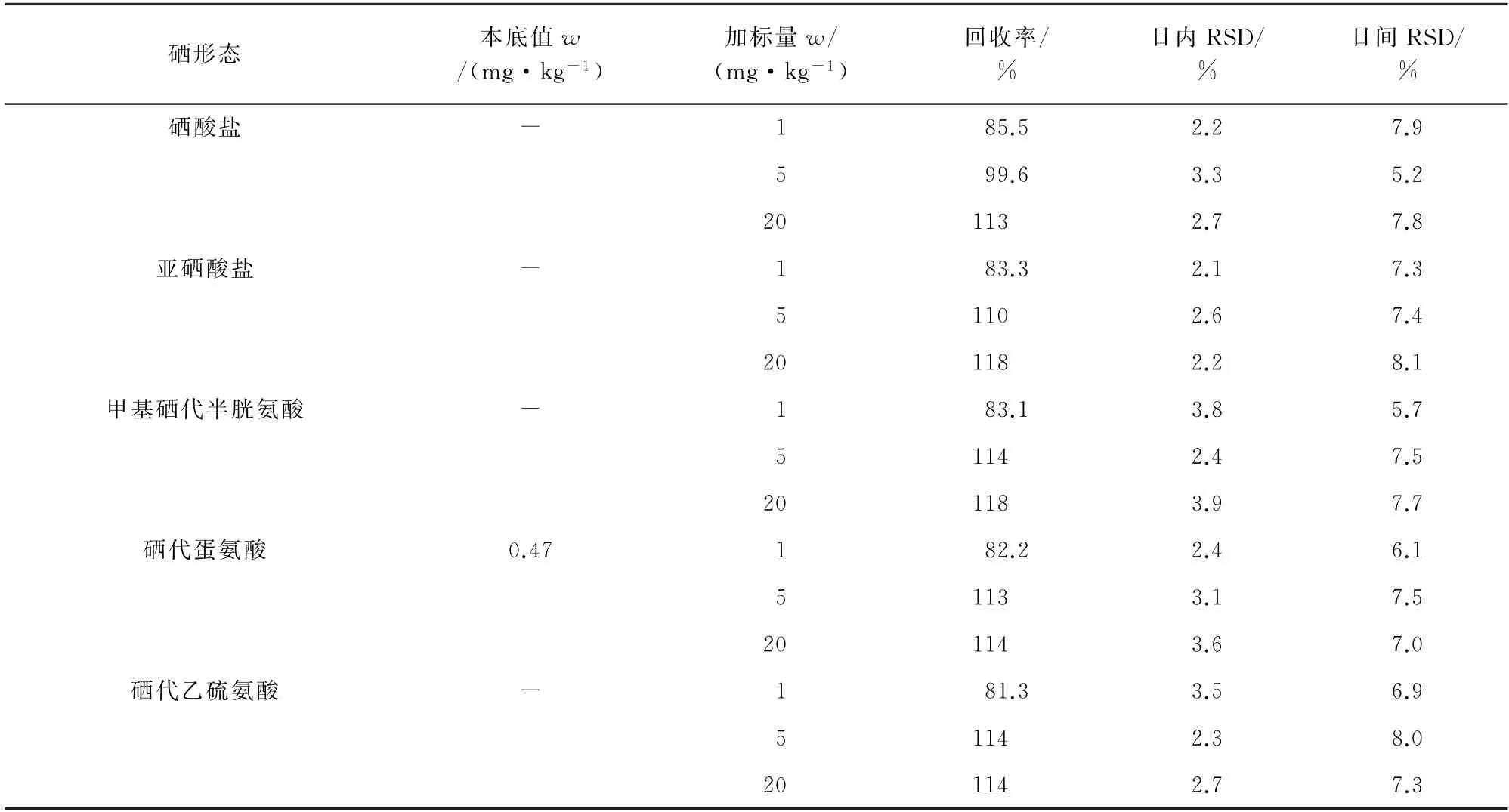
表4 精密度和回收试验结果(n=6)Tab.4 Results of tests for precision and recovery(n=6)
结果表明,在1,5,20 mg·kg-1的添加浓度水平下,硒酸盐、亚硒酸盐、甲基硒代半胱氨酸、硒代蛋氨酸和硒代乙硫氨酸的回收率为81.3%~118%,日内RSD 和日间RSD 均小于9.0%,表明该方法的准确度高、重复性好。
2.5 样品分析
采用优化后的试验方法对市售海产品进行测定,结果表明,小黄鱼中硒代蛋氨酸(以下均以硒计)的质量分数为(0.47±0.17)mg·kg-1;带鱼中硒代蛋氨酸的质量分数为(0.56±0.19)mg·kg-1;口虾蛄中硒代蛋氨酸的质量分数为(0.52±0.16)mg·kg-1,甲基硒代半胱氨酸的质量分数为(0.12±0.08)mg·kg-1;花蛤中硒代蛋氨酸的质量分数为(0.35±0.11)mg·kg-1,甲基硒代半胱氨酸的质量分数为(0.04±0.01)mg·kg-1,实际样品测定谱图如图6所示。试验数据表明,小黄鱼和带鱼中硒代蛋氨酸的测定结果比文献[27]研究中的大西洋鲑鱼和大西洋鳕鱼的测定值都要高,说明在我国食用小黄鱼和带鱼能够为居民补充较高水平的硒代蛋氨酸,口虾蛄也是补充硒代蛋氨酸的一种重要来源。
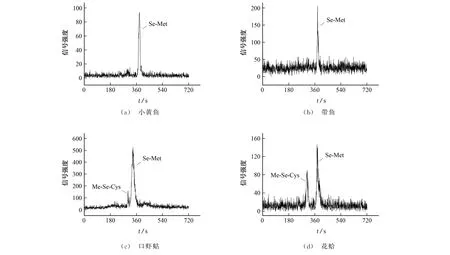
图6 海产品硒形态的色谱图Fig.6 Chromatograms of selenium species in seafood products
本工作采用HPLC-ICP-MS测定海产品中硒酸盐、亚硒酸盐、甲基硒代半胱氨酸、硒代蛋氨酸和硒代乙硫氨酸等5种硒形态含量。样品采用木瓜蛋白酶酶解处理后经ZORBAX SB-AQ 色谱柱快速分离,ICP-MS定性与定量检测。该方法前处理简单快捷、检测成本低、准确度高、重现性好,可较好地用于海产品中硒形态的测定。
