表面增强拉曼光谱法测定牛奶中青霉素G 钠的残留量
2022-04-24梁营芳周化岚张建国李晓迪王乐惠
梁营芳,周化岚,张建国,王 锋,李晓迪,王乐惠
(上海理工大学 医疗器械与食品学院,上海 200093)
β-内酰胺类抗生素是指分子中含有β-内酰胺环结构的一类抗菌药,具有杀菌活性强、毒性低、适应证广等诸多优点[1]。青霉素G 钠(NaBP)是一种具有代表性的β-内酰胺类化合物,在临床医学、兽医学和饲料添加剂等方面得到了广泛的应用[2]。该抗生素被专门用于治疗奶牛的乳腺炎,因此在鲜奶和乳制品中会有相应残留[3]。
青霉素G 钠的非法使用或者滥用会导致其出现在食物链中,并最终影响消费者健康并造成环境污染。目前,世界上许多国家正在预防和管理这一问题,许多组织规定了青霉素G 钠的残留限量。1999年,欧盟(EU)第508/1999号条例规定了牛奶中青霉素的残留限量为4μg·kg-1或1.2×10-8mol·L-1[4],美国食品药品监督管理局规定牛乳中青霉素G 的残留限量为5×10-9IU·m L-1[5],中国农业部于2006年发布公告《牛奶中青霉素类药物残留量的测定 高效液相色谱法》规定牛乳中青霉素G 的残留限量为4μg·L-1[6]。
目前,测定青霉素G 钠的方法主要有气相色谱法、高效液相色谱法、酶联免疫吸附试验、微生物法等[6-8]。但是在实际操作中,这些常用的方法存在设备昂贵、样品制备复杂、操作耗时等局限性。因此,开发一种低成本、灵敏、简便、快速的测定方法是十分必要的。
表面增强拉曼光谱(SERS)是一种与纳米尺度效应相关的拉曼散射现象。一般情况下,样品的拉曼信号非常微弱。但当待测样品吸附于具有纳米量级粗糙度的金属(常用金或银)结构表面时,样品的拉曼信号将得到极大的增强[9]。SERS因具有灵敏度高、响应迅速、无标记以及“指纹”识别等特点,在快速检测抗生素等方面具有较大的应用前景。文献[10]以银纳米粒子(Ag NPs)为基底,通过SERS检测方法对青霉酸进行了表征和定量分析,满足了实际应用中的灵敏度要求。文献[11]以单分散磁性高分子微球为载体,合成了一种新的SERS平台。该方法用于检测低水平抗生素阿莫西林的残留,检出限为10-8mol·L-1。在上述文献基础上,本工作以合成的Ag NPs 为基底,硫酸镁为凝聚剂,采用SERS测定牛奶中青霉素G 钠的含量。
1 试验部分
1.1 仪器与试剂
HORIBA Lab RAM HR Evolution型显微共聚焦拉曼光谱仪;UV-1200型紫外-可见分光光度计;Nova NanoSEM 450 型场发射扫描电子显微镜;PHS-3C型pH 计;81-2型恒温磁力搅拌器;Sigma-14 型高速离心机;Spinplis-6 型低速离心机;ML104/02型电子天平;TopPette型手动单道移液枪;毛细管(100 nm,1.8~2.2 mm)。
硝酸银的纯度为99%,柠檬酸钠(Na3C6H5O7·2 H2O)的纯度为99.8%,硫酸镁的纯度不小于98%,青霉素G 钠的纯度为99%,三氯乙酸的纯度不小于99%;所用其他试剂均为分析纯;试验用水为去离子水。
牛奶购自上海市某超市,使用前放置于4 ℃冰箱;试验所用玻璃器皿用体积比为3∶1的盐酸-硝酸混合液浸泡,并用水冲洗。
1.2 试验方法
1.2.1 银溶胶的制备
参考文献[12]中方法,采用经典的化学还原法制备银溶胶。将0.036 g硝酸银溶于200 mL水中,加热至98 ℃。然后在沸腾的硝酸银溶液中快速加入4 mL 1%(质量分数)柠檬酸钠溶液,并剧烈搅拌。持续加热40 min后,得到灰绿色胶体溶液,粒径约为60 nm。将其自然冷却,保存于4 ℃冰箱中进行下一步研究。
1.2.2 SERS样品的制备
取上述银溶胶30 mL,以转速5 000 r·min-1离心10 min,去除上清液以获得浓缩的Ag NPs(约3 mL)。将浓缩的AgNPs20μL与不同浓度(1×10-9~1×10-1mol·L-1)的青霉素G 钠溶液(pH 6)20μL 混合10 s。将上述混合溶液与1×10-2mol·L-1硫酸镁溶液8μL 混合10 s,胶体颜色迅速变为深灰色。最后,将得到的胶体注入毛细管中进行SERS检测。
1.2.3 牛奶中青霉素G 钠的SERS检测
以牛奶为检测对象,参考文献[13]中方法对样品进行预处理,去除牛奶中的蛋白质和脂质。在20 mL牛奶样品中加入0.5 mL 三氯乙酸,混合超声30 min,再以转速5 000 r·min-1离心30 min,得到上清液即除去了牛奶中的蛋白质。上清液经0.22μm 的聚偏二氟乙烯(PVDF)膜过滤,除去牛奶中的脂质,所得滤液于4 ℃保存。将样品制备成含不同浓度(1×10-6~1×10-3mol·L-1)青霉素G钠的加标样品。
1.2.4 SERS光谱采集
对显微共聚焦拉曼光谱仪参数进行设置:激光波长633 nm,扫描光谱波段500~2 000 cm-1,积分时间10 s,积分平均2次,平滑度1。为提高SERS谱图的重复性,每个样品测试过程中,随机在基底上采集5个不同的点分别获得谱图,取其平均值进行分析。
2 结果与讨论
2.1 AgNPs的表征
图1 为不同Ag NPs样品的扫描电子显微镜(SEM)图像和紫外-可见吸收光谱。在图1(a)中,可以观察到合成的Ag NPs大部分呈球形,粒径为60 nm 左右。浓缩AgNPs中添加青霉素G 钠溶液后的SEM 图像如图1(b)所示。随着硫酸镁溶液的加入,Ag NPs表现出明显的聚集性,说明硫酸镁溶液是一种有效的凝聚剂,如图1(c)所示。图1(d)中显示了不同Ag NPs 样品的紫外-可见吸收光谱。Ag NPs的最大吸收波长(曲线1)位于422 nm 处,同时也表明该溶液中存在平均粒径为60 nm 的球形纳米粒子。加入青霉素G 钠后,Ag NPs的局域表面等离子共振(LSPR)最大吸收峰略有红移,Ag NPs的最大吸收波长为424 nm(曲线2),这是由于青霉素G 钠分子会导致Ag NPs发生轻微聚集。进一步添加硫酸镁溶液后,Ag NPs的最大吸收波长从422 nm 明显移动到426 nm,表明硫酸镁溶液会导致Ag NPs发生明显聚集(曲线3)。该结果与SEM 测量结果一致。
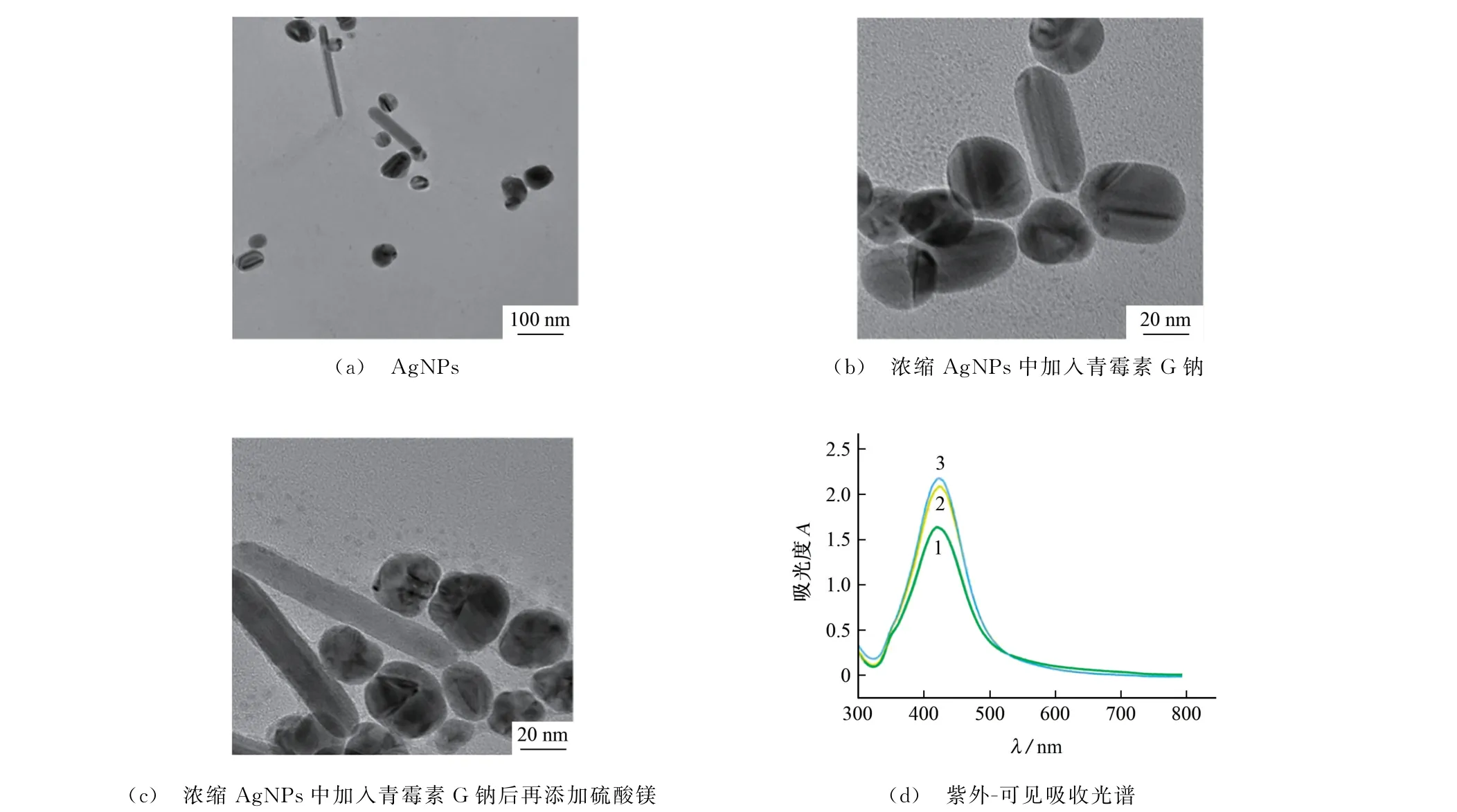
图1 不同Ag NPs样品的SEM 图像和紫外-可见吸收光谱Fig.1 SEM images and UV-Vis absorption spectra of different Ag NPs samples
2.2 青霉素G 钠的拉曼光谱及其归属
图2为青霉素G 钠的固体粉末(曲线1)和水溶液(曲线2)的常规拉曼光谱,吸附在Ag NPs上的SERS 光谱(曲线4)以及加入硫酸镁凝聚剂的SERS光谱(曲线3)。青霉素G 钠固体粉末的常规拉曼光谱强度明显高于水溶液。在固体粉末常规拉曼光谱中,1 002 cm-1处的典型峰被确定为β-内酰胺环和噻唑烷环的振动,包括β-内酰胺环的拉伸振动和两个甲基(-CH3)的扭转振动[14]。583 cm-1处的另一个强峰被认为是C-C(苯环和β-内酰胺环之间的烷基链)的伸缩振动和NH 的摇摆振动[15]。1 583 cm-1和1 602 cm-1处的其他弱带可归因于C-C(苯基环)的伸缩振动。与青霉素G 钠的常规拉曼光谱相比,吸附在Ag NPs上的青霉素G钠SERS光谱在拉曼强度和拉曼位移上都存在显著差异。吸附在Ag NPs上的青霉素G 钠SERS光谱在583 cm-1的峰非常微弱,1 000 cm-1处的峰有2 cm-1的偏移。这些变化是由于Ag NPs对青霉素G 钠分子的β-内酰胺环和噻唑烷环的电磁场、化学或电子增强效应所致。
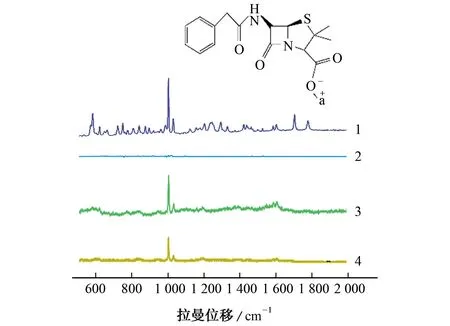
图2 不同形式下的青霉素G 钠的拉曼光谱Fig.2 Raman spectra of NaBP in different forms
2.3 硫酸镁浓度对青霉素G 钠溶液SERS增强的影响
凝聚剂硫酸镁对青霉素G 钠的SERS 增强起着至关重要的作用,硫酸镁的浓度也对增强效果有很大影响。在不同浓度(1×10-3,1×10-2,1×10-1,1 mol·L-1)的硫酸镁溶液中,1×10-2mol·L-1青霉素G 钠溶液在Ag NPs基底上的SERS光谱如图3所示。
由图3 可知,当硫酸镁浓度为1×10-2mol·L-1时,在Ag NPs基底上的青霉素G 钠表现出最大增强效果。原因可能是其他浓度硫酸镁的加入引起Ag NPs的聚集不足或者聚集过多,从而不利于有效“热点”的形成。因此,在后续试验中,选择的硫酸镁浓度为1×10-2mol·L-1。
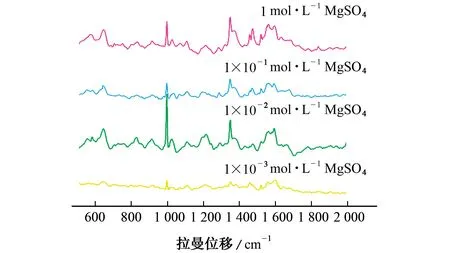
图3 在不同浓度硫酸镁溶液中青霉素G 钠在Ag NPs基底上的SERS光谱Fig.3 SERS spectra of NaBP on Ag NPs substrate with different concentrations of MgSO4 solution
2.4 青霉素G 钠溶液的酸度对SERS增强的影响
青霉素G 钠溶液很不稳定,在室温下放置容易失效,其结构中的β-内酰胺环对酸度、温度、β-内酰胺酶等高度敏感[16-17]。文献[18-19]研究表明,在酸性溶液中,青霉素容易通过中间体青霉酸迅速转化为丙烯酸,这也是青霉素在碱性介质中的降解产物。图4为不同酸度(pH 分别为2,4,6,8,10)的1×10-2mol·L-1青霉素G 钠溶液在Ag NPs基底上的SERS光谱。
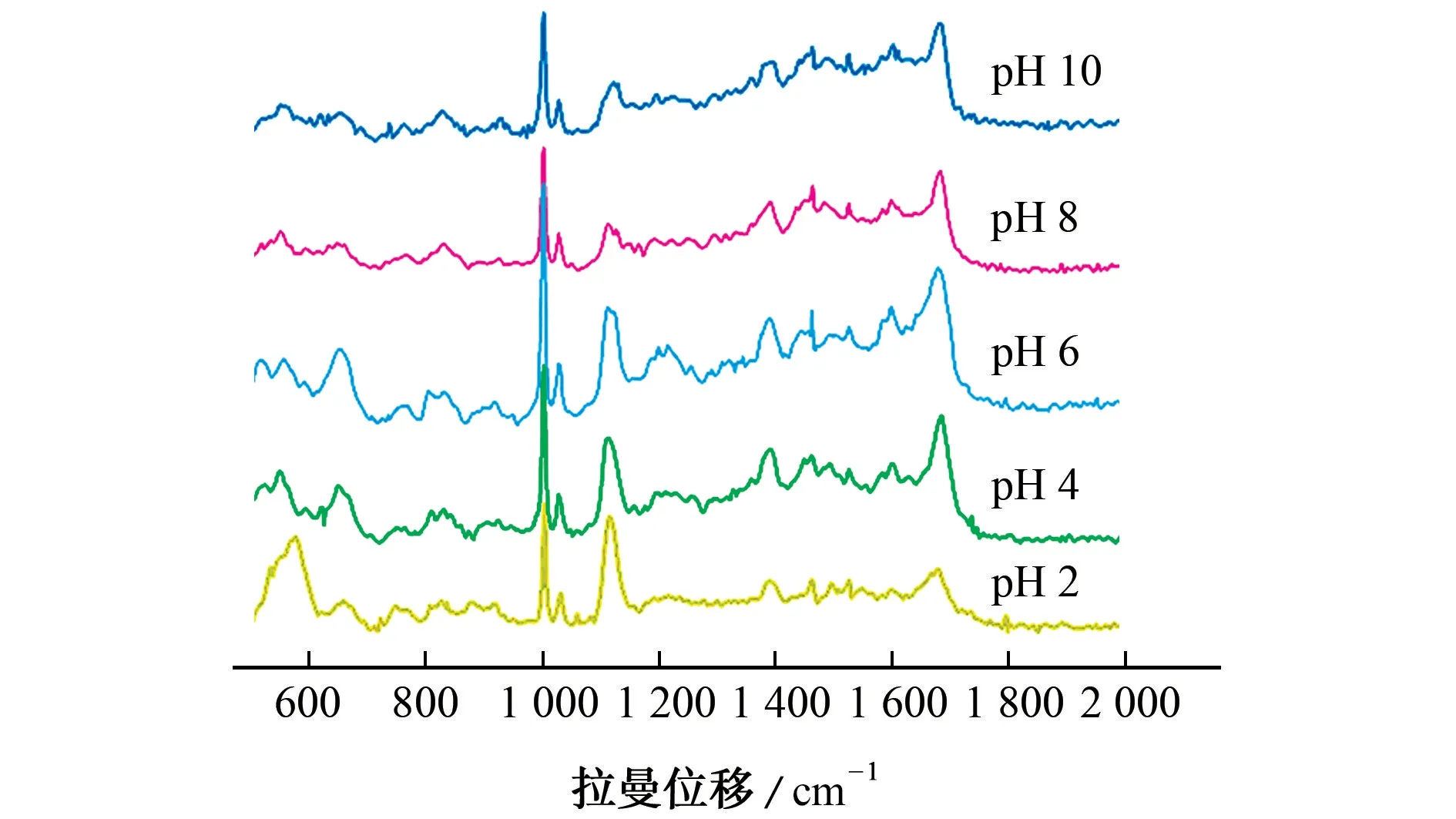
图4 不同酸度的1×10-2 mol·L-1青霉素G 钠溶液在Ag NPs基底上的SERS光谱Fig.4 SERS spectra of 1×10-2 mol·L-1 NaBP solution at different acidities on Ag NPs substrate
结果表明,不同酸度的青霉素G 钠溶液的SERS增强效果不同。当青霉素G 钠溶液的pH 为6(初始酸度)时,其SERS 光谱表现出最佳增强效果。随着酸度的增加或者减小,青霉素G 钠SERS光谱在1 002 cm-1处的强度逐渐降低。在强酸(pH 2)的600 cm-1左右处,出现了一些新的拉曼峰,其为COO-基团,这可能是β-内酰胺环打开而形成了青霉酸所致。
2.5 青霉素G 钠溶液的SERS检测
图5为不同浓度(1×10-9,1×10-8,1×10-7,1×10-6,1×10-5,1×10-4,1×10-3,1×10-2,1×10-1mol·L-1)的青霉素G 钠溶液在Ag NPs基底上的SERS光谱。结果表明SERS光谱强度随着青霉素G 钠溶液浓度的增加而增强。在青霉素G 钠溶液高浓度区域,随着其浓度的减小拉曼信号降低幅度较大,而在低浓度区域,拉曼信号降低幅度相对较小。当溶液浓度为1×10-9mol·L-1时,其在1 002 cm-1处的信号几乎检测不出。
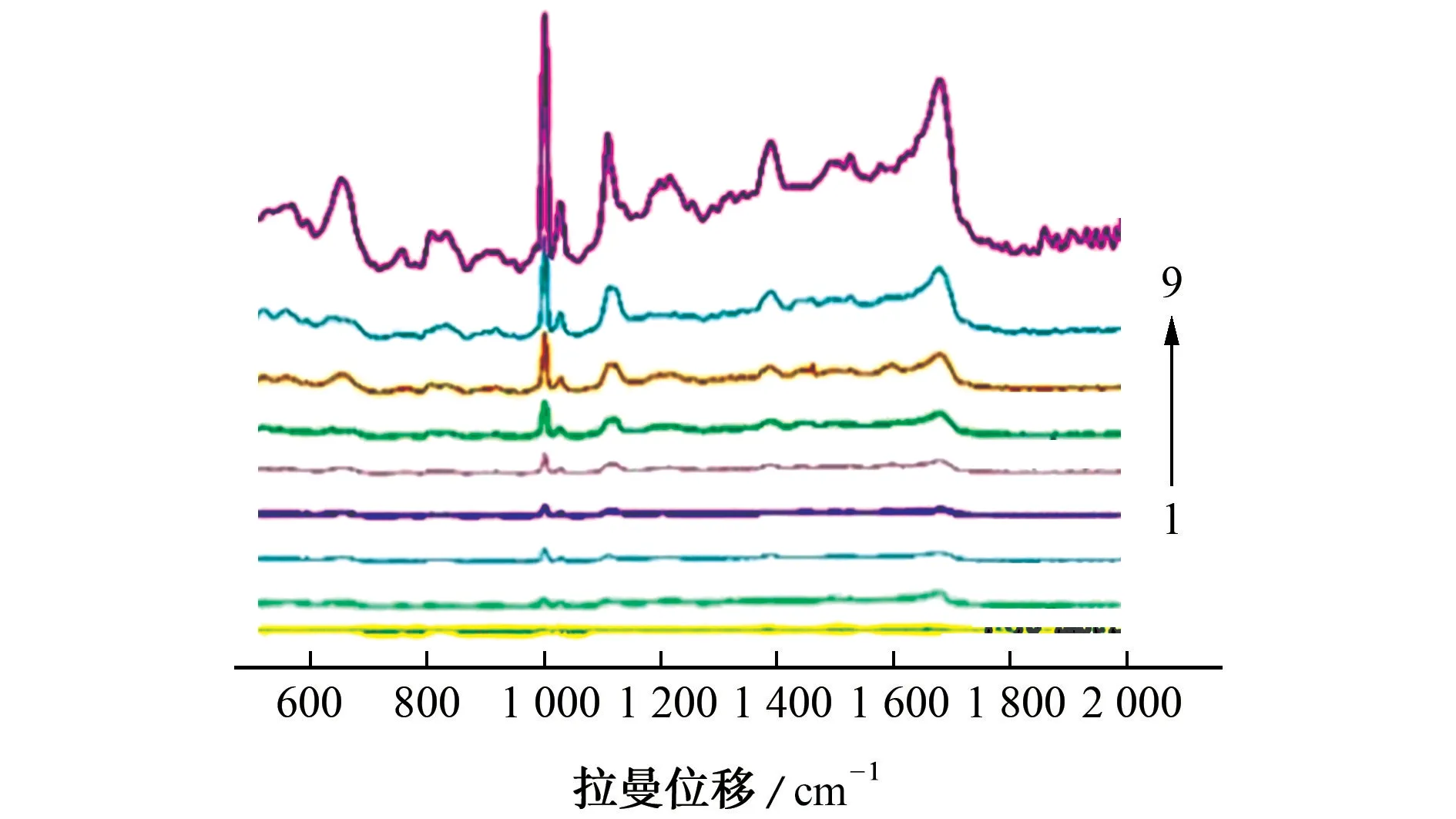
图5 不同浓度青霉素G 钠在Ag NPs基底上的SERS光谱Fig.5 SERS spectra of NaBP in different concentrations on Ag NPs substrate
图6显示了1 002 cm-1处青霉素G 钠浓度与SERS信号强度之间的定量关系,每个点表示来自5个点的平均强度。结果表明,SERS信号强度随着青霉素G 钠浓度的降低而减弱。青霉素G 钠浓度为1×10-8~1×10-3mol·L-1时,其浓度的对数值与相应的SERS峰强度呈线性关系,线性回归方程为y=1.583×102lgc+1.360×103,相关系数为0.997 9,这说明SERS可以在适当的浓度范围内对青霉素G 钠进行定量分析。
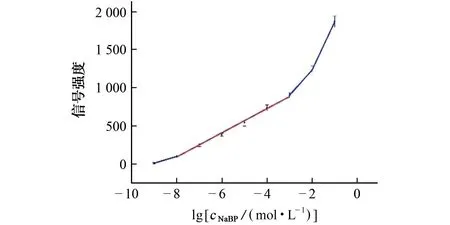
图6 1 002 cm-1处SERS信号强度与青霉素G 钠浓度对数的关系图Fig.6 The plot of relationship between signal intensity of SERS at 1 002 cm-1 and the logarithm of NaBP concentration
按照3s/k(s为空白样品标准偏差,k为标准曲线的斜率)计算方法的检出限,结果为8.2×10-9mol·L-1。
2.6 牛奶中青霉素G 钠的SERS检测
为了验证SERS测定青霉素G 钠含量方法的可行性,选用了1.2.3 节中制备的不同浓度水平(1×10-6~1×10-3mol·L-1)的牛奶加标样品进行SERS检测(图7),每个加标水平平行测定5次,并计算青霉素G 钠的回收率和相对标准偏差(RSD),结果见表1。
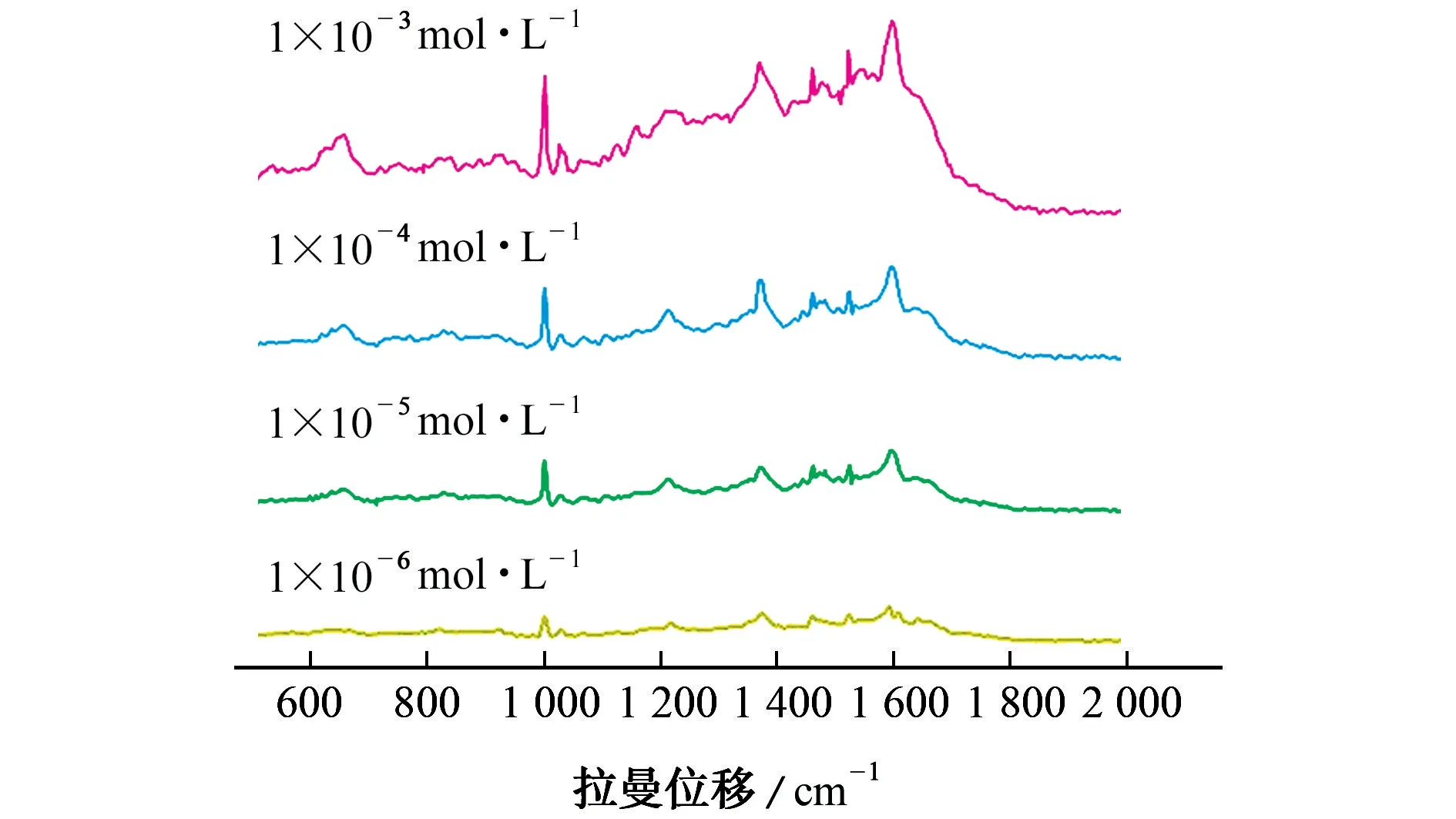
图7 不同加标浓度牛奶样品的SERS光谱Fig.7 SERS spectra of milk samples with different spiked concentrations
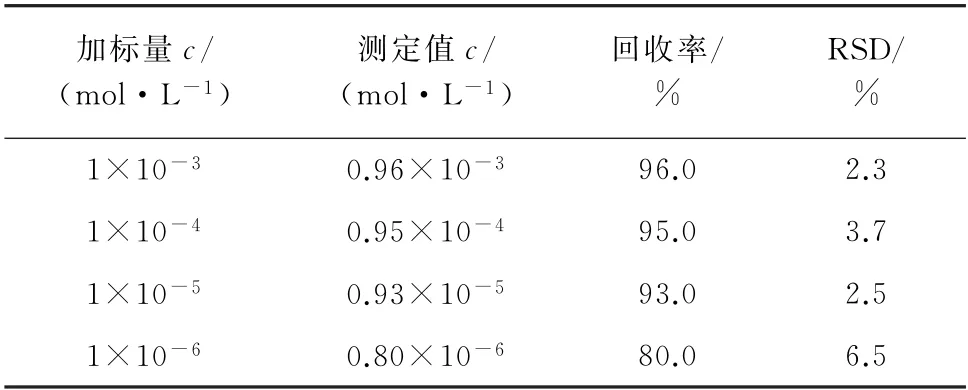
表1 精密度和回收试验结果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
结果表明,在1 002 cm-1处的SERS信号强度随着牛奶中青霉素G 钠浓度的降低而减弱。青霉素G 钠的回收率为80.0%~96.0%,测定值的RSD为2.3%~6.5%。说明所提出的SERS 是一种简便、可靠的测定牛奶中青霉素G 钠残留的方法。
本工作以Ag NPs为活性基底,在凝聚剂硫酸镁的协助下,对青霉素G 钠进行了SERS检测。该方法检出限可达8.2×10-9mol·L-1,低于欧盟抗生素药物最大残留限量标准。此外,方法简便、快速,有望成为一种标准的检测方法,有助于实际样品的现场检测。
