产神经酸微藻Mychonastes afer的兼养固碳培养
2022-04-22师晓艺丁晓婷万子璇李福利
师晓艺,丁晓婷,万子璇,英 瑜,李福利,高 昕,范 勇
1. 中国海洋大学 食品科学与工程学院,山东 青岛 266071
2. 中国科学院青岛生物能源与过程研究所,山东 青岛 266101
3. 青岛市食品药品检验研究院,山东 青岛 266071
微藻是一种单细胞光合微生物,因富含蛋白质和生物活性物质,可以作为水产动物的开口饵料和饲料营养强化剂[1-3]。微藻在改善养殖水质、净化养殖废水方面也有广泛应用,如卢崇德等[4]将小球藻 (Chlorella sp.) 固定后应用于水产养殖水体,通过生物增氧的方式改善水体缺氧问题;Ding等[5]将微藻与膜生物反应器耦合,对海水对虾养殖废水中的氮、磷实现了较高的清除效率。其中应用最广泛的微藻之一是小球藻。小球藻隶属绿藻门、绿藻纲、小球藻科、小球藻属,为一种单细胞绿藻,广泛分布在淡水水域中,蛋白质含量高,生长速度快。小球藻营养方式多样,可以自养培养,也可以利用有机碳源进行培养[6-8],特别在异养条件下可以实现生物量的快速积累[9-11]。中国科学院水生生物研究所探究出一种异养超高密度发酵培养方式,在实验室和中试发酵罐放大条件下,小球藻最高细胞生物量分别达到271和247 g·L-1[12],这是目前报道的小球藻最高生物量密度。
开发多种微藻种质资源是更好发挥微藻在水产养殖中积极作用的一种重要方式。2011年中国科学院青岛生物能源与过程研究所筛选到一株Mychonastes afer HSO-3-1微藻[13-15],其隶属于绿藻门、绿藻纲、麦可属,细胞粒径约为2~3 μm,属于超微型浮游藻类。超微型浮游藻类在生态系统的能量流动和物质循环中起主要作用,是浮游植物总生物量和生产力的主要组成部分,约占总叶绿素a的35%~44%和总初级生产力的42%~55%[16]。超微藻类是微食物环的重要组成部分,研究表明超微藻具有更高的二氧化碳 (CO2) 固定效率,对富营养化水体中初级生产力的贡献可达55%,且对浮游微生物的种群具有调控作用[17]。另外,该藻种神经酸含量可达到中性脂肪酸含量的6.5%,是世界上首次发现富含高比例神经酸的微藻品种[18]。神经酸是大脑神经细胞和神经组织的核心成分,是公认可以促进受损神经细胞、组织修复和再生的活性物质[19-20],M. afer作为天然神经酸的可靠来源[13,21],可以为水产动物提供更优质的脂质资源,且该藻种蛋白质氨基酸模式更合理,易于被水产动物吸收利用。
探究M. afer藻株的高效培养方式,通过加入有机碳源,加速细胞生长速度,缩短细胞生长时间,有利于实现高生物量和生物活性物质的积累。光合系统在加入有机碳源后所起作用、兼养过程中的通气以及通入高浓度CO2等问题仍备受争议。一些学者认为CO2的通入以及光合系统作用会降低有机碳利用速率,如Sforza等[22]发现在C. protothecoides和Nannochloropsis salina兼养过程中通入过量 (5%) CO2降低了有机碳源的同化效率,使得兼养条件的比生长速率基本等同于自养条件;Curien等[23]认为在嗜极微藻Galdieria sulphuraria培养基中加入有机碳源可以缓解CO2缺乏对细胞生长的抑制,但人为外加0.5% CO2却将自养与异养之间的协同效应打破,从而抑制了细胞的快速生长;Oliveira等[24]在研究Choricystis minor var.minor藻株时发现,兼养和异养条件下的细胞均比自养表现出更高的生长速率,但在兼养的同时通入CO2却导致生物量的下降,表明CO2削弱了有机碳源对细胞生长的促进作用。同时也有另一种观点,Martinez和Orus[25]在研究普通小球藻藻株UAM 101时发现,在以葡萄糖作为有机碳源的同时,通入2% CO2可使细胞实现最大的比生长速率。因此,微藻利用有机碳源生长与其自身光合作用之间的关系存在着种间差异,发现并优化可同时利用有机碳源和自身光合作用的藻种,是提高微藻经济效益的重要途径之一。本研究主要比较了小球藻C. sorokiniana和M. afer在兼养过程中利用有机碳源和协同光合作用的能力,并探索M. afer的最佳兼养培养条件。
1 材料与方法
1.1 实验藻种与培养
小球藻采样于山东青岛大沽河流域,本实验室保存,经18S测序为小球藻C. sorokiniana,保藏编号为xzl;M. afer HSO-3-1保藏于中国典型微生物保藏中心,藻种保藏号为CGMCC No. 4654。
两种微藻均以BG-11作为基础自养培养基。培养基通过121 ℃灭菌20 min后使用。进行兼养和异养培养时,向BG-11培养基内添加过滤除菌的葡萄糖作为有机碳源。前期研究通过比较葡萄糖、甘油、乙酸盐等不同浓度有机碳源对M. afer生长的影响,发现2 g·L-1葡萄糖最有利于M. afer生长[26]。因此本实验M. afer兼养培养使用2 g·L-1葡萄糖,小球藻以10 g·L-1葡萄糖作为有机碳源。
细胞培养于直径3 cm、高30 cm的玻璃柱式生物反应器中进行,培养体系为100 mL,使用白色荧光灯进行照明,光照强度为5 000 lx,光暗比16∶8,培养过程中全程通气,通气方式分为空气和高CO2(CO2体积分数为4%,使用流量计进行调节),因此本实验中,对两种微藻分别设置4个实验组:自养-4% CO2、兼养-4% CO2、兼养-空气、异养-空气。
1.2 实验方法
1.2.1 细胞生长测定和光合参数曲线
使用酶标仪 (SynergyTMHT, BioTek, Winooski,VT, USA) 测定藻液在λ750下吸光度,取藻液并适当稀释后,取200 μL加入96孔板进行测定,以OD750表征细胞密度,并绘制藻细胞生长曲线。
使用IMAGING-PAM调制叶绿素荧光仪(Walz, Effeltrich, Germany) 测定细胞光合电子传递效率ETR。加藻液200 μL于黑色96孔板中避光处理30 min后进行测定。
1.2.2 细胞呼吸耗氧和光合放氧水平测定
使用荧光光纤氧气测量仪 (FireStingO2, PyroS-cience GmbH, Germany) 和呼吸瓶传感器测定藻液光合放氧和呼吸耗氧水平。该测量仪利用REDFLASH光极O2传感器技术,REDFLASH指示剂荧光强度随接触的O2分子浓度升高而发生荧光淬灭,这种荧光变化通过光纤传输到测量仪,测量仪检测其相位漂移并据此换算成O2浓度。
参照仪器说明书,将荧光光纤氧气测量仪校正后,吸取2 mL藻液于呼吸瓶内,将呼吸瓶置于培养光强下,使用Pyro oxygen logger软件记录30 min内氧气增加情况,测算其速率,记为表观放氧速率;30 min后将呼吸瓶暗处理,连续测定30 min内氧气减少情况,计算其速率,记为呼吸速率;将表观放氧速率与呼吸速率相加,记为实际放氧速率 [mg·(L·h ·OD)-1]。
1.2.3 体系内葡萄糖剩余量测定
在培养的第3、第6和第8天取藻液,离心取上清,使用葡萄糖含量检测试剂盒 (BC2505, Solarbio) 测定培养基中葡萄糖剩余量,待葡萄糖耗尽后向体系中补充经过滤除菌的葡萄糖溶液;M. afer培养体系中补充0.2 g,小球藻中补充1.0 g。
1.2.4 细胞生物量测定
收集30 mL藻液,6 500 r·min-1离心10 min,弃去上清,超纯水清洗离心收集后冻干,使用分析天平测定藻细胞生物量。
1.2.5 M. afer细胞内脂肪酸和神经酸含量测定
1) 取30 mg的干藻泥,加入具塞玻璃管中,加入1.5 mL氯仿-甲醇溶液[V(氯仿)∶V(甲醇)=2∶1]和3.5 mL硫酸甲醇溶液 (2%硫酸),拧紧塞子充分混匀后置于85 ℃烘箱中反应2 h,取出后置于冰上冷却至室温;
2) 向上述各管中加入2 mL C26烷内标溶液,充分震荡混匀,然后加入700 μL 0.9%的氯化钾溶液,充分混匀,静置待分层;
3) 取萃取完全后的上清液200 μL于带内插管的气相小瓶中,使用气相色谱 (7890A, Agilent technologies, Inc., CA) 进行油脂成分分析;气相色谱升温程序为:100 ℃,5 min;以10 ℃·min-1升温14 min,达到240 ℃,维持6 min,分流比为10∶1。
1.3 统计与分析
实验数据采用Graphpad Prism软件进行整理及绘制,数据显著性分析采用单因素分析法 (Oneway ANOVA, N=3) 进行,P<0.05代表数据差异具有显著性。
2 结果
2.1 不同培养条件对细胞生长和光合参数的影响
从生长曲线 (图1-a,1-b) 来看,初始各组OD750为0.8,培养8 d,培养过程中,两种微藻对于有机碳源的利用显著不同,在避光条件下的异养培养过程中 (异养-空气组),小球藻生长好于自养培养,而M. afer在异养条件下生长十分缓慢,最终OD750为1.8,表明M. afer不能单纯依靠有机碳源营异养生长。而小球藻在葡萄糖的异养条件下,能够较好地生长,最终OD750为16。进一步在异养培养的基础上,添加光照处理,即兼养-空气的培养条件下,两种微藻均可较快生长,M.afer在该条件下同该藻自养培养的生长速率接近,最终OD750约为9.5;小球藻在该条件下达到最优的生长速率 (OD750达到25)。再进一步将空气替换成高CO2的混合气体进行通气,M. afer的生长速率进一步提升,该组OD750达到11.8,因此兼养-CO2条件对M. afer生长有最显著的促进作用。这个过程中仅改变了CO2的浓度,笔者认为是高浓度无机碳源促进了细胞的生长;而小球藻在该条件下,同兼养-空气相比,生长速率下降,最终OD约为16.5,高浓度的CO2抑制了细胞对有机碳源的利用。生长曲线的数据说明两种微藻在兼养条件下的性质不同,有机碳源和无机碳源的协同作用也不同。M. afer可以协同有机碳源和无机碳源的利用,而小球藻可以只利用有机碳源,但在高浓度CO2条件下其生长受到一定的抑制。
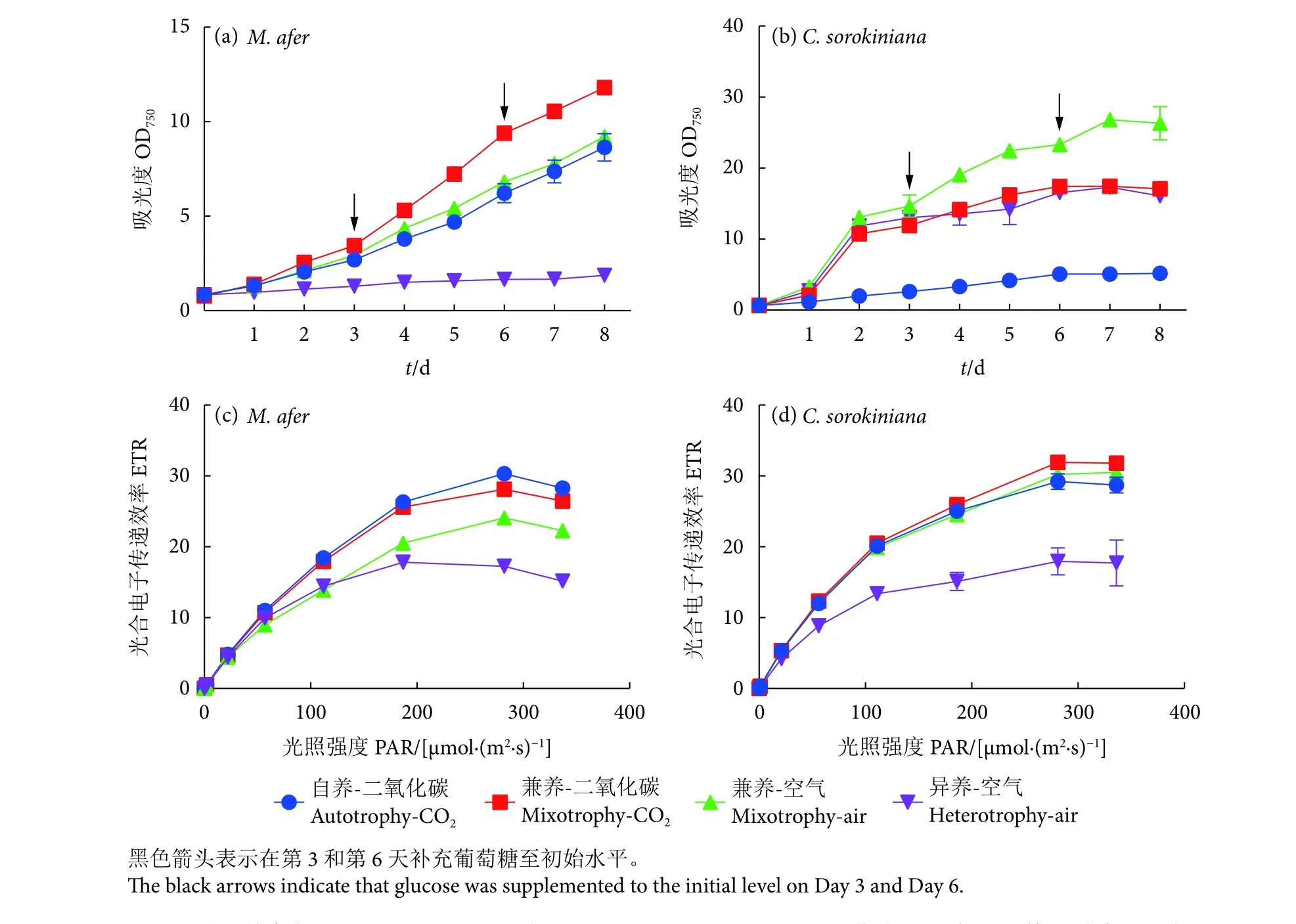
图1 不同培养条件下M. afer (a, c)和小球藻C. sorokiniana (b, d) 的生长曲线和光合电子传递效率变化情况Fig. 1 Growth curves and ETR of M. afer (a, c) and C. sorokiniana (b, d) under different culture conditions
对光合系统的参数进行测定也在一定程度上说明了两种微藻的不同,光合系统的最大电子传递效率可以表征光合作用的效率。本研究中选择生长过程发生显著分化的第4天,对不同培养条件下两种微藻的电子传递效率进行分析,在M. afer中(图1-c),异养培养的光合系统最大电子传递速率显著低于其他组,在光照条件下的不同处理过程中,M. afer的光合系统作用效率呈现梯度变化,高含量CO2通入的处理组,M. afer的光合效率较高,表明CO2的通入对光合效率提高有显著作用,高浓度CO2处理能提高M. afer的碳固定作用。在小球藻中 (图1-d),异养培养条件下小球藻的最大电子传递速率显著低于其他组,其他光照条件下的该参数无显著差异。
2.2 不同培养条件对细胞有机碳源利用效率的影响
兼养过程中,两种微藻在不同浓度CO2条件下,细胞的生长速率不同,有机碳源的利用速率也存在差异。在培养第3、第6和第8天取样测定培养基内葡萄糖剩余量,结果见表1。在兼养条件下,小球藻在通空气的情况下葡萄糖消耗速率最快,而M. afer在通高浓度CO2的情况下消耗最快,糖消耗速率的快慢与两株藻的生长情况一致。
表1 培养基中葡萄糖剩余量 ()Table 1 Residual glucose in culture mediumg·L-1
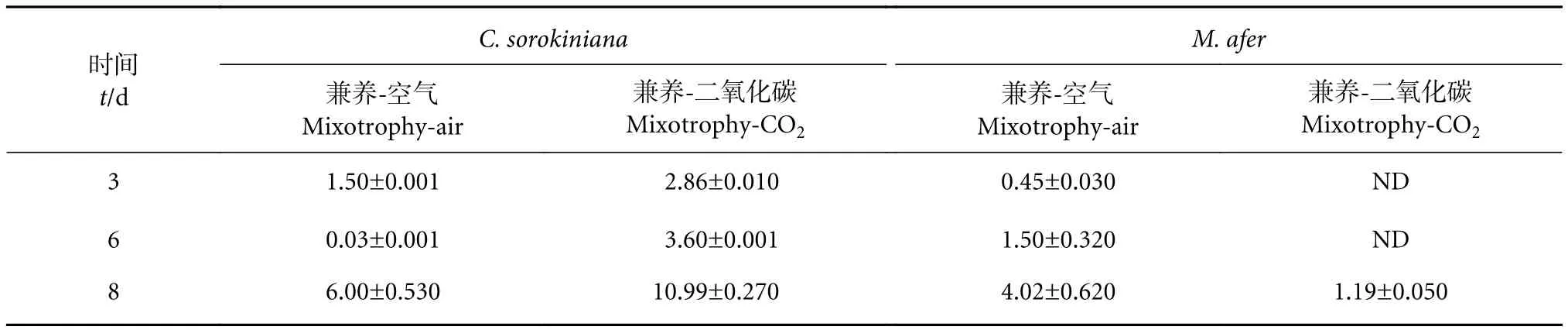
表1 培养基中葡萄糖剩余量 ()Table 1 Residual glucose in culture mediumg·L-1
注:ND为未检测出葡萄糖,即培养过程中每次添加的2 g·L-1葡萄糖在检测时已全部利用。Note: ND indicates that no glucose was detected, which means that 2 g·L-1 glucose had been fully utilized.
C. sorokiniana兼养-二氧化碳Mixotrophy-CO2 3 1.50±0.0012.86±0.0100.45±0.030ND 6 0.03±0.0013.60±0.0011.50±0.320ND 8 6.00±0.53010.99±0.2704.02±0.6201.19±0.050时间t/d M. afer兼养-空气Mixotrophy-air兼养-二氧化碳Mixotrophy-CO2兼养-空气Mixotrophy-air
2.3 不同培养条件对细胞光合放氧和呼吸耗氧水平的影响
在微生物发酵过程中,氧的传递非常重要。细胞进行呼吸作用需要大量氧气,同时光合微藻进行碳固定过程中也释放氧气,因此光合作用的效率可以通过氧气释放量来表达。本研究结合细胞生长和葡萄糖利用等结果,对培养系统中溶解氧变化过程进行监测和分析。图2-a显示了培养系统中检测溶解氧的过程,如方法中所述,首先从培养体系中取出藻液,在同样光照条件下测定不同培养体系的藻液在光照下30 min的耗氧变化,此过程分析光合作用放氧速率与细胞呼吸作用耗氧速率之间的差值;随后将检测体系避光处理,继续检测在黑暗条件下30 min的氧消耗变化,此过程分析不同条件下细胞的呼吸速率,溶解氧变化速率单位均为mg·(L·h·OD)-1。结果如图 2-b所示,在小球藻中放氧水平依次为自养>兼养-空气>兼养-CO2,而在M. afer中放氧速率为自养>兼养-CO2≈兼养-空气,有机碳源的加入均对两株藻的放氧水平产生了抑制作用,但小球藻放氧水平还在很大程度上受通气条件的影响。图2-c反映了两株藻在不同培养条件下的呼吸水平,与生长曲线 (图1-a,1-c) 结合分析发现,细胞呼吸水平与细胞生长成正比例关系。
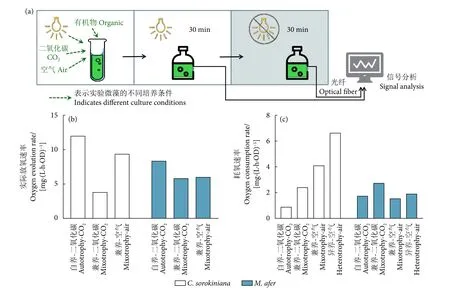
图2 溶解氧测定示意图及M. afer与小球藻 C. sorokiniana 耗放氧情况Fig. 2 Schematic diagram of dissolved oxygen determination and oxygen release, consumption rate of M. afer and C. sorokiniana
结合以上结果,小球藻在异养条件下耗氧速率最快且有较高的生长速率,该条件下细胞生长的全部能量依赖于有机碳源分解代谢产生的ATP,但在兼养条件下,添加有机碳源时,细胞的光合作用相比自养条件受到抑制;在有光的条件下,小球藻启动光合作用,细胞的呼吸水平降低,表明这个过程对细胞利用有机碳源生长产生抑制。在M. afer的检测过程中发现,在兼养通高浓度CO2条件下生长速率最快,同时该条件下细胞呼吸水平最高;相对于兼养-空气组,在有高浓度CO2的情况下,细胞呼吸水平提高,一定程度上说明CO2的吸收促进了细胞对有机碳源的利用;并且由于实际放氧速率在兼养条件下无显著差异,可以认为有机碳源的添加未对M. afer的光合系统造成影响。
2.4 不同培养条件对M. afer生物量、细胞内脂肪酸和神经酸产量的影响
由于M. afer生长过程中积累神经酸[13-14,26-27],因此对该藻在不同培养条件下的细胞油脂含量进行分析。将藻液离心后收集藻泥进行烘干,测定细胞生物量和细胞内脂肪酸、神经酸含量,结果见表2。与自养条件相比,葡萄糖加入后,细胞生物量、脂肪酸和神经酸含量均有显著提高,兼养-CO2组细胞生物量最大,为3.26 g·L-1。在兼养-CO2条件下,每克生物量含253.02 mg脂肪酸、5.93 mg神经酸,神经酸含量占总脂肪酸的2.34%;兼养-空气组每克生物量含154.01 mg脂肪酸、2.59 mg神经酸,脂肪酸占比为1.68%;自养条件下每克生物量仅含132.20 mg脂肪酸、0.93 mg神经酸。在最优的兼养-CO2组,神经酸含量分别为自养、兼养通空气条件的6.4、2.3倍。
表2 不同条件下M. afer细胞生物量、脂肪酸和神经酸质量分数 ()Table 2 Biomass, mass fraction of fatty acids and nervonic acids of M. afer cells under different conditions

表2 不同条件下M. afer细胞生物量、脂肪酸和神经酸质量分数 ()Table 2 Biomass, mass fraction of fatty acids and nervonic acids of M. afer cells under different conditions
神经酸质量分数Mass fraction of nervonic acid/(mg·g-1)自养-二氧化碳 Autotrophy-CO22.458 3±0.000 4132.20±9.680.93±0.02兼养-空气 Mixotrophy-air2.620 0±0.000 3154.01±16.632.59±0.01兼养-二氧化碳 Mixotrophy-CO2 3.261 7±0.000 1253.02±6.335.93±0.15生物量Biomass/(g·L-1)脂肪酸质量分数Mass fraction of fatty acid/(mg·g-1)
3 讨论
本研究主要比较了小球藻和M. afer在兼养过程中利用有机碳源和协同光合作用的能力,并探索M. afer最佳的兼养培养条件。M. afer和小球藻均可以利用有机碳源和光源进行兼养生长,但是两株藻在利用有机碳源和协同光合作用的能力方面存在显著差异。与M. afer相比,小球藻可以利用更高浓度的葡萄糖,实现更快速生长;小球藻属于一种高产蛋白质的微藻,而M. afer是一种典型产油微藻,与具有高淀粉或高蛋白含量的微藻相比,产油微藻通常表现出较慢的生长速率和较低的生物量,这一点在多种微藻中得到印证[28-30]。小球藻可以单独依靠有机碳源营异养生长,且在通空气的条件下生长速率更快,在有机碳源和光能同时存在时,小球藻更倾向于利用有机碳源,推测原因可能为有机碳源的加入抑制了小球藻细胞的光合作用,降低了光合色素含量[31]。但在培养初期,光合系统的代谢占总代谢的70%以上[32],仍然有助于细胞的生长,使兼养培养的生长速率较高。空气的持续通入供氧,更有利于葡萄糖的分解代谢,因此相对于兼养-CO2组,在兼养-空气条件下的生长速率更高。
有机碳源的引入对两株藻光合系统活性显示出不同程度的抑制作用。Vidotti等[33]发现,小球藻从自养条件转入兼养后,光合系统Ⅱ和光合系统Ⅰ活性及效率均下降,光合色素含量减少,细胞内光合相关基因如psbA、psbC、psaB等显著下调,同时检测到在光照条件下,培养基中葡萄糖的存在导致光合结构的降解以及类囊体膜蛋白丰度的降低。刘晓娟[34]研究不同营养方式对三角褐指藻(Phaeodactylum tricornutum) 的影响,发现有机碳源加入后,细胞内光合色素含量下降,PSⅡ系统活性/光合放氧速率等均下降,即有机碳降低了三角褐指藻的光合能力。外源葡萄糖通过分解代谢,为藻细胞生长提供所需能量及小分子碳骨架,从而降低了细胞对光能的依赖,因此兼养条件下细胞光合电子传递效率 (ETR)、光合放氧水平等均低于自养水平。
不同于小球藻,当切断光源后,M. afer几乎不能生长,表明M. afer不能完全摆脱对光源的依赖,完全营异养生长。M. afer在有机碳源和高浓度CO2共同存在时,具有最高的生长速率、最快的葡萄糖消耗速率、更高的呼吸水平,且积累了更多的生物活性物质。通常在自养条件下,高浓度CO2的引入,缓解了CO2缺乏对细胞生长的抑制,提高碳固定途径关键酶Rubisco (核酮糖-1,5-二磷酸羧化酶) 的活性[35],增加碳固定效率,积累更多生物量。本研究发现,在M. afer中,通过光合参数和放氧速率检测,通入高浓度的CO2并未使得光合系统的速率得到提升,但是细胞呼吸速率和葡萄糖的利用速率显著提高。该过程的分子机制仍有待通过转录组等数据阐明。推测在CO2通入细胞后,细胞的CO2通过类碳-4途径进行了初步的固定,首先丙酮酸在磷酸丙酮酸双激酶的作用下生成了磷酸烯醇式丙酮酸,然后在磷酸烯醇式丙酮酸羧化酶的作用下与CO2结合,进入中心碳代谢途径,进而与有机碳利用的糖酵解过程相偶联,促进了有机碳的利用。今后的工作中将进一步证明这个过程。
综上所述,两种微藻在兼养过程中协同有机碳源和光合作用的机制存在差异,M. afer在有机碳源存在的情况下仍可固定CO2,在这种培养模式下,期待能够一方面添加有机碳源提高微藻的生长速率,一方面固碳减排,使微藻快速积累生物量,为碳中和碳达峰的目标提供重要解决途径。
