蛋白核小球藻的培养体系优化研究
2022-10-21于枭燕邢向远赵国群
于枭燕,陈 丹,邢向远,赵国群,3,王 勇*
(1.河北科技大学 食品与生物学院,河北 石家庄 050000;2.阿尔格河北生命科学有限公司,河北 辛集052360;3. 河北省发酵技术创新中心,河北 石家庄 050000)
蛋白核小球藻作为一种单细胞绿藻,又被简称为小球藻[1]。在农业上,因其可以改善土壤营养状况,对作物果实提质增产,促进植物种子发芽[2],小球藻作为绿色化生物肥料受到广泛关注。此外,因小球藻可以吸附并排除毒素,可以抑制病原菌的生长繁殖。尽管小球藻的应用前景广阔,目前,小球藻培养仍存在着培养周期长、藻体密度低的技术瓶颈,这进一步提高了生产成本,限制了藻体的高效规模化生产。
本研究聚焦于蛋白核小球藻的培养工艺优化,分析了培养基构成、培养体系的装液量和接种量、培养基初始pH 等因素对蛋白核小球藻生长的作用影响,进一步优化了培养工艺,为小球藻的高效规模化生产提供了技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 藻株与培养基
蛋白核小球藻,由阿尔格河北生命科学有限公司提供。
藻体培养采用BG-11 培养基[3]。
1.1.2 实验试剂
葡萄糖(分析纯)购自天津市百世化工有限公司,乙二胺四乙酸二钠(分析纯)购自天津欧博凯化工有限公司,IAA(分析纯)购自上海易恩化学技术有限公司,其它试剂均为市售分析纯。
1.2 实验方法
1.2.1 小球藻种子液的制备
将BG-11 培养基装入250 mL 三角瓶内(装液量100 mL),灭菌条件为121 ℃,保温20 min。将适量蛋白核小球藻斜面培养物接入三角瓶,培养条件为28℃,光照强度2400 Lux,摇床转速140 rpm。
1.2.2 小球藻培养条件
取小球藻种子液转接入灭菌后的BG-11 培养基,接种率为10%,发酵培养条件为光照2400 Lux,光暗比24∶0,摇床转速140 rpm,温度28 ℃。
1.2.3 碳源对小球藻生长的影响
碳源分别采用等摩尔氮浓度(0.19 mmol/L)的葡萄糖、乙酸钠、NaHCO3、Na2CO3。进一步采用浓度梯度为1.0~10.0 g/L 的葡萄糖,以确定葡萄糖浓度对小球藻生长的影响。光照培养时间为7 d。
1.2.4 氮源对小球藻生长的影响
在葡萄糖浓度为7.0 g/L 条件下,氮源分别采用等摩尔氮浓度(17.6 mmol/L) 的NH4H2PO4、NH4NO3、(NH4)2SO4、NH4Cl、尿素和NaNO3。进一步采用浓度梯度为0.3~3.0 g/L 的尿素,以确定尿素浓度对小球藻生长的影响。光照培养时间为7 d。
1.2.5 无机盐对小球藻生长的影响
在7.0 g/L 葡萄糖和1.5 g/L 尿素条件下,采用浓度梯度为25.0~100.0 mg/L 的K2HPO4,光照培养时间为7 d。
在7.0 g/L 葡萄糖、1.5 g/L 尿素和0.075 g/L K2HPO4条件下,采用浓度梯度为35.0~1 000.0 mg/L的MgSO4,光照培养时间为7 d。
1.2.6 植物激素和维生素对小球藻生长的影响
在优化后培养基中分别添加浓度梯度为0.0~10.0 mg/L 的IAA;分别添加浓度梯度为0.0~100.0 μg/L的维生素B12;分别添加浓度梯度为0.0~1000.0 μg/L的生物素;光照培养7 d,以确定IAA、维生素B12及生物素对小球藻生长的影响。
1.2.7 接种量对小球藻生长的影响
当培养基组成为7.0 g/L 葡萄糖,1.5 g/L 尿素,0.075 g/LK2HPO4,0.15 g/LMgSO4,1.0 mg/LIAA,10 μg/L维生素B12和100 μg/L 生物素,其他成分不变时,采用接种量梯度为5~20%,光照培养7 d,以确定接种量对小球藻生长的影响。
1.2.8 培养基初始pH 与初始装液量对小球藻生长的影响
当培养基组成为7.0 g/L 葡萄糖,1.5 g/L 尿素,0.075 g/L K2HPO4,0.15 g/L MgSO4,1.0 mg/L IAA,10 μg/L 维生素B12和100 μg/L 生物素,其他成分不变时,采用培养基初始pH 梯度为6.0~10.0,250 mL 三角瓶装液量梯度为80~140 mL,光照培养7 d,以确定培养基初始pH 和装液量对小球藻生长的影响。
1.2.9 蛋白核小球藻培养条件优化
基于接种量、培养基初始pH 及初始装液量,开展3 因素3 水平的正交实验,正交实验设计见表1。

表1 正交实验设计表
1.2.10 分析方法
小球藻的生长测定采用血球计数板计数法。将待测藻液摇匀,取8 μL 适当稀释后藻液沿盖玻片边缘缓慢充满计数室。静置5 min,放在显微镜下进行计数。
2 结果与分析
2.1 碳源对小球藻生长的影响
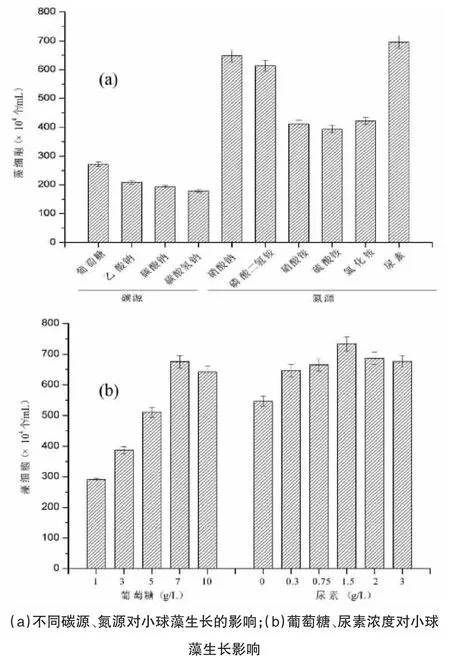
如图1(a)所示,当采用葡萄糖和乙酸钠时,藻细胞密度分别达到了2.71×106和2.09×106个/mL。本研究结果与刘茜等[4]在碳源优化分析中所得结果一致。如图1(b)所示,当将葡萄糖浓度从1.0 g/L 增加到7.0 g/L,藻细胞密度从2.9×106个/mL 提升到6.75×106个/mL。过高浓度的葡萄糖可能会对小球藻的生长产生抑制效应。
2.2 氮源对小球藻生长的影响
在采用不同氮源条件下(图1(a)),尿素对小球藻生长促进最明显,藻细胞密度达到了6.96×106个/mL。在无机氮源中,NaNO3为氮源时,小球藻细胞密度为6.48×106个/mL,略低于尿素条件。尿素作为小球藻的最适氮源这一结论也被葛珍珍等[5]研究报道。因此,本研究采用氮源为尿素。如图1(b)所示,当尿素浓度由0.3 g/L 提升到1.5 g/L 时,小球藻细胞浓度逐渐增高,当尿素浓度为1.5 g/L 时,藻细胞密度达到7.33×106个/mL,比不添加尿素的对照组提高了34%。当尿素浓度超过1.5 g/L 时,小球藻生物量有所下降。因此,小球藻的最适尿素浓度为1.5 g/L。
2.3 无机盐对小球藻生长的影响
磷通过作用于小球藻细胞膜、核酸、叶绿素等的合成对小球藻的生长及代谢产生影响[6]。如图2 所示,当磷源浓度为75.0 mg/L 时,藻细胞密度最高,为7.43×106个/mL,比对照组提高了11.2%。但是当磷源浓度达到100.0 mg/L 时,蛋白核小球藻的生长受到一定抑制,藻细胞密度略有下降。已有研究表明,当磷源浓度低于70.0 mg/L,小球藻的生长速率和生物量与磷源含量呈正相关,且最适磷源浓度为70.0 mg/L[7]。本研究中小球藻最适磷浓度采用75.0 mg/L。
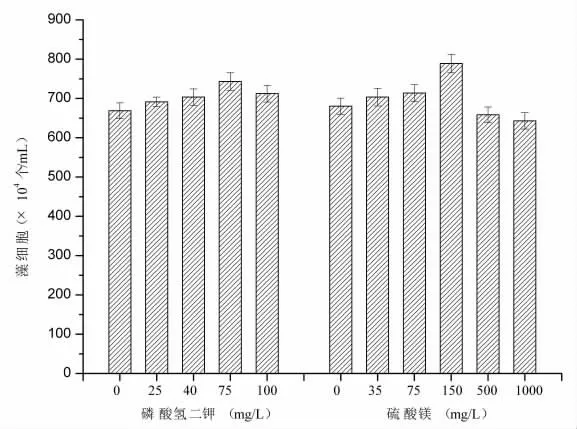
图2 磷酸氢二钾和硫酸镁对小球藻生长的影响
镁作为叶绿素和某些辅酶的主要构成成分,对小球藻的生长具有重要意义[8]。如图2 所示,当MgSO4浓度在0~150 mg/L,小球藻细胞密度随MgSO4浓度的增加而增加,小球藻最大藻体密度为7.88×106个/mL,比对照组提高了15.9%。当硫酸镁浓度超过150 mg/L 时,小球藻的生长受到一定程度的抑制。本研究中小球藻的最适MgSO4浓度为150 mg/L。
2.4 植物激素和维生素对小球藻生长的影响
2.4.1 IAA 对小球藻生长的影响
IAA 浓度对小球藻生长的影响如图3 所示,当IAA 浓度在0.05 mg/L~10 mg/L 时,对小球藻的生长均有促进作用。当IAA 浓度低于1.0 mg/L 时,小球藻的细胞密度随着IAA 浓度的增加而增大,当IAA 浓度为1.0 mg/L 时,小球藻细胞密度最高达8.13×106个/mL,为对照组的1.07 倍。然而,当IAA 浓度大于1.0 mg/L 时,小球藻的生长受到一定抑制。本研究确定最适IAA 浓度为1.0 mg/L。
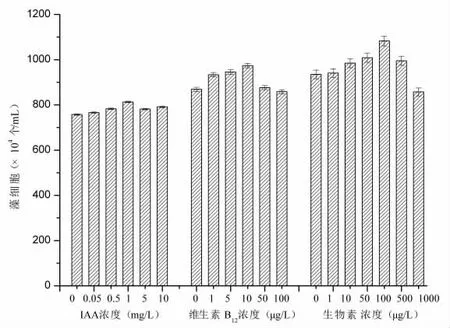
图3 IAA、维生素B12 和维生素B7 对小球藻生长的影响
2.4.2 维生素B12对小球藻生长的影响
王士伦等[9]发现添加适量的维生素B12能够促进小球藻的生长和叶绿素含量的提升。由图3 可知,在维生素B12浓度为0~10 μg/L 时,蛋白核小球藻生物量随着维生素B12浓度的增大而增加,小球藻细胞密度最高为9.73×106个/mL,比对照组提高了12%。当维生素B12浓度大于10 μg/L 时,其对小球藻的促进效果有所下降。本研究确定维生素B12最适添加量为10 μg/L。
2.4.3 生物素对小球藻生长的影响
生物素(也称为Vitamin H 或B7)作为辅因子对生理代谢产生重要意义[10]。由图3 可知,在生物素浓度为低于100 μg/L 时,蛋白核小球藻的生物量随着生物素浓度的增加而增大,蛋白核小球藻的生物量最高为1.08×107个/mL,比对照组提高了15.6%。当生物素浓度超过100 μg/L 时,小球藻的生物长受抑制。本研究中生物素的最适添加量为100 μg/L。
2.5 接种量对小球藻生长的影响
由图4 可知,当小球藻的接种量为5%时,藻细胞生长缓慢,生物量较其他接种组低。当接种量为10%时,小球藻的生物量最高,为1.04×107个/mL,比5%接种量组提高了14.7%。当接种量大于10%,小球藻的生物量随接种量增大而逐渐降低。本研究中小球藻培养的最适接种量为10%。
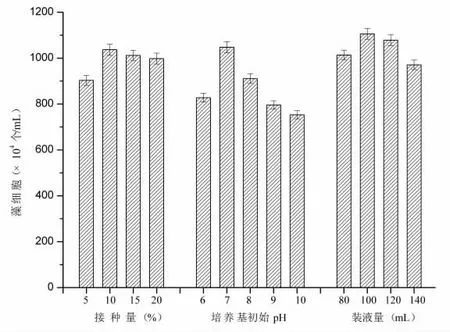
图4 接种量、培养基初始pH 及装液量对小球藻生长的影响
2.6 培养基初始pH 及初始装液量对小球藻生长的影响
如图4 所示,当培养基初始pH 为7 时,小球藻生物量最高,为1.05×107个/mL。当pH 达到10 时,小球藻的生物量最低,较pH7 处理组下降了28.3%。随着装液量的增大,小球藻的细胞密度呈现先升高后降低的趋势。当装液量为100 mL 时,藻细胞密度达1.1×107个/mL。显然,装液量过大会造成限制气体传质,装液量过低又会导致底物浓度受限。
2.7 蛋白核小球藻的培养条件优化
在以上基础上,采用葡萄糖7.0 g/L、尿素1.5 g/L、K2HPO475 mg/L 及MgSO4150 mg/L,进行3 因素3 水平的正交优化实验(表2)。
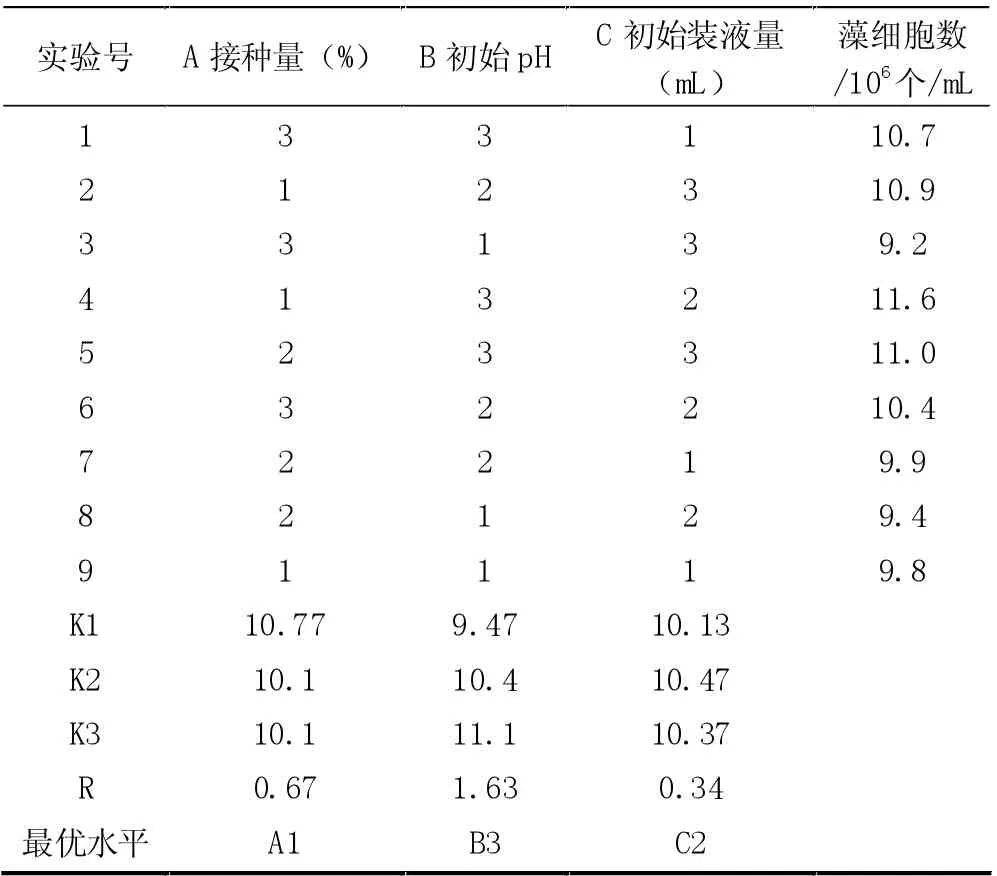
表2 正交实验设计及结果
由表3 可知,培养基初始pH 和接种量对蛋白核小球藻细胞密度影响显著。最优培养条件为接种量10%,培养基初始pH8,装液量100 mL。最优条件下,蛋白核小球藻的生物量为1.16×107个/mL。

表3 方差分析表
2.8 小球藻在优化条件下的生长曲线
将小球藻的种子液接种至优化培养基中,在优化培养条件下进行发酵培养(图5)。当培养时间为10d时,小球藻的藻细胞数达到峰值为1.37×107个/mL。培养时间超过10d 后,小球藻细胞密度达到稳定。魏东等[11]发现小球藻培养10 天后生长基本稳定,与本研究结果一致。因此,本研究中小球藻在优化条件下发酵周期为10d。
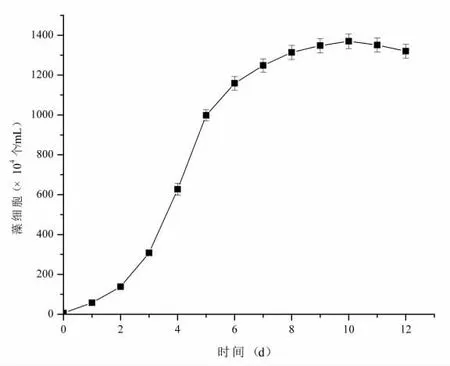
图5 小球藻在优化条件下的生长曲线
3 结论
本研究确定了蛋白核小球藻培养的最适碳氮源及浓度,阐明了无机盐、植物激素和微生素对微藻生长的影响。在优化培养基构成为葡萄糖7.0 g/L、尿素1.5 g/L、K2HPO475 mg/L、MgSO4150 mg/L,IAA 1 mg/L、维生素B1210 μg/L 和生物素100 μg/L 条件下,小球藻生物量达到1.08×107个/mL。确定了最佳培养条件为接种量10%,培养基初始pH8,装液量100 mL。最佳条件下,蛋白核小球藻的生物量达到1.16×107个/mL,且在此条件下小球藻的发酵周期为10 d。
