碳离子束诱变选育高产角鲨烯类酵母及电转化初探
2022-04-22丛培虎冯银刚宋晓金
肖 艳,王 璐,王 森,丛培虎,陆 栋,冯银刚,崔 球,宋晓金
1. 中国科学院生物燃料重点实验室/山东省合成生物学重点实验室/山东省能源研究院/中国科学院青岛生物能源与过程研究所,山东 青岛 266101
2. 山东大学 澳国立联合理学院,山东 威海 264209
3. 山东省科技服务发展推进中心,山东 济南 250101
4. 中国科学院近代物理研究所,甘肃 兰州 730000
角鲨烯 (Squalene, C30H50) 是一种含有6个双键的开链线性三萜,主要存在于深海鲨鱼肝油中,少部分存在于细菌、真菌、微藻和植物中[1-2]。角鲨烯具有抗肿瘤、耐缺氧、抗氧化、抗辐射和细胞保护等生物活性[3],已在水产、医药和化妆品领域获得广泛应用[4-5]。在水产领域,提升水产动物体内的角鲨烯含量可明显增强其非特异性免疫细胞水平和抗病力。给罗非鱼 (Oreochromis spp.) 注射角鲨烯可提高其巨噬细胞增殖量,获得了更多的非特异性免疫细胞[6]。此外,角鲨烯被认为是优良的黏膜免疫佐剂而应用于鱼类口服疫苗开发中[7]。
目前,鲨鱼肝油仍然是角鲨烯的主要来源,但不同种类鲨鱼肝油中的角鲨烯含量差异显著[8],随着海洋污染的加剧和鲨鱼资源的过度捕捞,亟需寻找其他可替代的天然资源。微生物发酵生产角鲨烯是一条绿色可循环、周期短、可规模化生产的途径,是工业化生产角鲨烯的优良选择[9]。裂殖壶菌(Schizochitrium sp.)、大肠杆菌 (Escherichia coli) 和酿酒酵母 (Saccharomyces cerevisiae) 作为经典的工业发酵微生物,通过基因工程手段提高角鲨烯产量已有报道[9-11],然而这些微生物自身的角鲨烯产量并不高,选育更具发酵潜力的微生物菌株[12-13],利用基因工程手段进一步提高角鲨烯产量将是一种更有潜力的手段。Pseudozyma sp. SD301是本项目组自主筛选到的单细胞海洋类酵母,摇瓶培养时角鲨烯产量达0.79 g·L-1,具有较高的角鲨烯产量[12]。碳离子 (12C6+) 束辐照诱变育种具有诱变率高、诱变谱宽、突变体稳定等优势,已广泛应用于微生物育种领域[14-16]。本研究以Pseudozyma sp. SD301为出发菌株,采用12C6+束辐照诱变技术,选育更加高产角鲨烯的突变株。在此基础上,以高产突变株为例,开发高效的电转化方法,用于实现外源基因的表达,为进一步遗传改良提供了可能,为角鲨烯的微生物发酵生产奠定基础,并为深海来源的角鲨烯资源提供可能的替代选择。
1 材料与方法
1.1 菌株
以实验室自主选育的野生型类酵母Pseudozyma sp. SD301 (CGMCC no. 9687) 作为初始菌株,该野生菌株具有较高的产角鲨烯性能[12]。
1.2 主要试剂
酵母提取物购自英国Oxoid;过氧化氢 (H2O2)和葡萄糖购自上海国药集团化学试剂有限公司;琼脂粉和潮霉素B购自北京索莱宝科技有限公司;角鲨烯购自北京百灵威科技有限公司;质粒提取试剂盒、DNA片段纯化试剂盒和胶回收试剂盒均购自OMEGA生物公司;限制性内切酶购自Thermo Scientific公司;2×ES Taq MasterMix购自康为世纪生物科技有限公司;2×PCR Besttaq MasterMix购自中国南京爱必梦生物材料有限公司;其余常用生化试剂均为国产分析纯。
1.3 培养基与培养条件
GY液体培养基 (1 L):葡萄糖60 g,酵母提取物20 g,海水晶15 g。
GY固体培养基 (1 L):葡萄糖60 g,酵母提取物20 g,海水晶15 g,琼脂粉20 g。
培养条件:菌株在25 ℃、200 r·min-1条件下,使用GY液体培养基活化2次,每次活化2 d(批次培养时,2 d达指数生长期,3 d后达平台期,此时胞内角鲨烯质量最高)[12],然后按照10%接种量转接到摇瓶中培养,在相同条件下继续发酵3 d,之后收集菌体用于菌体干质量及角鲨烯质量分析。
1.4 12C6+束辐照、突变株的筛选及稳定性分析
12C6+束辐照:以SD301为出发菌株,培养2 d后,将菌液分装成每管2 mL,用于辐照实验。12C6+束辐照实验在中国科学院近代物理研究所重离子加速器国家实验室 (Heavy Ion Research Facility in Lanzhou, HIRFL) 进行,辐照条件为:采用12C6+束,能量 80 MeV·μ-1,LET 31 keV·μm-1,辐照剂量为0、20、60、90、120、150和180 Gy,每个辐照剂量设置3个平行样品。经过辐照后的菌液稀释到1×10-4和 1×10-5,取 100 μL 菌液稀释液涂布在GY固体平板上,之后25 ℃倒置培养,用于计数不同辐照剂量对应的存活菌落数。
突变株筛选条件:为了确定产角鲨烯类酵母SD301对H2O2的敏感性,将类酵母SD301菌液稀释到1×10-5后,涂布在H2O2浓度分别为10、100和1 000 μmol·L-1的平板上培养并记录菌落数。
突变株筛选:选择120、150和180 Gy的12C6+束辐照剂量处理后的菌液进行适当稀释,进行H2O2压力筛选 (稀释后的菌液涂布在含有100 μmol·L-1H2O2的 GY 平板上,培养 2 d),挑取单菌落在25 ℃、200 r·min-1培养3 d,收集菌体提取角鲨烯,应用气相色谱分析角鲨烯质量,每个样品平行3次测定。
突变株稳定性:将获得的突变株在25 ℃、200 r·min-1条件下,使用50 mL GY液体培养基传代培养,培养时间为2 d,连续传代15次后,测定突变株的角鲨烯质量,每个样品平行3次测定。
1.5 突变株的角鲨烯产量和质量分析
将对照菌株SD301和突变株PS120、PS150和PS180分别接种到GY培养液中25 ℃、200 r·min-1活化2次,之后分别在20 mL培养液和100 mL培养液中批次培养3 d,11 000×g离心2 min收集一定量菌体进行冷冻干燥,干燥后称质量计算生物量。称取 25 mg干菌粉,加入 300 μL 6 mol·L-1盐酸 (HCl),在-80 ℃和100 ℃下反复冻融3次,冷却后加入 450 μL 氯仿-甲醇溶液 [V(氯仿)∶V(甲醇)=2∶1]、500 μL 饱和氯化钠 (NaCl) 和 500 μL 正己烷,混匀,10 000×g离心5 min,取上清过有机滤膜后用于气相色谱分析角鲨烯质量。角鲨烯质量根据角鲨烯标准曲线计算得到。每个样品平行3次测定。角鲨烯产量根据角鲨烯质量及生物量计算得到。
1.6 质粒pYES2-hph和pYES2-hph-egfp的构建
以潮霉素B作为遗传筛选标记,潮霉素B的质量浓度为300 mg·L-1。以pYES2 (Invitrogen)为初始质粒,以HPH(潮霉素B抗性基因) 的DNA为模板,用引物Hph-F/Hph-R扩增HPH基因,用BamHI和XhoI双酶切的方式连接到载体pYES2,构建质粒pYES2-hph,用引物P-C-F/P-C-R进行菌落PCR验证。以EGFP(增强型GFP基因) 的DNA为模板,用引物P-egfp-F/P-egfp-R扩增EGFP基因。用XhoI单酶切质粒进行线性化,将EGFP基因的PCR产物和线性化载体pYES2-hph (XhoI) 在Exnase的催化下进行重组反应,之后将反应产物加入大肠杆菌Top10的感受态细胞中进行转化,转化完成后,将细胞液涂布到含有100 mg·L-1氨苄青霉素的LB平板上,37 ℃倒置过夜培养。用引物P-egfp-C-F/P-C-R对平板上长出的克隆进行菌落PCR验证,在PCR验证目的片段大小正确后,使用OMEGA公司的胶回收试剂盒进行PCR产物回收并送到北京擎科生物科技有限公司进行测序。本研究中质粒构建所用引物见表1。
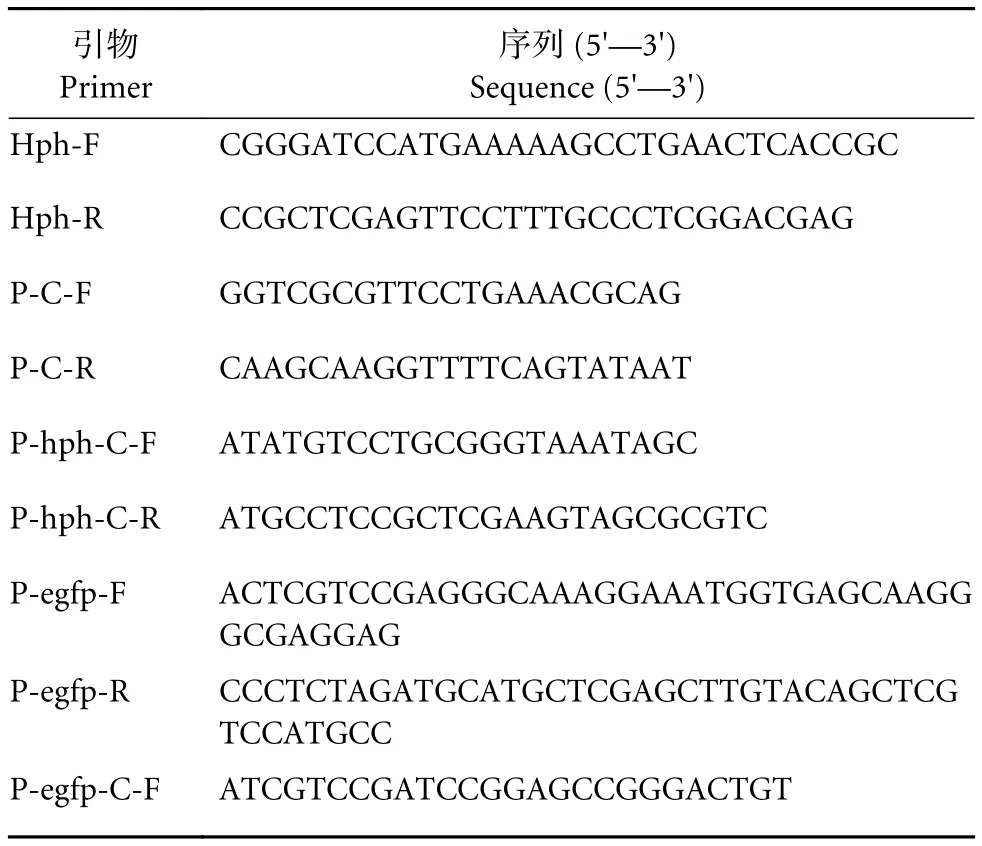
表1 本研究中质粒构建所用引物Table 1 Oligonucleotides used in vector construction
1.7 电转化方法
已有研究证实使用醋酸锂和山梨醇处理Pseudozyma属细胞制备的感受态细胞有利于提高其电转化效率[17-18],本研究中使用的电转化方法在Marchand等[18]、Masaaki等[19]和Morita等[20]报道的方法基础上进行了改进和电压优化。
YC 预处理液 (1 L):山梨醇 1 mol·L-1,Tris-HCl 10 mmol·L-1,LiAc 100 mmol·L-1,DTT 10 mmol·L-1,pH 6.4。
CX 细胞重悬液 (1 L):1 mol·L-1山梨醇-GY 液体培养基 (V∶V=1∶1)。
YP液体培养基 (1 L):蔗糖60 g,酵母提取物20 g,海水晶15 g,甘油100 g。
GP固体培养基 (1 L):半乳糖10 g,蔗糖60 g,酵母提取物20 g,海水晶15 g,琼脂粉20 g,甘油100 g,潮霉素B 300 mg。
感受态细胞制备:菌株在25 ℃、200 r·min-1条件下,使用YP液体培养基活化2次,然后取出1 mL菌液稀释10倍后测定其在600 nm的光密度(OD),OD600在1左右即可用于感受态细胞制备。取1 mL菌液,在4 ℃、4 000×g离心2 min收集菌体,菌体用1 mL预冷的无菌蒸馏水洗涤2次,之后用1 mL预冷的YC预处理液漂洗2次,再用1 mL预冷的CX细胞重悬液洗涤2次,最后用预冷的CX细胞重悬液将菌液稀释250倍,使得细胞个数约为 1×108个·mL-1。
电击条件:将50 μL感受态细胞液和5 μg质粒混匀后加入预冷的0.2 cm电转杯 (Bio-Rad),冰上静置15 min,之后置于自主研发的细胞电穿孔高压脉冲发生器 (SW11-3K) 中电击。参数设置:电压650、900、1 150和1 400 V,频率2 000 Hz,占空比10%和脉冲数40个,电击后立即加入1 mL的CX细胞重悬液到电转杯中,并将其转至1.5 mL试管,冰上放置15 min,之后于25 ℃、200 r·min-1复苏培养1 h,之后取出100 μL涂布GP固体培养板,之后25 ℃倒置培养。
转化子验证:挑取GP固体培养板上长出的单菌落,使用引物P-C-F和P-C-R对pYES2-hphegfp的转化子进行PCR验证,将扩增出的大小正确的目的条带用OMEGA公司的胶回收试剂盒进行回收,并将回收到的PCR产物送到北京擎科生物科技有限公司进行测序,将测序结果与目的序列进行比对以确证克隆是否正确。选择验证正确的含有质粒pYES2-hph-egfp的阳性转化子进行激光共聚焦显微镜观察。
1.8 激光共聚焦显微镜分析
在载玻片上滴加40 μL无菌水,挑取验证正确的阳性转化子均匀分散到无菌水中,加上盖玻片后静置片刻,之后置于激光共聚焦显微镜下观察,选择480 nm激发波长用于增强型荧光蛋白EGFP的观察[21]。
2 结果与分析
2.1 12C6+束辐照后的细胞存活曲线出现马鞍形波动
应用12C6+束对类酵母SD301菌株进行辐照,辐照剂量为20、60、90、120、150和180 Gy,细胞存活数分别为74、74、65、69、77和33。在辐照剂量为120、150和180 Gy时,细胞存活数出现了类似马鞍形的波动。12C6+束诱变的马鞍形效应在30多个属的微生物中被观测到,虽然具体的形成原因还不清楚,但马鞍形波动可能对应着较好的突变效果[15],因此选择马鞍形波动对应的经过120、150和180 Gy辐照的菌株进行突变效应筛选 (图1)。
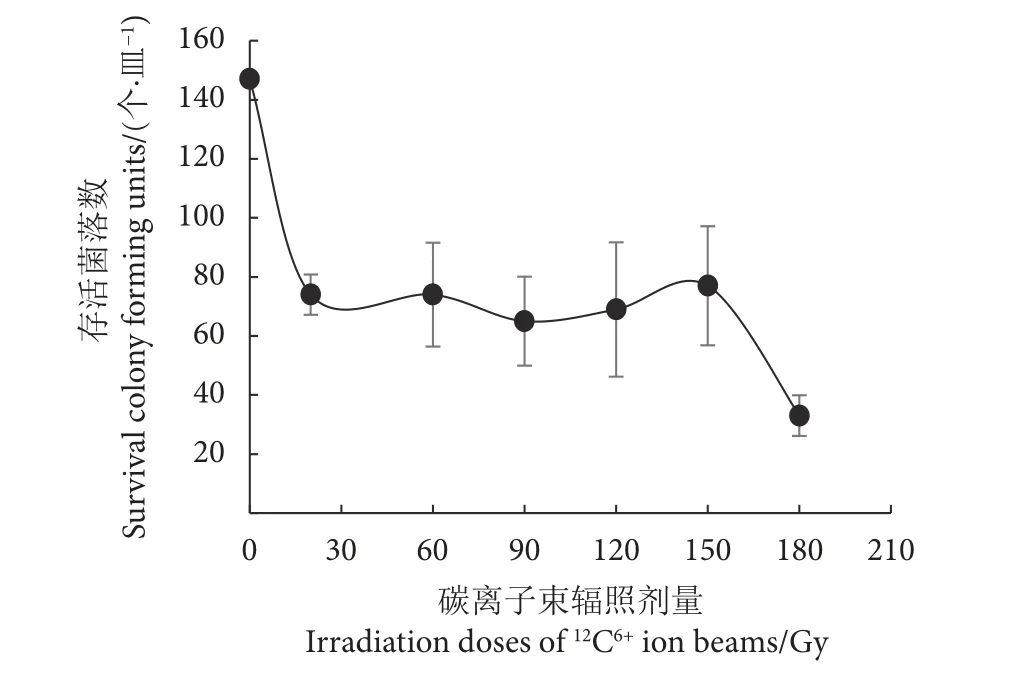
图1 类酵母SD301碳离子束辐照诱变后菌落存活情况Fig. 1 Survival colony forming units of yeast-like strain SD301 after carbon-ions mutagenesis
2.2 H2O2可作为筛选压力筛选高产角鲨烯SD301突变株
研究发现,在本实验条件下所有H2O2处理组平板上均有明显的菌落生成,H2O2浓度达到100 μmol·L-1时,突变株菌落成活率保持在20%左右,所以选择 100 μmol·L-1H2O2作为筛选压力 (图 2)。后续培养实验表明,该筛选压力下实验组表现出更高的角鲨烯质量 (22.53 mg·g-1vs. 12.52 mg·g-1) 和产量 (267.31 mg·L-1vs. 100.96 mg·L-1)。
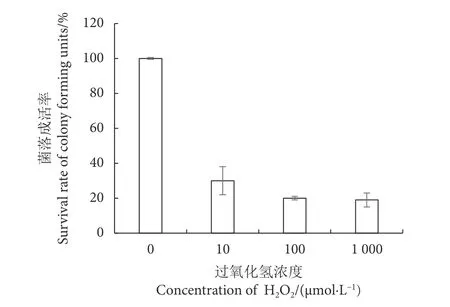
图2 不同浓度的过氧化氢对类酵母SD301生长的影响Fig. 2 Effects of H2O2 with different concentrations on growth of yeast-like SD301
2.3 高产角鲨烯SD301的突变株具有较好的遗传稳定性
经12C6+束对类酵母SD301菌株进行辐照,最终筛选到3株比出发菌株具有更高角鲨烯质量的突变株PS120、PS150和PS180。这3株菌株连续传代15次后,再次测定了角鲨烯质量,数据表明传代前后细胞内角鲨烯的质量无显著变化,获得的3株突变株经过传代后角鲨烯合成性能较为稳定(图 3)。
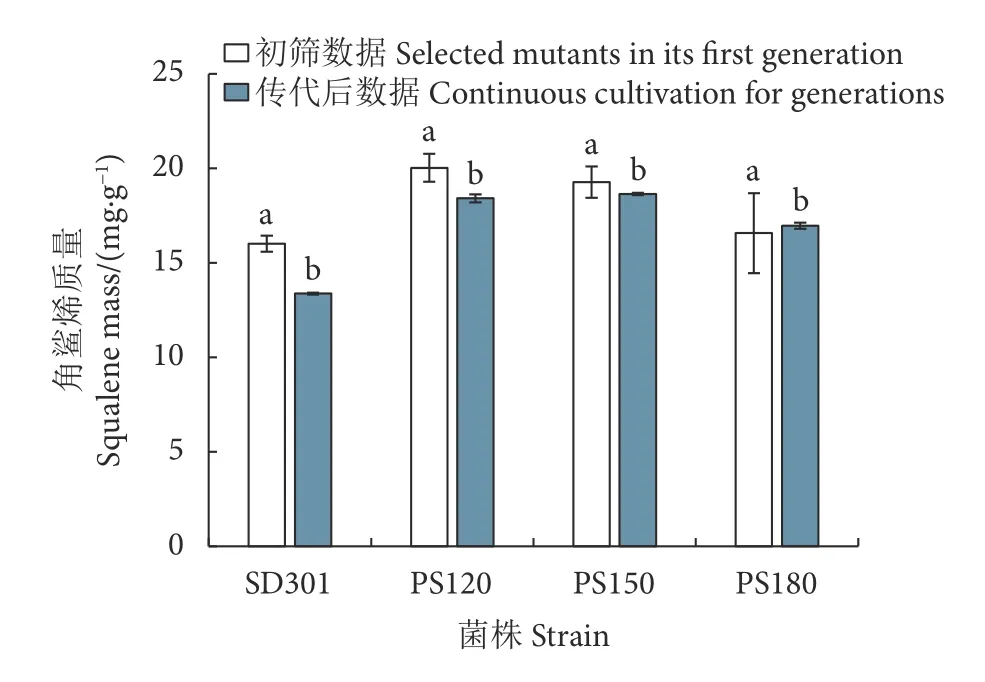
图3 SD301及其突变株的角鲨烯质量稳定性Fig. 3 Squalene mass stability of SD301 and its mutants
2.4 突变株比出发菌株具有更高的角鲨烯生产性能
摇瓶实验证实,突变株PS120的角鲨烯产量和质量均高于出发菌株 SD301 (1.33 g·L-1vs. 0.82 g·L-1,41.31 mg·g-1vs. 26.82 mg·g-1,图 4)。突变株 PS120的角鲨烯产量明显高于同属菌株Pseudozyma sp.JCC 207 (0.34 g·L-1)[22],甚至高于经过代谢工程改造后的某些解脂耶氏酵母 (Yarrowia lipolytica )(0.30 g·L-1)[23]、酿酒酵母 (0.21 g·L-1)[24]和大肠杆菌(0.17 g·L-1)[25]。有研究发现,通过细胞质和过氧化物酶体双重调节,可进一步提高角鲨烯产量,最终通过优化发酵方法,可将角鲨烯产量提至11.00 g·L-1[17]。本文筛选到的突变株PS120作为遗传改造的出发菌株具有角鲨烯产量较高的起始优势,遗传改造手段的应用有望进一步大幅提高其角鲨烯产量,因此,本文将优先探索并建立稳定高效的电转化方法用于菌株的后续遗传改造。
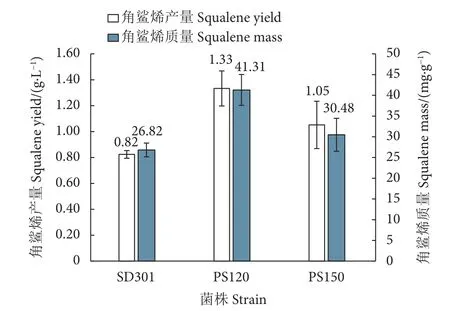
图4 SD301及其突变株PS120和PS150的角鲨烯生产性能分析Fig. 4 Performance analysis of SD301 and its mutants (PS120 and PS150)
2.5 电转化方法可以成功将质粒转入突变株PS120
潮霉素B通常对Pseudozyma属细胞具有抑制作用,因此本研究引入潮霉素B抗性基因作为构建重组质粒的抗性筛选标记[18-19]。本研究以半乳糖诱导型质粒pYES2为模板,将潮霉素B抗性基因HPH和编码增强型绿色荧光蛋白的EGFP基因引入载体,构建重组质粒pYES2-hph-egfp。通过菌落PCR扩增重组质粒中的EGFP基因 (EGFP基因片段的大小为1 014 bp),并对PCR产物进行琼脂糖凝胶验证、回收和测序研究,测序结果表明EGFP基因正确插入载体,重组质粒pYES2-hph-egfp构建成功 (图 5-a)。
以突变株为出发菌株进行电转化,测试电压分别为650、900、1 150和1 400 V。通过菌落PCR扩增重组质粒中的HPH和EGFP基因表达盒 (该基因表达盒的大小为2 430 bp),并对PCR产物进行琼脂糖凝胶验证、回收和测序,测序结果表明重组质粒pYES2-hph-egfp成功转入到细胞中,成功获得含有质粒pYES2-hph-egfp的阳性转化子 (图5-b)。900 V电压条件下获得的阳性转化率 (30%,6个阳性克隆/20个克隆) 较1 400 V电压更高 (15%,3个阳性克隆/20个克隆)。此外,激光共聚焦显微镜观察也显示在900 V电压下获得的阳性转化子比1 400 V电压下有更多可以正常表达绿色荧光蛋白的细胞 (图6)。本研究使用的电压仅为900 V,远低于已报道的Pseudozyma属的电转化电压 (1 850 V[19]和5 kV[20]),操作上更具安全性。
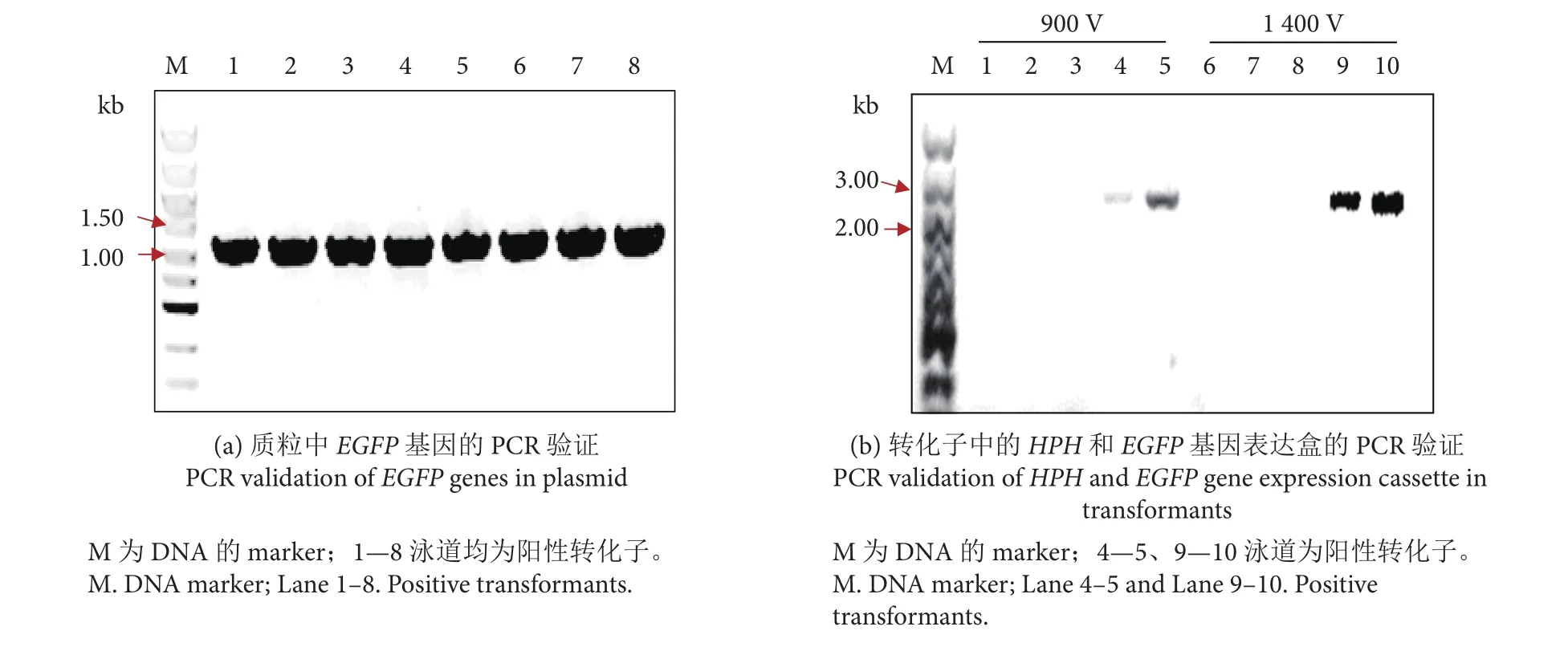
图5 质粒和转化子的PCR验证Fig. 5 PCR validation of plasmid and transformants
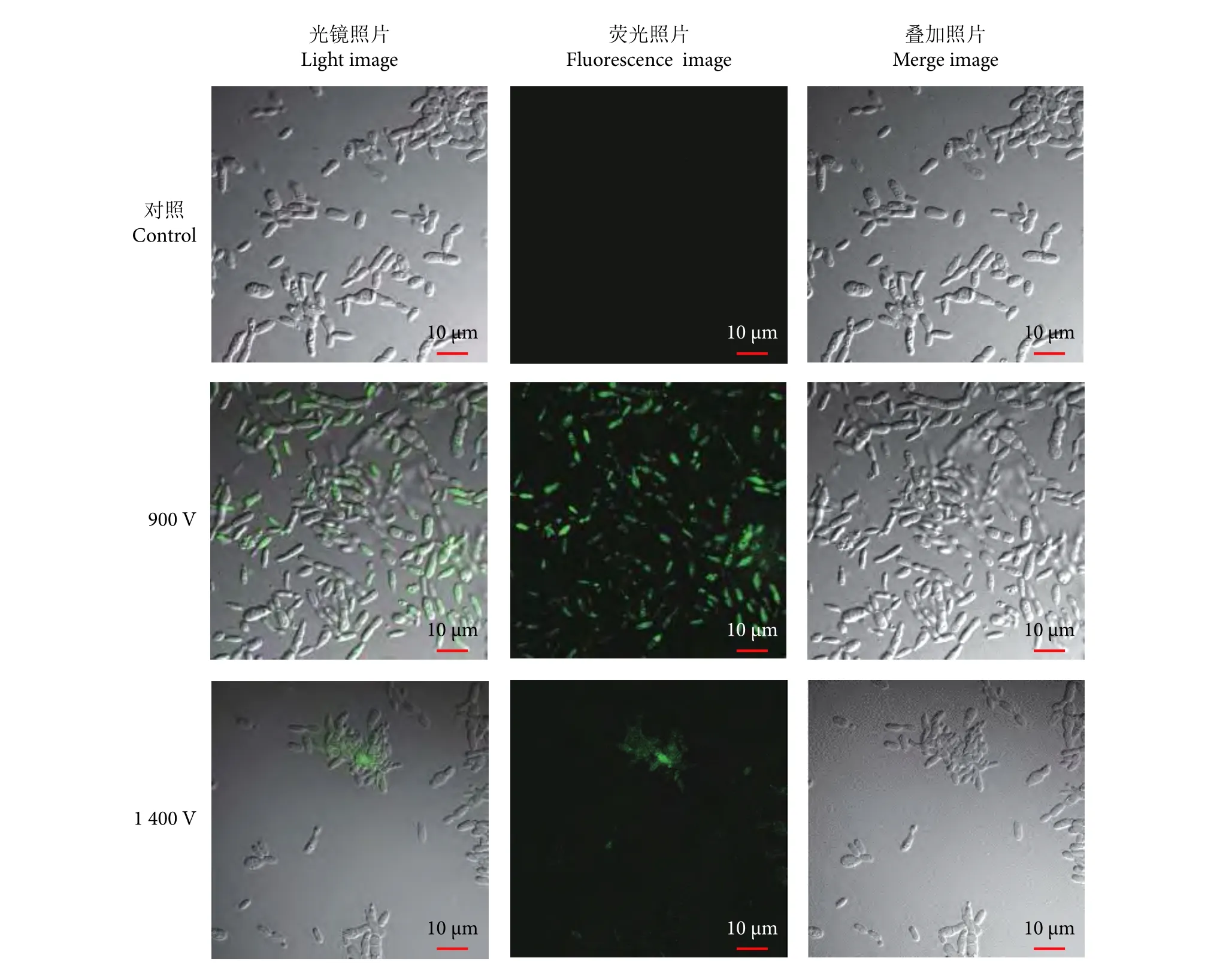
图6 激光共聚焦显微镜验证增强型荧光蛋白EGFP在突变株PS120的表达水平Fig. 6 Fluorescence intensity of enhanced fluorescent protein (EGFP) in mutant strain PS120 observed by laser scanning confocal microscopy
3 结论
本研究使用12C6+束辐照诱变产角鲨烯类酵母Pseudozyma sp. SD301,通过筛选初步获得了高产角鲨烯突变株PS120,摇瓶培养条件下其角鲨烯产量达到1.33 g·L-1,高于出发菌株SD301,是目前已报道过的使用诱变选育获得的最佳突变株之一[12,26]。PS120以葡萄糖为碳源进行1 L摇瓶培养3 d后菌体干质量 (干燥后细胞质量) 达22.10 g·L-1,高于产角鲨烯的南极酵母、酿酒酵母和裂殖壶菌[17,22,26-29],具备通过高密度发酵生产角鲨烯的潜力。除了通过诱变选育获得高产角鲨烯的突变株以外,通过代谢工程改造也可以有效提高角鲨烯的产量[17,30-34]。为了进一步提高突变株的角鲨烯产量,本研究改进了Pseudozyma属的电转化条件并优化了电压条件,结果显示在900 V电压下进行电转化可获得较高的阳性转化率 (30%),下一步工作重点是提高电转化效率和完善基因编辑系统。本研究结果可为产角鲨烯类酵母的遗传改造提供重要的技术支撑。
